Similar presentations:
Соли, их классификация и свойства
1.
Соли, их классификация исвойства.
Получение и применение.
2.
Что такое соли?Соли – это класс химических соединений,
состоящих из ионов металла и ионов
кислотного остатка.
(Например: NaCl, NH4NO3, AgY)
Солями называют электролиты, которые
при диссоциации образуют катионы
металла (или аммония NH4+) и анионы
кислотных остатков.
(Например: K3PO4 = 3K+ + PO43- )
3.
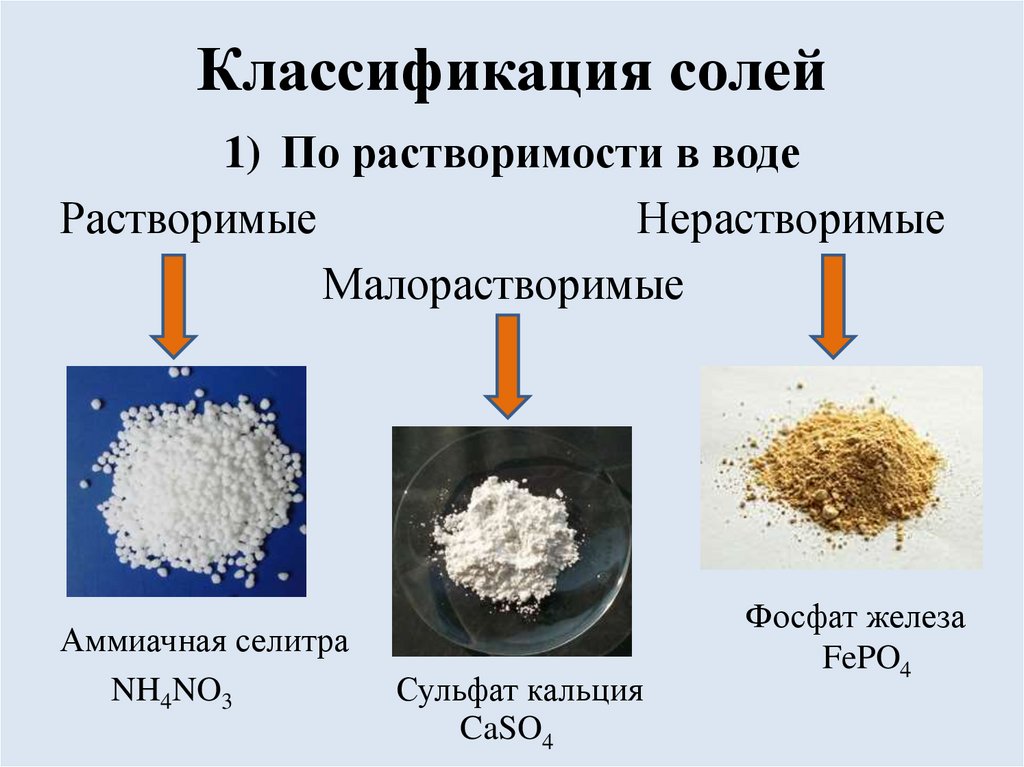
Классификация солей1) По растворимости в воде
Растворимые
Нерастворимые
Малорастворимые
Аммиачная селитра
NH4NO3
Сульфат кальция
CaSO4
Фосфат железа
FePO4
4.
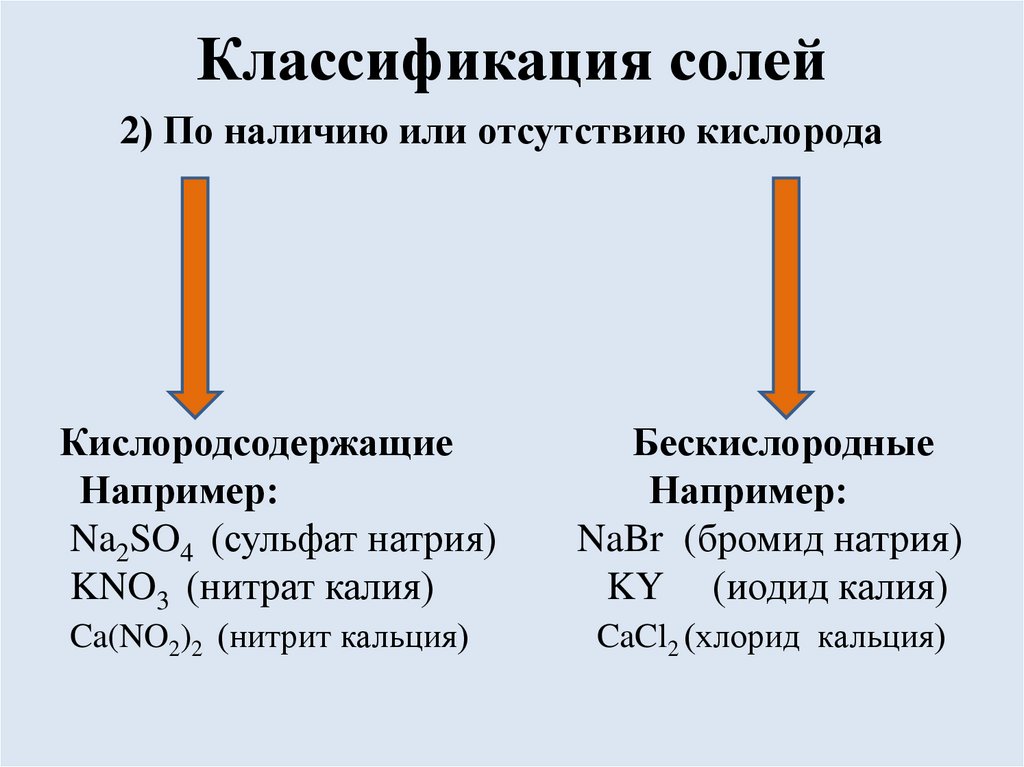
Классификация солей2) По наличию или отсутствию кислорода
Кислородсодержащие
Например:
Na2SO4 (сульфат натрия)
KNO3 (нитрат калия)
Бескислородные
Например:
NaBr (бромид натрия)
KY (иодид калия)
Ca(NO2)2 (нитрит кальция)
CaCl2 (хлорид кальция)
5.
Разновидности солейСоли бывают:
1) Средние соли – это продукты полного
замещения атомов водорода в кислоте на
металл.
Например: Na2CO3 (карбонат натрия)
CuSO4 (сульфат меди)
Диссоциация средних солей:
Na2CO3 = 2Na+ + CO32-
6.
Разновидности солей2) Кислые соли – это продукты неполного
замещения атомов водорода в кислоте на
металл.
Например:
NaHCO3 (гидрокарбонат натрия)
Mg(HSO4)2 (гидросульфат магния)
Диссоциация кислых солей:
Ca(HSO4)2 = Ca2+ + 2HSO4-
7.
Разновидности солей3) Основные соли – это продукты
неполного замещения гидроксогрупп в
основании на кислотный остаток.
Например:
(CuOH)2CO3 (гидроксокарбонат меди (II))
AlOHCl2 (гидроксохлорид алюминия)
Диссоциация основных солей:
AlOHCl2 = AlOH2+ + 2Cl-
8.
Установите соответствиеФОРМУЛА ВЕЩЕСТВА
КЛАСС ВЕЩЕСТВА
А) Cu(NO3)2
Б) Ca(OH)2
В) H3PO4
1) оксид
2) кислота
3) соль
4) основание
9.
Установите соответствиеФОРМУЛА ВЕЩЕСТВА
КЛАСС ВЕЩЕСТВА
А) CаОНNO3
Б) Ca(НСO3)2
В) Са3(PO4)2
1) соль средняя
2) соль кислая
3) соль основная
4) основание
5) кислота
10.
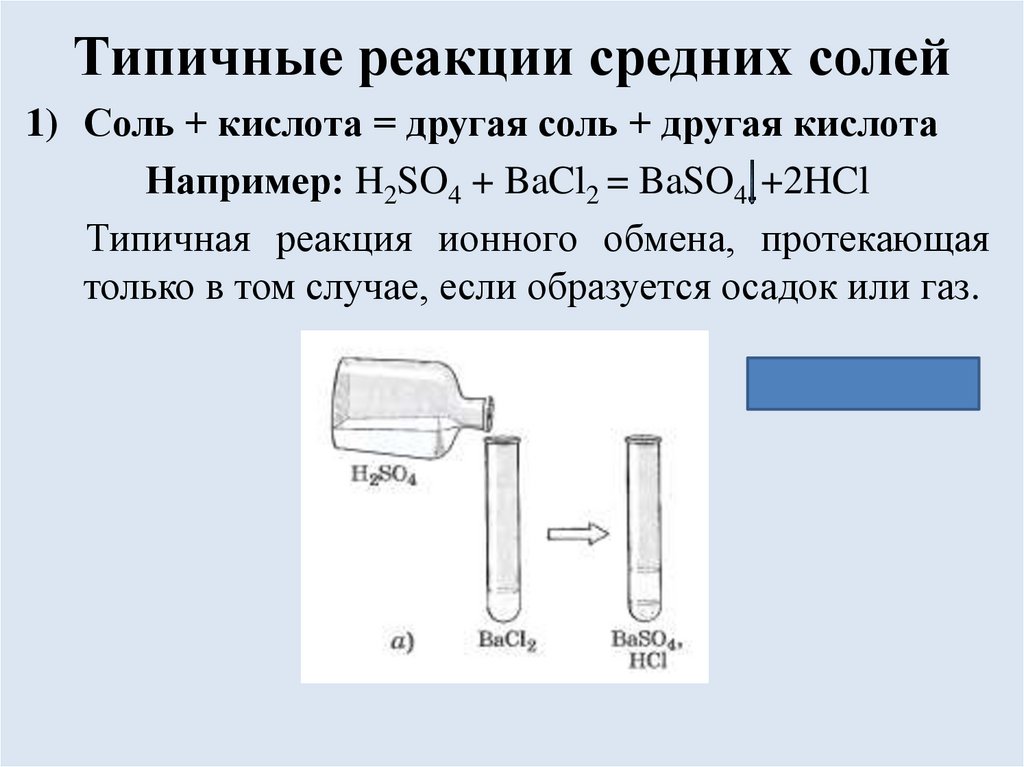
Типичные реакции средних солей1) Соль + кислота = другая соль + другая кислота
Например: H2SO4 + BaCl2 = BaSO4 +2HCl
Типичная реакция ионного обмена, протекающая
только в том случае, если образуется осадок или газ.
11.
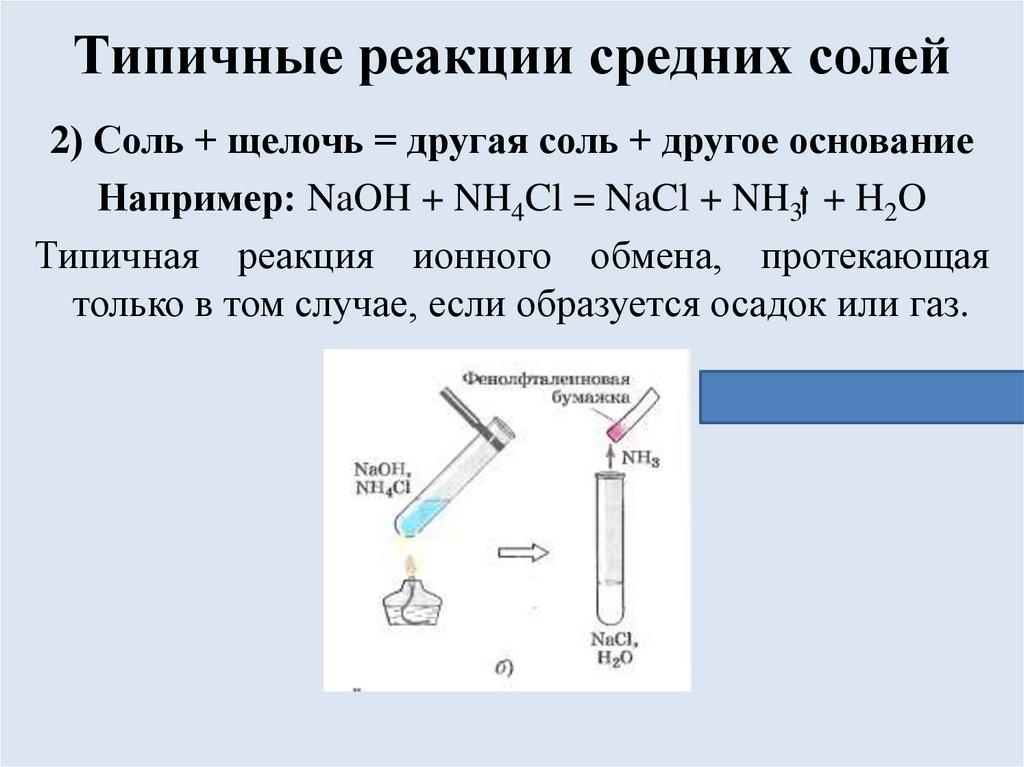
Типичные реакции средних солей2) Соль + щелочь = другая соль + другое основание
Например: NaOH + NH4Cl = NaCl + NH3 + H2O
Типичная реакция ионного обмена, протекающая
только в том случае, если образуется осадок или газ.
12.
Типичные реакции средних солей3) Соль1 + соль2 = соль3 + соль4
Например: Na2SO4 + BaCl2 = BaSO4 +2NaCl
Типичная реакция ионного обмена, протекающая
только в том случае, если образуется осадок.
13.
Типичные реакции средних солей4) Соль + металл = другая соль + другой металл
Например: CuSO4(p-p) + Fe = FeSO4 (p-p) + Cu
Правила: а) Каждый металл вытесняет из
растворов
солей
все
другие
металлы,
расположенные правее его в ряду напряжений;
б) обе соли (и реагирующая, и образующаяся в
результате реакции) должны быть растворимыми;
в) металлы не должны взаимодействовать с водой,
поэтому металлы главных подгрупп I и II группы
ПС Д.И.Менделеева не вытесняют другие
металлы из растворов солей.
14.
Получение солей:1. Взаимодействие кислоты с Ме:
Zn + 2HCI → ZnCI2 + H2
2. Взаимодействие кислоты с основными оксидами:
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3 H2O
3. Взаимодействие кислотного оксида со щёлочью:
N2O5 + Ca(OH)2 →Ca(NO3)2 + H2O
4. Взаимодействие кислотного оксида с основным
оксидом:
SiO2 + CaO → CaSiO3
5. Взаимодействие металла с неметаллом:
2Fe + 3CI2 → 2FeCI3
15.
Применение солей- в стирке, с помощью порошка, с состав
которого входит стиральная (кальцинированная)
сода – Na2CO3;
- удобрения, которые мы вносим в почву –
NH4NO3- аммиачная селитра; CaHPO4- простой
суперфосфат и другие.
- в домашней аптечке – ляпис AgNO3
- СuSO4- медный купорос, который добавляют в
побелку, применяют против болезней и
вредителей растений.
да и сам наш организм содержит соли, в костях –
Ca3(PO4)2
16.
Домашнее задание:•Параграф. 26, стр. 111-115, выписать и выучить:
1) Определения с примерами солей.
2) Типичные реакции солей с примерами
уравнений реакций.
3) Получение солей с примерами и уравнениями
реакций.
4)Подготовиться к тесту по теме «Соли».
5) Письменно слайд № 17 из презентации.
6) По желанию на дополнительную отметку стр.
115, вопрос 10.
17.
Задание 1. Запишите формулывеществ по их названию
• Оксид магния –
• Оксид серы (IV) • Гидроксид алюминия • Соляная кислота • Гидроксид калия • Серная кислота –
Задание 2. Напишите название веществ и укажите к
какому классу неорганических соединений они
относится?
P2O5, NaСl, Cu(OН)2, Са3(РО4)2, HNO3, Ba(OH)2, MgO,
H2SO4, KOН, SO3, CaCO3













 chemistry
chemistry








