Similar presentations:
Соли. Классификация. Физические и химические свойства. Получение и применение солей
1.
Записать формулы:• Оксид магния –
• Оксид серы (IV) • Гидроксид алюминия • Соляная кислота • Гидроксид калия • Серная кислота –
2.
• Азотистая кислота• Фосфорная кислота
• Кремниевая кислота
• Угольная кислота
• Гидроксид железа (III)
• Оксид азота (II)
3.
Ответы• −MgO,
• – SO2,
• – Al(OH)3,
• −HCl,
• −KOH,
• −H2SO4
4.
В нашей лаборатории расцвёл цветок необычайнойкрасоты – на его лепестках – формулы веществ.
Расклассифицируйте вещества по классам: oксиды,
кислоты, основания
P2O5, NaСI, CuOН, Са3(РО4)2 , HNO3,
Ba(OH)2, MgO, H2SO4, KOН, SO3, CaCO3
5.
Соли. Классификация.Физические и химические свойства.
Получение и применение солей.
6.
Цели урока:1)Познакомить учащихся с понятием соли,
изучить основные классификации солей;
2)Изучить основные химические свойства
солей;
3)Изучить основные способы получения солей;
4)Продолжить формирование умений составлять
уравнения химических реакций;
7.
• NaСI• Са3(РО4)2
• CaCO3
8.
Что такое соли?Соли–это сложные вещества, образованные
атомами металлов и кислотными остатками
9.
Номенклатура солейНазвание
Название
Указание
Кислотного + металла (в Р.п.) + валентности
остатка
• NaCl
хлорид натрия
• CaCO3
карбонат кальция
• Са3(РО4)2 фосфат кальция
• МgCI2
хлорид магния
(если она переменная)
10.
Попробуйте сами дать названия следующимсолям:
• KCI
• CaCI2
• BaCO3
11.
Классификация солей1) По растворимости в воде
Растворимые
Нерастворимые
Малорастворимые
Аммиачная селитра
NH4NO3
Сульфат кальция
CaSO4
Фосфат железа
FePO4
12.
Классификация солей2) По наличию или отсутствию кислорода
Кислородсодержащие
Например:
Na2SO4 (сульфат натрия)
KNO3 (нитрат калия)
Бескислородные
Например:
NaBr (бромид натрия)
KY (иодид калия)
Ca(NO2)2 (нитрит кальция)
CaCl2 (хлорид кальция)
13.
Классификация солейСоли
Средние
(нормальные)
Кислые
Основные
14.
Разновидности солейСоли бывают:
1) Средние соли – это продукты полного
замещения атомов водорода в кислоте на
металл.
Например: Na2CO3 (карбонат натрия)
CuSO4 (сульфат меди)
15.
Разновидности солей2) Кислые соли – это продукты неполного
замещения атомов водорода в кислоте на
металл.
Например:
NaHCO3 (гидрокарбонат натрия)
Mg(HSO4)2 (гидросульфат магния)
16.
Разновидности солей3) Основные соли – это продукты
неполного замещения гидроксогрупп в
основании на кислотный остаток.
Например:
(CuOH)2CO3 (гидроксокарбонат меди (II))
AlOHCl2 (гидроксохлорид алюминия)
17.
Физические свойства:Все соли твердые кристаллические вещества.
Соли имеют различную окраску, и разную
растворимость в воде.
18.
Написать названия солей1. NaCl
2. CaCO3
3. Са3(РО4)2
4. МgBr2
5. KNO2
6. CuSO4
19.
Написать формулы солей• 7. Сульфит бария
• 8. Силикат магния
• 9. Иодид калия
• 10. Фосфат цинка
• 11. Карбонат бария.
• 12. Нитрат серебра
20.
Химические свойства1) Соль + кислота = другая соль + другая кислота
Например: H2SO4 + BaCl2 = BaSO4 +2HCl
Типичная реакция ионного обмена, протекающая
только в том случае, если образуется осадок или газ.
21.
Химические свойства2) Соль + щелочь = другая соль + другое основание
Например: NaOH + NH4Cl = NaCl + NH3 + H2O
Типичная реакция ионного обмена, протекающая
только в том случае, если образуется осадок или газ.
22.
Химические свойства3) Соль1 + соль2 = соль3 + соль4
Например: Na2SO4 + BaCl2 = BaSO4 +2NaCl
Типичная реакция ионного обмена, протекающая
только в том случае, если образуется осадок.
23.
Химические свойства4) Соль + металл = другая соль + другой металл
Например: CuSO4(p-p) + Fe = FeSO4 (p-p) + Cu
Правила: а) Каждый металл вытесняет из
растворов
солей
все
другие
металлы,
расположенные правее его в ряду напряжений;
б) обе соли (и реагирующая, и образующаяся в
результате реакции) должны быть растворимыми;
в) металлы не должны взаимодействовать с водой,
поэтому металлы главных подгрупп I и II группы
ПС Д.И.Менделеева не вытесняют другие
металлы из растворов солей.
24.
Получение солей:1. Взаимодействие кислоты с Ме:
Zn + 2HCI → ZnCI2 + H2
2. Взаимодействие кислоты с основными оксидами:
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3 H2O
3. Взаимодействие кислотного оксида со щёлочью:
N2O5 + Ca(OH)2 →Ca(NO3)2 + H2O
4. Взаимодействие кислотного оксида с основным
оксидом:
SiO2 + CaO → CaSiO3
5. Взаимодействие металла с неметаллом:
2Fe + 3CI2 → 2FeCI3
25.
Применение солей- в стирке, с помощью порошка, с состав которого
входит стиральная (кальцинированная) сода –
Na2CO3;
- удобрения, которые мы вносим в почву –
NH4NO3- аммиачная селитра; CaHPO4- простой
суперфосфат и другие.
- в домашней аптечке – ляпис AgNO3
- СuSO4- медный купорос, который добавляют в
побелку, применяют против болезней и вредителей
растений.
да и сам наш организм содержит соли, в костях –
Ca3(PO4)2
26.
Мрамор, известняк, мел27.
ИЗДЕЛИЯ ИЗМАЛАХИТА
28.
Обобщение темыТест «Как я запомнил тему»:
1) Выберите формулу соли:
а) HCl
б) Ca(OH)2
в) Na2SO4 г) MgО
2) Какая из приведенных солей растворима в воде:
а) AgCl б) MgS
в) FePO4 г) CuSO4
3) Какая из приведенных солей бескислородная:
а) CаSO4 б) KBr
в) NH4NO3 г) Na2CO3
29.
.4) К какому типу солей относится
данная соль AlOHCl2:
а) средняя б) основная
в) кислая г) ни к одной из этих
5) Какая реакция не является типичной реакцией
для средних солей:
а) соль + металл б) соль + кислота
в) соль + оксид г) соль + щелочь
30.
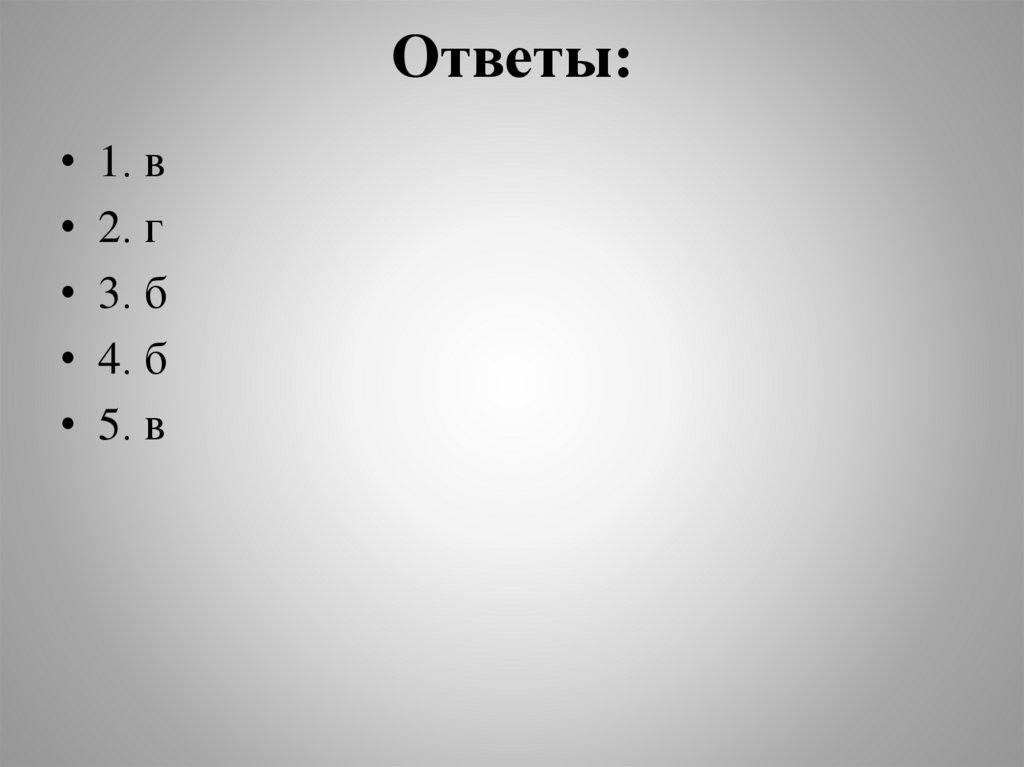
Ответы:• 1. в
• 2. г
• 3. б
• 4. б
• 5. в
31.
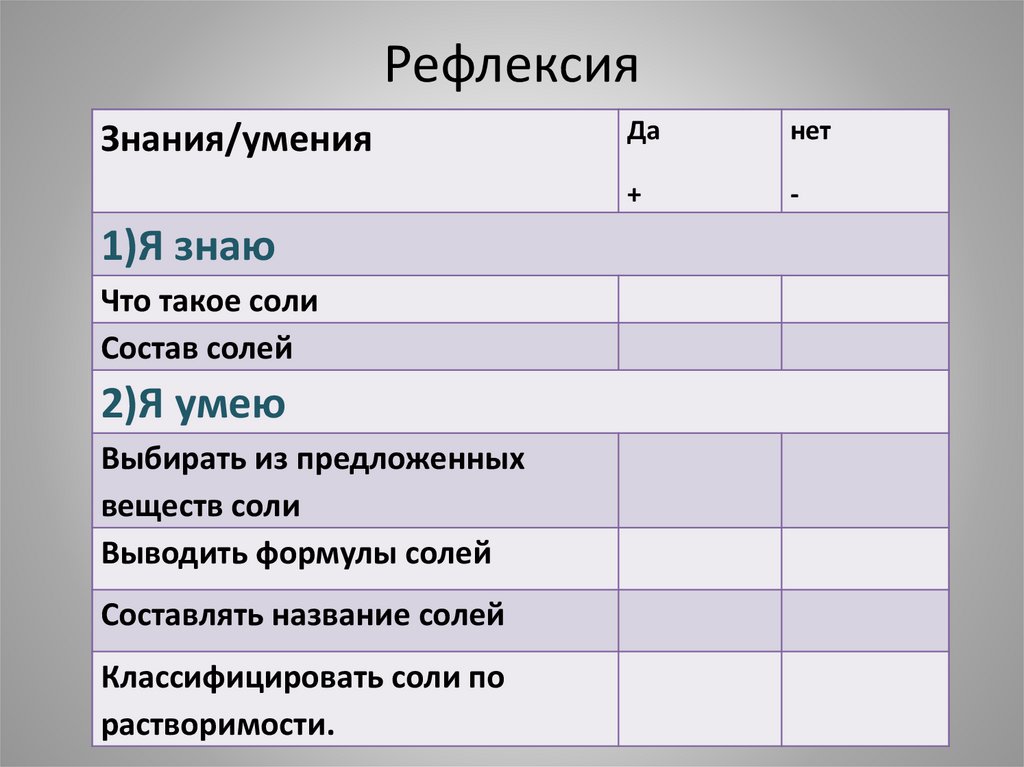
РефлексияЗнания/умения
1)Я знаю
Что такое соли
Состав солей
2)Я умею
Выбирать из предложенных
веществ соли
Выводить формулы солей
Составлять название солей
Классифицировать соли по
растворимости.
Да
нет
+
-
32.
Домашнее задание:§ 26 Упр. 6, 7 стр.115
33.
Список источниковИспользованы фотографии:
http://ru.wikipedia.org/wiki/Фосфат железа (III)
фосфат железа
http://www.freetorg.ru/lead/ammiachnaya-selitra-azotno-fosfornokalijnoe-udobrenie-npk,1506202.html
аммиачная селитра
http://www.freetorg.com.ua/lead/prodam-kalcijsernokislyj,2478523.html
сульфат кальция































 chemistry
chemistry








