Similar presentations:
Потенциометрический метод анализа Основные типы немембранных индикаторных электродов
1.
Лекция 3.Потенциометрический метод анализа
Основные типы немембранных индикаторных
электродов;
Электроды сравнения;
Диффузионный потенциал;
Уравнение Гендерсона.
2.
Анализ уравнения НернстаG 0 j 0j i i0 RT ln K (1)
j
i
0
i
E
0
j
i
i
0
j
j
zF
i
a
i
RT
E E 2,303
lg
zF a j j (4)
0
(2)
RT
E
ln K
zF
0
E
R 8,314 Дж моль 1 К 1
F 96487 Кл моль 1
0, 0001984 Дж Кл 1 K 1 Т
Т 298
0, 0591В
Т 298
(3)
0, 0591 0, 0002(Т 298) В
tg
z
lg a
3.
Электроды первого родаM z
M
M
M z ze
E E
0
M z / M
(1)
RT aM z (2)
ln
zF
aM =1
Ag , Cu , Zn, Cd , Hg ;( Pb, Sn, In, Ga )
Ag
Ag e
Процесс самопроизвольный
RT
0
0
E E Ag / Ag
ln a Ag ;
E Ag
0, 799 В
/ Ag
F
Zn Процесс несамопроизвольный
Zn 2 2e
RT
0
0
E EZn
ln
a
E
0, 76 В
2
2 ;
/ Zn
Zn
Zn 2 / Zn
F
4.
Амальгамные электродыM z
M , Hg
M ( Hg ) (1)
M z ze
E E
0
M z / M , Hg
aM z (2)
RT
ln
zF aM ( Hg )
M x Hg y
xM z xze yHg
E E
0
M z / M x , Hg y , Hg
aMx z
RT
ln
xzF aM x Hg y ( Hg )
(3)
(4)
5.
Электроды второго родаA
MA ze
M
zA
(1)
aMA
RT
ln
zF aM a Az
(2)
E E A0 / MA, M lg a A
(3)
E E A0 / MA, M
a A
ПРMA
aM
(4) E E
E E
0
M /M
RT
ln aM
F
Cl / AgCl , Ag
MA, M
0
A / MA, M
(6)
RT
RT
ln ПРMA
ln aM (5)
F
F
E
0
A / MA, M
Cl / Hg 2Cl2 , Hg
E
0
M /M
RT
ln ПРMA (7)
F
SO42 / Hg 2 SO4 , Hg
6.
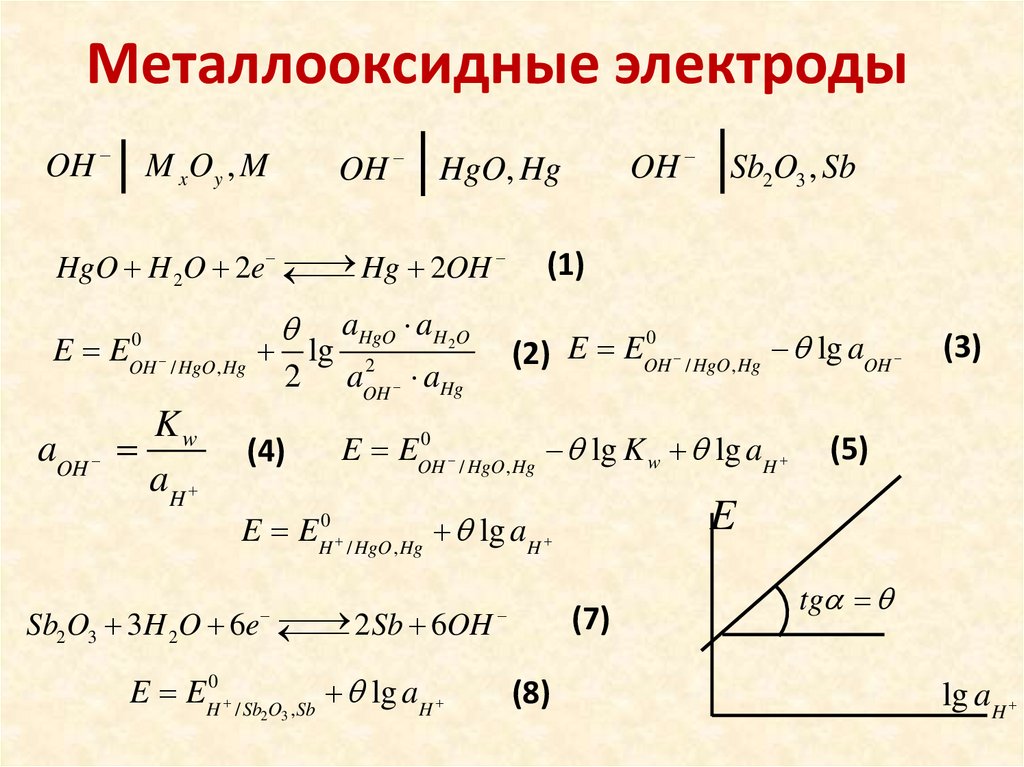
Металлооксидные электродыOH
OH
M x Oy , M
Hg 2OH
HgO H 2O 2e
E E
Kw
aOH
aH
(4)
0
OH / HgO , Hg
2
lg
aHgO aH 2O
2
OH
a
OH
HgO, Hg
(1)
0
E
E
lg aOH
(2)
OH / HgO , Hg
aHg
0
E EOH
lg K w lg aH
/ HgO , Hg
2Sb 6OH
Sb2O3 3H 2O 6e
E EH0 / Sb O , Sb lg aH
(7)
(8)
(3)
(5)
E
E EH0 / HgO , Hg lg aH
2 3
Sb2O3 , Sb
tg
lg aH
7.
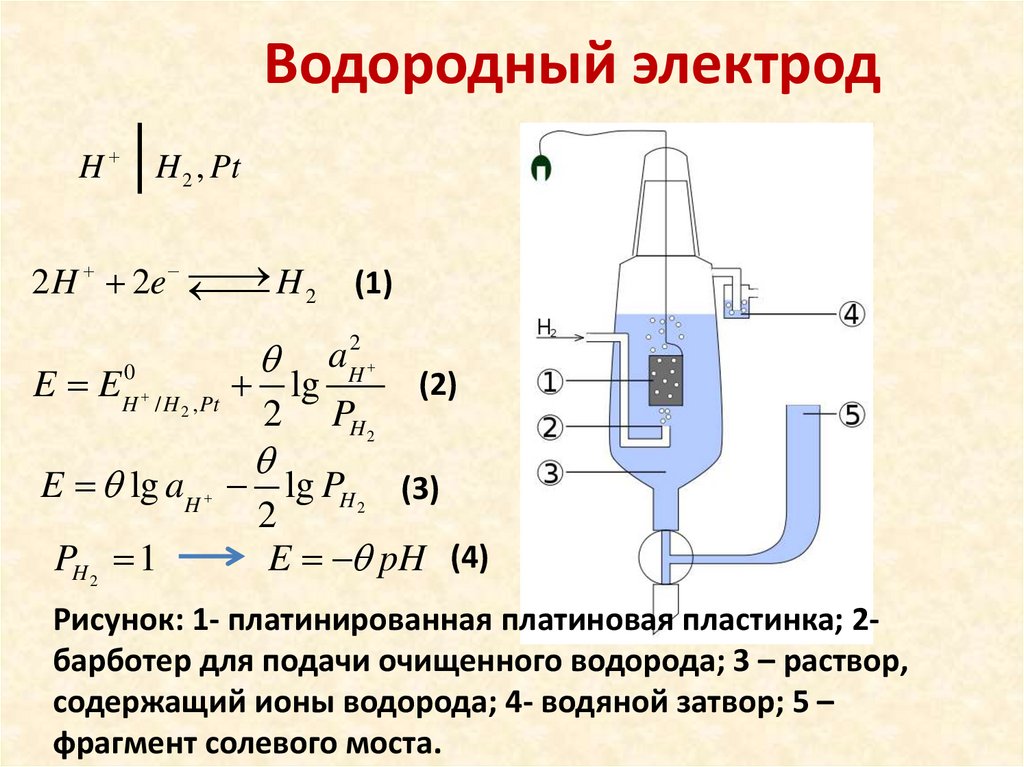
Водородный электродH
H 2 , Pt
H2
2 H 2e
E E
0
H / H 2 , Pt
2
lg
(1)
aH2
PH 2
(2)
E lg aH lg PH 2 (3)
2
PH 2 1
E pH (4)
Рисунок: 1- платинированная платиновая пластинка; 2барботер для подачи очищенного водорода; 3 – раствор,
содержащий ионы водорода; 4- водяной затвор; 5 –
фрагмент солевого моста.
8.
Другие газовые электродыCl
OH O2 , Pt
Cl2 , Pt
4OH (3)
O2 2 H 2O 4e
(1)
Cl2 2e
2
Cl
E E
0
Cl / Cl2 , Pt
2
lg
PCl2
aCl2
Идут побочные реакции,
материал электрода
корродирует
(2)
E E
0
1
4
lg
PO2
4
aOH
OH HO2
O2 H 2O 2e
(4)
E E
0
2
2
lg
PO2
2
aOH
Параллельно идут два процесса,
описываемые уравнениями (3)
и (4), устанавливается плохо
воспроизводимый смешанный
потенциал
9.
Окислительно-восстановительныеэлектроды
Ox, Red
Ox, Red , H
Pt
Fe 2
Fe3 e
2
MnO4 8H 5e
Mn
4 H 2O (5)
(1)
MnO42
MnO4 e
(2)
aFe3 (3)
0
E EFe3 , Fe2 lg
aFe2
0
E EMnO
lg
, MnO 2
4
4
Pt
aMnO
4
aMnO2
4
E E
0
MnO4 , Mn 2
lg
5
aMnO aH8
E f ( pH )
(4)
4
aMn2
(6)
10.
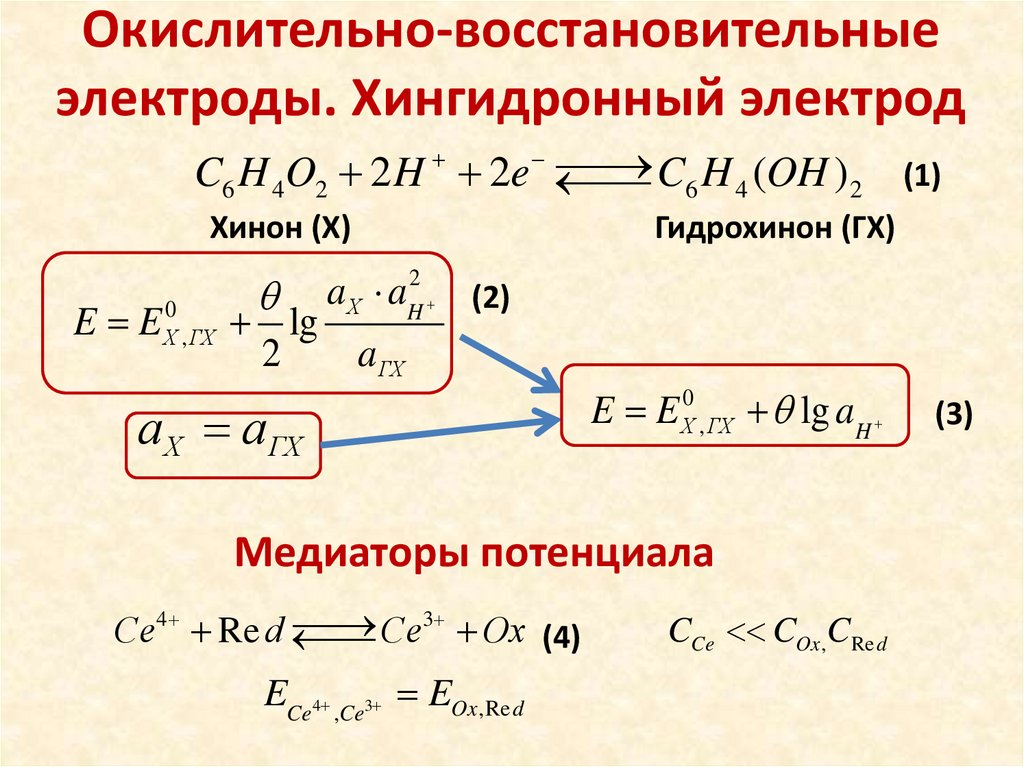
Окислительно-восстановительныеэлектроды. Хингидронный электрод
C6 H 4 (OH ) 2
C6 H 4O2 2 H 2e
Хинон (Х)
2
a
a
(2)
Х
0
H
E E Х , ГХ lg
2
aГХ
а Х аГХ
Гидрохинон (ГХ)
E E Х0 , ГХ lg aH
Медиаторы потенциала
3
Сe 4 Re d
Сe
Ox (4)
ECe4 ,Ce3 EOx ,Re d
(1)
CCe COx ,CRe d
(3)
11.
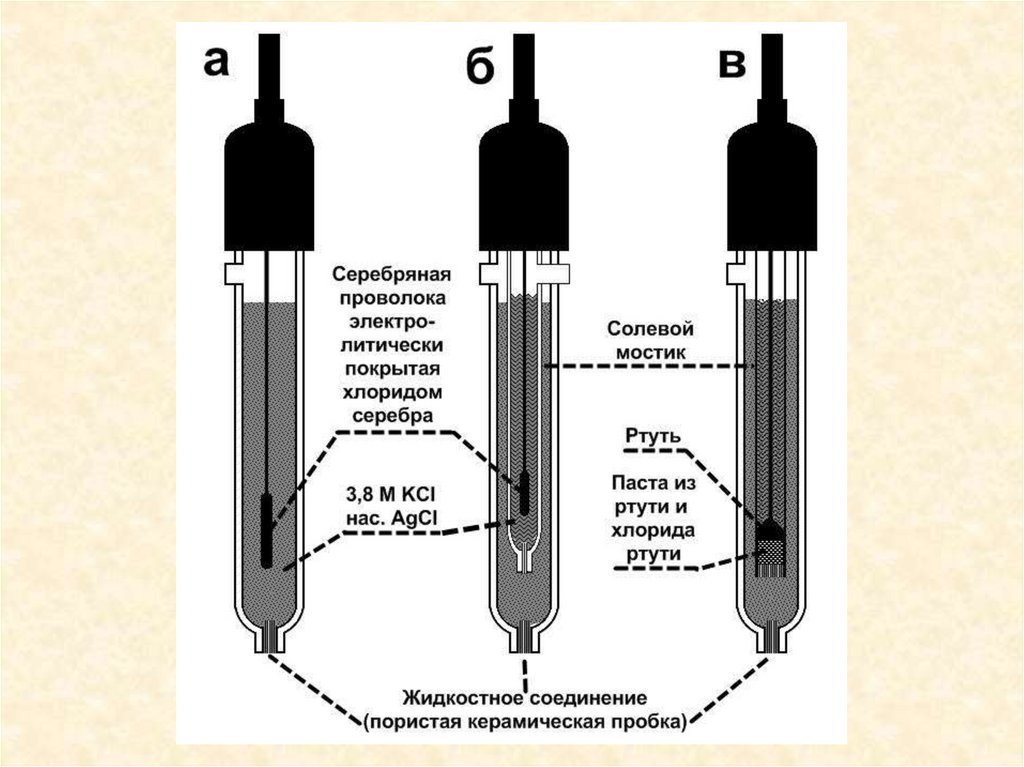
ЭЛЕКТРОДЫ СРАВНЕНИЯ(1)
(2)
(3)
(4)
12.
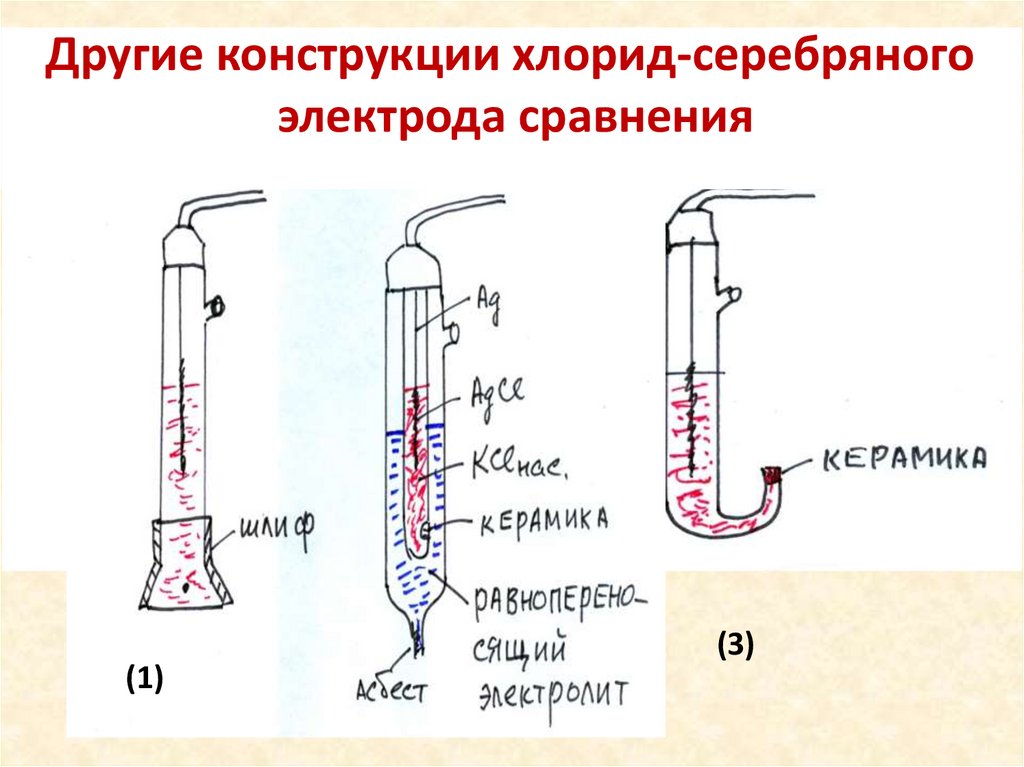
Другие конструкции хлорид-серебряногоэлектродаДсравнения
(1)
(3)
13.
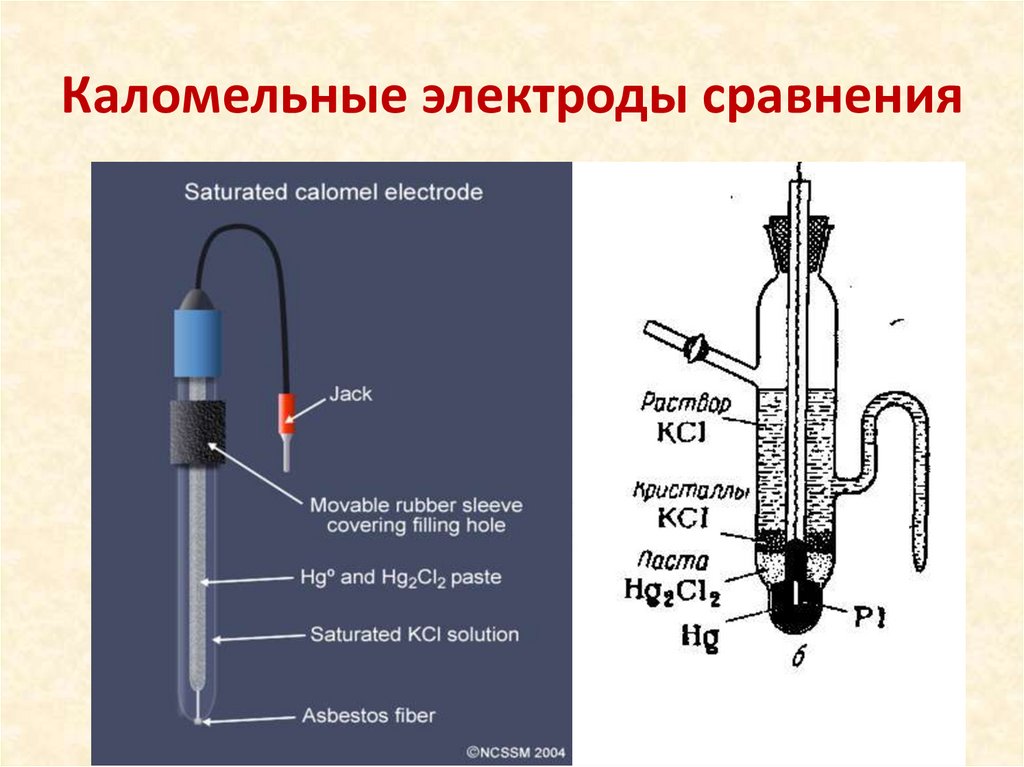
Каломельные электроды сравнения14.
15.
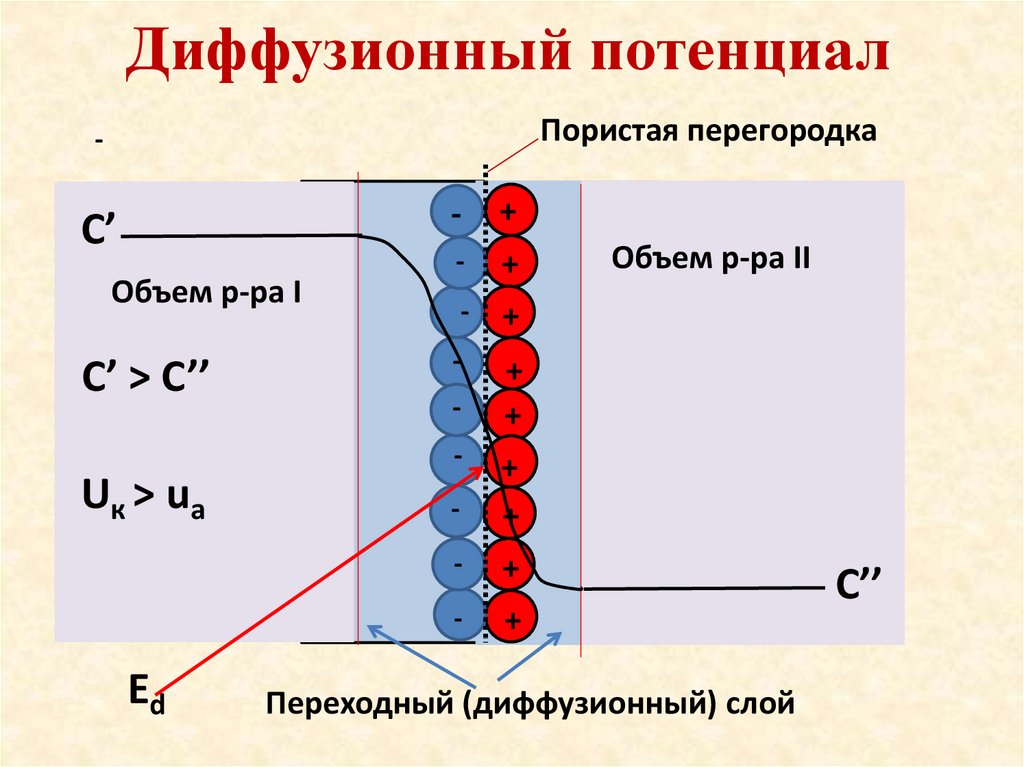
Диффузионный потенциалПористая перегородка
-
-
+
+
-
+
-
+
+
-
С’
Объем р-ра I
С’ > C’’
-
-
Uк > uа
Еd
-
+
+
-
+
-
+
Объем р-ра II
Переходный (диффузионный) слой
С’’
16.
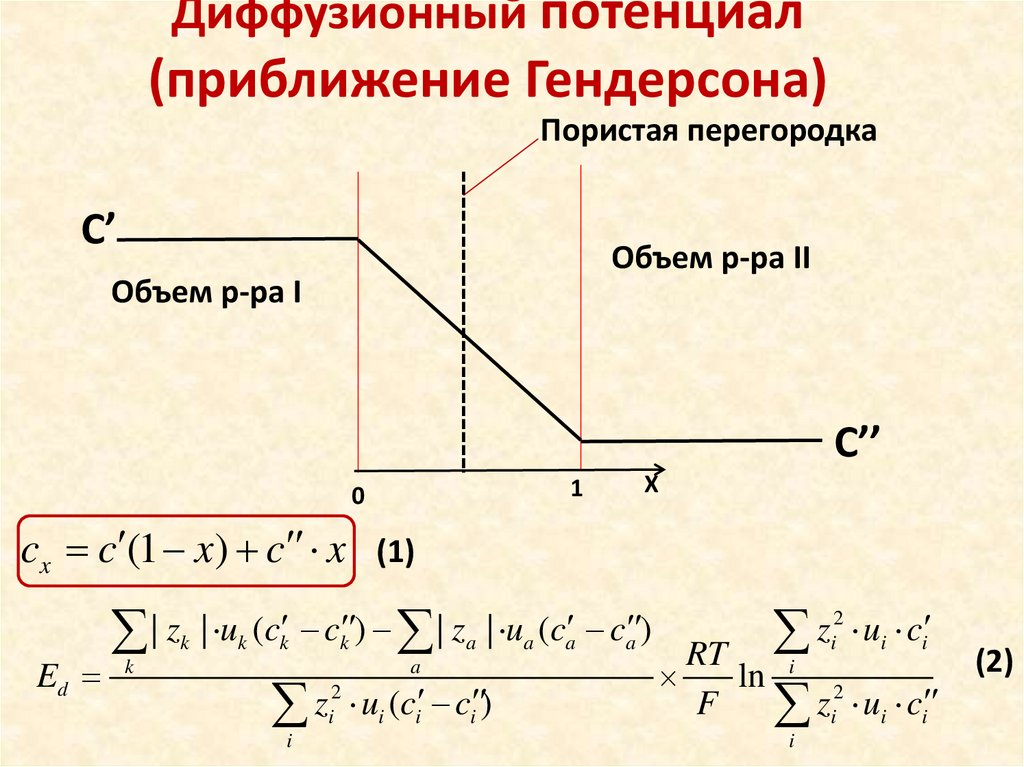
Диффузионный потенциал(приближение Гендерсона)
Пористая перегородка
С’
Объем р-ра II
Объем р-ра I
С’’
1
0
Х
cx c (1 x) c x (1)
Ed
| zk | uk (ck ck ) | za | ua (ca ca )
k
a
2
z
i ui (ci ci )
i
2
z
i ui ci
RT
ln i 2
F
zi ui ci
i
(2)
17.
ДИФУЗИОННЫЙ ПОТЕНЦИАЛЧАСТНЫЕ СЛУЧАИ
А В А В
1)
2)
или:
С C
uK u A RT C
Ed
ln
uK u A F
C
zK z A 1
А1 В А2 В
А В1 А В2
zK z A 1
С C
RT uK1 u A1
Ed
ln
F
uK2 u A2
«+» - ОБЩИЙ АНИОН
«-» - ОБЩИЙ КАТИОН
18.
Значения подвижностей некоторыхионов
Ион
u∙109см2∙с-1Дж-1моль
H+
Li+
Na+
K+
OH−
Cl−
NO3−
Ac−
SO42−
37,6
4,24
5,47
8,00
20,6
8,11
7,58
4,38
4,24
KCl + KNO3 (4:1)
Идеальный
равнопереносящий
электролит
19.
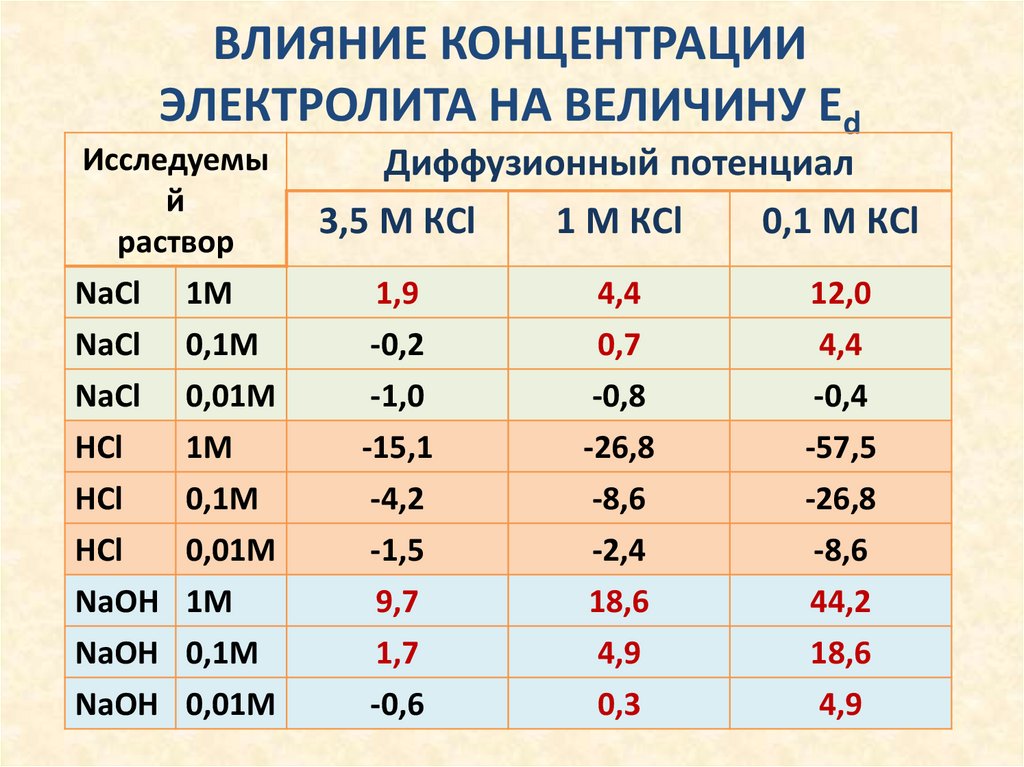
ВЛИЯНИЕ КОНЦЕНТРАЦИИЭЛЕКТРОЛИТА НА ВЕЛИЧИНУ Еd
Исследуемы
й
раствор
NaCl 1M
NaCl
NaCl
HCl
0,1М
0,01М
1M
HCl
0,1М
HCl
0,01М
NaOH 1M
NaOH 0,1М
NaOH 0,01М
Диффузионный потенциал
3,5 М КCl
1 М КCl
0,1 М КCl
1,9
-0,2
-1,0
-15,1
-4,2
-1,5
9,7
1,7
-0,6
4,4
0,7
-0,8
-26,8
-8,6
-2,4
18,6
4,9
0,3
12,0
4,4
-0,4
-57,5
-26,8
-8,6
44,2
18,6
4,9
20.
Дополнительная литература к лекции 3.В.Морф. Принципы работы ионоселективных электродов и
мембранный транспорт. М.: Мир. 1985. с.52-58.










 chemistry
chemistry








