Similar presentations:
Растворы. Электрохимия
1.
ОБЩАЯ ХИМИЯ(лекция 11)
Продолжение лекции «Растворы»
2.
д.х.н., профессоркафедры общей химии
Конюхов Валерий Юрьевич
VK id2476227
3.
План лекций4.
Электрохимия• Типы электрохимических процессов. Окислительно-восстановительные системы.
Двойной электрический слой, скачок потенциала на межфазной границе.
Электродный потенциал. Уравнение Нернста. Зависимость электродного потенциала
от материала электродов и состава раствора. Электрохимический ряд напряжения.
Стандартный электрод сравнения.
Классификация электродов: металлические, неметаллические, окислительновосстановительные, газовые электроды (водородный, кислородный) и электродные
реакции, протекающие на них.
Ионоселективные электроды.
Химические источники тока: обратимые, необратимые, концентрационные.
Гальванический элемент, аккумулятор, разовые источники тока, топливный элемент.
Устройство и принцип действия.
Электродвижущая сила.
Электролиз. Последовательность электродных процессов для водных растворов
электролитов. Перенапряжение.
Основные виды коррозии металлов. Электрохимическая коррозия. Коррозия
металлов и проблема надежности. Методы защиты от коррозии.
5.
Тема 17. КОНТРОЛЬНЫЕ ВОПРОСЫПО КУРСУ ХИМИИ
(для подготовки к экзамену и выполнения
итогового домашнего задания)
1.Двойной электрический слой, электродный потенциал,
гальванический элемент, электродвижущая сила. Уравнение
Нернста.
2.Электролиз водных растворов. Потенциалы водородного и
кислородного электродов, их зависимость от рН среды.
Перенапряжение. Последовательность разряда ионов на
катоде и аноде.
3.Коррозия
металлов.
Виды
коррозии.
Специфика
электрохимической коррозии. Примеры коррозии в системах
цинк–медь, железо–цинк. Методы защиты от коррозии.
6.
Тема 15. РАСТВОРЫ. ЭЛЕКТРОХИМИЯ1. Электрохимические процессы. Гальванический элемент.
2. Двойной электрический слой. Электродный потенциал.
3. Электродный потенциал (относительный). Стандартный водородный электрод.
4. Электроды первого рода. Уравнение Нернста для электродов первого рода (металлических и
неметаллических электродов).
5. Электроды второго рода, уравнение Нернста для электродов второго рода, примеры электродов.
6. Окислительно-восстановительные электроды. Уравнение Нернста. Влияние рН среды на
потенциалы окислительно–восстановительного электрода.
7. Конструкция и электродные процессы водородного и кислородного электродов, зависимость их
потенциалов от рН среды.
8. Химические и концентрационные электрохимические цепи (гальванические элементы), расчет ЭДС
цепей по уравнению Нернста.
9. Электролиз. Законы Фарадея. Примеры металлов, получаемых электролизом водных растворов.
Реакции электролиза.
10. Факторы, определяющие последовательность разряда ионов при электролизе?
11. Перенапряжение и факторы, которые определяют его величину.
12. Электрохимическая коррозия на примере систем Fe–Cu и Fe–Sn.
13. Защита металлов от коррозии.
7.
Список литературы1. Н.В. Коровин. Общая химия. М.: Высшая школа.
2014.
2. Н.С.Ахметов. Общая и неорганическая химия –
М.:ВШ, 2012.
3. Н.Л. Глинка «Общая химия» М.: Изд. «Химия»,
2002.
4. Жукова Т.В., Глаголева М.А., Липанова Н.В.,
Сергиевский В.В., Сорока И.В. Общая химия
(основные понятия, примеры, задачи). М.: МИФИ,
2008.
5. Сергиевский В.В., Ананьева Е.А., Жукова Т.В.,
Звончевская М.Ф., Кучук Ж.С., Котыхова О.А.
Неорганическая химия: учебное пособие для
внеаудиторной работы. М.: МИФИ, 2007.
8.
Литература• Общая химия лабораторные работы
(под редакцией Е.А. Ананьевой) М.:
МИФИ, 2010.
• Сборник тестов и задач по курсу
химии. НИЯУ МИФИ. М.: 2014.
• Общая и неорганическая химия (под
редакцией А.Ф. Воробьева).
• Т. 1 и 2. М.: Академкнига. 2004.
9.
Скачки потенциалов на границераздела фаз
10.
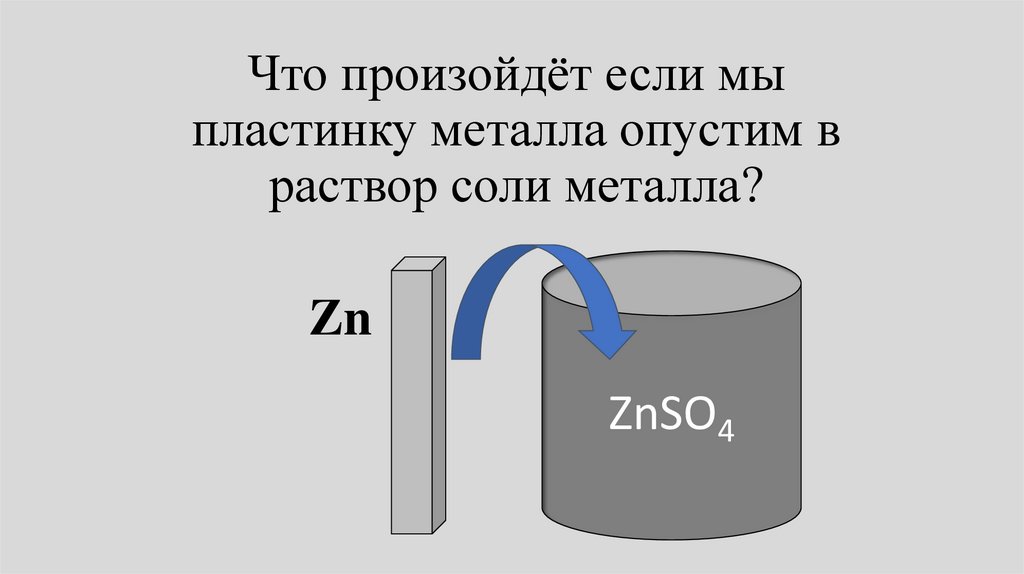
Что произойдёт если мыпластинку металла опустим в
раствор соли металла?
Zn
ZnSO4
11.
• В общем случае химический потенциалметалла Zn,М в фазе металла отличается от
химического потенциала металла в
растворе Zn,L. Потенциалы начнут
выравниваться.
• При этом в зависимости от соотношения
Zn,М и Zn,L либо металл будет
растворяться, либо ионы металла будут
разражаться и высаживаться на пластине.
12.
• По мере протекания процессапроисходит разделение зарядов.
Одна фаза (например, раствор)
заряжается положительно, другая
(металл) отрицательно (и
наоборот).
• Образующиеся заряды тормозят
переход ионов и, наконец,
остановят его.
13.
•Т. о. при контакте металла ираствора происходит заряжение
контактирующих фаз (металл –
прилегающий раствор) зарядами
различного знака и образуется
ДЭС.
14.
За счёт разделения зарядов награнице раздела фаз возникает
двойной электрический
(ионный) слой (ДЭС).
15.
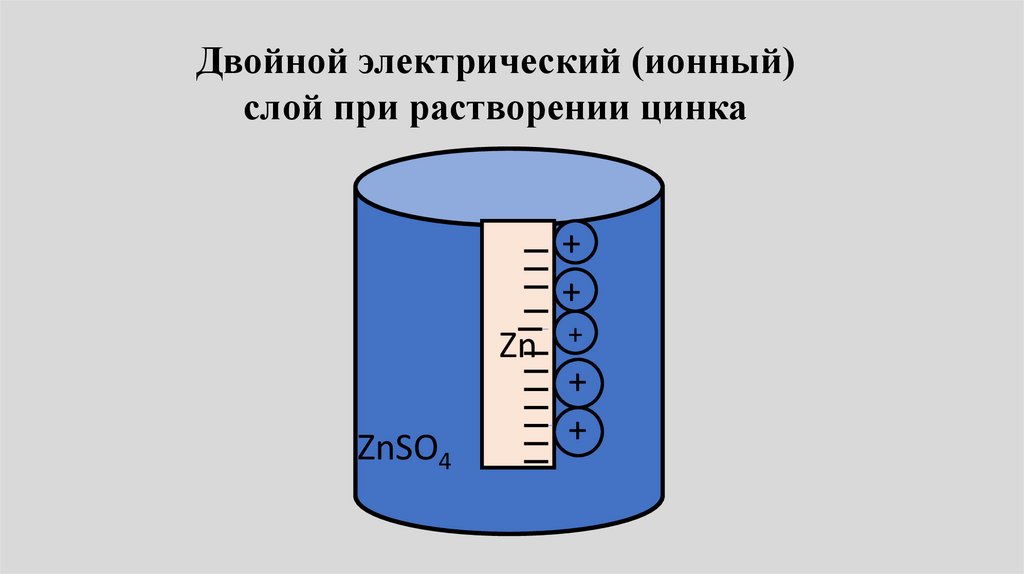
Двойной электрический (ионный)слой при растворении цинка
+
+
Zn
+
ZnSO4
+
++
+
16.
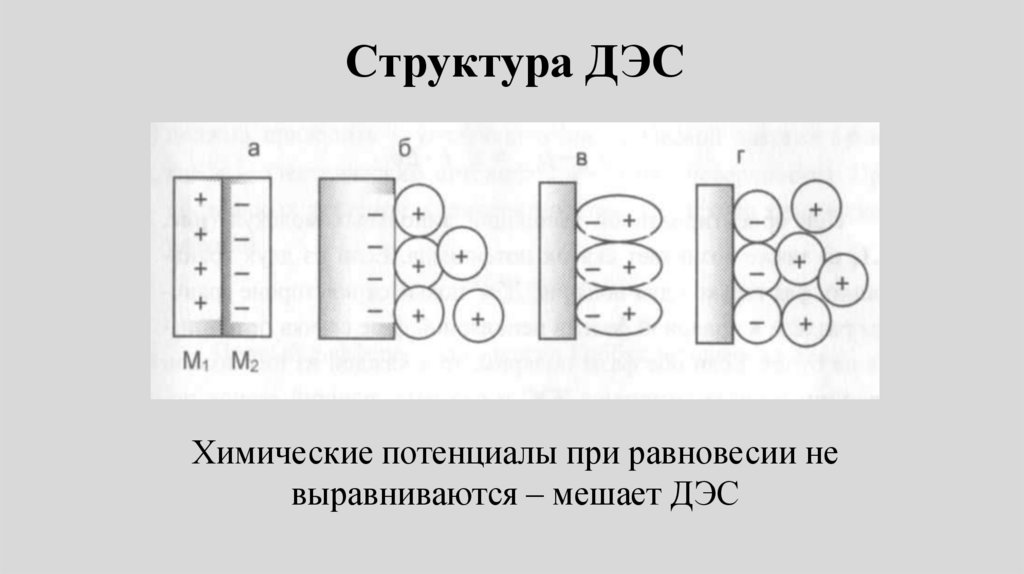
Структура ДЭСХимические потенциалы при равновесии не
выравниваются – мешает ДЭС
17.
• Там где образуется заряд возникаетпотенциал.
• Пространственное разделение
зарядов приводит к разности
потенциалов
• (скачку потенциала).
18.
На границе раздела фазвозникает скачек потенциала
M L= M L
гальвани-потенциал
19.
• Гальвани - потенциал нельзя рассчитатьи измерить, так как по определению
электрический заряд не должен
химически взаимодействовать с фазами,
что неосуществимо,
• При этом его взаимодействие с фазами
различно, т.к. фазы имеют разный
химический состав.
20.
•Металл, опущенный в растворсобственной соли, с ДЭС и
скачком потенциалов на
границе раздела фаз
•- электрод.
21.
• 1. Металл, погруженный в раствор солиэтого металла. Например,
металлическая медь в растворе
сульфата меди:
• CuSO4 Cu или Cu2+ Cu
• Границу раздела фаз изображают
вертикальной чертой.
• Это электрод первого рода
22.
• Из электродов составляютэлектрохимические системы (цепи) –
гальванические элементы.
• Электрохимическая система служит для
осуществления взаимного превращения
электрической и химической форм энергии.
• На электродах цепи протекают
электродные реакции (полуреакции), в
цепи протекает токообразующая реакция.
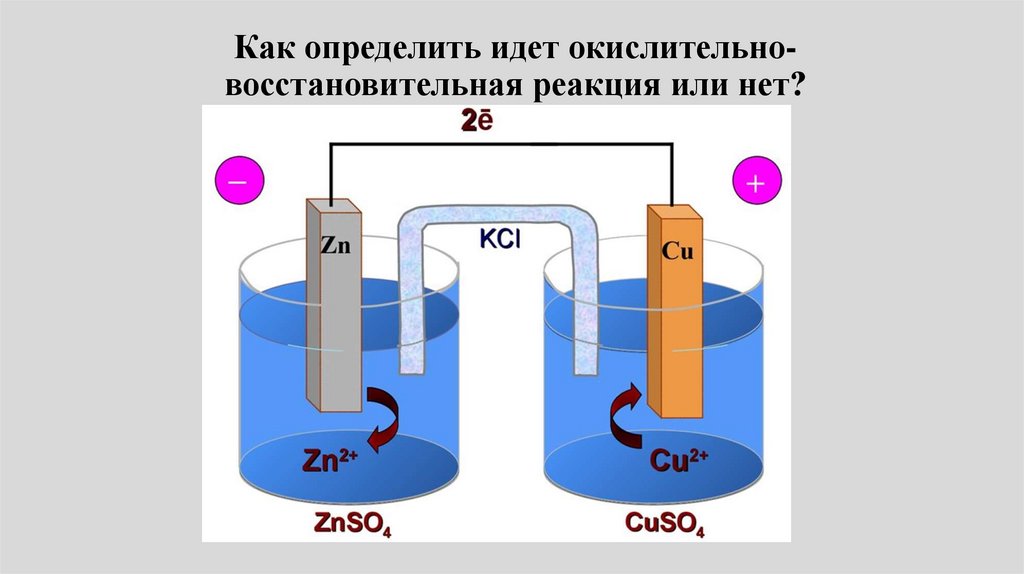
23.
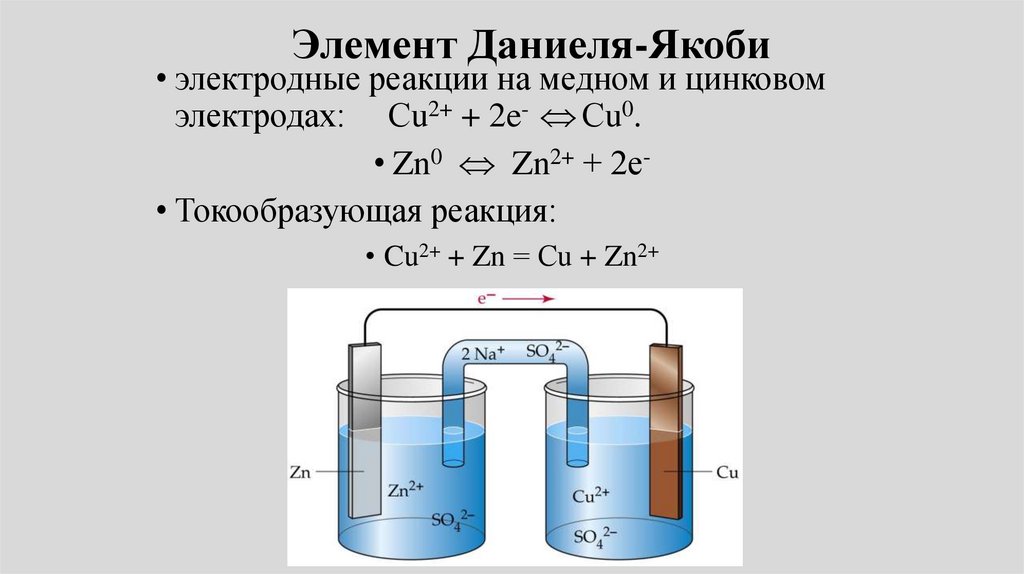
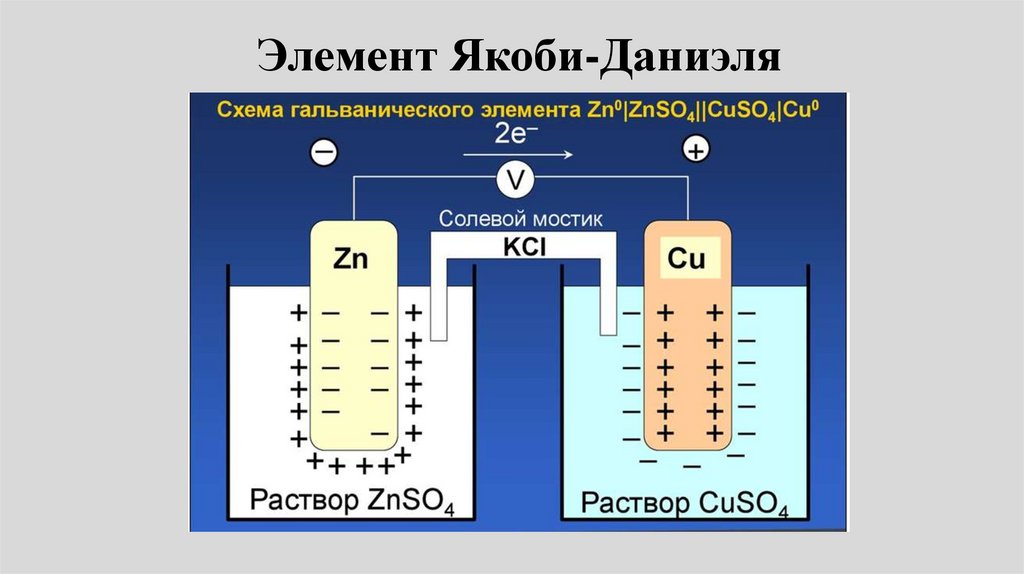
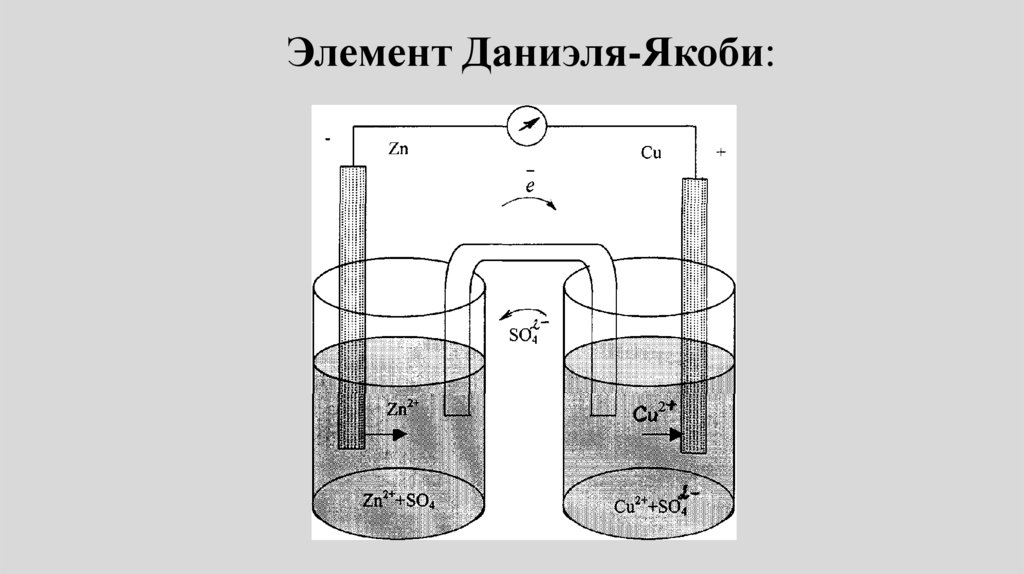
• Пример: Электрохимическая цепьДаниэля – Якоби состоит из
цинковой пластинки, погруженной в
водный раствор ZnSО4, (цинковый
электрод) и медной пластинки,
погруженной в водный раствор
CuSО4 (медный электрод), растворы
контактируют через мембрану или
солевой мостик.
24.
Элемент Даниеля-Якоби• электродные реакции на медном и цинковом
электродах: Сu2+ + 2e- Сu0.
• Zn0 Zn2+ + 2е• Токообразующая реакция:
• Cu2+ + Zn = Сu + Zn2+
25.
• Электролиты могут контактироватьчерез пористую перегородку
(диафрагму) (б) или при помощи
солевого мостика U-образной
трубки, заполненной раствором
электролита с близкими
подвижностями ионов (КСl, NH4NO3),
иммобилизованном агар-агаром (в).
26.
• При разомкнутой цепи видимыеизменения в системе не происходят.
• При замкнутой цепи Даниэля-Якоби
происходит непрерывный процесс
растворения цинка
• Zn Zn2+ + 2е• и непрерывный процесс осаждения
меди
• Сu2+ + 2e- Сu.
27.
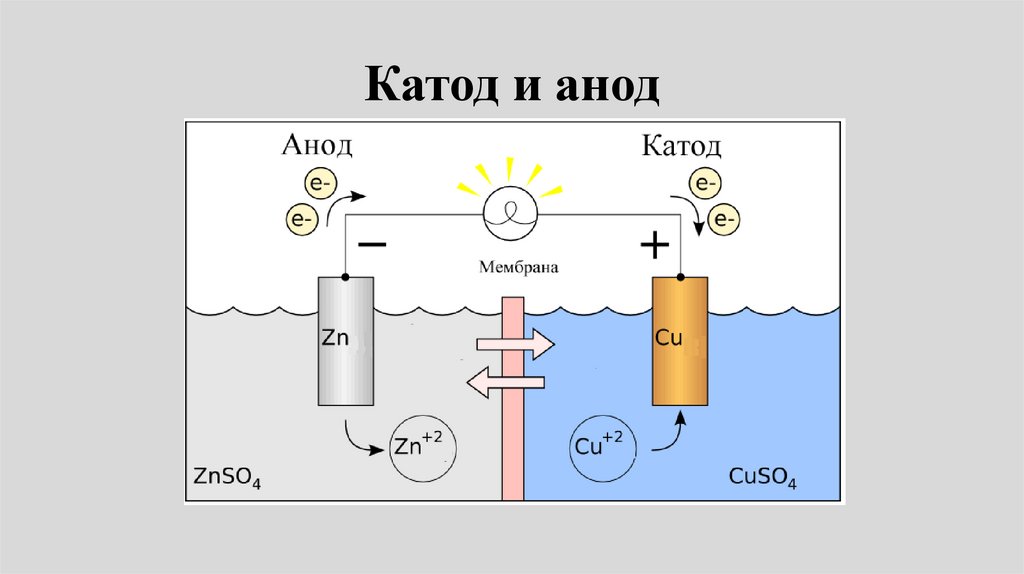
• Электрод, на котором происходитвосстановление, называют катодом
(знак +)(правый электрод).
• Сu2+ + 2e- Сu.
• Электрод, на котором происходит
окисление, - анодом (знак -)
• (левый электрод),
• Zn Zn2+ + 2е-
28.
Катод и анод29.
•Электрохимическую цепь(гальванический элемент)
принято записывать так, чтобы
анод (-) находился слева.
•На аноде протекает реакция
окисления:
2+
•Zn = Zn + 2e
30.
•Катод (+) должен находитсясправа.
•На катоде протекает реакция
восстановления:
•Cu2+ + 2e- = Cu
31.
•Электродные реакции на обоихэлектродах обычно записывают как
реакции восстановления:
•Сu2+ + 2е- = Сu
2+
•Zn + 2e = Zn
•Cu2+ + Zn = Сu + Zn2+
32.
• Общая реакция (токообразующаяреакция) в гальваническом элементе
записывается как разность между
реакциями, протекающими на
правом и левом электродах:
• Правый электрод: Сu2+ + 2е- = Сu0
• Левый электрод: Zn2+ + 2е- = Zn0
• Общая реакция :
• Cu2+ + Zn = Сu + Zn2+.
33.
• Гальвани - потенциал (междуконтактирующими фазами) нельзя
рассчитать и измерить. А знать
потенциалы для различных расчетов
очень хочется!!!!
• Как быть?
• Придумали измерять потенциалы
электродов (разность потенциалов)
относительно электрода (стандартного),
потенциал которого приняли за 0.
34.
•Выбрали в качестве левогоэлектрода некий стандартный
электрод сравнения, его
электродный потенциал при
всех температурах приняли за
нуль.
•Что это за электрод? Кто знает?
35.
• Стандартный водородныйэлектрод это водородный
электрод с активностью ионов Н+
(Н3О+) в растворе, равной 1, и
парциальным давлением
газообразного водорода, равным 1
атм.
• На водородном электроде
протекает реакция:
• Н+ + e- 1/2Н2,
• и его потенциал принимается
равным нулю при любой
температуре.
36.
• Измеряют ЭДС цепи, составленной изэтого стандартного электрода (слева)
и исследуемого электрода (справа).
• Измеренную ЭДС считают
электродным потенциалом
(условным электродным
потенциалом) исследуемого
электрода.
37.
• Согласно конвенции Международногосоюза по чистой и прикладной химии
(IUPAC, 1953 г.), электродный
потенциал Е это ЭДС цепи,
составленной из исследуемого электрода
L| M (справа) и стандартного
водородного электрода (слева):
38.
• Обычно в качестве электродовсравнения используют не
водородный электрод, а электроды
с постоянным Е:
• хлорид-серебряный, каломельный,
ртутно-сульфатный и ртутнооксидный электроды.
39.
Термодинамическаятеория ЭДС
40.
• При равновесном режиме работыгальванического элемента (ток в
цепи I 0) может быть получена
максимально возможная полезная
работа электрическая работа:
• rG = Wmax = n F E
• F – число Фарадея – 96500 К/моль
41.
• Химическую реакцию,сопровождающуюся переходом электронов
между молекулами двух участвующих в
реакции веществ можно записать в виде:
1Ox1 2 Red 2 1Red1 2 Ox 2 (1)
где Ох – окисленная форма, Red –
восстановленная форма, например:
Сu2+ + Zn = Сu +Zn2+
42.
• В электрохимической цепи эта реакцияразбивается на два электродных процесса или
две окислительно-восстановительные
полуреакции:
Ox1 n1e Red1 (а)
Ox 2 n 2e Red 2 (б)
2+ + 2е = Сu0
Сu
Например:
Zn2+ + 2e = Zn0
На самом деле вторая реакция – реакция окисления
Zn = Zn2+ + 2e- , но принято записывать обе реакции как реакции
восстановления.
43.
•Для реакции (1), протекающей вэлектрохимической цепи
постоянных температуре и
давлении, максимальная полезная
работа W max равна:
r G RT ln K a RT i ln ai
Wmax
(2)
44.
С другой стороны максимальнаяполезная работа (электрическая
работа), совершаемая обратимой
электрохимической цепью равна:
r G n F E (3)
Wmax
Объединяя (2) и (3), получаем:
RT
RT
E
ln Ka
i ln ai (4)
n F
n F
45.
Первое слагаемое правой частиуравнения (4) при заданных Р и Т величина постоянная.
Это – стандартная ЭДС
электрохимической цепи (Е°) - при
активности каждого участвующего в
реакции вещества, равной единице:
RT
E
ln Ka
nF
0
46.
С учетом (4) получаемRT
E E
i ln ai
nF
0
(5)
Для реакции (1) уравнение (5) имеет вид:
1
2
a
a
RT
Re
d
0
1 Ox 2
E E
ln 1 2
nF aOx1 aRe d 2
- уравнение Нернста (1890)
(6)
47.
Так как электрохимический процесс (1)представляет собой разность двух
электродных процессов, то и ЭДС можно
представить разностью двух электродных
потенциалов соответственно:
1
Re d1
1
Ox1
a
RT
0
E1 E1
ln
n F a
пр
2
Re d 2
2
Ox2
RT a
E2 E
ln
n F a
лев
0
2
a
RT
Re d1
0
E1
ln
n1F aOx1
RT aRe d2
E
ln
n2 F aOx2
0
2
48.
• где Е01 и Е02 - стандартные потенциалыэлектродов, а n1 1 = n2 2 = n.
• В общем виде потенциал электрода
можно записать через активности всех
веществ, участвующих в электродном
процессе:
RT
Ei E
i ln ai
n F
0
i
(7)
- уравнение Нернста для электродного
потенциала
49.
В общем виде выражение для ЭДС:1
Re d1
1
Ox1
RT a
E ( E1
ln
n F a
0
RT a
) ( E2
ln
n F a
0
E1 E2
пр
2
Re d 2
2
Ox2
лев
- уравнение Нернста (1890)
)
50.
Элемент Якоби-Даниэля51.
20
2
0
Cu 2е Cu
Zn 2е Zn
Напоминаю, что на самом деле цинк окисляется, но так принято
записывать
E ЕCu 2 ЕZn 2 ( E
0
Cu 2
(E
Принимают, что
0
Zn 2
RT aCu 0
ln
)
2 F a Cu2
RT aZn 0
ln
)
2 F aZn 2
aCu 0 aZn 0 1
52.
Окончательно Е элемента Даниэля –Якоби как разница двух
электродных потенциалов:
E ЕCu 2 ЕZn 2 ( E
0
Cu 2
(E
0
Zn 2
RT
ln аCu 2 )
2F
RT
ln aZn 2 )
2F
53.
Для всей токообразующей реакции:2
Cu Zn Cu Zn
где
0
0
2
a
RT
0
Сu 2
Е E
ln
2 R aZn 2
E E
0
0
Cu 2
RT mCu 2
0
E E
ln
2F mZn 2
E
0
Zn 2
- для сильно
разбавленных
растворов
54.
Стандартный электродныйпотенциал
55.
• Стандартный электродный потенциал Еравен ЭДС цепи, составленной из
стандартного водородного электрода (слева)
и исследуемого электрода (справа) в
стандартном состоянии (т.е. при активности
потенциалопределяющих ионов в растворе,
равной 1).
56.
• Стандартные электродные потенциалы иотвечающие им электродные реакции
восстановления сведены в справочники
(табулированы).
• Знак стандартного электродного потенциала
означает, что потенциал данного электрода
более положителен или более
отрицателен, чем потенциал стандартного
водородного электрода.
57.
• Например, стандартные электродныепотенциалы цинкового и медного
электродов определяются как ЭДС
цепей:
• Cu | Pt | Н2 Н+ ¦¦ Zn2+ | Zn | Cu,
• Сu | Pt | Н2 H+ ¦¦ Cu2+ | Cu
• и равны Е°(Zn2+/ Zn) = 0,760 В и
• Е°(Cu2+/ Cu) = + 0,340 В при 298 К.
58.
• Зная значения стандартныхпотенциалов, можно рассчитать
стандартную ЭДС гальванического
элемента.
• Например, для элемента ДаниэляЯкоби стандартная ЭДС равна:
59.
• На электроде с более положительнымстандартным электродным потенциалом
протекает реакция восстановления
(присоединение электронов):
• М1Z+ + z e М1,
• а на электроде с более отрицательным
стандартным электродным потенциалом
протекает реакция окисления (отдача
электронов):
• М2 z e М2 Z+
60.
Электроды первого рода61.
• Электроды первого рода –электрохимическая система, состоящая из
электронного проводника (металла или
металлоида), погруженного в раствор,
содержащий его ионы.
• Условное изображение электрода
(электронный проводник - металл):
• MZ+ M
• Электродная реакция:
• MZ+ + ze- M
• Вертикальная черта – граница раздела фаз.
62.
• В электродах первого родавосстановленной формой является
металл электрода, а окисленной
формой - ионы этого металла
(простые или комплексные).
63.
• Электроды первого рода обратимыпо катиону, это означает что их
потенциал является функцией
активности катиона.
• Примерами электродов первого рода
являются электроды элемента
Даниэля-Якоби:
• Zn2+ Zn Cu2+ Cu
64.
Элемент Даниэля-Якоби:65.
Схемаэлектрохимическо
й цепи,
химическая
реакция и
уравнение для
электродного
потенциала
электродов 1-го
рода:
66.
Cu Pt | H 2 H ||Mz
M ze M
0
z
M Сu
z
0
M H 2 M zH
2
z
1 / 2H 2 H e z
RT
RT aM
RT
0
EМ Z |M ln K a ln
EМ Z |M ln aM z
zF
zF aM Z
zF
n=z
67.
• Общая формула для потенциалаэлектрода первого рода:
RT
Е E
ln ai
zi F
0
Е0 - стандартный потенциал, zi - заряд
потенциалопределяющих ионов, ai активность потенциалопределяющих ионов
в растворе.
68.
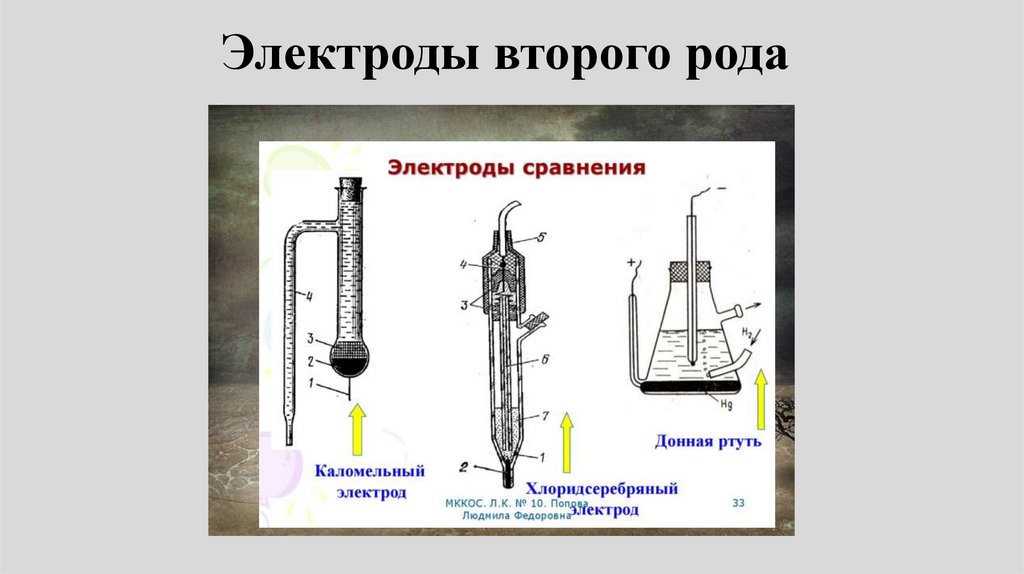
Электроды второго рода69.
• Электрод второго рода этоэлектрохимическая система,
состоящая из металла, покрытого
слоем его малорастворимого
соединения (соли, оксида или
гидроксида) и погруженного в
раствор хорошо растворимого
электролита, содержащий тот же
анион, что и малорастворимое
соединение электродного металла.
70.
Схема, электродная реакция и потенциалэлектрода второго рода:
z
A | M A | M
M A ne M A
z
n z z
Если вещество МА:
E z
A
E
/ MA / M
Пример:
0
z
A / MA / M
RT
ln a A z (1)
nF
AgCl e Ag Cl
71.
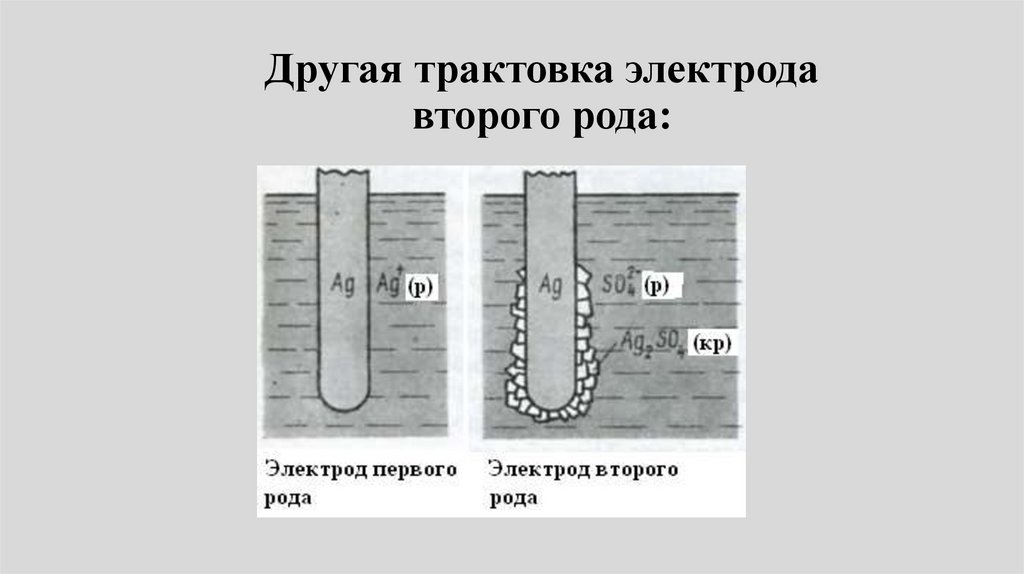
Другая трактовка электродавторого рода:
72.
Постарайтесь понять трактовкуэлектрода второго рода:
73.
• Электрод второго рода можнорассматривать как электрод первого
рода, обратимый относительно катиона:
• Mz+ + ze M,
• у которого активность Mz+ определяется
растворимостью МА.
Электродный потенциал тогда равен
ЕM z / M E
0
M z / M
RT
ln aM z (2)
zF
74.
• В простейшем случае, для соединения МАактивность катиона равна:
• аMz+ = L/aAz(3)
• L – произведение растворимости
(активностей) МА.
• Подстановка (3) в (2) дает выражение для
электродного потенциала:
ЕM z / M E
0
M z / M
RT
RT
(4)
ln L
ln a Az
zF
zF
75.
• Сопоставление выражений (1) и (4)дает:
Е
0
A z / MA / M
E
0
M z / M
RT
ln L
zF
Из сопоставления потенциалов
соответствующих электродов первого и
второго рода можно найти произведение
растворимости малорастворимых
соединений.
76.
Хлорсеребряный электрод77.
• Губчатое серебро, покрытое осадкомхлорида серебра в растворе хлорида
калия:
Ag | AgCl | Cl
AgCl e Ag Cl
ECl / AgCl / Ag E
0
Cl / AgCl / Ag
RT
ln a
Cl
F
78.
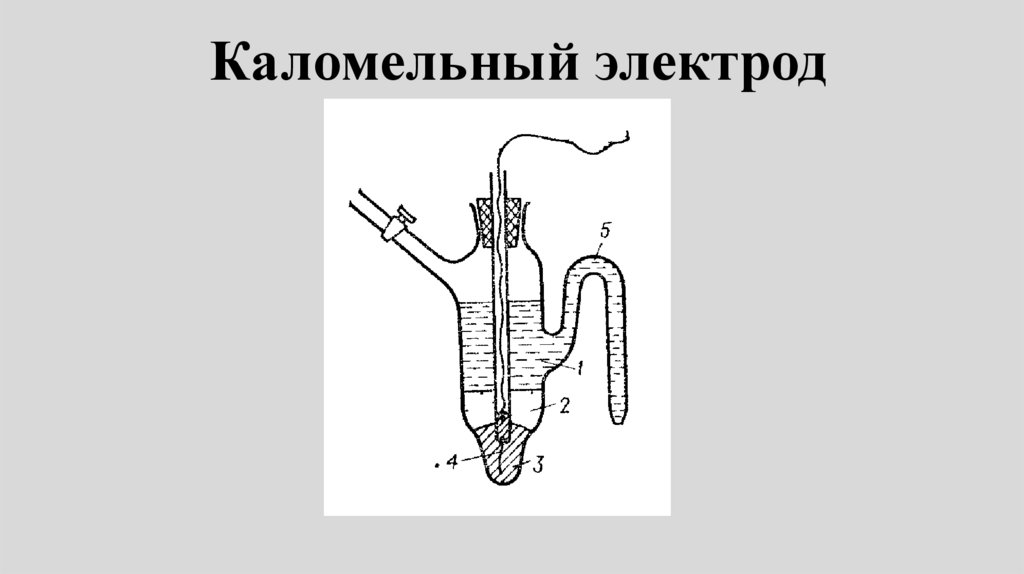
Каломельный электрод79.
• Каломельный электрод представляетсобой ртуть, покрытую пастой из
смеси каломели со ртутью,
находящуюся в контакте с раствором
хлорида калия:
Hg | Hg 2Cl2 | Cl
80.
• Электродная реакция сводится квосстановлению каломели до
металлической ртути и аниона
хлора:
1/ 2Hg 2Cl2 e Hg Cl
Электродный потенциал:
ECl / Hg Cl / Hg E
2
2
0
Cl / Hg 2Cl 2 / Hg
RT
ln aCl
F
81.
• Е электрода определяется активностьюионов хлора aCl-, поэтому концентрация
KCl в растворе должна быть точно
известна.
• Наиболее часто употребляют в качестве
электродов сравнения каломельные
электроды c концентрацией KCl: 0,1; 1,0
и насыщенный раствор
В табл. 79 на стр.146 даны точные
значения Е каломельного электрода при
указанных концентрациях KCl
82.
• Каломельный, ртутно-сульфатный,ртутно-оксидный и хлорсеребряный
электроды получили широкое
распространение в качестве
электродов сравнения.
• Они могут быть использованы для
определения произведения
растворимости малорастворимых
соединений.
83.
Окислительновосстановительные электроды84.
• Окислительно-восстановительныеэлектроды (редокс-электроды) –
электрохимические системы,
состоящие из инертного проводника
(обычно Pt), погруженного в раствор,
содержащий и окисленную, и
восстановленную формы вещества.
85.
• Окислительно-восстановительныеэлектроды принципиально отличаются
других тем, что катионы и анионы,
изменяя свой заряд, не выделяются на
электродах и не появляются в растворе
в результате ионизации материала
электрода.
• Материал электрода не принимает
участия в реакции, он инертный (Pt)
86.
• Окислительно-восстановительныеэлектроды можно разделить на простые
и сложные.
• Для простых окислительновосстановительных электродов
электродная реакция сводится к
перемене зарядов ионов без изменения
их состава. Например:
3
Fe e Fe
2
87.
• Если обозначить окисленные ионыOx, а восстановленные Red, то
написанные выше реакции можно
выразить общим уравнением:
Ox ne Red
Red, Ox | Pt - схема записи и потенциал
ERеd ,Ox E
0
Rеd ,Ox
RT aOx
ln
nF aRеd
88.
• В сложных ред-окс электродах протекаетреакция с изменением заряда реагирующих
частиц и их состава.
• В таких реакциях обычно участвуют ионы
Н3О+, OН и молекулы воды.
4
2
MnO 8H 5e Mn 4 H 2O
4
2
MnO , Mn , H | Pt
89.
Направление реакций окислениявосстановления• Реакции окисления-восстановления по своей
природе обратимы, как обратимо большинство
химических реакций в растворах.
• Реакция идет слева направо тем полнее, чем
больше разность стандартных потенциалов
участвующих пар. Реакцию можно считать
практически обратимой, если разность
потенциалов пар меньше 0,2 В.
90.
Как определить идет окислительновосстановительная реакция или нет?91.
Например:• Будет ли идти реакция
• SnCl4 + 2FeCl2 = SnCl2 + + 2FeCl3?
• Здесь SnCl4 окислитель и восстанавлявается, а
FeCl2 – восстановитель и окисляется.
• Мы имеем две полуреакции, осуществим их в
гальваническом элементе, состоящем из двух ОВ
электродов:
• Правый – катод, на нем должна идти реакция
восстановления: Sn4+ +2e Sn2+ . Стандартный
электродный потенциал такого электрода:
• Е°(Sn4+/ Sn2+) = +0,15 В.
• Левый – анод, на нем должна идти реакция
окисления: Fe2+ - 1е Fe3+
• Е°(Fe3/Fe2+) = +0,77 В
92.
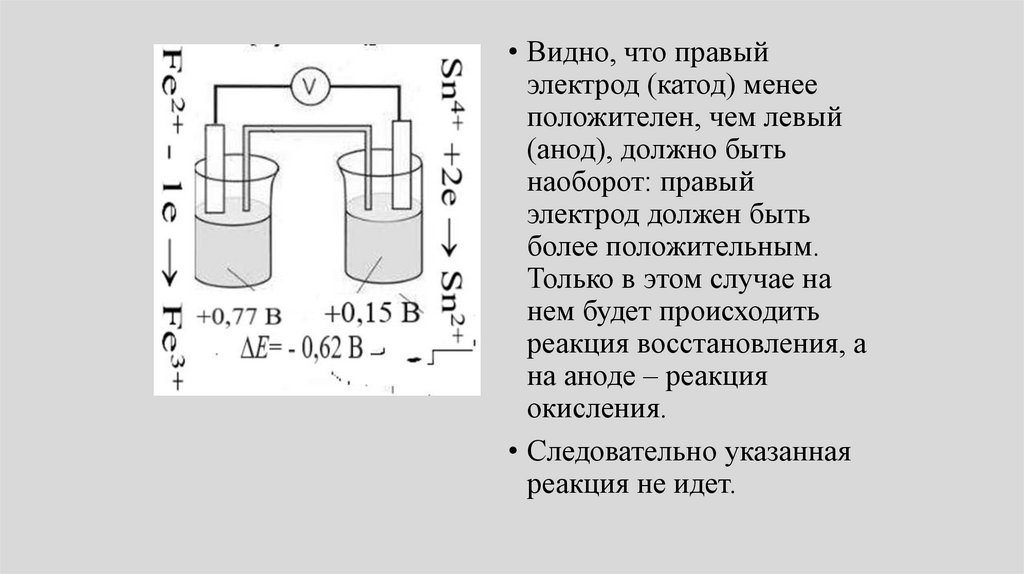
• Видно, что правыйэлектрод (катод) менее
положителен, чем левый
(анод), должно быть
наоборот: правый
электрод должен быть
более положительным.
Только в этом случае на
нем будет происходить
реакция восстановления, а
на аноде – реакция
окисления.
• Следовательно указанная
реакция не идет.
93.
Как это дают в курсе общей химии• Пример 7. Будет ли идти реакция
• SnCl4 + 2FeCl2 = SnCl2 + 2FeCl3?
• Решение. В таблице находим
• Е°(Sn4+/ Sn2+) = +0,15 В,
• Е°(Fe3/Fe2+) = +0,77 В.
• Оказалось, что исходный окислитель SnCl4
слабее, чем образующийся окислитель FeCl3.
Реакция самопроизвольно идти не может.
94.
• Условием состояния равновесия является равенство потенциаловокислительно-восстановительных пар, участвующих в реакции.
• Напишем реакцию в общем виде
Для обеих пар окислитель-восстановитель:
ERеd ,Ox E
0
Rеd ,Ox
RT aOx
ln
nF aRеd
ERеd ,Ox E
0
Rеd ,Ox
RT aOx
ln
nF aRеd
В состоянии равновесия Е равны друг другу
n F (E02 - E01) = RTlnKa
95.
• Е°1 — стандартный редокс потенциал пары,содержащей исходный окислитель, Е°2 —
стандартный редокс потенциал пары,
содержащей исходный восстановитель. Если
Е°1 > Е°2 , то константа равновесия больше
единицы, и равновесие сдвинуто вправо.
• Если разность электродных потенциалов
превышает 0,2 В, то реакция протекает
практически необратимо.
96.
Определение термодинамическиххарактеристик реакций,
протекающих в гальваническом
элементе
97.
•Зная стандартную ЭДСгальванического элемента,
0
можно рассчитать rG и
константу равновесия
протекающей в элементе
реакции:
0
0
• rG = n F E = RTlnKa
98.
• Измеряя ЭДС элемента при несколькихтемпературах, можно определить (дЕ/дТ)
- температурный коэффициент ЭДС, зная
который, можно рассчитать rS и rН
реакции, протекающей в гальваническом
элементе:
• rS = n F (дЕ/дТ)P
• rH = rG + T rS
99.
Пример 8. Пойдут ли самопроизвольно реакции
Fe2(SО4)3 + 2KBr = 2FeSО4 + Br2 + K2SО4
Fe2(SО4)3 + 2KI = 2FeSО4 + I2 + K2SО4?
• Решение. Сначала напишем реакции в ионной форме:
• 2Fe3+ + 2Br- = 2Fe2+ + Вr2
2Fe3+ + 2I- = 2Fe2+ + I2
• Очевидно, что железо понижает степень окисления и
является окислителем. Ионы галогенов Вr- и I-, отдавая
электроны, играют роль восстановителей. Далее, найдем в
таблице стандартные потенциалы имеющихся в реакциях пар
и напишем их под исходными веществами в уравнениях
реакций, а также вычислим разности потенциалов:
100.
• очевидно, что в первой реакции потенциалокислителя ниже потенциала восстановителя,
и электроны от Вr- к Fe3+ переходить не будут.
Реакция самопроизвольно не идет. Могла бы
протекать обратная реакция.
• Во второй реакции потенциал окислителя
выше потенциала восстановителя, и эта
реакция пойдет самопроизвольно.


























































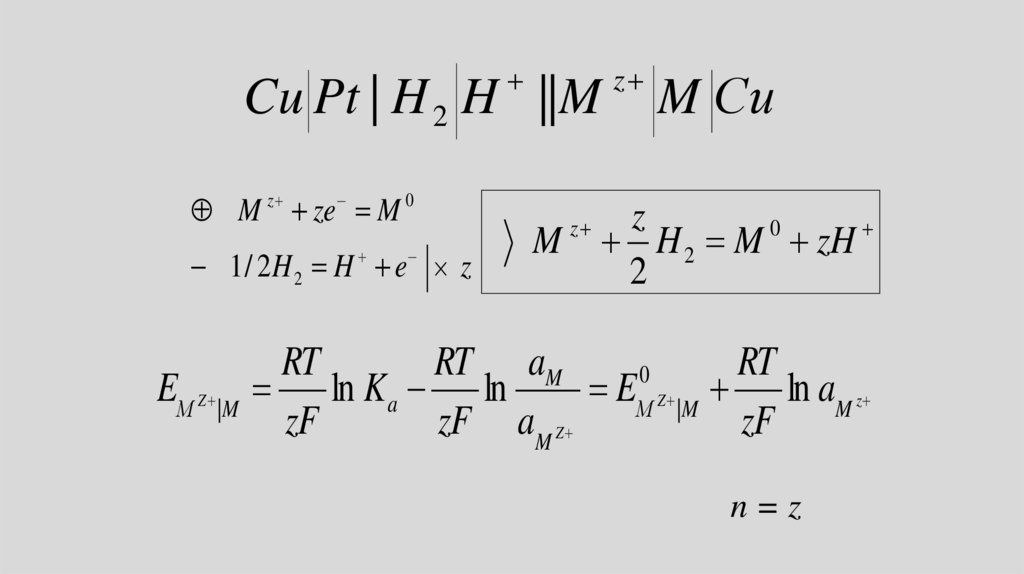






























 chemistry
chemistry








