Similar presentations:
Методы молекулярно-абсорбционной спектроскопии в УФ- и видимой областях
1. Методы молекулярно-абсорбционной спектроскопии в УФ- и видимой областях
Методы молекулярноабсорбционной спектроскопиив УФ- и видимой областях
канд.хим.наук, доцент Л.А. Дрыгунова
2. Основы методов
Молекулярно-абсорбционная спектроскопия в УФ- и видимой
областях основана на избирательном поглощении веществами
излучения.
Поглощение вызвано переходом валентных электронов внутри
молекулы с занятых орбиталей основного электронного
состояния на вакантные орбитали возбужденного состояния.
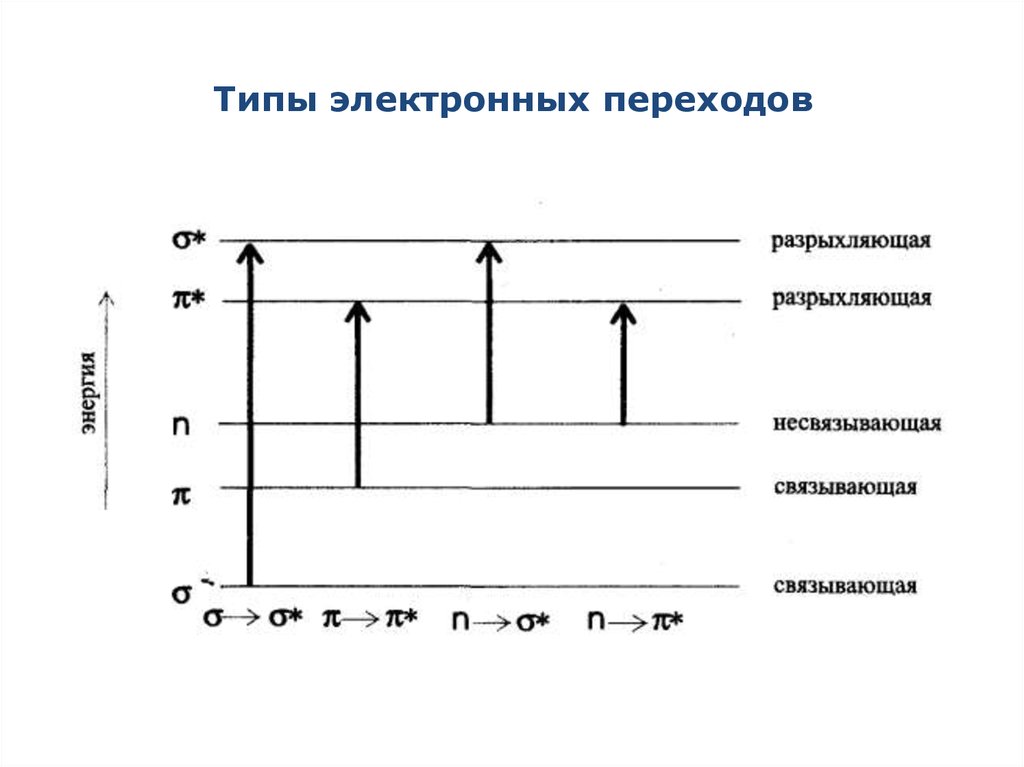
3. Типы электронных переходов
4. Типы электронных переходов
σ→σ*-переходы - связаны с самыми большимиизменениями энергии. Наблюдаются в вакуумной УФобласти (λ<200нм). Характерны для метана и его гомологов.
n→σ*-переходы – связаны уже с меньшими затратами
энергии. Характерны для соединений, содержащих
гетероатомы (N, O, S). Полосы поглощения, вызванные
этими переходами, наблюдаются в УФ – области до 300 нм.
Значение длины волны в максимуме поглощения зависит от
электроотрицательности гетероатома.
CH3Cl λmax = 173 нм
CH3OH λmax = 184 нм
5. Типы электронных переходов
π → π * - переходы - требуют еще меньшей энергии,полосы поглощения, соответствующие этим переходам,
находятся в более длинноволновой области и имеют
наибольшую интенсивность. Характерны для молекул,
содержащих кратные связи.
n→ π* - переходы - полосы поглощения, соответствующие
этим переходам, находятся в наиболее длинноволновой
области и имеют меньшую интенсивность. Характерны для
молекул, содержащих кратные связи и гетероатом. π → π* переходы и n→π* - переходы имеют наибольшее
аналитическое значение
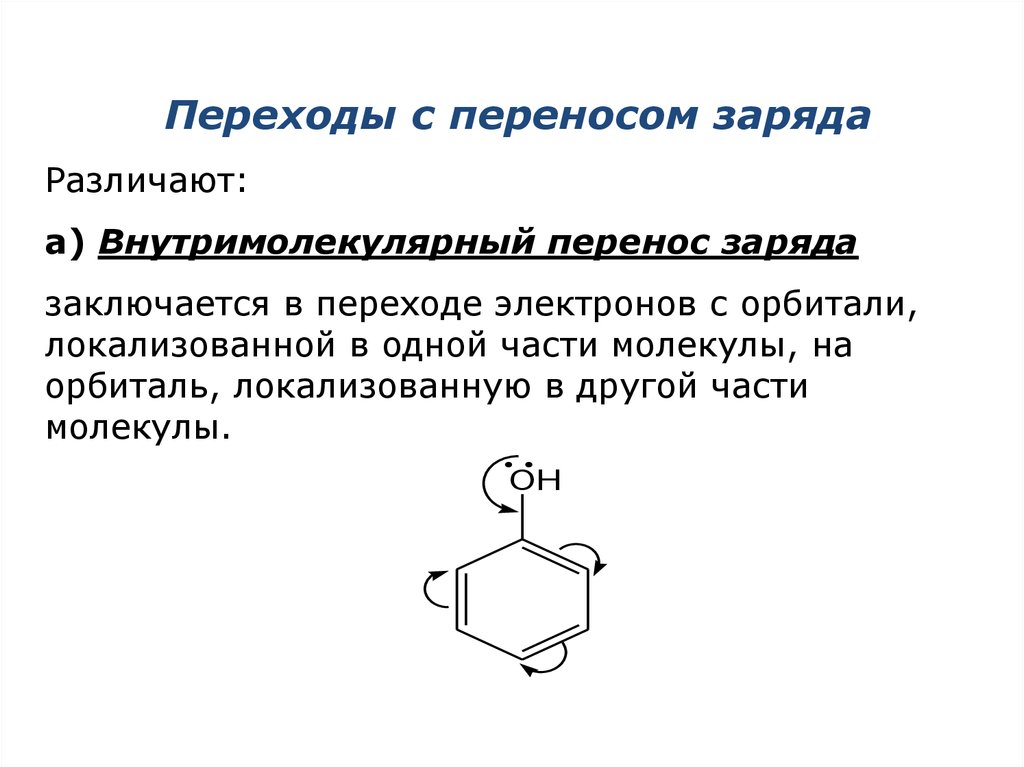
6.
Переходы с переносом зарядаРазличают:
а) Внутримолекулярный перенос заряда
заключается в переходе электронов с орбитали,
локализованной в одной части молекулы, на
орбиталь, локализованную в другой части
молекулы.
OH
7.
Переходы с переносом зарядаб) Комплекс с переносом заряда
Две частицы (молекулы или ионы) образуют
новую частицу (комплекс), в котором происходит
переход электронов с орбитали одной частицы на
орбиталь другой.
C6H6 I2
h
C6H6 I2
8. Фотоэлектроколориметрия
9. Основы метода
• Фотоэлектроколориметрия основана наизбирательном поглощении немонохроматического
излучения в видимой области спектра, приводящее к
изменению энергии электронов.
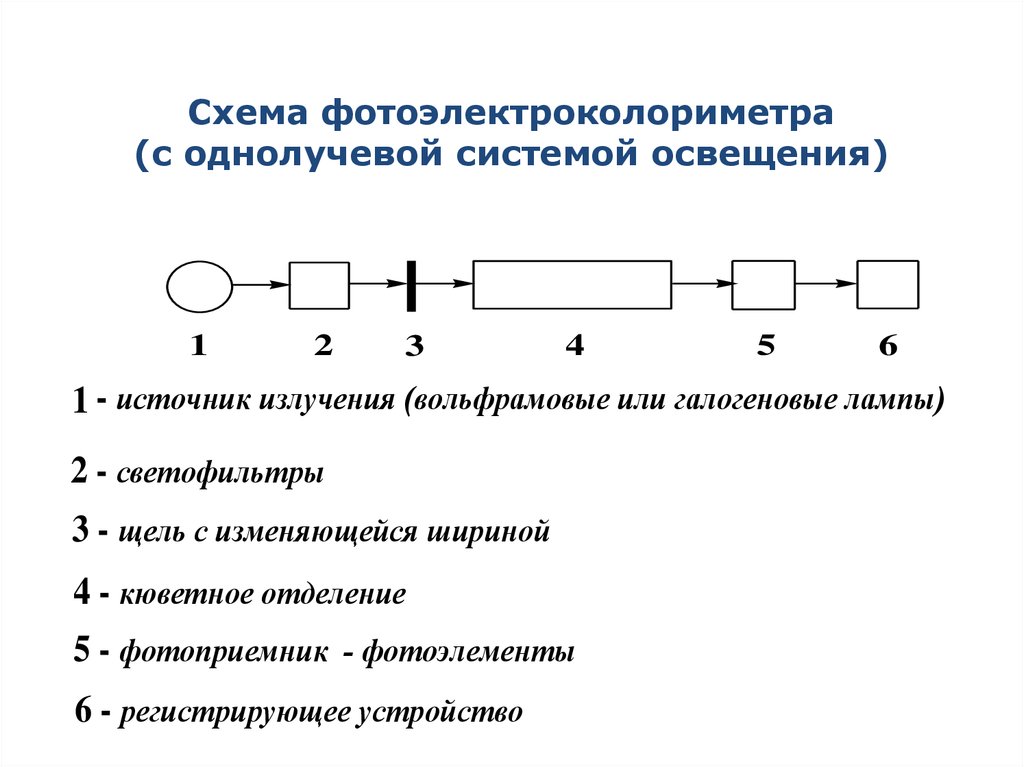
10. Схема фотоэлектроколориметра (с однолучевой системой освещения)
12
3
4
5
6
1 - источник излучения (вольфрамовые или галогеновые лампы)
2 - светофильтры
3 - щель с изменяющейся шириной
4 - кюветное отделение
5 - фотоприемник - фотоэлементы
6 - регистрирующее устройство
11. Условия проведения фотоэлектроколориметрического анализа
1. Проведение фотометрической реакции.В видимой области поглощают только окрашенные вещества.
Фотометрическая реакция – перевод неокрашенных и
слабоокрашенных соединений действием специальных
реагентов в окрашенные соединения для увеличения
интенсивности поглощения.
•Чаще в качестве фотометрических реакций используют
реакции комплексообразования, а также окислительновосстановительные, с различными органическими
реагентами и др.
Cu2+ + 4 NH3 = [ Cu(NH3)4 ] 2+
12. Требования к фотометрическим реакциям
•Чувствительность- реакция считается чувствительной, есливеличина молярного коэффициента поглощения
образующегося окрашенного соединения не менее 40000.
•Избирательность – в реакцию должно вступать только
определяемое вещество.
•Устойчивость образующегося комплекса.
•Полнота связывания определяемого компонента в
комплекс.
•Интенсивная окраска образующегося комплекса.
•Хорошая растворимость комплекса в растворителе.
•Разность между длинами волн, соответствующих
максимумам поглощения реагента и продукта реакции
(оптимально, если ∆λ=80 нм).
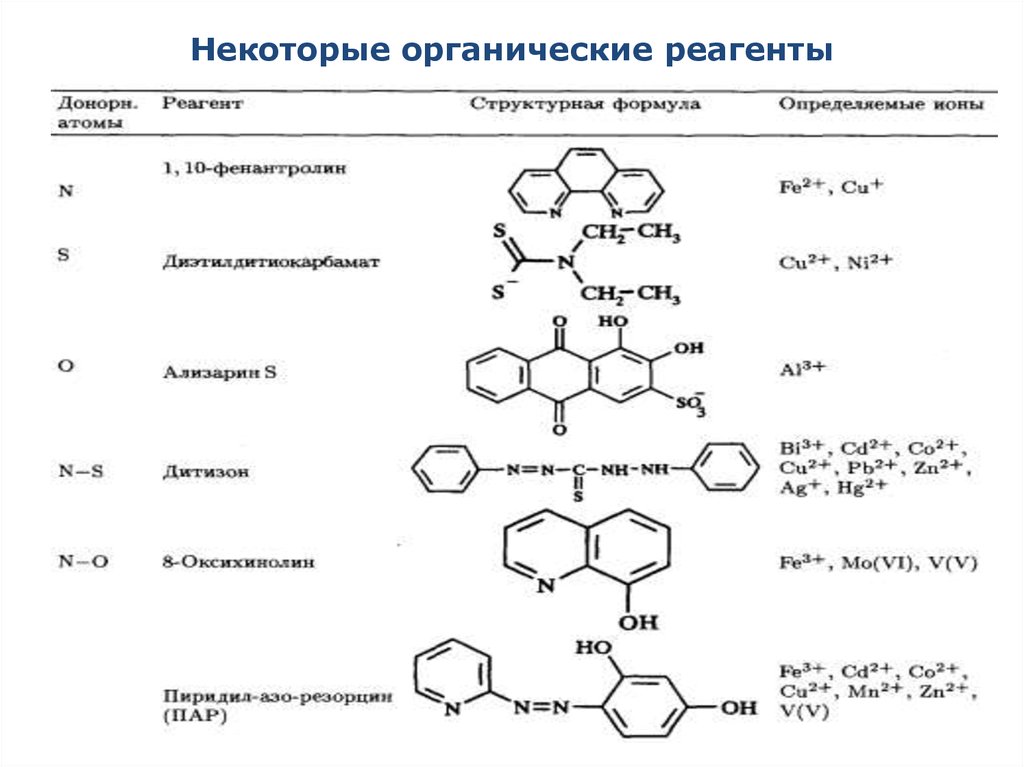
13. Некоторые органические реагенты
14. Фотометрические реакции
Экстракционная фотометрия – гибридный метод анализа, в
котором после проведения фотометрической реакции,
образующийся ее продукт экстрагируют несмешивающимся с
водой растворителем, в котором он фотометрируется.
Экстракционную фотометрию чаще используют в случаях,
когда продукт фотометрической реакции плохо растворим в
воде, либо в растворе присутствуют соединения, мешающие
определению.
15. Условия проведения фотоэлектроколориметрического анализа
2. Выбор аналитической длины волны• При помощи светофильтра выбирается длина волны
светового потока, соответствующая максимальному
поглощению.
• Измеряют оптическую плотность исследуемого раствора при
разных длинах волн.
• Выбирается светофильтр, при котором оптическая плотность
максимальна.
A
Amax
max
16. Условия проведения фотоэлектроколориметрического анализа
3. Диапазон концентраций анализируемых растворов• Оптимальный диапазон оптических плотностей в
фотоэлектроколориметрии 0.12 – 1.2
А=ε·l·C
• Подбирают концентрацию и толщину кюветы таким
образом, чтобы обеспечить оптимальный диапазон
оптических плотностей, обычно C < 0.01моль/л.
4. Наличие раствора сравнения
• При анализе однокомпонентных растворов раствором
сравнения является растворитель или это может быть
раствор, содержащий все компоненты анализируемого
раствора, кроме определяемого вещества.
17. Методы количественного фотоэлектроколориметрического анализа
• Немонохроматичность применяемого электромагнитногоизлучения не позволяет использовать для расчетов
аналитическую форму закона Бугера-Ламберта –Бера.
• Применяют следующие методы:
1.Метод сравнения
При l = const, выполняется следующая зависимость:
Аст
Ах
=
Сст
Сх
отсюда
Ах Сст
Сх =
Аст
18. Методы количественного фотоэлектроколориметрического анализа
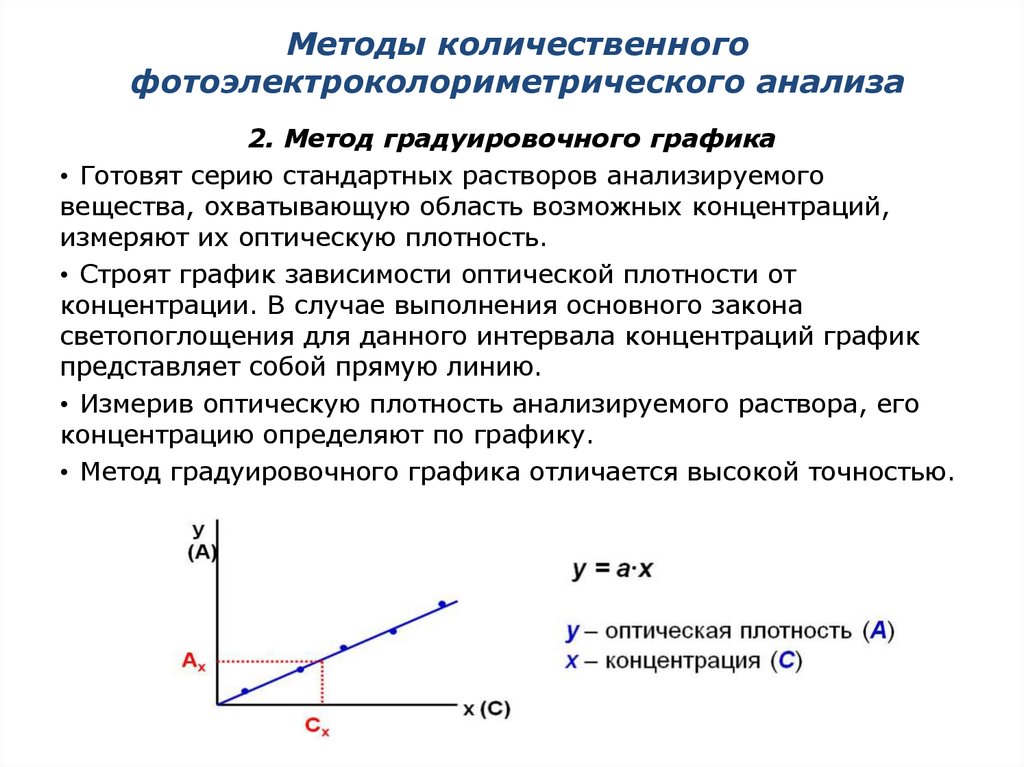
2. Метод градуировочного графика• Готовят серию стандартных растворов анализируемого
вещества, охватывающую область возможных концентраций,
измеряют их оптическую плотность.
• Строят график зависимости оптической плотности от
концентрации. В случае выполнения основного закона
светопоглощения для данного интервала концентраций график
представляет собой прямую линию.
• Измерив оптическую плотность анализируемого раствора, его
концентрацию определяют по графику.
• Метод градуировочного графика отличается высокой точностью.
19. Методы количественного фотоэлектроколориметрического анализа
3. Метод добавокОптическая плотность анализируемого раствора:
Ax = ε·l·Cx
Оптическая плотность анализируемого раствора c добавкой
стандартного:
Ax+ст = ε·l·(Cx+Сст)
Выполняется зависимость:
Ах
Сх
=
Ах+ст
Сх + Сст
Ах (Сх + Сст ) = Ах+ст Сх
При решении, получаем:
Сх = Сст
Ах
Ах+ст - Ах
20. УФ – СПЕКТРОСКОПИЯ (СПЕКТРОФОТОМЕТРИЯ В УФ – И ВИДИМОЙ ОБЛАСТИ)
21.
ПриборРабочая область
спектра
Диспергирующий
элемент
Регистрируемый сигнал
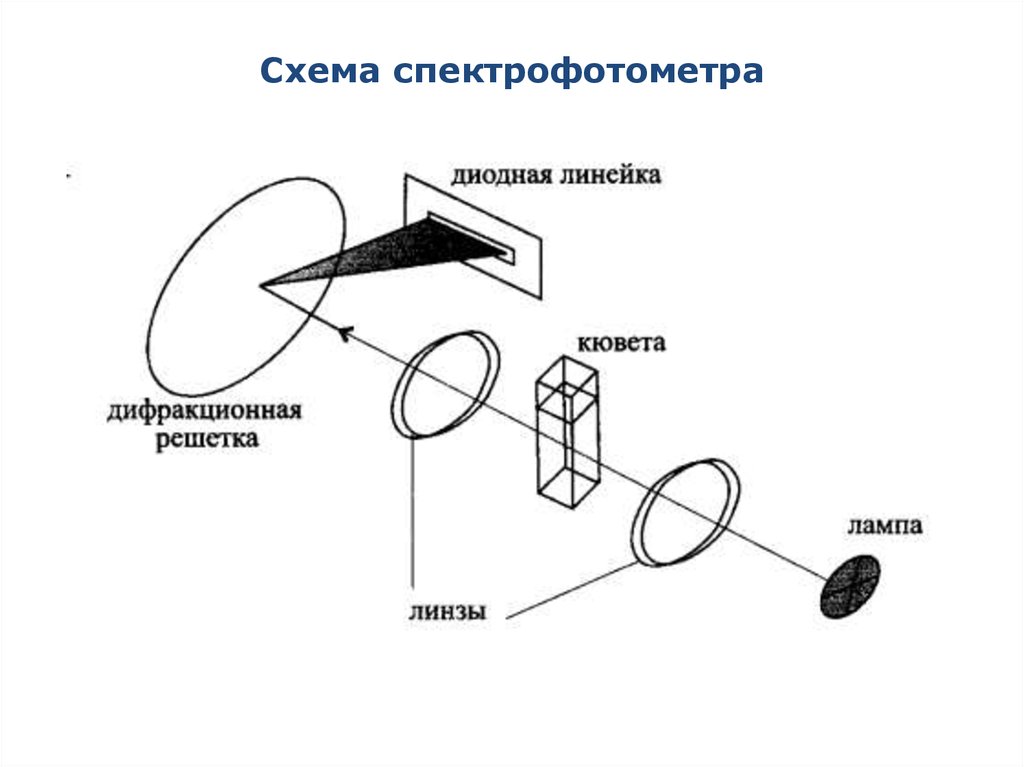
Спектрофотометр
200 – 1100 нм
Призмы или
дифракционные
решетки
1. Оптическая
плотность и
пропускание при
фиксированной длине
волны.
2.Электронные спектры в
форме кривых
А = f(λ).
22. Схема спектрофотометра
23. Спектофотометрические определения
Определения содержания веществ можно проводитьнепосредственно, а также с использованием специальных
фотометрических реагентов.
Определения без реагентов
• В УФ-области можно определять многие органические
соединения, имеющие полосы поглощения π→π* и n→π*переходов в УФ-области, например, ароматические
углеводороды и т.д.
• В видимой области можно определять окрашенные
органические соединения, имеющих полосы π→π* и n→π*переходов в видимой области, а также окрашенные
неорганические соединения, поглощение которых, как
правило, вызвано совершением d→d*- переходов, например,
MnO4--, Cr2O72—ионы.
Определения с помощью реагентов
Для проведения анализа проводят фотометрическую реакцию.
24. Методы количественного спектрофотометрического анализа
1. Метод сравнения.2. Метод градуировочного графика.
3. Метод добавок.
4. Метод молярного (удельного) коэффициента поглощения
Обязательное условие применения методаподчинение анализируемой системы закону Бугера-Ламберта-Бера.
• Если коэффициент поглощения анализируемого вещества неизвестен, его
определяют экспериментально.
• Готовят серию стандартных растворов анализируемого вещества, измеряют
оптическую плотность, для каждого рассчитывают коэффициент
поглощения, получают среднее значение.
Aст
l Cст
• Измерив оптическую плотность анализируемого раствора и зная коэффици
Ax
Cx =
l ср
25. Дифференциальная фотометрия
1. Метод отношения пропусканий• В качестве раствора сравнения используют раствор
известной концентрации С0 (причем, С0< Сх). Метод
применяют при анализе растворов с высокой оптической
плотностью.
26. Дифференциальная фотометрия
2. Метод анализа следовИспользуют при анализе растворов с низкой оптической
плотностью. Границы оптической плотности
устанавливаются по раствору известной концентрации и
раствору контрольного опыта. Расчет концентрации
проводят методом градуировочного графика.
3. Метод предельной точности
Границы оптической плотности устанавливаются по двум
растворам известной концентрации С1 и С2 (С1< Сх< С2).
Расчет концентрации проводят методом градуировочного
графика.
27. Многоволновая спектрофотометрия (метод Фирордта)
• Метод применяют для анализа растворов, содержащихнесколько светопоглощающих частиц. Основой метода
является закон аддитивности оптических плотностей.
• Для раствора, содержащего два вида светопоглощающих
частиц:
• Решение системы уравнений позволит рассчитать
концентрации С1 и С2.
28. Производная спектрофотометрия
• Аналитическим сигналом является производнаяоптической плотности n-порядка.
А- электронный спектр; Б –его первая производная; В – его вторая
производная.
• Производная спектрофотометрия позволяет более точно
определять длину волны в максимуме поглощения,
снижает систематические погрешности.
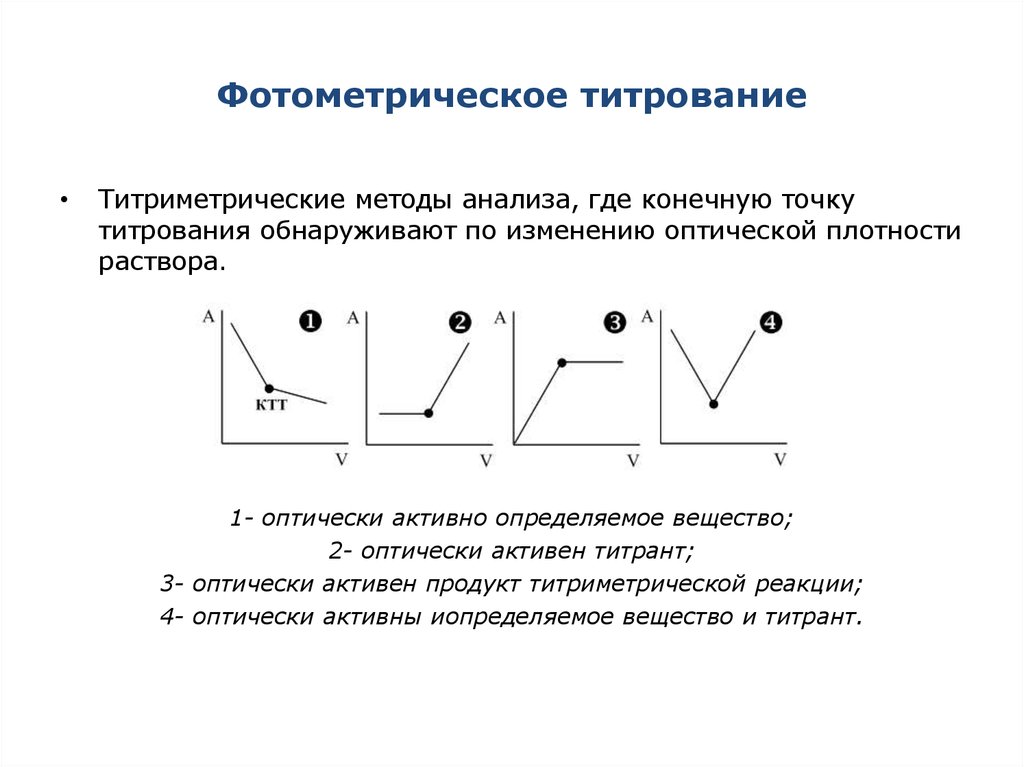
29. Фотометрическое титрование
Титриметрические методы анализа, где конечную точку
титрования обнаруживают по изменению оптической плотности
раствора.
1- оптически активно определяемое вещество;
2- оптически активен титрант;
3- оптически активен продукт титриметрической реакции;
4- оптически активны иопределяемое вещество и титрант.
30. Применение спектроскопии в УФ- и видимой областях в фармацевтическом анализе.
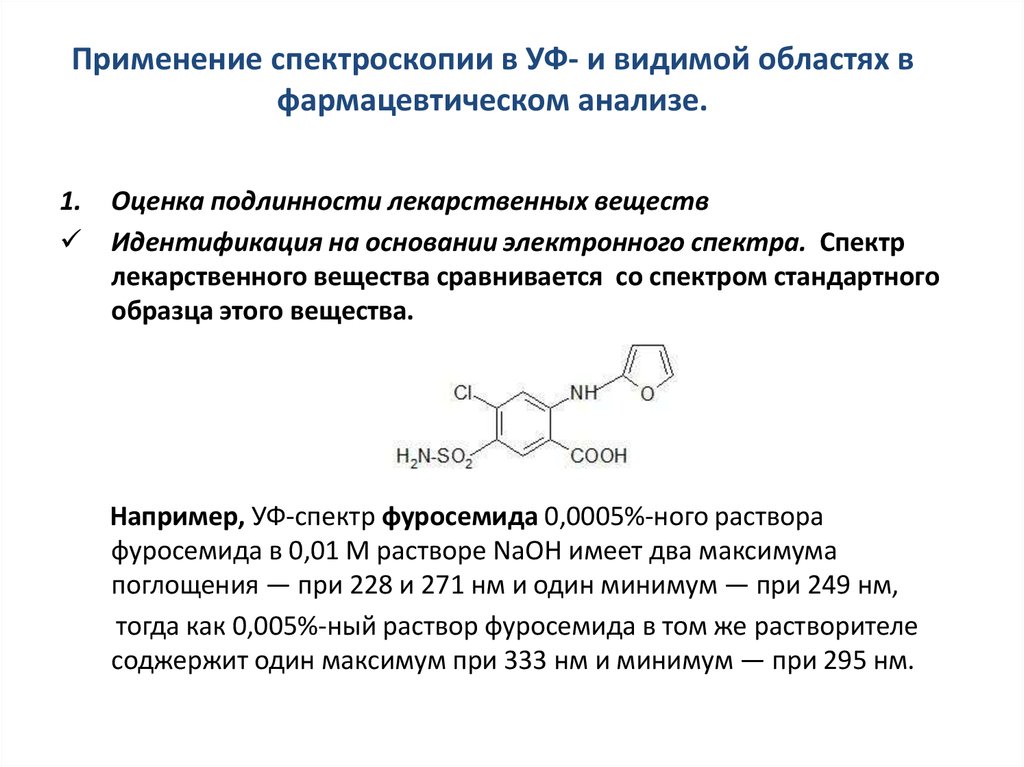
1.Оценка подлинности лекарственных веществ
Идентификация на основании электронного спектра. Спектр
лекарственного вещества сравнивается со спектром стандартного
образца этого вещества.
Например, УФ-спектр фуросемида 0,0005%-ного раствора
фуросемида в 0,01 М растворе NaOH имеет два максимума
поглощения — при 228 и 271 нм и один минимум — при 249 нм,
тогда как 0,005%-ный раствор фуросемида в том же растворителе
соджержит один максимум при 333 нм и минимум — при 295 нм.
31. Применение спектроскопии в УФ- и видимой областях в фармацевтическом анализе.
Идентификация на основании коэффициента поглощенияНапример, коэффициент поглощения парацетомола в 0,1М
растворе HCl при 240 нм равен 880 л/моль см.
2. Оценка чистоты лекарственного вещества.
Готовят раствор лекарственного вещества определенной
концентрации и измеряют величину оптической плотности при
определенной длине волны. Например, оптическая плотность 16%ного раствора анальгина при 400 нм не должна превышать 0.1.
обнаружение специфических примесей по появлению
дополнительных полос поглощения в электронном спектре.
Например, максимум поглощения адреналина находится при 278
нм, а его специфической примеси – адреналона, при 310 нм.
3. Определение количественного содержания лекарственных веществ.
32. Связь УФ – спектров со строением органических соединений
Хромофоры – это структурные группы,содержащие изолированные и сопряженные кратные
связи, ароматические фрагменты, радикалы и атомы с
неподеленными электронными парами, которые
избирательно поглощают электромагнитное излучение.
33.
Полосы поглощения некоторых соединенийСоединение
1
Этан
Тип
электронного
перехода
σ→σ*
2
Вода
n→σ*
167
7000
3
Метанол
n→σ*
183
500
4
Этилен
π→π*
165
10000
5
Ацетилен
π→π*
173
6000
6
Ацетон
π→π*
n→σ*
n→π*
π→π*
π→π*
π→π*
π→π*
π→π*
~150
188
279
180
204
255
244
282
1860
15
60000
8000
215
12000
450
π→π*
n→π*
278
319
1100
50
9
Бензол
10
Стирол
11
Ацетофенон
λmax , нм
εmax
135
34. Основные понятия
Ауксохромы - электронодонорные заместители, (−ОН,−ОR, −NН2 -NHR, галогены).
Батохромный сдвиг (или красный сдвиг) –сдвиг полосы
поглощения в сторону больших длин волн.
Гипсохромный сдвиг (или синий сдвиг) – сдвиг полосы
поглощения в сторону меньших длин волн.
Гиперхромный эффект - повышение интенсивности
поглощения.
Гипохромный эффект – понижение интенсивности
поглощения.
35. Качественный анализ на основе электронных спектров
1. Идентификация органических соединенийОсуществляется сравнением спектра исследуемого
соединения со спектрами других соединений
известной структуры. По УФ-спектрам можно
отличить соединения, содержащие сопряжённые
хромофоры и ауксохромы, от соединений с
изолированными хромофорами и ауксохромами
36. Качественный анализ на основе электронных спектров
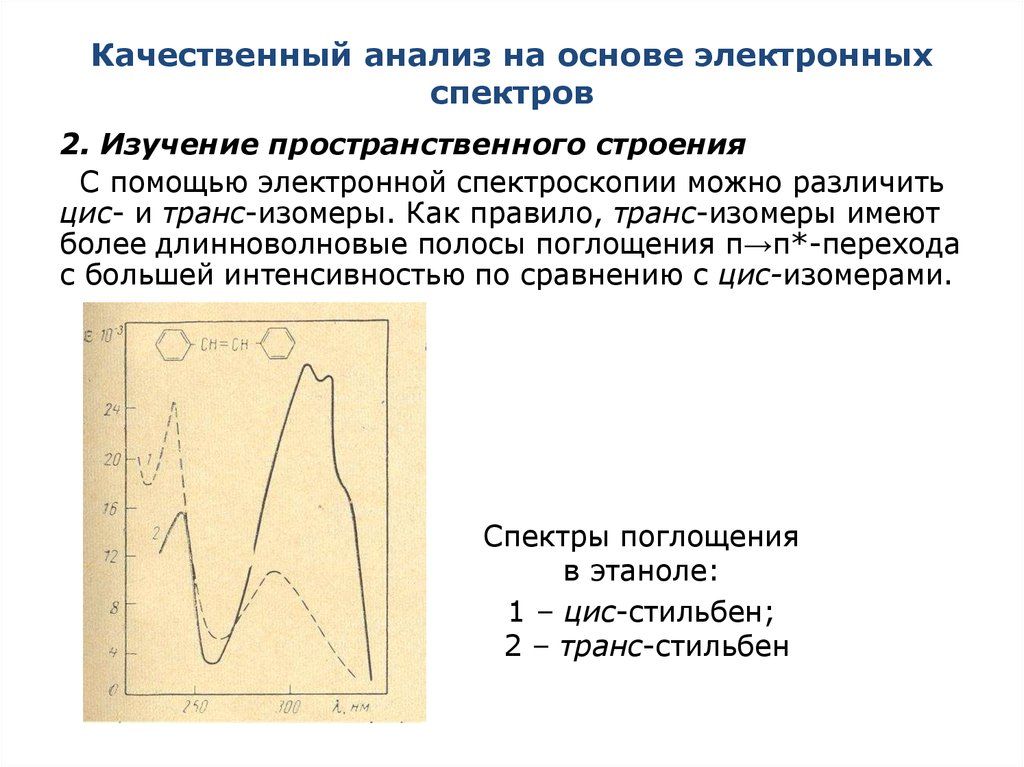
2. Изучение пространственного строенияС помощью электронной спектроскопии можно различить
цис- и транс-изомеры. Как правило, транс-изомеры имеют
более длинноволновые полосы поглощения π→π*-перехода
с большей интенсивностью по сравнению с цис-изомерами.
Спектры поглощения
в этаноле:
1 – цис-стильбен;
2 – транс-стильбен
37. Качественный анализ на основе электронных спектров
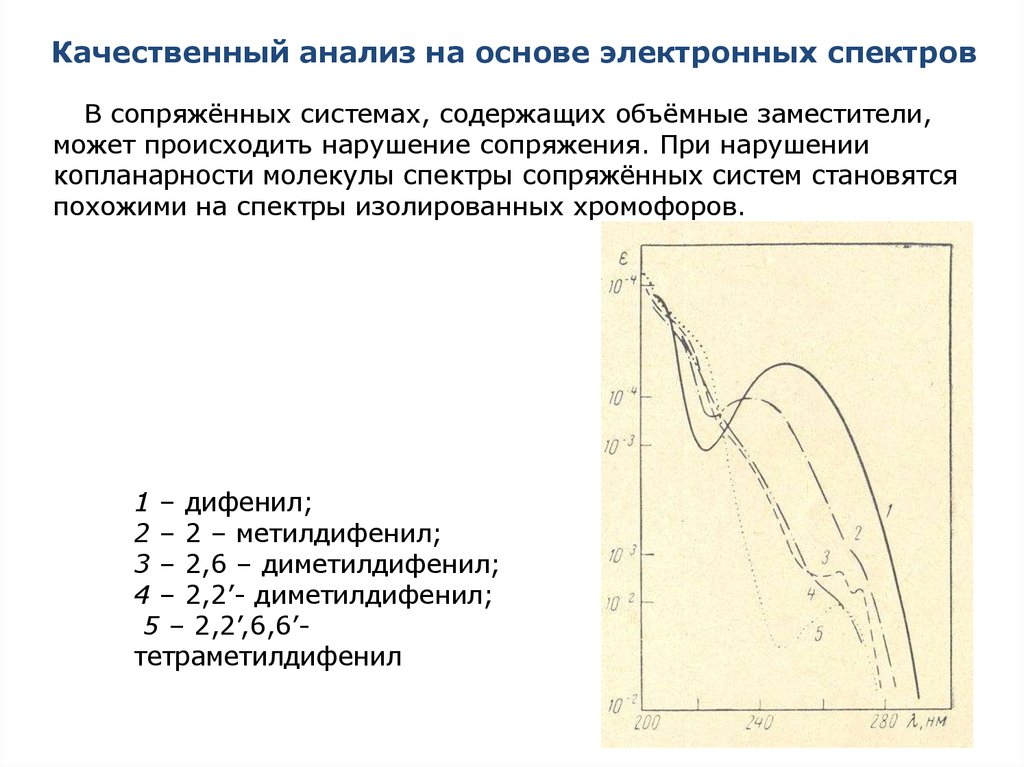
В сопряжённых системах, содержащих объёмные заместители,может происходить нарушение сопряжения. При нарушении
копланарности молекулы спектры сопряжённых систем становятся
похожими на спектры изолированных хромофоров.
1 – дифенил;
2 – 2 – метилдифенил;
3 – 2,6 – диметилдифенил;
4 – 2,2’- диметилдифенил;
5 – 2,2’,6,6’тетраметилдифенил
38. Качественный анализ на основе электронных спектров
3. Изучение кинетики и контроль за ходом реакцииОсуществляется в процессе синтеза органических
соединений. В этих случаях спектры записывают для
выбранных аналитических длин волн исходного
соединения и (или) продукта реакции. Регистрируется
изменение оптической плотности от начала до конца
реакции как функция времени.
39. Качественный анализ на основе электронных спектров
4. Исследование равновесий в растворахИспользуется при изучении таутомерных превращений,
кислотно-основных взаимодействий. Метод применим лишь
в тех случаях, когда изомеризация затрагивает
хромофорную группу.
40. Электронные спектры поглощения отдельных классов органических соединений
АЛКАНЫВ алканах возможны только σ→σ* электронные переходы.
Эти переходы не могут быть обнаружены при помощи
серийных спектрофотометров. Поэтому жидкие алканы
применяют в электронной спектроскопии в качестве
растворителей.
41.
АЛКЕНЫИзолированные двойные углерод-углеродные связи имеют
интенсивную полосу поглощения, обусловленную π→π*
переходом, в области 165 – 200 нм. Этилен λmax =165 нм.
Алкильные заместители у этиленовых углеродных атомов
приводят
к
небольшому
батохромному
сдвигу,
и
соответствующее поглощение наблюдается при 175–200 нм.
Циклические непредельные углеводороды имеют спектры,
аналогичные спектрам алкенов.
При сопряжении кратных связей наблюдают батохромный и
гиперхромный эффекты полос поглощения.
42.
Поглощение некоторых ненасыщенных соединенийСистема
1
Соединение
Этилен
λmax,
нм
165
εmax
15000
2
С=С–С–С–С
Пентен – 1
184
10000
3
С=С–С–С–С=С
Гексен – 1,5
185
20000
4
С=С−С=С
Бутадиен – 1,3
217
21 000
226
21400
6
С−С=С−С=С−С
2,3 – диметилбутадиен –
1,3
Гексадиен – 2,4
227
23 000
8
С=С−С=С−С=С
Гексатриен – 1,3,5
263
53000
9
(−С=С−)4
Декатетраен – 2,4,6,8
310
76 500
10
(−С=С−)11
Ликопин
504
170 000
11
С=С−С≡С
Винилацетилен
219
6 500
5
43.
АЛКИНЫДля ацетиленовых углеводородов с изолированной
С≡С связью наблюдается полоса поглощения π→π*
перехода.
Ацетилен λmax = 173 нм
алкилацетилены λmax= 187 нм
диалкилацетилены λmax 190 нм.
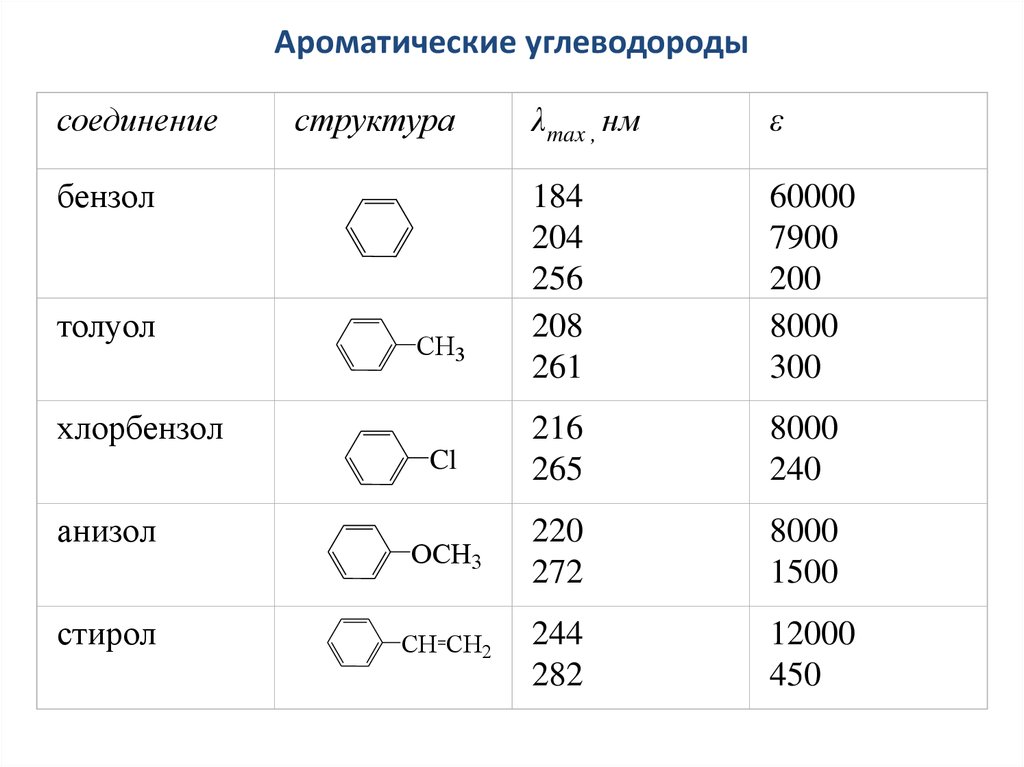
44. Ароматические углеводороды
соединениеструктура
λmax , нм
ε
184
204
256
208
261
60000
7900
200
8000
300
Cl
216
265
8000
240
OCH3
220
272
8000
1500
CH CH2
244
282
12000
450
бензол
толуол
СН3
хлорбензол
анизол
стирол
45.
ацетофенонC
244
282
12600
1600
251
280
330
230
281
9000
1000
130
8000
1500
NH3
203
254
8000
160
OH
211
270
6300
1500
CH3
O
нитробензол
NO2
анилин
анилиний ион
фенол
NH2
46.
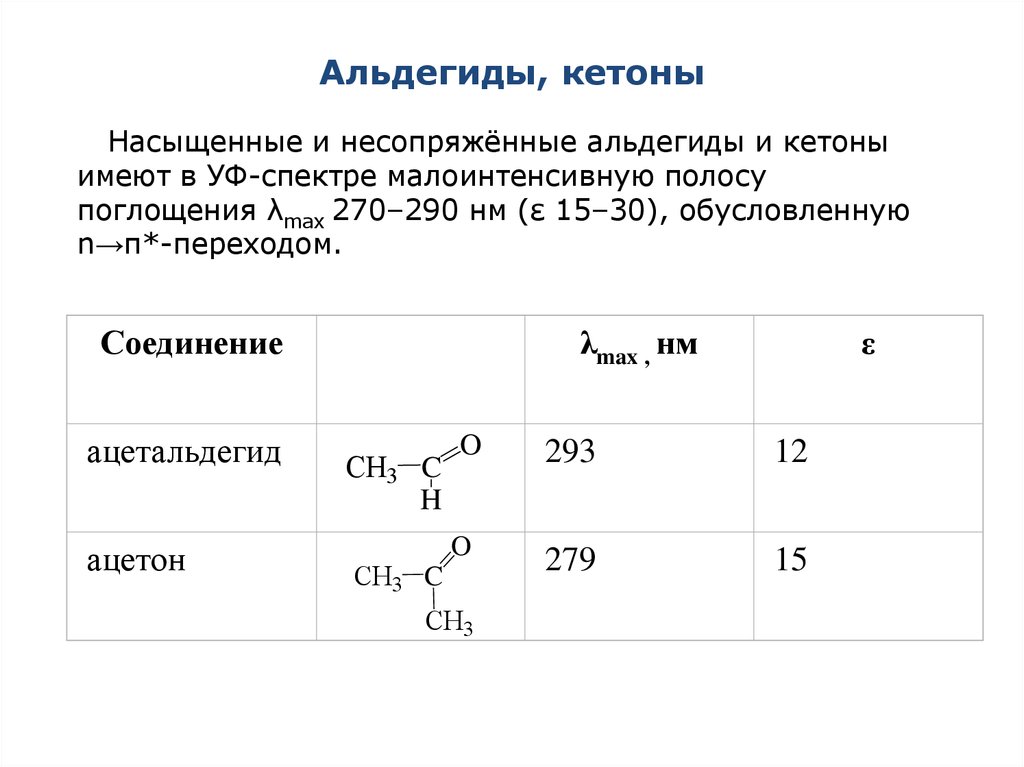
47. Альдегиды, кетоны
Насыщенные и несопряжённые альдегиды и кетоныимеют в УФ-спектре малоинтенсивную полосу
поглощения λmax 270–290 нм (ε 15–30), обусловленную
n→π*-переходом.
Соединение
ацетальдегид
ацетон
λmax , нм
CH3 C
H
CH3 C
O
O
CH3
ε
293
12
279
15
48. В сопряжённых карбонильных соединениях происходит батохромное смещение полос поглощения.
ПропанальCH
207 (π→π*) 12000
328 (n→π*) 20
O
C
CH2
H
пент-3-ен-2-он
H3C
CH
C
H
4-метилпент-3ен-2-он
H3C
O
C
CH3
CH
C
CH3
221 (π→π*) 12000
312 (n→π*) 40
O
C
CH3
238(π→π*) 12000
316 (n→π*) 60
49. Карбоновые кислоты Алифатические карбоновые кислоты и их функциональные производные имеют слабые полосы поглощения в области 204–235 нм (ε 2
Карбоновые кислотыАлифатические карбоновые кислоты и их функциональные
производные имеют слабые полосы поглощения в области
204–235 нм (ε 20–60), соответствующие n→π*-переходам.
В спектрах α,β-ненасыщенных кислот проявляются
интенсивные полосы поглощения, соответствующие π→π*переходу в сопряжённых системах, а также наблюдают
батохромное смещение полос поглощения, обусловленных
n→π*-переходами .
50. Заключение
• Методы молекулярно-абсорбционнойспектроскопии являются одними из самых
применимых в анализе веществ неорганической
и органической природы, в том числе и
лекарственных веществ.






































 physics
physics








