Similar presentations:
Процессы трансформации дихлоруксусной кислоты в атмосфере
1.
Министерство образования и науки РФРоссийский химико-технологический университет им.Д.И.Менделеева
Институт химии и проблем устойчивого развития
Высший колледж рационального природопользования
Лаборатория кластерных и радикальных процессов, ИХФ РАН
ПРОЦЕССЫ ТРАНСФОРМАЦИИ
ДИХЛОРУКСУСНОЙ КИСЛОТЫ В АТМОСФЕРЕ
Шартава Д.К., Васильев Е.С., Морозов И.И.
1
2.
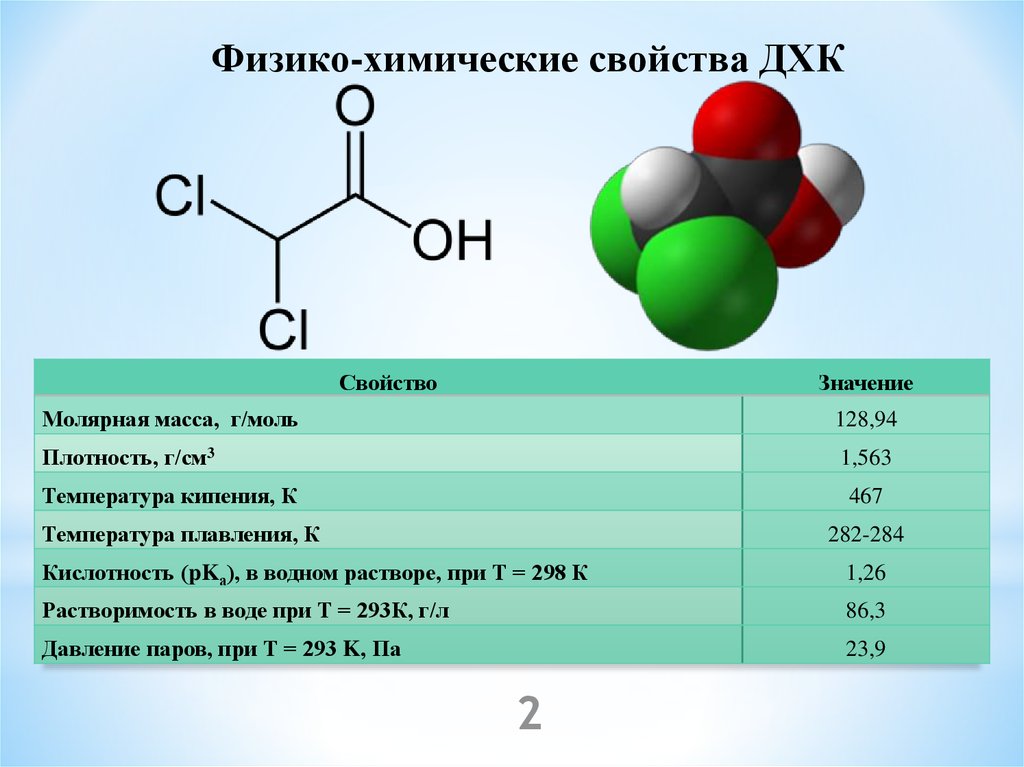
Физико-химические свойства ДХКСвойство
Значение
Молярная масса, г/моль
128,94
Плотность, г/см3
1,563
Температура кипения, К
467
Температура плавления, К
282-284
Кислотность (pKа), в водном растворе, при Т = 298 К
1,26
Растворимость в воде при Т = 293К, г/л
86,3
Давление паров, при Т = 293 K, Па
23,9
2
3.
Получение ДХКНаиболее
распространенный
метод
производства
для
дихлоруксусной кислоты является гидролиз хлорангидрида,
который получают окислением трихлорэтилена:
CHCl=CCl2 + O2
CHCl2-COCl + H2O
CHCl2-COCl
CHCl2COOH + HCl
3
4.
Применение ДХК4
5.
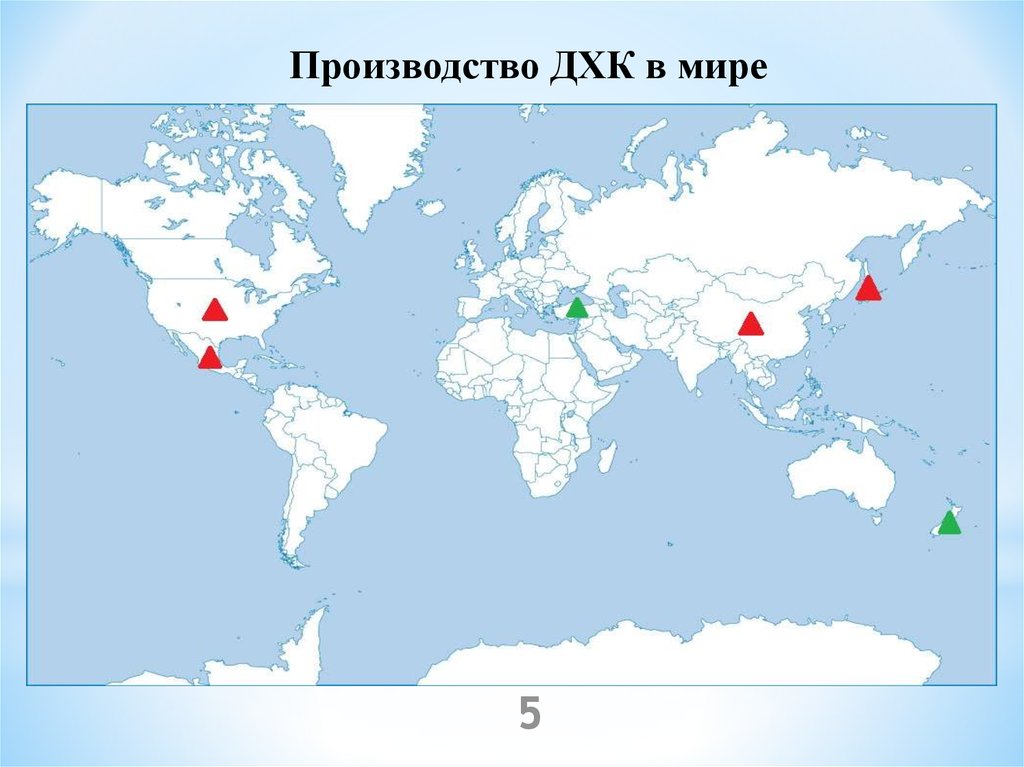
Производство ДХК в мире5
6.
Токсикологическое действие ДХКВ 2002 г. Международное агентство по изучению
рака (МАИР) отнесло ДХК к группе 2В (возможное
канцерогенное действие на человека).
Гигиенические нормативы ДХК
Норматив
ПДК р.з.
ДХК
4 мг/м3 (3 класс опасности)
ОБУВ атм. возд.
0,4 мг/м3
ОДУ хоз.-пит.
0,05 мг/л (2 класс опасности)
6
7.
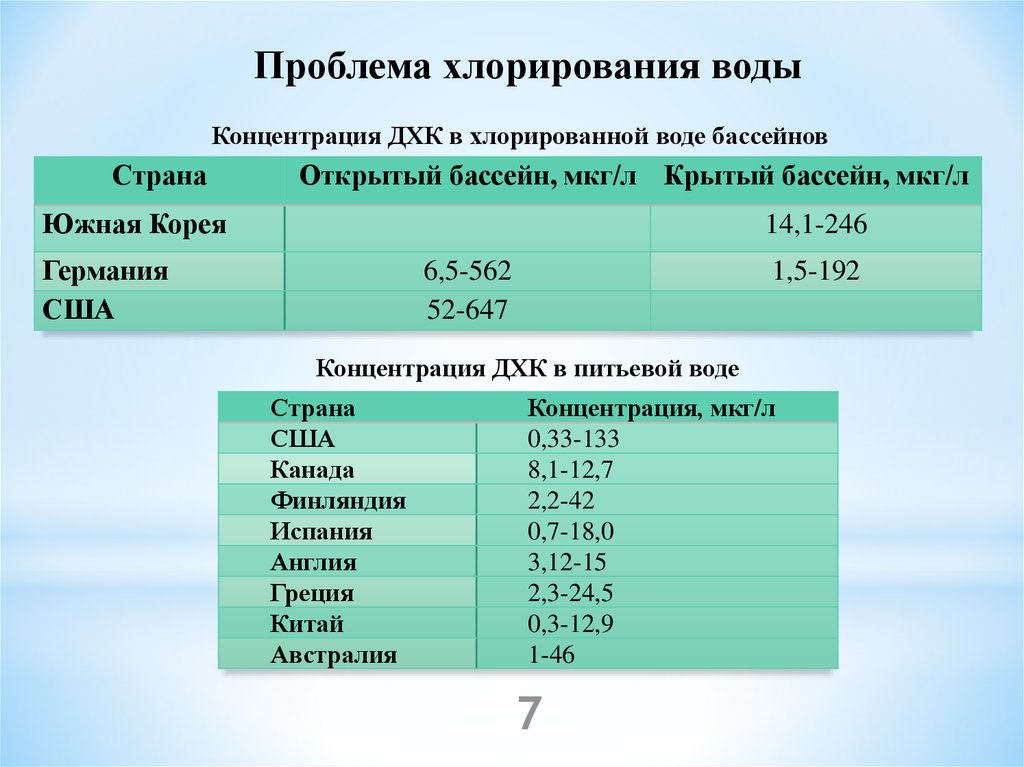
Проблема хлорирования водыКонцентрация ДХК в хлорированной воде бассейнов
Страна
Открытый бассейн, мкг/л Крытый бассейн, мкг/л
Южная Корея
14,1-246
Германия
США
6,5-562
52-647
1,5-192
Концентрация ДХК в питьевой воде
Страна
США
Канада
Финляндия
Испания
Англия
Греция
Китай
Австралия
Концентрация, мкг/л
0,33-133
8,1-12,7
2,2-42
0,7-18,0
3,12-15
2,3-24,5
0,3-12,9
1-46
7
8.
Реакции ДХК в атмосфереКонцентрация радикалов OH в атмосфере приблизительно
составляет 106 молекул в см3.
OH● + CHCl2COOH C●Cl2COOH
OH● + CHCl2COOH CHCl2COO
O2 + C●Cl2COOH продукты
O2 + CHCl2COO● продукты
F + CHCl2COOH C●Cl2COOH
F + CHCl2COOH CHCl2COO
8
9.
Метод конкурирующих реакцийF + CHCl2COOH продукты (C*Cl2COOH; CHCl2COO*; HF)
F + c-C6H12 продукты (C6H11*; HF)
F + A → продукты
F + В → продукты
9
10.
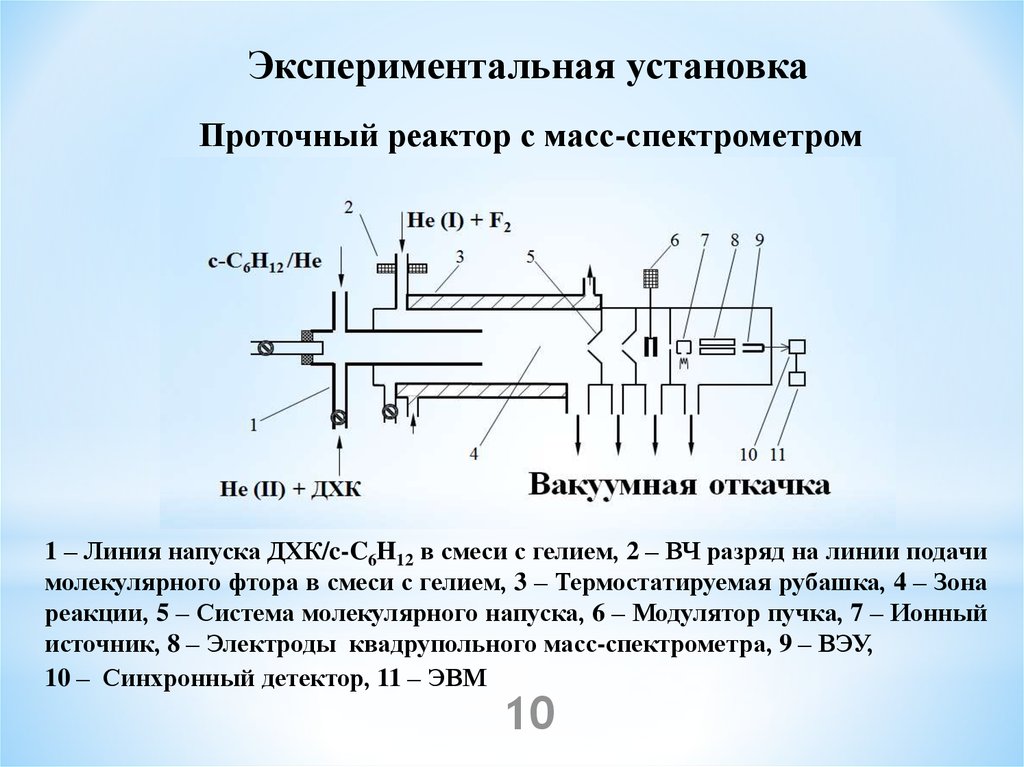
Экспериментальная установкаПроточный реактор с масс-спектрометром
1 – Линия напуска ДХК/c-C6H12 в смеси с гелием, 2 – ВЧ разряд на линии подачи
молекулярного фтора в смеси с гелием, 3 – Термостатируемая рубашка, 4 – Зона
реакции, 5 – Система молекулярного напуска, 6 – Модулятор пучка, 7 – Ионный
источник, 8 – Электроды квадрупольного масс-спектрометра, 9 – ВЭУ,
10 – Синхронный детектор, 11 – ЭВМ
10
11.
Экспериментальная установка11
12.
Экспериментальная установкаРазряд
Система вакуумной откачки
(паромасляный насос)
12
13.
Экспериментальная установкаРеактор
13
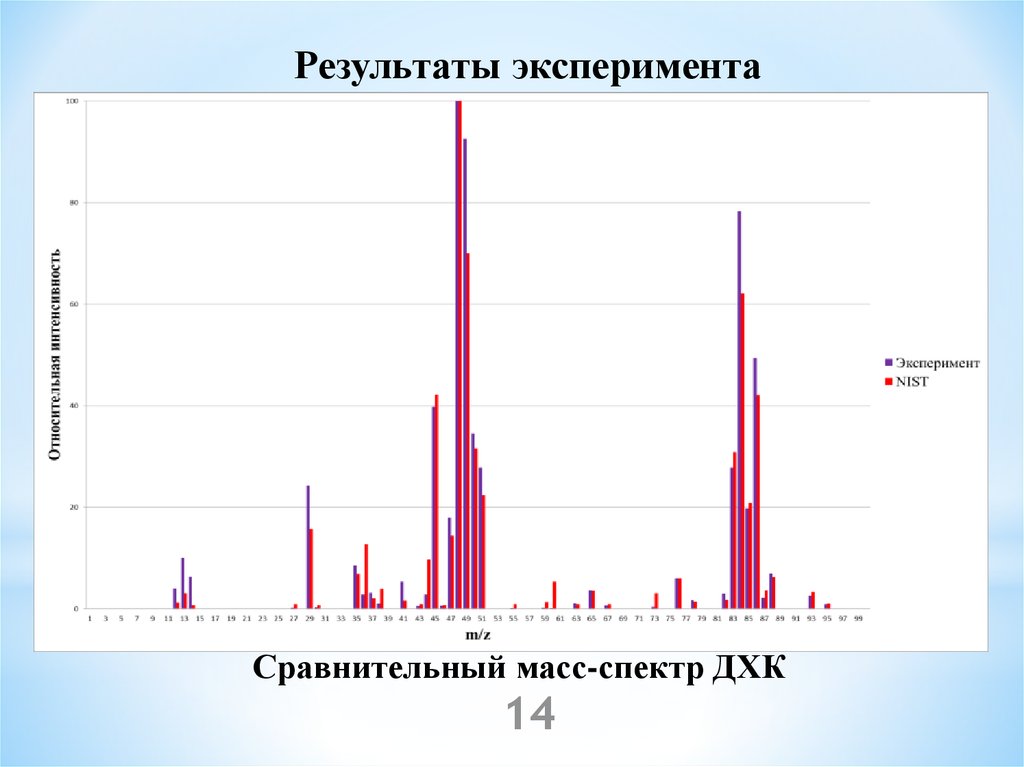
14.
Результаты экспериментаСравнительный масс-спектр ДХК
14
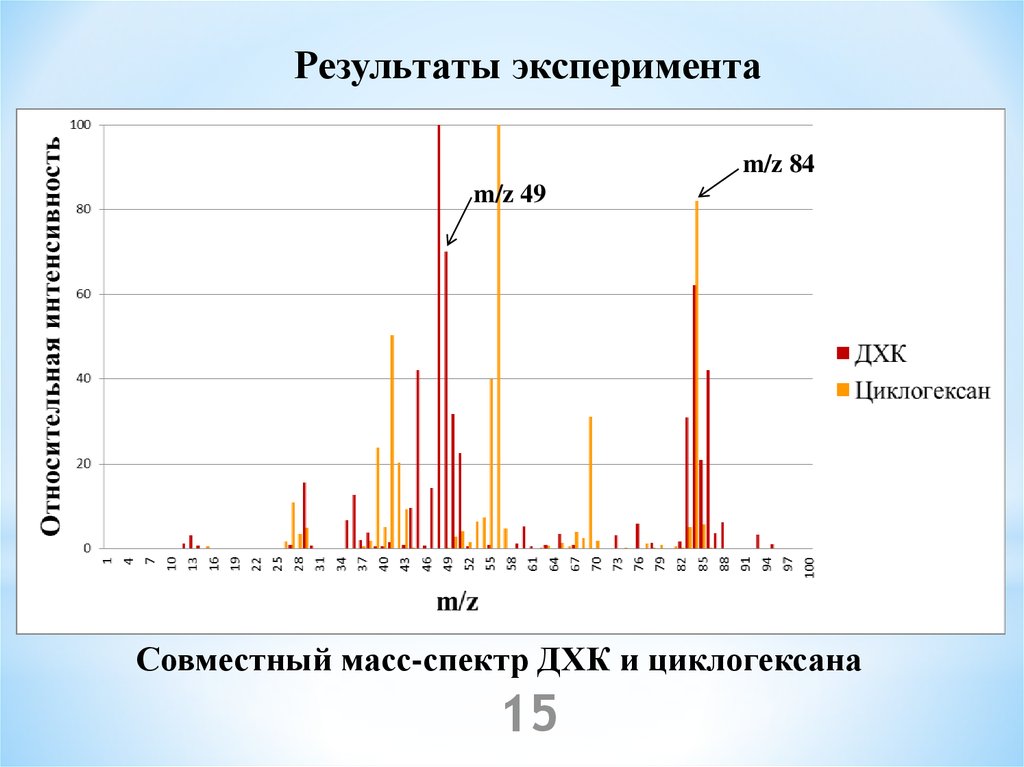
15.
Результаты экспериментаm/z 84
m/z 49
Совместный масс-спектр ДХК и циклогексана
15
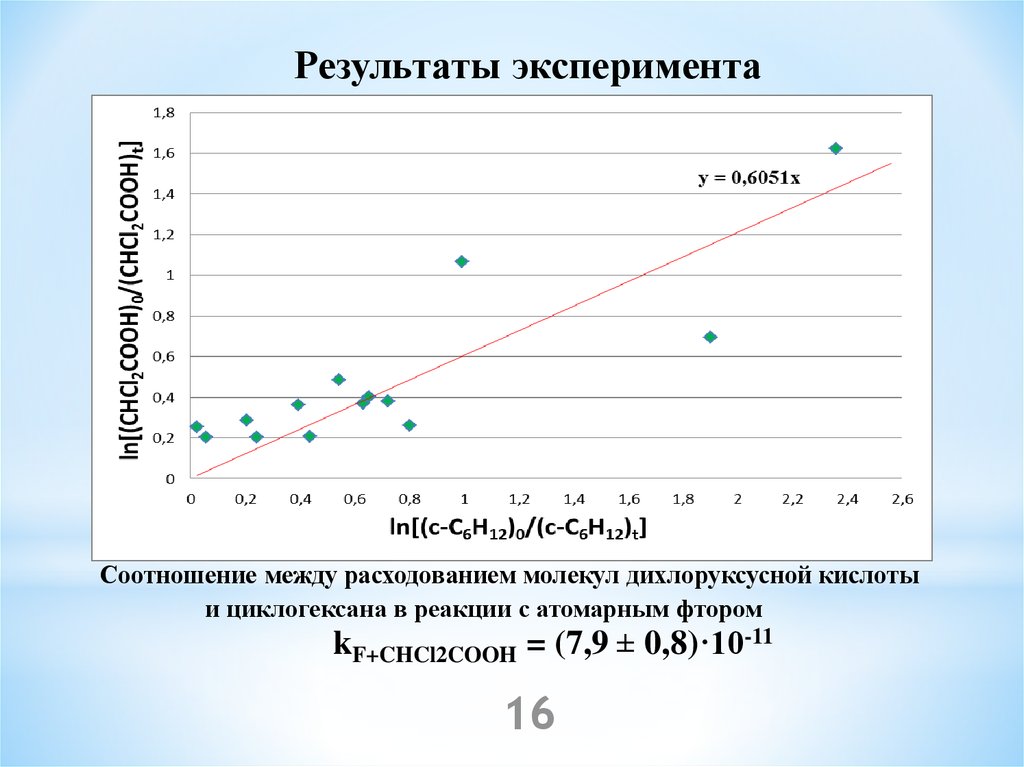
16.
Результаты экспериментаСоотношение между расходованием молекул дихлоруксусной кислоты
и циклогексана в реакции с атомарным фтором
kF+CHCl2COOH = (7,9 ± 0,8)·10-11
16
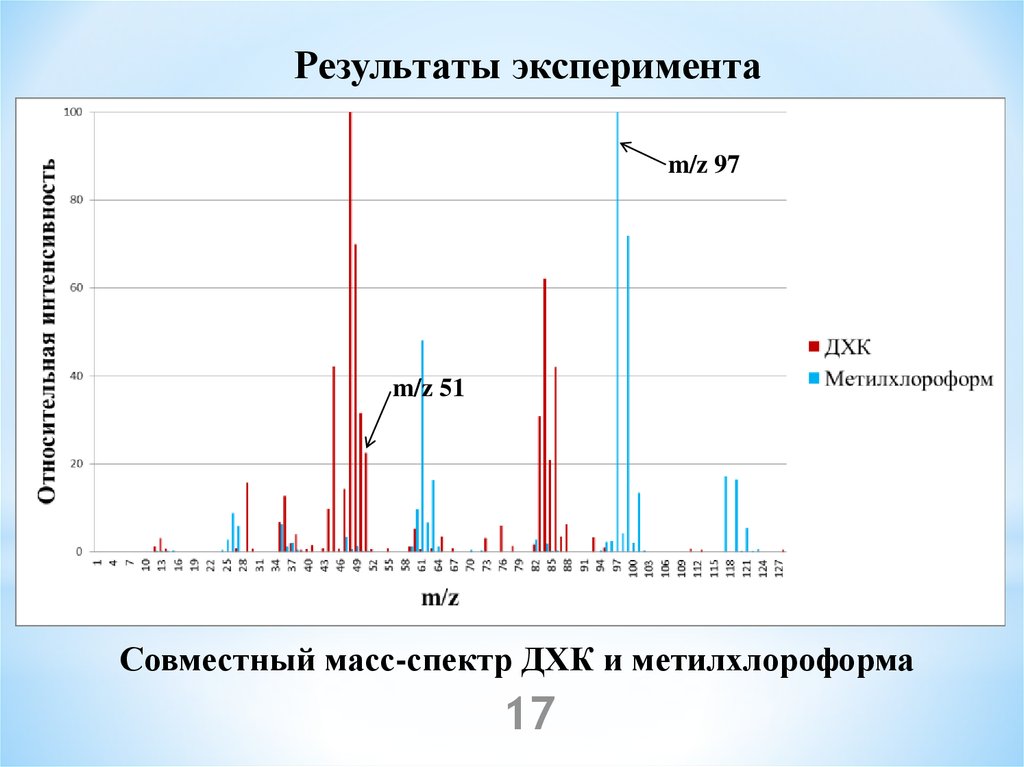
17.
Результаты экспериментаm/z 97
m/z 51
Совместный масс-спектр ДХК и метилхлороформа
17
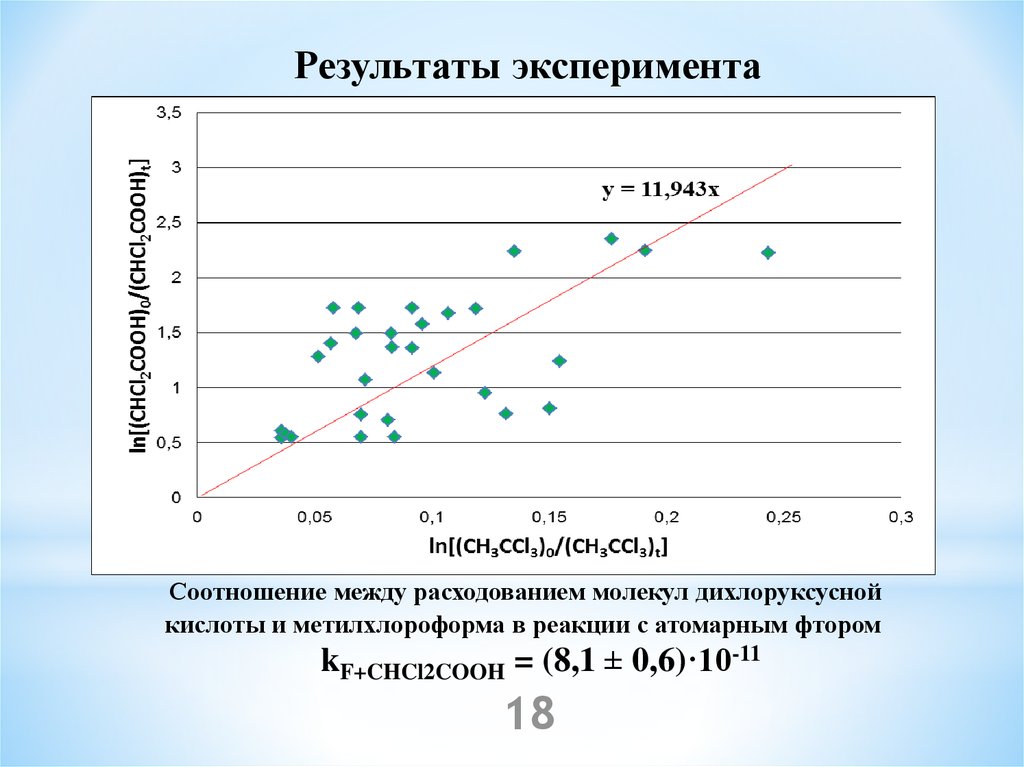
18.
Результаты экспериментаСоотношение между расходованием молекул дихлоруксусной
кислоты и метилхлороформа в реакции с атомарным фтором
kF+CHCl2COOH = (8,1 ± 0,6)·10-11
18
19.
ВыводыРеакция
F + CHCl2COOH
Конкурирующее вещество
Значение константы,
cm3 molecule-1 s-1
CH3CCl3
(8,1 ± 0,6)·10-11
C-C6H12
(7,9 ± 0,8)·10-11
Среднее значение константы скорости реакции
составляет:
kF+CHCl2COOH = (8,0 ± 0,9)·10-11 cm3 molecule-1 s-1
19











 chemistry
chemistry








