Similar presentations:
Термодинамика и термохимия процессов горения и взрыва
1.
Термодинамика и термохимия процессов горения и взрываВажнейшими параметрами эффективности ВС являются теплоты сгоранияQсгор, и теплоты взрывчатого превращения - Qвп, поскольку эти тепловые эффекты
определяют баллистические и взрывчатые характеристики. Основная задача
термохимии состоит в корректной оценке этих тепловых эффектов.
2.
Кислородный баланс, кислородный коэффициент,коэффициент избытка окислителя
Чтобы
оценить
энергетические
возможности
ВС,
необходимо
найти
соотношение между горючими компонентами и окислителем в молекуле. Это
соотношение можно
характеризовать величиной кислородного баланса (КБ) КБ -
выраженный в % избыток или недостаток окислителя в составе ВВ в расчете на полное
окисление горючих элементов до высших окислов.
3.
Для ВС формулы СаНвOcNd:КБ
(c 2a 0.5b) 16
100% ,
ММвв
(4.1)
Пример: рассчитать КБ тротила
С7Н5O6N3, ММтротила=227 :
КБ
Это означает, что на 100г
(6 14 2.5) 16
100% 74% .
227
ТНТ нехватает 74г кислорода, чтобы окислить все
горючие элементы до высших оксидов (СО2 , H2O)
4.
ВВ с положительным КБ принято называть окислителем. Избыток в молекуле ВВгорючего, как и избыток окислителя, с точки зрения энергетики, играет роль
балласта.
Зная КБ отдельных компонентов, можно рассчитать состав смеси с заданным КБ.
5.
ПРИМЕР: Рассчитать количество ТНТ и NH4NO3, необходимое для приготовления1 КГ амматола с КБ= -10%
1.Рассчитывается КБ каждого индивидуального компонента:
NH4NO3:
(3 2) 16
КБ
100% 20%
80
TНT:
КБ= -74 %
2. Составляется система из двух уравнений: по массе и по содержанию кислорода
Х - количество ТНТ в смеси
У - количество селитры
Х + У = 1000
(1)
X*(-74) + У*(+20) = 1000*(-10)
(2), откуда
Х= 319 г. У= 681 г.
6.
Для расчета КБ смесевой системы необходимо составить брутто-формулу смеси.Если система содержит металл в количестве Мк, а его высшая валентность n, и
галоген в количестве Хе, то для ВС состава СаHвОсNдХеМК
КБ
(c 0.5е 2a 0.5b 0.5 n к) 16
100% . (4.2)
ММвв
Поскольку при расчете КБ учитывается молекулярная масса, КБ зависит от
содержания в молекуле азота.
7.
Энергетические возможности можно оценить с помощью кислородногокоэффициента или коэффициента избытка окислителя.
Кислородный коэффициент А :
А
с 0.5e
100% . (4.3)
2a 0.5b 0.5 n к
Коэффициент избытка окислителя :
с 0.5e
. (4.4)
2a 0.5b 0.5 n к
Самые выгодные с точки зрения энергетики : А = 100%, =1.
8.
Чрезвычайно невыгодно иметь в молекуле окислитель уже связанный с горючим.Это означает, что ВВ уже частично сгорело.
Пример: ТЭН С-(СH2-O-NO2)4
В молекуле ТЭНа четыре связи С-O, на каждую связь "горючее-окислитель"
теряется ~100КДж тепла, таким образом для ТЭНа эта потеря составляет ~400 КДж/моль
9.
Термохимия процессов горения и взрываТермохимию процессов горения и взрыва можно рассматривать совместно,
поскольку химизм процессов горения и взрыва ВС очень близок. В термохимии
традиционно
существует
две
системы
знаков:
термохимическая
и
термодинамическая. Термохимическая исходит от окружающей среды: в ней
тепловыделение (экзотермические процессы) оценивается знаком плюс (+),
поглощение тепла (эндотермические процессы) - знаком минус (-).
В термодинамической системе исходят от самой системы. В ней тепловыделение
идет со знаком (-), а поглощение тепла со знаком (+).
10.
Первое начало термодинамики в термохимической системе знаков имеет вид:Q v Q p A , (4.5)
где Qv- тепловой эффект реакции при v=const (изохорный тепловой эффект);
Qр - тепловой эффект реакции при р=const (изобарный тепловой эффект);
А - работа расширения (внешняя работа).
11.
Первое начало термодинамики в термодинамической системе знаков имеет вид:H U A , (4.6)
где H - изменение теплосодержания системы;
U - изменение внутренней энергии системы;
А - работа, совершенная системой;
12.
Переход от одной системы знаков к другой:H Q p
U Q v
, (4.7)
,
(4.8)
13.
v2A P dV V P n RT
, (4.9)
v1
где n - изменение числа молей газообразных продуктов в процессе химической
реакции
n n 2 n 1 ,
где n 1 - число молей газообразных продуктов, вступающих в реакцию;
n 2 - число моей газообразных продуктов, полученных в результате реакции.
Тогда:
Q v Q p nRT . (4.10)
14.
Все термодинамические расчетные величины принято приводить к стандартнымусловиям:
Р = 1 Кг/см3 = 760 мм.рт.ст. = 101,3 КПа
Т=298.15 °К (25°С)
R= 8,31 Дж/мольК , отсюда
RТ = 2,48 КДж/моль ,отсюда
Q v Q p 2.48 n . (4.11)
Уравнение (4.11) - переход от изобарного теплового эффекта к изохорному.
Взрыв, как явление быстротечное, уподобляется изохорному процессу.
15.
Основные тепловые эффекты термохимии взрывчатых веществТеплота взрыва Qвп - количество тепла, которое выделяется при взрыве 1кг или
1моля ВВ.
Теплота горения Qсгор- количества тепла, выделяющееся при сгорания 1кг (1 моля)
ВВ.
При горении и детонации процессы химического превращения идут за счет горючих
и окислителя, содержащихся в самой взрывчатой системе.
16.
Из закона Гесса:Q вп Q об р.пв Q об р.вв , (4.12)
Q сго р Q об р.пг Q об р.вв
где:
Q
Q
об р.пг
об р.пв
, (4.13)
- сумма теплот образования продуктов взрыва;
- сумма теплот образования продуктов горения;
Qоб р.вв - теплота образования исходного ВВ.
Для смесевых ВС вместо Qобр.вв необходимо вычитать
Q
об р.исх.веществ
, с учетом их
количества в составе смеси.
Чтобы рассчитать Qвп и Qсгор, необходимо знать теплоты образования ВВ (Qобр.вв)
17.
Теплота образования Qобр - количество тепла, выделяющееся или поглощаемое приобразовании одного моля вещества из молекул газов соответствующих элементов
(Н2, О2, N2, и т.д.) и простых веществ (С, металл и т. п.) Реакции образования могут
быть как реальными, так и гипотетическими.
H2 + 0.5O2
H2O + Qобр - реальная реакция
С + O2
CO2 + Qобр - реальная реакция
7Cтв+2.5H2+3O2+1.5N2
C7H5O6N3 + Qобр - гипотетическая реакция образования
тротила.
18.
Гипотетическая реакция образования ВВ общей формулы СаНвОсNd:аСтв + в/2Н2 + с/2O2 + d/2 N2
СаНвОсNd + Qобр
b c d
n 0 , следовательно
2 2 2
b c d
Q vоб р Q pоб р 2.48 , или
2 2 2
Q vоб р Q pоб р 124
. b c d . (4.14)
Теплоту образования ВВ в прямом эксперименте определить невозможно, ее
можно рассчитать из экспериментально найденной стандартной теплоты сгорания
соответствующего вещества.
19.
Стандартная теплота сгорания Qсгор.станд.- это количество тепла, котороевыделяется при сгорании одного моля вещества в избытке кислорода при полном
переходе С в СО2, Н в Н2О, N в N2, Х (галоид) в НХ.
Для веществ формулы СаНвОсNd реакция сгорания в избытке кислорода
записывается следующим образом:
СаНвОсNd + (а + b/4 - c/2) O2
aCO2 + b/2 H20жидк + d/2 N2 + Qсгор.
n = a + d/2 + c/2 - a - b/4 = d/2 + c/2 - b/4
d c b
Q v.сго р.ст Q p.сго р.ст 2.48 .
2 2 4
По Гессу,
Q сго р.ст . Q об р.пс.ст . Q об р.вв , отсюда
Q об р.ВВ. Q об р.пс.ст . Q сго р.ст . . (4.15).
20.
Стандартная теплота сгорания - это константа данной ВС, наивысшийтепловой эффект химического превращения. На практике
Qсгор.ст. никогда не
реализуется. Этот тепловой эффект получают при сжигании вещества в
калориметрической бомбе в избытке кислорода. Qсгор.ст. необходима исключительно
для расчета
Qобр (теплоты образования) соответствующего вещества. Для
определения термохимических характеристик
ВС необходима прецизионная
калориметрия. Особенно это касается тепловых эффектов систем, применяемых в
ракетной технике. Для БВВ небольшие ошибки при оценке Qобр ВВ допустимы,
поскольку окончательная приемка
ВВ, как правило, производится по натурным
испытаниям изделий (определение метательного действия, разрушения преград и
т.п.).
21.
На практике основные энергетические характеристики ВВ не всегда могутбыть определены экспериментальным путем по причине того, что имеется малое
количество ВВ, либо оно вообще еще не синтезировано, а известна лишь его
формула. В таких случаях прибегают к чисто расчетным методам оценки
соответствующих тепловых эффектов.
Как следует из закона Гесса, для расчета Qвп и
Qг
качественный и количественный состав продуктов взрыва
необходимо
знать
и горения, т.е. знать
реакцию взрыва и горения. Кроме того, для расчета указанных тепловых эффектов
необходимо знать теплоты образования исходных веществ. Возможны следующие
варианты расчета:
1. Рассчитать Qсгор.ст., через нее рассчитать Qобр.ВВ, а затем вычислить Qвп или Qсгор.
2. Рассчитать Qобр.ВВ, а затем вычислить теплоту взрыва или горения.
22.
Расчет стандартных теплот сгорания и теплот (энтальпий) образованияВсе расчетные схемы основаны на принципе аддитивности энергетических
вкладов отдельных фрагментов, заместителей, типов связей, содержащихся в
молекуле, в соответствующий тепловой эффект. При расчетах учесть влияние
абсолютно всех факторов практически невозможно, поэтому всегда будут иметь
место погрешности, даже в случае применения наиболее точных методов расчета.
Все методы расчета в зависимости от
точности получаемого результата
подразделяются на три группы: методы нулевого приближения (самые неточные),
методы первого приближения и второго. Методов расчета достаточно много, здесь
рассматриваются наиболее часто применяемые при расчетах, связанных с ВВ.
23.
Методы нулевого приближенияЭто методы грубой экспрессоценки. Они не учитывают индивидуальность
молекулы, ее строение. В этих методах учитывается только брутто состав, т.е.
соотношение между горючим и окислителем.
Метод Юнга и Кейса
По Юнгу и Кейсу рассчитываются стандартные теплоты сгорания соединений
формулы СаНвОсNd
Для большого числа соединений такого типа с известными из опыта Qсгор.ст. был
подсчитан фактор -S
S- количество атомов кислорода, необходимое для полного окисления горючих
элементов в высшие окислы.
24.
S=2a + b/2 - p/2 ,где 2а - количество атомов кислорода, необходимое для окисления С
СО2
в/2 - количество атомов кислорода, необходимое для окисления Н
H2О
р/2 - количество атомов кислорода уже связанных с горючим.
р - количество имеющихся связей “горючее-окислитель".
Из графика Qр.сгор.ст=f(S) для взятого массива веществ была найдена зависимость
Qр.сгор.ст=f(S)
Qр.сгор.ст=210,6 S . (4.16)
Пример: Рассчитать Qр.сгор.ст пикриновой кислоты
OH
NO2
O2N
NO2
S = 2 6 + 3/2 -1 = 12.5
Qр.сгор.ст = 210,6 12,5 = 2.63 МДж/моль.
25.
Методы первого приближенияЭти методы наряду с брутто-составом учитывают энергетический вклад
функциональных групп и определенных типов связей в соответствующий тепловой
эффект, но не учитывают взаимодействие между заместителями и его энергетический
вклад. Такие методы пригодны для инженерных расчетов.
Метод Караша
По Карашу рассчитывается стандартная теплота сгорания (Qр.сгор.ст.ж) для
жидкого состояния функциональнозамещенных органических соединений.
Сгорание вещества - это процесс перемещения электронов от атомов водорода и
углерода к атомам кислорода. Экспериментально установлено, что на каждую вновь
образующуюся связь "горючее-окислитель" выделяется 109,05 КДж тепла. Теплота
сгорания рассчитывается по формуле:
Q р.сгор.ст.ж = 109.05 (4a + b - p) + k i i
, (4.17)
26.
где (4а + в - р) -число вновь образующихся связей горючее-окислитель в продуктахсгорания;
k
i
i
- суммарный энергетический вклад заместителей и связей в стандартную
теплоту сгорания;
i - вклад заместителя (связи);
k i - число однотипных вкладов.
При расчете по Карашу теплот сгорания для твердых веществ из полученной
величины Qр.сгор.ст.ж необходимо вычесть теплоту плавления вещества - qпл
По Вальдену,
q пл 0.0565 Tпл , где Тпл в 0К, тогда
Qр.сгор.ст. тв. = 109,05 (4а + в - р) +
k
i
i -приводятся в справочных таблицах (см. табл. 4.1)
i
- qпл , (4.18)
27.
Вклады (инкрименты) к расчетам по методу КарашаТаблица 4.1
КДж
Группы и связи
структура
Нитрогруппа в алифатических и ароматических
R-NO2
-54,4
Нитрогрупга в гем-динитро
R-CH(NO2)2
-41,8
Нитрогруппа в тринитрметане
Alk-C(NO2)3
-27,2
Нитрогруппа в тетранитрометане
C(NO2)4
0
Нитрамин первичный
R-NH-NO2
+14,6
Нитрамин вторичный
R1 N NO
2
R2
+54,4
первичные
Alk-NH2
+54,4
вторичные
(Alk)2-NH
+91,6
третичные
(Alk)3-N
+108 ,8
первичные
Ar-NH2
+27,2
вторичные
(Ar)2-NH
+54,4
третичные
(Ar)3-N
+91,6
/гр (связь)
соединениях
Амины алифатические:
Амины ароматические
28.
Спирты:первичные
R-OH
+54,4
вторичные
R2CH-OH
+27,2
третичные
R3C-OH
+14,6
Нитраты
R-ONO2
0
Фенолы
Ar-OH
+14,6
Углеродный атом четвертичный
R4 C
-14,6
Кетоны (алифатические и ароматические)
R2C=O
+27,2
O
+54,4
Альдегиды (ароматические и алифатические)
R
C
Амиды кислот
H
O
R
C
Амиды замещенные
O
R
Изонитрилы в алифатическом ряду
-14,6
NH2
R
C
+27,2
N
N
(R)
2
C
+138,5
Карбоксильная группа:
В алифатических кислотах
Alk-COOH
0
В ароматических кислотах
Ar-COOH
-54,4
ароматических радикалов
Ar-Ar
-27,2
ароматического радикала с алифатическим
Ar-Alk
-14,6
Связи:
29.
ароматический радикал с хлоромAr-Cl
+27,2
ароматический радикал с бромом
Ar-Br
+54,4
ароматический радикал с виниловым
Ar C
ароматический радикал с
Ar C
-27,2
C
C
-27,2
ацетиленовым
ароматический радикал с азотом
N
-14,6
Alk-Cl
+54,4
Ar
(типа NH3)
алифатический радикал с Сl и Вr
Alk-Br
Этиленовая связь
C
+54,4
C
Ацетиленовая связь
RC
CH
+192,9
Ацетиленовая замещенная
RC
CR
+138,5
Азидная группа
-N3
+293
Сульфогруппа в ароматическом соединении
Ar-SO3H
-98
простые
R1-O-R2
+91,6
сложные алифатические
R1
Эфиры:
O
R
2
+69,1
O
Ar
2
+41,8
C
O
сложные ароматических кислот
Нитрил в ароматическом соединении
Ar1
C
O
Ar-CN
-27,2
30.
Нитрил в алифатическом соединенииAlk-CN
+69,1
Азосоединения
R-N=N-R
+268
Тетразолы
N
+268
CH
N
N NH
Ангидриды карбоновых кислот
+41,8
Ar
C
O
O
C
O
Гидразинная связь
=N-N=
+69
Нитрозоамин
=N-NO
+69
Инкрименты для нитропроизводных учитывают взаимное влияние нитрогрупп, связанных с одним
и тем же углеродным атомом, что является элементами второго приближения в методе Караша.
31.
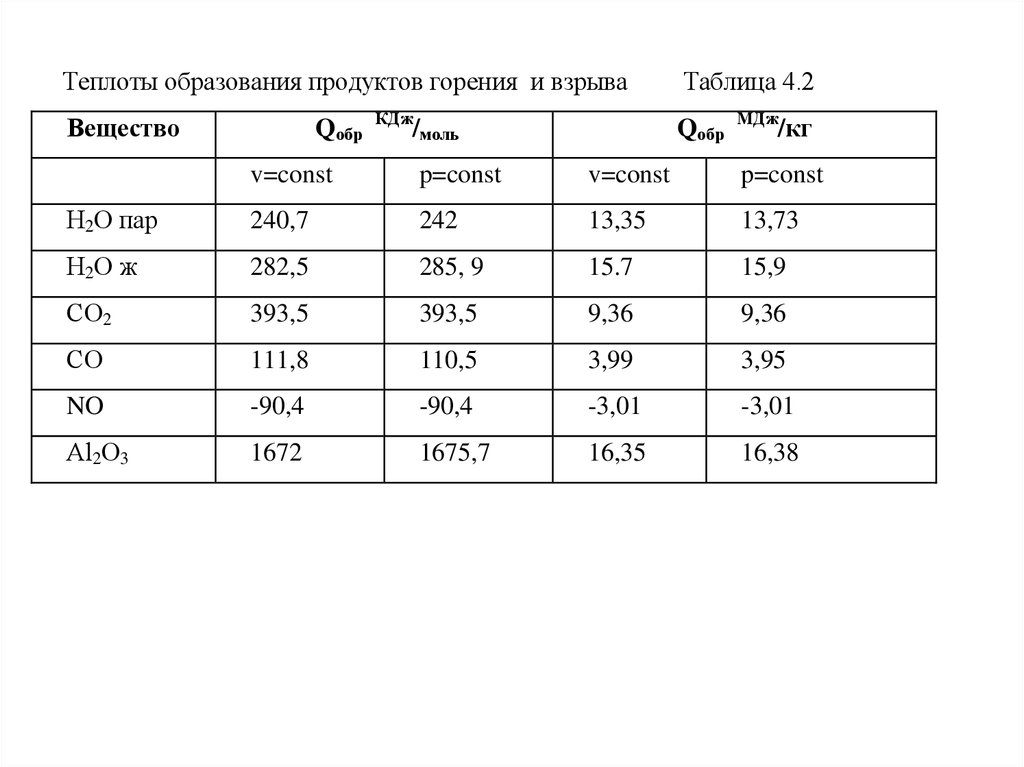
Теплоты образования продуктов горения и взрываВещество
Qобр
КДж
/моль
Таблица 4.2
Qобр
МДж
/кг
v=const
p=const
v=const
p=const
Н2О пар
240,7
242
13,35
13,73
Н2О ж
282,5
285, 9
15.7
15,9
СО2
393,5
393,5
9,36
9,36
СО
111,8
110,5
3,99
3,95
NO
-90,4
-90,4
-3,01
-3,01
Аl2О3
1672
1675,7
16,35
16,38
32.
Пример: Пользуясь методом Караша, рассчитать теплоту образования (Qv.обр)тринитроэтилового спирта,
Тпл=80 0С
(NO2)3C-ÑH2-OH ; C2H3O7N3
I. Расчет по Карашу Qp.сгор.ст.
Qp.сгор.ст. = 109,05*(4*2 +3-2) + [3*(-27,2)+1*(-14,6)+54,4] - 0,0565*353=919.7
Qp.сгор.ст.
Qv.сгор.ст.
Qv.обр.ВВ
Первый вариант расчета Qv.обр.ВВ :
2. Переход Qp.сгор.ст.
Qv.сгор.ст
Qv.сгор.ст= Qp.сгор.ст.+ 2.48 n
Реакция сгорания:
C2H3O7N3 = 2CO2 + 1.5 H2Oж + 1.5N2 + 0.75 O2
n = 2 + 1,5 + 0,75 = 4,25
Qv.сгор.ст= 919,7 + 2,48*4,25 = 930,2
3. Расчет Qv.обр.ВВ:
КДж
/моль
Q v.сго р.ст Q v.об р.пс.ст . Q v.об р.ВВ , отсюда
Q v.об р.ВВ Q v.об р.пс.ст . Q v.сго р.ст
Qv.обр.ВВ =(2*393.5 + 1.5*282,5) - 930,2 = 280,5 КДж/моль
КДж
/моль
33.
Второй вариант расчета Qv.обр.ВВ:Qp.сгор.ст.
Qp.обр.ВВ.
Qv.обр.ВВ
2. Расчет Qp.обр.ВВ.
Q p.об р.ВВ Q p.об р.пс.ст . Q p.сго р.ст
Qp.обр.ВВ =(2*393.5 + 1.5*285,9) - 919,7 = 296,15 КДж/моль
3. Переход Qp.обр.ВВ.
Qv.обр.ВВ
Реакция образования ВВ:
2Ств + 1,5 Н2 + 3,5 О2 + 1,5 N2
C2H3O7N3
n = -1,5 -3,5-1,5= -6.5
Qv.обр.= 296,15 - 2,48*6,5 = 280,03
КДж
/моль
34.
Расчетэнтальпий
образования
по
методу
Франклина
(метод
первого
приближения)
Энтальпия образования веществ рассчитывается путем суммирования
энергетических вкладов в нее отдельных заместителей и целых фрагментов молекул.
Расчет ведется для жидкого состояния.
По Франклину:
Hf жидк ( n i H i ) , (4.19)
где
H i - энергетический вклад в энтальпию образования отдельного
заместителя или фрагмента молекулы. Эти вклады приводятся в справочниках по
термохимии (см табл. 4.3);
ni - число однотипных заместителей или фрагментов.
Пример: по Франклину рассчитать энтальпию образования ( Hf ) и теплоту
образования (Qv.обр) ТЭНа , Тпл = 141 0С
35.
1. Структурную формулу соединения расчленить на фрагменты, на которые втаблице есть вклады:
С-(СН2ОNО2)4
С
-1
СН2
-4
ОNО2 - 4
2. Расчет Hf
Hf ж = 1*14,65 + 4*(-25,53) + 4*(-119,5)= -564,67
Hf тв = -564,67 - 0,0565*(273 +141)= - 588 КДж/моль
3.Переход от Hf к Qp.обр
Qp.обр = - Hf = 588 КДж/моль
4.Переход от Qp.обр к Qv.обр
Реакция образования:
5Ств + 4 Н2 + 6O2 + 2 N2
С5H8О12N4
n = -(4+6+2)= -12
Qv.обр = 588 + 2,48*(-12) = 558 КДж/моль
КДж
/моль
36.
Энергетические вклады к методу ФранклинаГруппа
H i
СН3
КДж
Таблица 4.3
КДж
Группа
H i
-48,14
ONO2
-119,3
СН2
-25,53
N3
335,2
СН
-5,44
NH-NН ал
146,65
Сар-Н
8,37
N - N ар
226,26
С
14,65
СООН ал
-436,2
Сар
18,84
СООН ар
-428,6
ОН ал
-205,5
СНО ал
-142,46
ОН ар
-215,6
CНО ар
-134,1
NО2 ал
-67,81
СОО ал
-369,5
NО2 ар
-51,07
N-NO2
39,8
NО2 в ди
-43,57
NH-NО2
-12,57
NО2 в три
-15,1
N=N
259,7
CN ал
93,43
CF3
-662
CN ар
100,56
Cl
-62,8
NH2 ар
-29,3
СF2
-402,2
NH2 ал
-6,5
F
-207,11
NН ал
39,8
НH ар
8,38
Аромат.
cоед.
N ал
92,18
C6H5
60,29
N ар
62,85
C6H4
71,71
0 ал
-129,9
C6H3
83,14
0 ар
-136,6
C6H2
94,56
СО ал
-159,22
C6 H
105,98
СО ар
-150.84
С6
117,4
/гр
/гр
37.
Метод ГИПХа (метод второго приближения)Метод ГИПХа - уточненный метод Франклина, в котором при
энтальпии
образования
веществ
учитывается
попарное
расчете
взаимодействие
заместителей, что и делает его методом второго приближения.
За основу берется формула Франклина, в которую введен второй член,
учитывающий взаимодействие заместителей.
i
j
1
1
Hfжидк ( ni H i ) ( n j H j ) , (4.20)
где H i - энергетический вклад в энтальпию образования отдельного заместителя
или
фрагмента молекулы. Эти вклады приводятся в справочниках по термохимии;
ni. - число однотипных заместителей или фрагментов;
H j
-
энергетический
вклад
в
Hf жидк , учитывающий взаимодействие
заместителей;
nj - число однотипных попарных взаимодействий.
Поправки на взаимодействие заместителей получены как разность между энтальпией
образования
вещества,
рассчитанной
из
стандартной
теплоты
сгорания
(экспериментальной), и энтальпией образования того же вещества, рассчитанной по
Франклину (см. табл. 4.4).
38.
ПРИМЕР: Рассчитать энтальпию образования гексанитроэтана методом ГИПХаNO2
O2N
O2N C
O2N
C
NO2
NO2
1. Расчленить формулу ГНЭ на фрагменты, для которых есть вклады H i в таблице
С
- 2
NO2 - 6
2.
Установить
характер
заместителями.
NO2-C-NO2
- 6
NO2-C-C-NO2 - 9
и
количество
попарных
взаимодействий
между
39.
3. Рассчитать энтальпию образования ГНЭ:Hf жидк = 2*14,65 + 6*(-67,81) + 6*51,07 + 9*18 = 90,84 КДд/моль
Экспериментальаые данные для ГНЭ:
ИХФ АН ....... Hf = 96,28 КДж/моль
ГИПХ .......... Hf = 94,18 КДж/моль
Энтальпия образования ГНЭ без учета взаимодействия заместителей:
Hf жидк =2*14.65 + 6*(-67,81) = - 377 КДж/моль
Таким образом для полизамещенных соединений метод Франклина дает чрезвычайно
большую погрешность.
40.
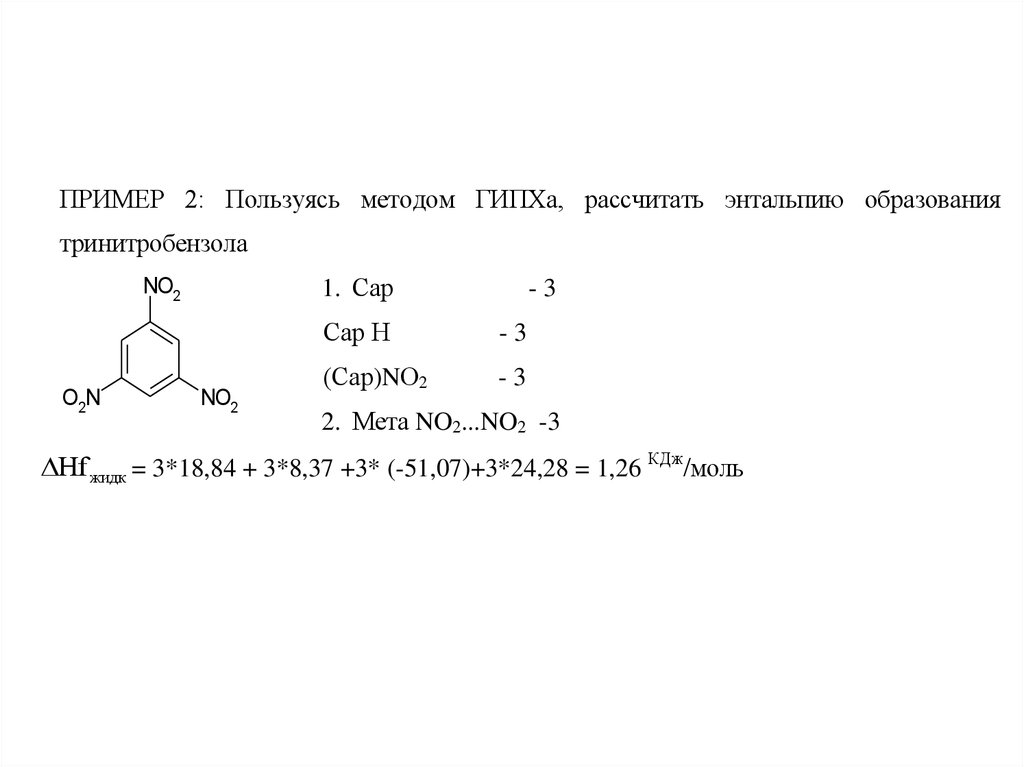
ПРИМЕР 2: Пользуясь методом ГИПХа, рассчитать энтальпию образованиятринитробензола
1. Сар
NO2
O2N
NO2
-3
Сар Н
-3
(Сар)NО2
-3
2. Мета NO2...NO2 -3
Hf жидк = 3*18,84 + 3*8,37 +3* (-51,07)+3*24,28 = 1,26 КДж/моль
41.
В тех случаях, когда табличные данные по H j отсутствуют, при расчетах H jможно
использовать
заместительные
константы
Тафта
для
полизамещенных
алифатических соединений и константы Гаммета для полизамещенных ароматических
соединений.
Для алифатических соединений типа Х-С-У между H j и , константами Тафта,
существует линейная зависимость:
H j = 3.35 x y , (4.21)
где x и y - константы Тафта, которые приводятся в термохимических таблицах.
Если взаимодействие ослаблено удалением заместителей еще на одну метиленовую
группу: Х-С-С-У ,то при расчетах вводят коэффициент ослабления
H j = 3.35
x y
K
, (4.22)
где К - коэффициент ослабления, для одной группы СН2 - К = 2,8.
Для ароматических соединений типа Х-С6Н4-У
H j = x y , (4.23)
где 7.53 ;
x , y - заместительные константы Гаммета, соответствующих заместителей с
учетом их взаимного расположения.
42.
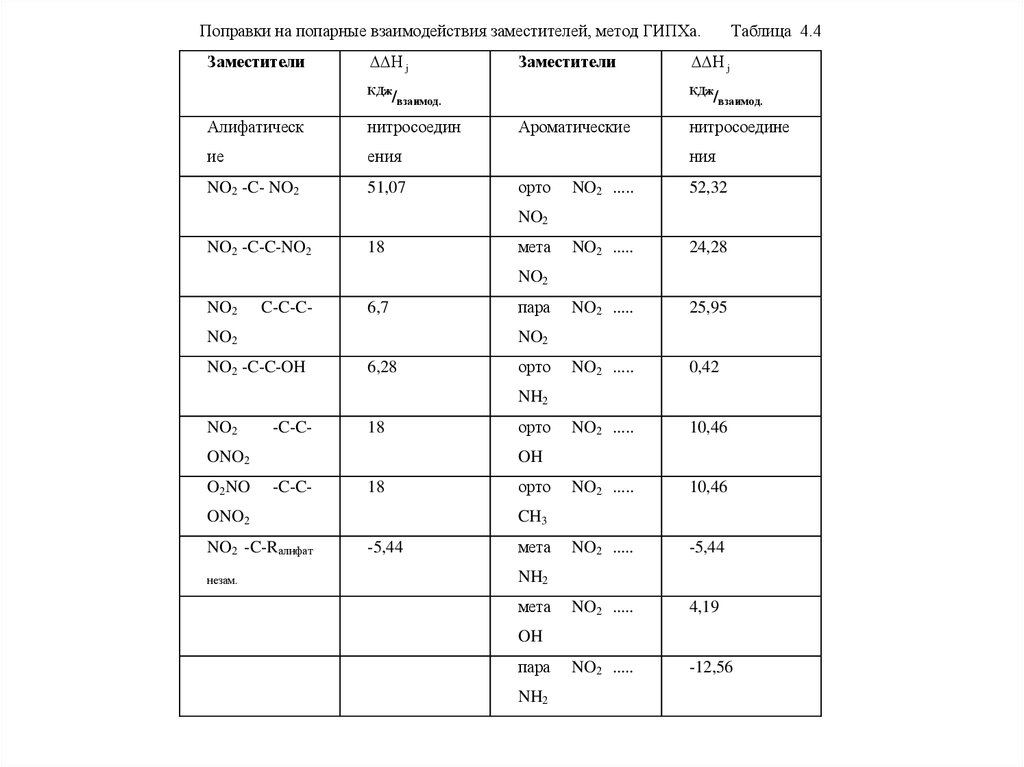
Поправки на попарные взаимодействия заместителей, метод ГИПХа.Заместители
H j
Заместители
КДж
нитросоедин
ие
ения
NO2 -C- NO2
51,07
H j
КДж
/взаимод.
Алифатическ
Таблица 4.4
/взаимод.
Ароматические
нитросоедине
ния
орто
NO2 .....
52,32
NO2 .....
24,28
NO2 .....
25,95
NO2 .....
0,42
NO2 .....
10,46
NO2 .....
10,46
NO2 .....
-5,44
NO2 .....
4,19
NO2 .....
-12,56
NO2
NO2 -C-C-NO2
18
мета
NO2
NO2
C-C-C-
6,7
NO2
пара
NO2
NO2 -C-C-OH
6,28
орто
NH2
NO2
-C-C-
18
ONO2
O2NO
OH
-C-C-
18
ONO2
NO2 -C-Rалифат
незам.
орто
орто
CH3
-5,44
мета
NH2
мета
OH
пара
NH2
43.
Расчет теплот образования веществ по энергиям связей, методЛейдлера
(Метод первого приближения)
Если в веществе общей формулы СаНвOcNd разрушить все связи, то получится
система атомов и газообразного углерода:
СаНвОсNd аСгаз + вН + сО + dN
Рис. 4.1 Энергетическая схема переходов
44.
Чтобы перевести вещество в это состояние, необходимо затратить энергию равнуюсумме энергий связей
между атомами ( Qсвязей ). Таким образом сумма энергий
связей, содержащихся в данном веществе, составляет теплоту образования моля
этого вещества из атомов. Чтобы рассчитать теплоту образования вещества,
получаемую из молекул газов и твердого углерода, из суммы энергий связей
необходимо вычесть сумму теплот ассоциации и десублимации, см рис. 4.1.
Из этой схемы в соответствии с законом Гесса
Q об р.ВВ. Q связей Q ассоц.,десубл .
Энергия связи - это количество энергии, необходимое для разрыва данной
связи. Существует два вида значений энергий связи: истинная и средняя
термохимическая. При расчетах используются средние термохимические значения
энергий связей, которые приводятся в справочниках термодинамических и
термохимических величин (см табл. 4.5, 4.6). Расчет по энергиям связей широко
используется в теоретической органической химии. К ВВ данный метод имеет
ограниченное применение, т.к. расчет ведется для газообразного состояния ветества,
в то время как точные значения перехода из газообразного состояния в твердое
неизвестны, известно только, что они значительны, доходят до 80 КДж/моль.
45.
Энергии ассоциации и десублимации.Таблица 4.6
Элементы
Qассоц. И десубл. КДж/атом
H H2
218,1
N N2
473,02
O O2
249,48
F F2
79,53
Cгаз Cтв
715,4
46.
Энергии связей и термов (групповых вкладов).Таблица 4.5
Тип связи, терм
Qсвязи КДж/связь, терм
С-С
355,7
С=С
608.2
С С
846,7
С-H
410,2
C-O-H
829
C-N
304,7
N-N
163
C-NO2 (моно)
1189,9
C-NO2 (гем)
1175,7
C-NO2 (три)
1155
C-O-NO2
1490,9
C-N-NO2
1718,35
47.
Пример: рассчитать по методу Лейдлера Qобр ТЭНа C-(CH2-ONO2)41.Выделить имеющиеся связи и термы
С - С ......... 4
С - Н ..........8
С - О -NO2...4
Q
Q
связей
=4*355,8 + 8*410,2 + 4*1490,9 = 10668,4
асс.,десубл
КДж
/моль
= 5*715,4 + 8*218,1 + 12*249,48 + 4*473,02 = 10206 КДж/моль
2. Qобр.газ. = 10668,4 - 10206 =462.4 КДж/моль
48.
Общая схема энергетических состояний веществРис. 4.2 Общая схема энергетических состояний вещества
49.
Теплоты образованияосновных ВВ
Таблица 4.7
ВВ
Qv.обр КДж/моль
Тротил
+ 42,28
Тетрил
- 55,67
Пикриновая
+ 200,09
кислота
Гексоген
-93.35
Октоген
-89,93
ТЭH
+ 502,35
Азид свинца
- 464,65
Гремучая ртуть
- 263,72
Перхлорат
+ 281,72
аммония
Аммиачная
селитра
+354,55
50.
Теплота взрыва (горения).Теплота взрыва (горения) - суммарный тепловой эффект реакций взрывчатого
превращения
(горения),
протекающих
между
горючими
компонентами
и
окислителем, содержащимися в ВС, отнесенный к КГ или молю ВВ.
По Гессу
Q вп Q об р.ПВ Q об р.ВВ ,
а теплота горения
Qсго р Qоб р.ПГ Qоб р.ВВ .
Для полного перехода горючих элементов в высшие оксиды у штатных ВС
собственного окислителя не хватает, поэтому в продуктах взрыва (горения)
присутствуют продукты неполного окисления и вообще неокисленные продукты,
например, Ств , Н2. , СО и т.д.
51.
Если теплота образования ВВ и стандартная теплота сгорания это физикохимические константы вещества, то теплота взрыва и теплота горения не являютсяконстантами,
их
величины
зависят
от
условий,
в
которых
протекает
соответствующий процесс.
В условиях взрыва ряд компонентов в продуктах взрыва несовместимы, поэтому в
них непрерывно идут равновесные вторичные реакции: состав продуктов взрыва все
время меняется до момента установления равновесия.
Состав продуктов взрыва стабилизируется примерно за 0.1 сек.
Существует два понятия теплоты взрыва:
- ФУГАСНАЯ теплота взрыва (калориметрическая). Именно эта теплота реализуется
за время 0.1 с.
- ДЕТОНАЦИОННАЯ теплота взрыва - теплота , которая реализуется в зоне
детонационной волны за время 10-7 сек.
Фугасную теплоту взрыва можно определить опытным путем во взрывных
калориметрах. Теплоты, относящиеся к малым временам, не поддаются измерению.
52.
Экспериментальное определение теплоты взрываПри определении фугасной теплоты взрыва во взрывном калориметре с
помощью электродетонатора производится подрыв заряда ВВ массой 25-50 г. Объем
калориметрической жидкости 50-100 литров. Определяемая Qвзр существенно
зависит от условий эксперимента, в частности, от степени закалки продуктов взрыва,
поэтому данные по теплотам взрыва, найденные из эксперимента, могу существенно
различаться.
Метод весьма трудоемкий, требующий большого расхода ВВ, поэтому Qвп чаще
всего находят расчетным путем. Расчет ведется по закону Гесса,
Q v.вп Q v.об р.ПВ Q v.об р.ВВ .
Таким образом задача сводится к нахождению качественного и количественного
состава продуктов взрыва, т.е. написанию предполагаемой реакции
взрывчатого
превращения, из которой рассчитывается Q v.об р.ПВ
Существует метод расчета Q v.об р.ПВ без написания уравнения реакции взрывчатого
превращения.
53.
Основные и второстепенные равновесные реакции в продуктах взрываОсновными продуктами взрыва веществ состава СаНвOcNd являются: СО2,
СО, Н2Опар, Н2, N2, Ств. Меньшее значение имеют продукты: NО, СH4, NH3, НСN,
СН3ОН и др. Конечный состав продуктов взрыва определяется суммарным
действием различных реакций.
Основными среди этих реакций являются следующие:
1. Н2 + 0,5 O2
Н2О пар + 240,7 КДж
2. С
+ 0,5 О2
СО
+ 111.8 КДж
3. СO + 0,5 O2
СО2
+ 281,7 КДж
4. 2СО
СО2 + С + 170 КДж
- реакция Будуара (доменного
СО + Н2О - 41,02 КДж
- реакция водяного пара.
газа)
5. СО2 + Н2
Кроме основных реакций в продуктах взрыва протекает ряд второстепенных реакций,
энергетический вклад которых в Qv.вп. очень мал, поэтому при расчетах их, как правило, не
учитывают.
54.
Примеры таких реакций:СH4 + СО2
2СО + 2H2 + 242 КДж
2NО + 2СО
N2+ 2СО2 + 744,3 КДж
N2 + О2
2NО
- 180,8 КДж
N2+3Н2
2NH3
+ 87,1 КДж и другие.
Далее речь будет идти только об основных равновесных реакциях. Вклад
каждой из этих реакций зависит от соотношения кислорода и горючих элементов в
составе ВВ.
По признаку соотношения кислорода и горючих элементов все ВВ формулы
СаНвOcNd можно разделить на три группы.
55.
I. ВВ, у которых собственного кислорода достаточно для окисления всех горючихэлементов до высших окислов, т.е. с КБ 0
Принадлевность к этой группе определяется соотношением: с 2а + в/2
Главной, т.е. управляющей реакцией для этой группы ВВ является
реакция:
СО + 0,5 О2
СО2
Именно эта реакция учитывается при приближенных расчетах состава продуктов
взрыва.
Из штатных ВВ к этой группе относятся: нитроглицерин, аммиачная селитра.
56.
2. ВВ, у которых кислорода не хватает для перевода всех горючих элементов ввысшые окислы, но достаточно для полной газификации горючих, КБ<0.
Принадлежность к этой группе определяется соотношением: а + в/2 < с < 2а + в/2
Управляющая реакция:
СО2+ Н2
СО + Н2О
К этой группе относятся мощные БВВ: гексоген, октоген, ТЭН
57.
3. ВВ с резким дефицитом кислорода, в продуктах взрыва есть конденсированнаяфаза - твердый углерод.
Принадлежность к этой группе определяется соотношением: с < а + в/2
Управляющая реакция:
2 СО
СО2+ С
К этой группе относятся: тротил, тетрил.
58.
Приближенные методы написания уравнений взрывчатого превращенияЭти методы пригодны только для ориентировочных расчетов теплот взрыва и
не пригодны для определения состава продуктов взрыва, т.к. не учитывают роль
управляющих равновесных реакций.
Метод Уилсона (Вильсона) и Бринкли
Пригоден для расчетов состава продуктов взрыва всех трех групп ВВ.
Это метод последовательного окисления:
H2 до H2O
C
до CO
СО до СО2.
Теоретическим обоснованием такой последовательности окисления является тот
факт, что константа диссоциации паров H2O в условиях взрыва значительно ниже
константы диссоциации окиси углерода.
59.
ПРИМЕРЫ:1. С3H5N3O9
2,5Н2О + 3СО2 + 1,5 N2 + 0,25 О2 ( Нитроглицерин)
2. С5H8N4O12
4H2O + 3СО2 + 2СО +
2N2 ( ТЭН)
3. С7H5N3O6
2,5Н2О + 3.5СО + 3,5С + 1,5 N2 (Тротил)
Расчет теплоты взрыва ТНТ:
Qv.вп. = 2,5*240,7 + 3,5*111,8 - 42,28 = 950,8 КДж/моль
Q v.вп.уд
950.8 10 3
4.186
227
МДж
/КГ
Метод Уилсона и Бринкли не пригоден для расчетов Qv.вп ВВ с низким и высоким
содержанием водорода: в первом случае получаются заниженные значения по
теплотам взрыва, во втором - завышенные. Хорошие результаты получаются
для ВВ, имеющих среднее соотношение водорода и углерода.
Примеры: высоководородное ВВ - нитрогуанидин - СН4O2N4,
Низководородное ВВ -тринитробензол - С6H3О6N3
в/а = 3/6
в/а =4/1
60.
Метод Камлета (США, Военно-морская лаборатория)Расчет состава продуктов взрыва ведется для максимального тепловыделения.
Последовательность решения:
-водород окисляется до воды - (Н2. до Н2O)
-углерод до диоксида (С до CO2)
Рассчитанные по этому методу Qv.вп
использовались автором для вычисления
скорости детонации. Поскольку в условиях детонации развиваются очень высокие
давления, реакция Будуара будет смещаться вправо:
2СО
СО2 + C ,
P
поэтому в продуктах взрыва будет только СО2.
61.
По Камлету, реакция взрывчатого превращения гексогена :С3H6О6N6 3Н2О + 1,5СО2 + 1.5С + 3N2 , (Qv.обр.гексогена= -93.35 КДж/моль)
Qv.вп = 3*240,7 + 1,5*393,5 - (-93,35) = 1405 КДж/моль
Q v.вп.уд
1405 10 3
6.32
222
МДж
/КГ
Для сравнения, Qv.вп гексогена , рассчитанная по Уилсону и Бринкли:
С3H6О6N6 3Н2О + 3СО + 3N2
Qv.вп= 3*240,7 + 3*111,8 -(-93,35) = 1150,8 КДж/моль
Q v.вп.уд
1150.8 10 3
518
.
222
МДж
/КГ
Наиболее корректное значение Qv.вп для гексогена составляет : Qv.вп.уд=5,53 МДж/КГ
Практика показывает, что в составе продуктов взрыва всегда присутствует углерод,
но не в тех больших количествах, которые дает метод Камлета. Таким образом метод
Камлета переоценивает роль реакции Будуара, а метод Уилсона и Бринкли
недооценивает ее роль.
Более корректными методами расчета состава продуктов взрыва являются методы,
учитывающие управляющие реакции, константы равновесия которых зависят, как
известно, от температуры. Поэтому необходимо оценивать температуря горения и
взрыва ВС.
62.
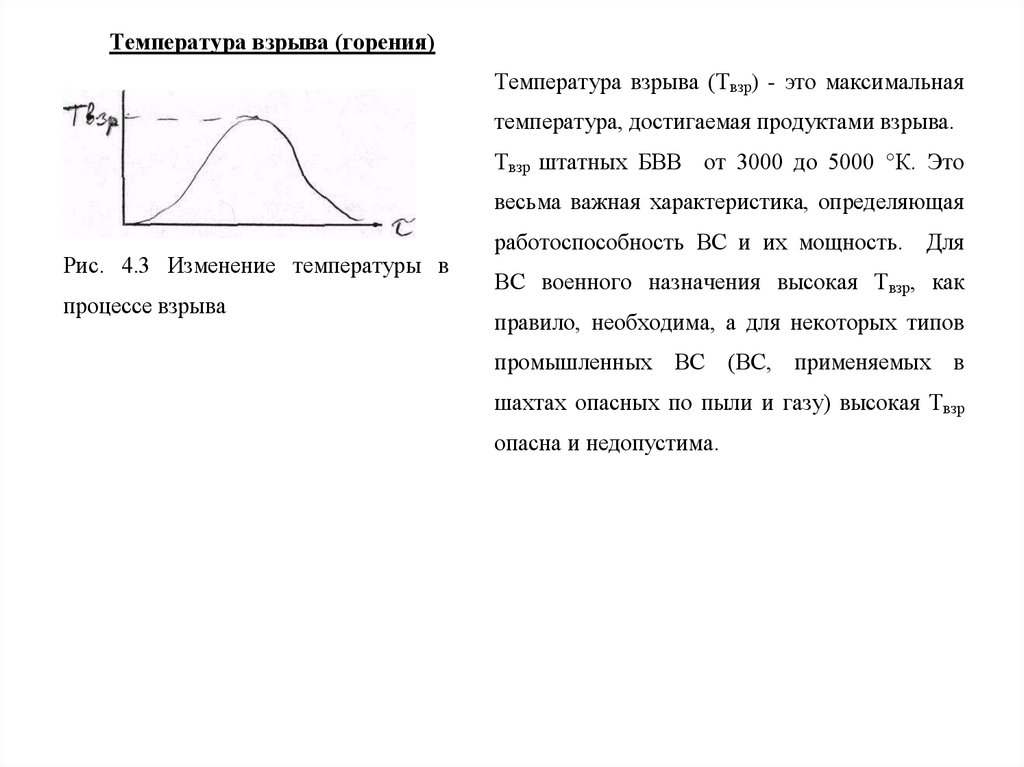
Температура взрыва (горения)Температура взрыва (Твзр) - это максимальная
температура, достигаемая продуктами взрыва.
Твзр штатных БВВ от 3000 до 5000 °К. Это
весьма важная характеристика, определяющая
Рис. 4.3 Изменение температуры в
процессе взрыва
работоспособность ВС и их мощность. Для
ВС военного назначения высокая Твзр, как
правило, необходима, а для некоторых типов
промышленных ВС (ВС, применяемых в
шахтах опасных по пыли и газу) высокая Твзр
опасна и недопустима.
63.
Для снижения Твзр в состав таких ВС вводят вещества, обладающие высокойтеплоемкостью (NаСl, KCl т.п.). Эти добавки нередко играют роль ингибиторов
реакций окисления горючих газов кислородом воздуха. Такие ВС называют
антигризутными ВВ.
Экспериментальные методы определения Твзр ввиду больших скоростей процесса
сложны. Наиболее корректными являются спектральные методы, основанные на
анализе цветового спектра излучения при взрыве. Тгор в дозвуковых потоках (при Тгор
ниже 26000К) можно измерять с помощью термопар, более высокие Тгор тоже
измеряются спектральными методами. Температуры взрыва чаще всего находят
расчетным путем.
64.
Расчет температуры взрываМетодов расчета много. При расчете Твзр любым методом делаются следующие
допущения:
- взрыв - процесс адиабатический;
- взрыв протекает в условиях постоянного объема.
В таком случае все тепло химических реакций расходуется на нагрев продуктов
взрыва, следовательно: Qv.вп = Твзр Сv.пв , отсюда
Tвз р
Q v.вп
Сv.пв
, (4.24)
где Qv.вп - теплота взрыва;
Сv.пв - средняя изохорная теплоемкость продуктов взрыва.
65.
Расчет температуры взрыва по изменению внутренней энергии продуктоввзрыва
В
термодинамических
таблицах
приводятся
данные
по
изменению
внутренней энергии различных веществ, в том числе продуктов горения и взрыва, в
различных температурных интервалах. Эти данные используются при расчетах
температуры взрыва.
СХЕМА РАСЧЕТА:
Исходные данные для расчета: состав продуктов взрыва (уравнение взрывчатого
превращения) и теплота образования ВВ- Qv.обрВВ
1. Задают предполагаемую температурой взрыва - Твзр
2. Пользуясь термодинамическими таблицами, подсчитывают изменение внутренней
энергии продуктов взрыва - U при нагревании их от начальной, т.е. комнатной
температуры, до Твзр, которой задались. Таким образом подсчитывается изменение
внутренней энергии всех продуктов взрыва - U пв .
66.
3. По закону Гесса рассчитывают теплоту взрыва ВВ:Qv.вп= Q v.об р.пв - Qv.обрВВ
4. Сравнивают
знаки, т.е.
U
U
пв
пв
и Qv.вп. Они должны быть численно равны и иметь различные
= - Qv.вп
Если это равенство выполняется в пределах допустимой погрешности, заданная
температура соответствует Твзр, если нет,
температуру.
расчет повторяют задавая новую
67.
Расчет температуры взрыва по высокотемпературным энтальпиям продуктоввзрыва
При
нагревании
вещества
(высокотемпературная) энтальпия
его
H T
энтальпия
возрастает.
Полная
включает начальную, т.е. стандартную
энтальпию образования вещества H f и энтальпию, полученную за счет нагрева.
T
H H f
T
C
p
dT H i , (4.25)
298.15
где
C
p
dT - энтальпия, толученная от нагрева;
H i - энтальпия перехода (плавления, испарения, рекристаллизации и т.д.).
Для взрывных процессов H i приравнивают нулю.
Высокотемпературные энтальпии продуктов взрыва берут из термодинамических
таблиц.
68.
СХЕМА РАСЧЕТА :Исходные данные для нахождения Твзр:
Состав продуктов взрыва (горения), энтальпия образования исходных веществ H f .
1. Задают предполагаемую Tвзр (гор)
2. Из таблиц высокотемпературных энтальпий по заданной температуре находят
сумму высокотемпературных энтальпий продуктов реакции, -
T
ПВ.( ПГ )
3. Критерием решения задачи по нахождению Твзр.(гор) является энергетический
баланс, равенство:
T
ПВ
H fВВ (топлива)
Если равенство выполняется, заданная температуры соответствует Твзр(гор), если
нет- расчет повторяют, задавая новую температуру .
69.
Расчет состава продуктов взрыва, теплоты взрывчатого превращения ВВ, Твзрпо константам равновесия
В качестве исходных данных для решения задачи необходимо иметь:
- брутто формулу ВВ - СаНвOcNd
- теплоту образования ВВ - Qv.обр.вв
СХЕМА РАСЧЕТА:
1. Необходимо оценить группу ВВ по соотношению горючих и окислителя, т.е.
установить вид основной управляющей реакции.
2. С учетом группы ВВ написать предполагаемый качественный состав продуктов
взрыва.
Положим, что вещество относится ко второй группе, тогда управляющей реакцией
будет реакция водяного газа:
СО2 + Н2
СО + Н2O , а реакция взрыва будет иметь вид:
СаНвOcNd хСО2 + уСO + zН2О + hН2 + рN2
70.
3.Для написанной реакции составляются уравнения материального баланса;- по азоту ........... 2р=d
(1)
- по углероду.......х + у = а
(2)
- по водороду......2z + 2h = в
(3)
- по кислороду....2х + у + z = с (4)
В качестве (5) уравнения берется константа равновесия управляющей реакции:
СО2 + Н2
x
h
Kp
y z
x h
СО + H2О
y
z
(5)
Константа равновесия зависит от температуры.
4. Задаются предполагаемой Твзр
5. По заданной Твзр в таблицах находят константу равновесия для управляющей
реакции.
71.
6. Решают систему из пяти уравнений и находят уравнение разложения , т.е. х, у, z, h, р.7.По полученному составу продуктов взрыва одним из рассмотренных ранее методов
рассчитывают Твзр и сравнивают ее с заданий Твзр. Если они отличаются более чем на
500, то задаются новой Т и решение повторяют до хорошего совпадения значений
температур.
8.Найдя Твзр и соответствующий ей состав продуктов взрыва, по Гессу рассчитывают
теплоту взрыва - Qv.вп.
Если ожидаемая Твзр.(гор)
более 50000К, в составе продуктов реакции
обязательно будут содержаться ионы, поэтому при расчетах необходимо учитывать
константы
диссоциации
электронейтральности.
(Кдисс),
т.е.
соответствующие
уравнения
72.
Для взрывных процессов этот метод применяется редко, т.к. в его основе лежитдопущение, что при взрыве все тепло расходуется только на нагрев продуктов
взрыва. В действительности при взрыве часть тепла расходуется на преодоление сил
отталкивания между молекулами, которые сжаты до колоссальных давлений. Кроме
того, при написании уравнения взрывчатого превращения учитывается только одна
управляющая реакция, т.е. берется очень бедный состав продуктов взрыва. В
результате метод расчета весьма трудоемкий, но малоэффективный.
Однако этот метод широко применяется для расчета состава продуктов
горения. Все сделанные допущения для процессов горения справедливы. При
написании состава продуктов горения берется 20 и более компонентов, при этом
учитываются константы равновесия всех управляющих равновесных реакций и все
константы диссоциации. Расчет ведется на ЭВМ.
73.
Расчет теплоты взрыва (Qv.вп) без написания уравнения взрывчатогопревращения
(метод Авакяна)
В связи с трудностями корректного расчета состава продуктов взрыва
разработан инженерный метод расчета теплоты взрыва (Qv.вп), не требующий знания
состава продуктов взрыва. Расчет пригоден для веществ состава С аНвОсNd, как
индивидуальных, так и смесевых.
Теоретические основы метода
Для ВВ, у которых теплота образования близка к нулю, теплота взрыва
определяется только соотношением между горючими компонентами и кислородом.
Наиболее строго это соотношение можно выразить с помощью кислородного
коэффициента А.
A
c
100 / % / , (4.26)
2a 0.5b
где с - количество кислорода, содержащееся в ВС;
2а+0.5b - количество кислорода, необходимое для превращения С СО2,
Н2 Н2О.
Чем больше А, тем полнее идут реакции окисления и тем больше теплота взрыва
Qv.вп
74.
1. Авакян ввел представление о максимально возможной суммарной теплотеобразования продуктов взрыва,
Q
v.об р.ПВ.max
.
Эта величина, как правило, идеальная, она реализуется при окислении водорода до
воды:
Н2 + 0,5О2 Н2О + 240,7 КДж/моль
и при окислении углерода до СО2:
С + О2 СО2 + 393,5 КДж/моль
Для ВВ 2 и 3 групп , где А<100%,
Q
Для ВВ 1 группы , где А 100%,
Q
v.об р.ПВ.max
v.об р.ПВ.max
= 240,7* в/2 + 196,75*(с - в/2)
= 240,7* в/2 + 393,5*a.
2. Авакян ввел представление о коэффициенте реализации тепла - К, который равен:
K
Q
Q
Q
v.об р.ПВ.(р еальная )
, отсюда
v.об р.ПВ.max
v.об р.ПВ.(р еальная )
= К Q v.об р.ПВ.max . (4.27)
Физический смысл коэффициента реализации тепла: коэффициент К учитывает
совокупное действие всех констант равновесия управляющих реакций, действующих
в продуктах взрыва данной реакции.
Максимальное теоретическое значение К=1, в реальных случаях К<1.
75.
3. Коэффициент реализации тепла тем больше, чем больше в составе ВС кислорода.Авакян предположил, что между К и А существует строгая функциональная
зависимость - К(А).
Для нахождения вида этой зависимости были взяты 15 ВВ с Q v.об р 0 и надежными
данными по теплотам взрыва - Q v .ВП .
Для этих ВВ Q v.ВП Q v.обр.ПВреальн
Для
Q
указанных
v.об р.ПВ.max
ВВ
были
рассчитаны
коэффициенты реализации тепла
- К и кислородные коэффициенты - А.
Далее
была
найдена
графическая
и
аналитическая зависимоста К(А)
Рис. 4.4 Зависимость коэффициента
реализации тепла от кислородного
коэффициента
tg( ) 0.24
lg(K)=0.24*lg(A)+lg(0.32)
K=0.32*A0.24
Ограничения: если А 115 , то К>1, что не
имеет физического смысла.
76.
Схема расчета Qv вп по Авакяну1. Составить брутто-формулу вещества - СаНвОсNd
2. Рассчитать А:
A
c
100%
2a 0.5b
3. Рассчитать К:
K=0.32*A0.24
4.Рассчитать
II и III гр:
Q
5.Рассчитать
Q
Q
v.об р.ПВ.max
= 240,7* в/2 + 196,75*(с - в/2)
v.об р.ПВ.max
Q
v.об р.ПВ.р еальная
с учетом группы ВВ.
v.об р.ПВр еальн
= К Q v.об р.ПВ.max =Qv.вп
6. Для ВВ, у которых теплота образования не равна нулю, рассчитать Qv.вп
Qv.вп= Q v.об р.ПВ.max - Qv.обр.вв КДж/моль
7. Рассчитать Qv.вп удельную:
Q v.вп.уд
Q v.вп 10 3
ММ
МДж
/Кг
77.
Пример: рассчитать Qv.вп динитратадиэтанолнитрамина O2N-N-(CH2-CH2-ONO2)2MM = 240, Qv.обр.вв = 283,4 КДж/моль
1. C4H8O8N4
2. A
8
100 66.7%
2 4 8 / 2
3. К = 0,32*66,70.24 = 0,877
4.
Q
v.об р.ПВ.max
5.
Q
v.об р.ПВ.
= 240,7* 4 + 196,75*(8 - 4)=1750 КДж/моль
= 1750*0.877=1536 КДж/моль
6. Qv вп= 1536-283.4= 1252.6 КДж/моль
7. Q v.вп.уд
1252,6 10 3
5219
240
КДж
/КГ
При расчете Qv.вп по Авакяну не учитывается влияние плотности заряда
на теплоту взрыва.
78.
Зависимость теплоты взрыва от плотности заряда 0Для ВВ с дефицитом кислорода теплота взрыва растет с увеличением
плотности заряда. Это объясняется тем, что с ростом плотности увеличивается
детонационное давление, а значит реакция Будуара, протекающая в продуктах
взрыва, будет смещаться в сторону увеличения количества СО2, что приводит к
росту теплоты взрыва.
2СО
СО2 + C
P
Поскольку для ВВ с нулевым и положительным кислородным балансом реакция
Будуара существенной роли не играет, у них не наблюдается зависимость Qv.вп от
плотности заряда.
Существует расчетный метод для определения Qv.вп, который учитывает зависимость
последней от плотности заряда.
79.
Расчет теплоты взрыва по методу Пепекина ( ИХФ АН )Это усовершенствованный метод Авакяна. Расчет теплоты взрыва ведется без
написания уравнения взрывчатого превращения с учетом зависимости Qv.вп от
плотности заряда. Метод позволяет рассчитывать Qv.вп ВВ Формулы СаНвOcNd и
формулы СаНвOcNdFe, где F- галоген. Расчет ведется для изобарного состояния. Для
ВВ формулы СаНвOcNd коэффициент реализации тепла Кр равен:
Kp
Q p вп max
для ВВ II и III гр.
Q р вп
,
Q р вп max
242 b 2 196.75 (c b 2) H f
103 ,
MM
80.
В отличие от метода Авакяна, коэффициент реализации по Пепекину не толькоучитывает совокупное действие всех констант равновесия реакций в продуктах
взрыва, он также учитывает влияние плотности заряда на Qр.вп. Таким образом Кр
показывает, какая часть энергии от Qр.вп.max реализуется при данной плотности заряда.
5.73 2 .28 0
3
(
1
.
4
)
b
1.4
K p 1 0.528 0165
. 0 14
. 1
,
a
b
где - коэффициент избытка окислителя;
с
;
2a 0.5b
0 - фактическая плотность заряда, г/см3.
81.
Теплоты взрыва основных БВВ.ББВ
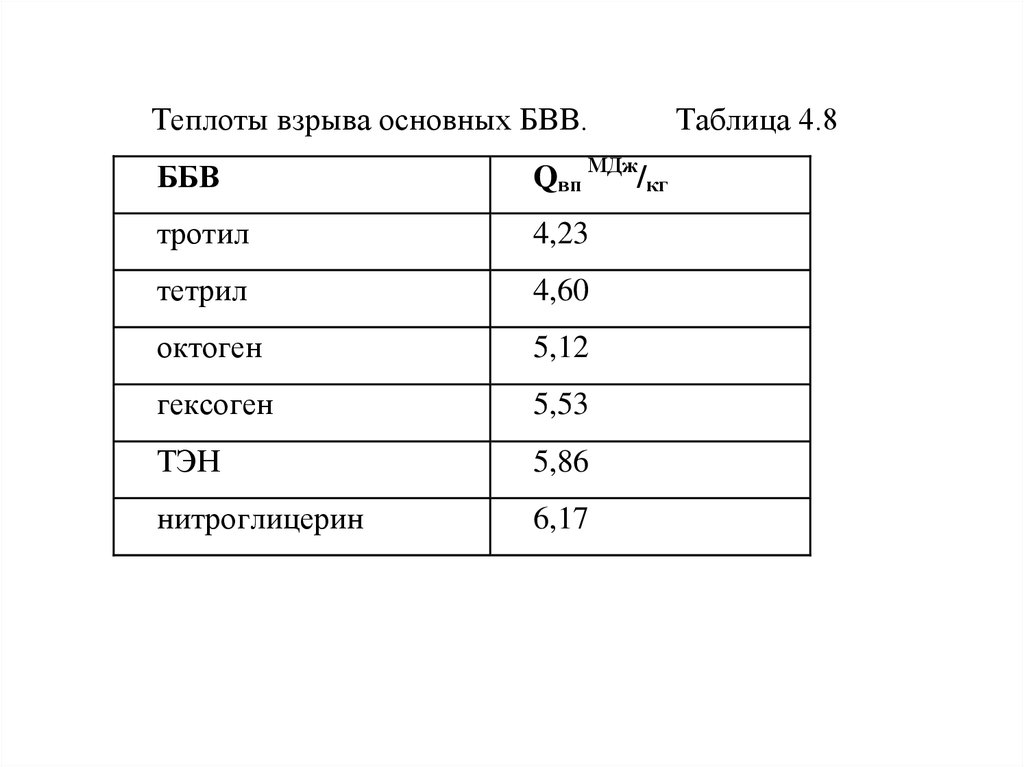
Qвп МДж/кг
тротил
4,23
тетрил
4,60
октоген
5,12
гексоген
5,53
ТЭН
5,86
нитроглицерин
6,17
Таблица 4.8
82.
Расчет состава продуктов взрыва по методу АвакянаВ основу расчета положен коэффициент реализации тепла - К.
Метод позволяет получить данные по составу продуктов взрыва достаточно хорошо
согласующиеся с опытными результатами.
Порядок расчета:
Для ВВ СаНвOcNd пишут самый общий состав продуктов взрыва /ПВ/.
1.СаНвОсNd хСО2 + уСО +zН2О + hH2 + рN2 + мО2 +nСтв......./I/
2.Рассчитывают кислородный коэффициент А.
3.Рассчитывают коэффициент реализации тепла К.
4 .Рассчитывают
Q
v.об р.ПВ.
Q
v.об р.ПВ.
= K Q v.об р.ПВ.max .
83.
Для ВВ II и III группыQ
v.об р.ПВ.max
Q
v.об р.ПВ.
= 240,7*в/2 + 196,75*(с - в/2 ) , тогда
= (240,7*в/2 + 196,75*(с - в/2 ))*K ....../2/
Из уравнений /I/ и /2/
240,7*z = 240,7*(в/2)*К , тогда
1) Z H 2 0 = (в/2)*К
- количество воды в продуктах взрыва.
2) h H 2 = в/2 - (в/2)*К = в/2*(1 - К) - количество водорода в ПВ.
Для нахождения СО и СО2 составляют уравнение теплового баланса сгорания С:
393,5х + 111,8 у = 196, 75 (с - в/2)*К
/3/
В качестве второго берется уравнение материального баланса по кислороду:
2 х + у = с - (в/2)*К ..... /4/
84.
Решая систему уравнений /3/, /4/ относительно х, находим:b
. (c b 2 K)
3) x co 196,75 (c 2) K 1118
2
170
4) уco = с - в/2*К - 2х
5) p N 2 = d/2
6) nс= а-(х+у)
85.
Для ВВ I группы:Q v.об р.ПВ. = 240.7*В/2*К + 393,5*а*К
1) Z H 2 0 = (в/2)*К
2) h H 2 = в/2 - (в/2)*К = в/2*(1 - К)
Уравнение теплового баланса по углероду:
393,5 х + 111,8 у = 393,5*а*К
Уравнение материального баланса по углероду:
х+у=а
3)
x co 2
. ) a
(393,5 K 1118
.
2817
4) уco = a-х
5) mo 2 = 0.5*(c-2x-z-y).
















































































 chemistry
chemistry








