Similar presentations:
Термодинамика. Термохимия
1.
Российский государственный университетНЕФТИ и ГАЗА
имени И.М. ГУБКИНА
ТЕРМОДИНАМИКА
ТЕРМОХИМИЯ
Доцент Солодова Е.В.
Кафедра общей и неорганической химии
2. Классическая термодинамика – макроскопическая теория, изучающая взаимные превращения энергии, теплоты и работы
Теплота и работа – формы передачиэнергии
3. Закон сохранения энергии:
Энергия никуда не исчезает иниоткуда не возникает, а переходит
из одного вида в другой
Внутренняя энергия –
суммарная энергия частиц системы, которая
складывается из кинетической энергии
поступательного, колебательного и
вращательного движения частиц, а также из
потенциальной энергии сил притяжения и
отталкивания, действующих между частицами.
4.
Термодинамическая система это частьмакроскопического пространства, отделенная от
окружающей среды реальной или воображаемой
поверхностью
Открытые
E ≠0; m≠0
Любой живой
организм
Закрытые
E ≠0; m=0
Изолированные
E =0; m=0
Ампула с
веществом
Термос
5.
Термодинамические параметры системы:Состав, масса, объем, давление, температура и др.
Измеряемые:
давление, температура, количество вещества и т.д.
Неизмеряемые (вычисляемые):
энергия, энтальпия, энтропия
Экстенсивные (суммирующиеся):
масса, объем, заряд и т.д.
Интенсивные (выравнивающиеся):
давление, температура, концентрация и т.д.
6.
Совокупность параметров определяетсостояние системы
Состояние системы называют равновесным, если
все параметры остаются постоянными во времени и в
системе отсутствуют потоки вещества и энергии.
При изменении одного из параметров протекает
термодинамический процесс.
Классическая термодинамика изучает свойства
только равновесных систем.
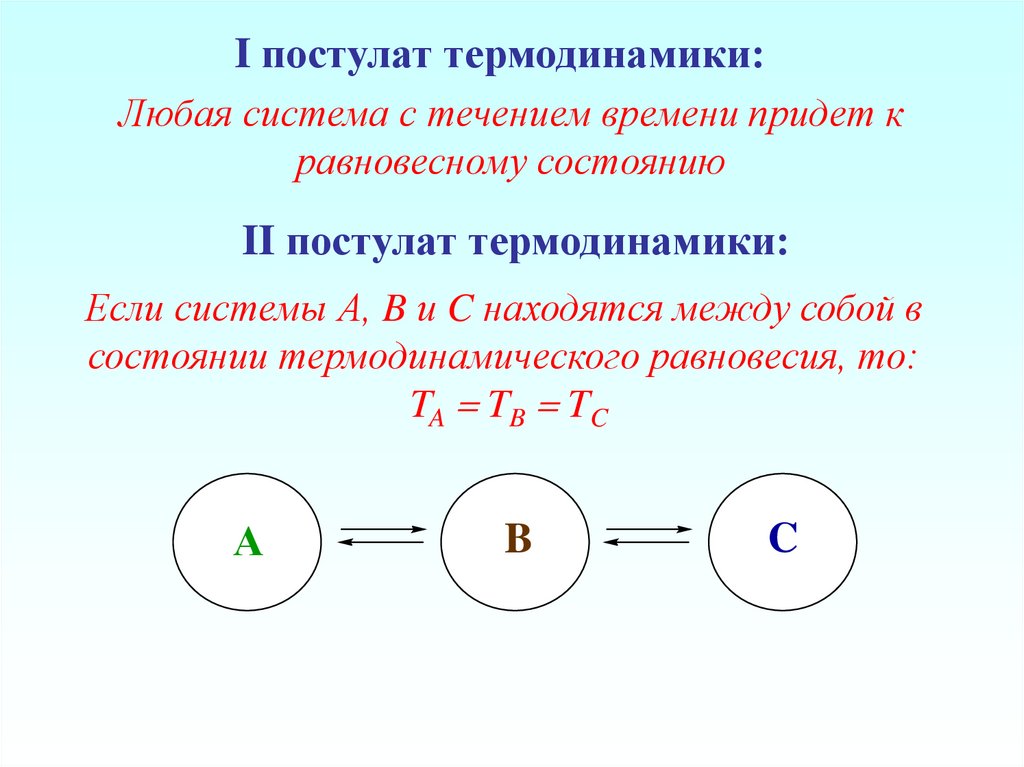
7.
I постулат термодинамики:Любая система с течением времени придет к
равновесному состоянию
II постулат термодинамики:
Если системы А, B и C находятся между собой в
состоянии термодинамического равновесия, то:
TA TB TC
А
B
C
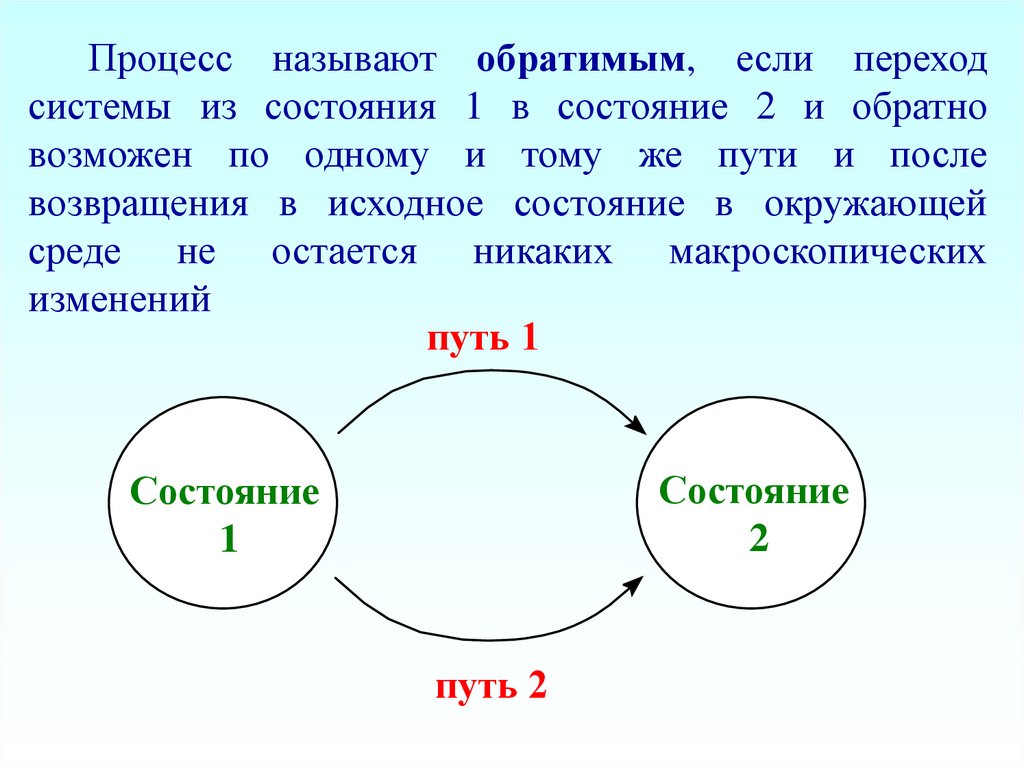
8.
Процесс называют обратимым, если переходсистемы из состояния 1 в состояние 2 и обратно
возможен по одному и тому же пути и после
возвращения в исходное состояние в окружающей
среде не остается никаких макроскопических
изменений
путь 1
Состояние
2
Состояние
1
путь 2
9.
Признаки обратимых процессов:- протекают под действием бесконечно малой
разности обобщенных сил;
- протекают крайне медленно;
- система совершает максимальную работу;
- абсолютные значения работы прямого и обратного
процессов равны;
- изменение внешней силы на бесконечно малую
величину меняет направление процесса на противоположное;
10.
Функции состояния- это переменные, значения которых зависят только
от состояния системы и не зависят от пути достижения
этого состояния;
Функциями состояния являются:
давление (р), объем (V), температура (T), внутренняя
энергия (U), энтальпия (H), энтропия (S), свободная
энергия Гиббса (G) и др.
Работа (A) и теплота (Q) функциями состояния
не являются!
11.
I закон термодинамики:Q = U + A
Количество
теплоты,
переданное
системе,
расходуется на изменение внутренней энергии U и
совершение работы против внешних сил
- показывает эквивалентность теплоты, работы и
энергии;
1 Дж = 0,239 кал или 1 кал = 4,18 Дж
- алгебраическая сумма Q A остается неизменной
12.
1. Изохорный процесс (V = const):V = 0 A = p V = 0
Qv = U
2. Изобарный процесс (p = const):
Qp = U + p V = U2 + p V2 (U1 + p V1) = H2 H1 = H
H – изменение энтальпии
Qp = H
3. Изотермический процесс (T = const):
V2
P1
A nRTln nRTln
V1
P2
13.
Направление протекания процесса1. Стремление системы перейти в состояние с
наименьшим запасом энергии;
2. Стремление системы к достижению наиболее
вероятного состояния, которое характеризуется
максимальным количеством независимых частиц.
Энтропия (S) термодинамическая функция состояния
системы, которая отражает вероятность реализации того или
иного состояния системы в процессе теплообмена.
Q
В обратимом процессе: ΔS
T
Q
В необратимом процессе: ΔS
T
14.
Уравнение Больцмана:S = k lnW
k постоянная Больцмана, равная 1,38 10 23 Дж K 1
W число способов, которыми система может осуществить
свое макросостояние.
Энтропия (S) мера беспорядка в системе.
С увеличением
возрастает.
беспорядка
в
системе
энтропия
Отдельная частица обладает энергией, но не обладает
энтропией.
15.
Свободная энергия Гиббса:G = H T S
Если G 0, то процесс самопроизвольно протекает
в прямом направлении;
Если G > 0, то процесс самопроизвольно протекает
в обратном направлении;
Если G = 0, то состояние является равновесным.
16.
II закон термодинамики:В изобарно-изотермических условиях в
изолированной системе самопроизвольно
протекают те процессы, которые
сопровождаются увеличением энтропии
Невозможен некомпенсированный
переход теплоты от менее нагретого
тела к более нагретому
17.
ТермохимияЭкзотермические реакции: Q > 0, H 0
Эндотермические реакции: Q < 0, H 0
Qp = H
Химическое уравнение:
2H2 O2 2H2O
Термохимическое уравнение:
H2(газ) ½O2(газ) H2O(газ)
H0 242 кДж/моль
18.
Стандартные условия:1) В реакции участвуют индивидуальные вещества,
взятые в наиболее устойчивых модификациях;
2) Концентрации реагентов составляют 1 моль
вещества на 1 кг растворителя;
3) p = 1 атм = 760 мм рт ст = 101 325 Па;
4) T = 250C = 298 K.
19.
Стандартное состояние вещества:1) Для газовой фазы это состояние химически
чистого вещества в газовой фазе под стандартным
давлением 101 325 Па, подразумевая наличие свойств
идеального газа;
2) Для беспримесной фазы, смеси или растворителя в
жидком или твёрдом агрегатном состоянии это
состояние химически чистого вещества в жидкой или
твёрдой фазе под стандартным давлением;
3) Для раствора — это состояние растворённого
вещества со стандартной моляльностью 1 моль/кг, под
стандартным давлением или стандартной концентрации,
исходя из условий, что раствор неограниченно разбавлен.
20.
Стандартные термодинамическиевеличины:
H0298
G0323
S0500
Читать: «дельта аш стандартное»
Стандартная энтальпия образования вещества:
C(тв.) О2(газ) СО2(газ);
H0обр O2 0;
H0обр CO2 394 кДж/моль.
H0обр O3 0.
Стандартная энтальпия сгорания вещества:
CH4(газ) + 2О2(газ) СО2(газ) + H2O(газ); H0сгор CH4 802 кДж/моль.
H0сгор H2O, CO2 и других высших оксидов 0.
21.
Закон Гесса, 1836 г.Изменение
энтальпии
реакции
образования заданных продуктов из
данных реагентов не зависит от
числа и вида реакций, в результате
которых образуются эти продукты,
а определяется только видом и
состоянием исходных веществ и
продуктов реакции
Г.И. Гесс (1802 – 1850)
Профессор Горного
Института, Петербург
22.
Следствия из закона ГессаДля реакции вида:
aA + bB = cC + dD
I следствие:
0
0
0
0
ΔH 0р и (с ΔH обр.
С d ΔH обр.
D) (a ΔH обр.
A b ΔH обр.
B)
II следствие:
0
0
0
0
ΔH 0р и (a ΔH сгор.
A b ΔH сгор.
B) (c ΔH сгор.
C d ΔH сгор.
D)
ΔS 0р и (с S 0С d S 0 D) (a S 0 A b S 0 B)
0
0
0
0
ΔG 0р и (с ΔGобр.
С d ΔGобр.
D) (a ΔGобр.
A b ΔGобр.
B)




















 physics
physics chemistry
chemistry








