Similar presentations:
Теоретические основы теплотехники. Техническая термодинамика
1. ТЕРМОДИНАМИКА (2 СЕМЕСТРА)
• ЛЕКТОР – КАЛИНИН АЛЕКСАНДР ФЕДОРОВИЧ• ОБЪЕМ КУРСА – 4 ЧАСА В НЕДЕЛЮ:
- 1 ЧАС ЛЕКЦИЙ,
- 2 ЧАСА ПРАКТИЧЕСКИХ ЗАНЯТИЙ,
- 1 ЧАС ЛАБОРАТОРНЫХ РАБОТ.
КОНСУЛЬТАЦИИ – 1 ЧАС В НЕДЕЛЮ.
• ВИД ИТОГОВОГО КОНТРОЛЬНОГО ИСПЫТАНИЯ:
ЭКЗАМЕН.
2.
• Литература:1. Термодинамика
и
теплопередача
в
технологических процессах нефтяной и газовой
промышленности / А.Ф. Калинин, С.М. Купцов,
А.С. Лопатин, К.Х. Шотиди – М.: ИЦ РГУ нефти и
газа, 2016. – 264 с.
2. Теоретические основы теплотехники Часть I. /
Б.П. Поршаков, А.Ф. Калинин, С.М. Купцов,
А.С. Лопатин, К.Х. Шотиди – М.: РГУ нефти и газа
им. И.М. Губкина, 2005. – 148 с.
3. Теоретические основы теплотехники. Часть II. /
Б.П. Поршаков, А.Ф. Калинин, С.М. Купцов,
А.С. Лопатин, К.Х. Шотиди – М.: РГУ нефти и газа
им. И.М. Губкина, 2006. – 109 с.
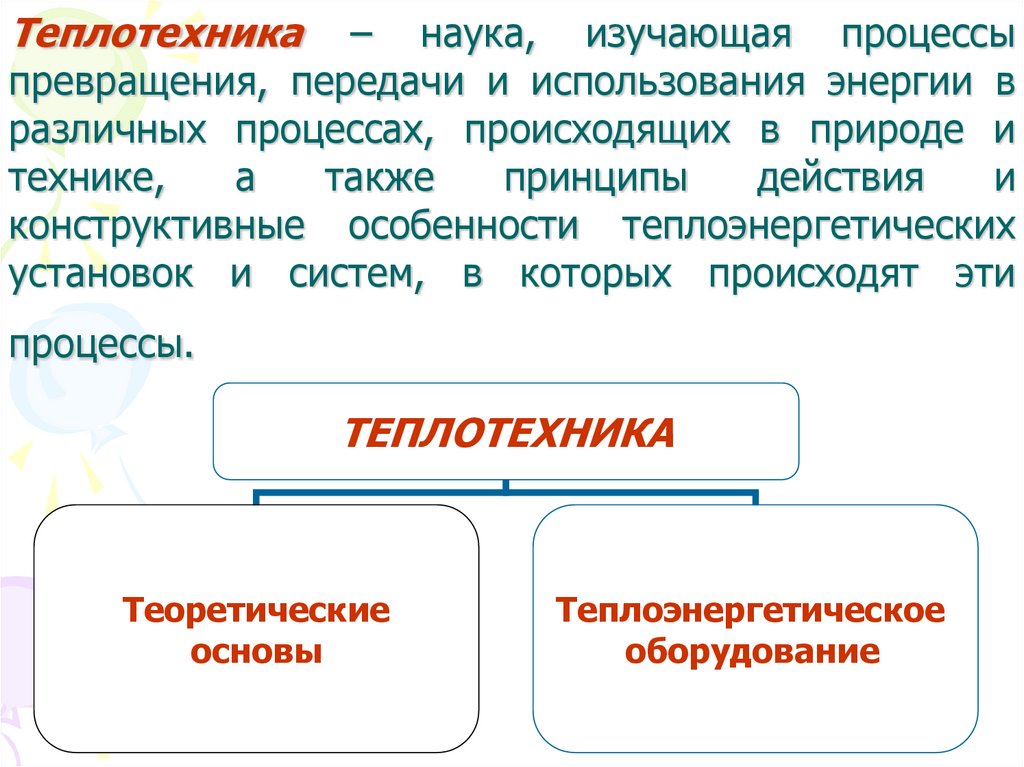
3. Теплотехника – наука, изучающая процессы превращения, передачи и использования энергии в различных процессах, происходящих в
природе итехнике,
а
также
принципы
действия
и
конструктивные особенности теплоэнергетических
установок и систем, в которых происходят эти
процессы.
ТЕПЛОТЕХНИКА
Теоретические
основы
Теплоэнергетическое
оборудование
4.
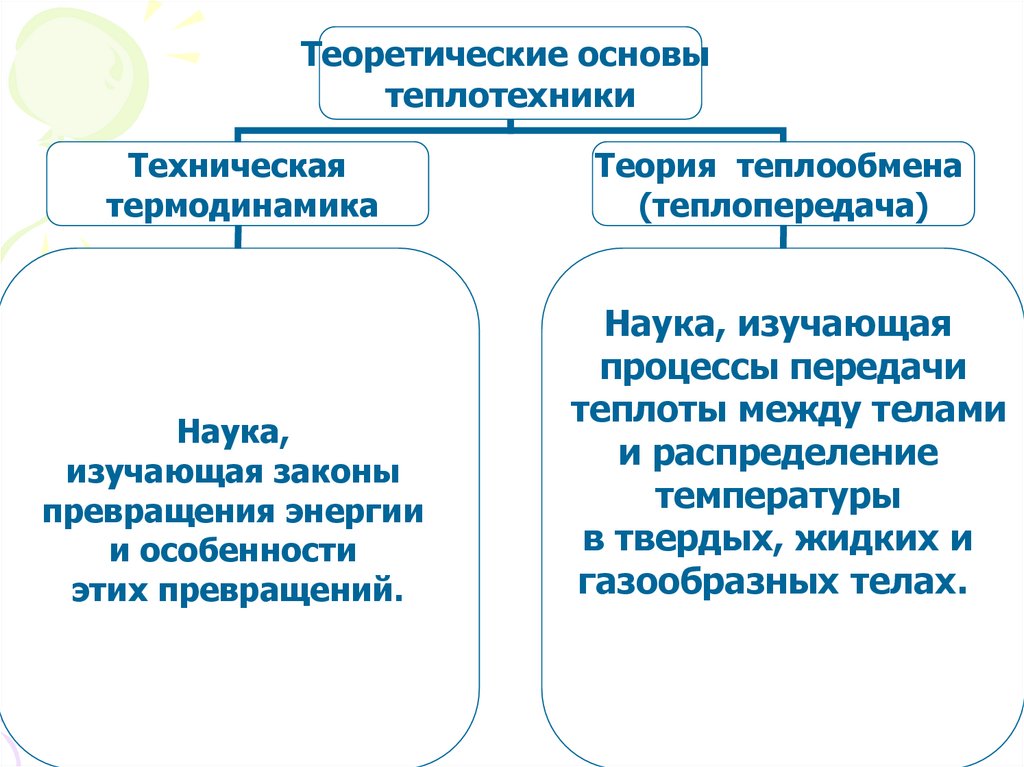
Теоретические основытеплотехники
Техническая
термодинамика
Теория теплообмена
(теплопередача)
Наука,
изучающая законы
превращения энергии
и особенности
этих превращений.
Наука, изучающая
процессы передачи
теплоты между телами
и распределение
температуры
в твердых, жидких и
газообразных телах.
5.
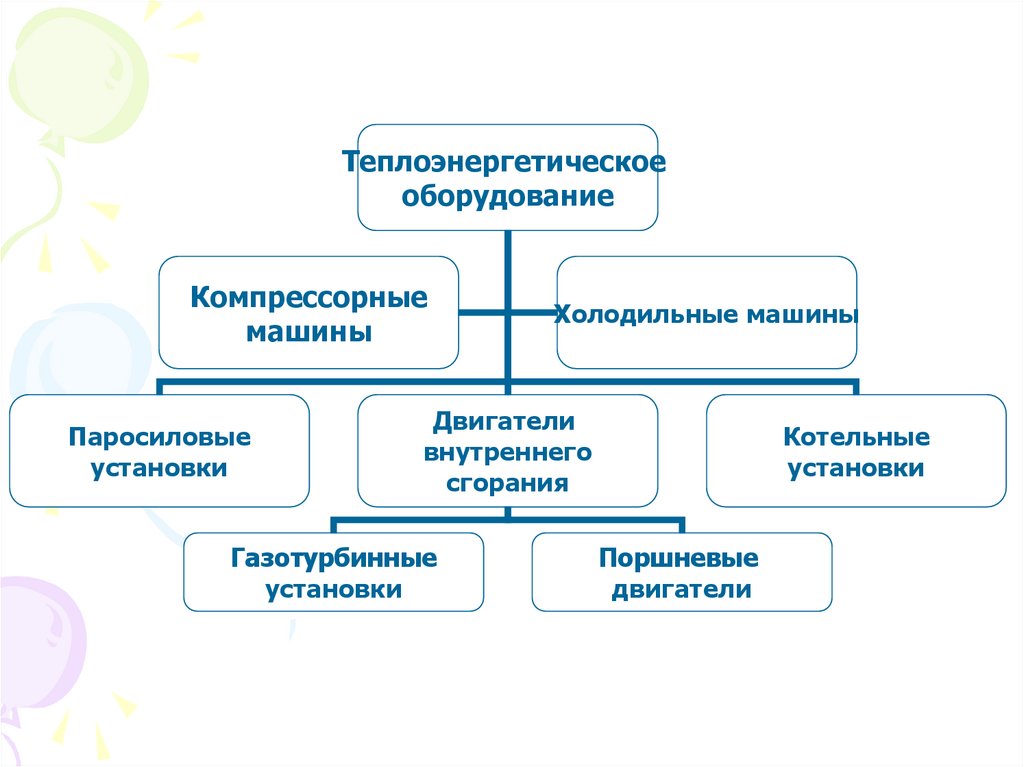
Теплоэнергетическоеоборудование
Компрессорные
машины
Паросиловые
установки
Холодильные машины
Двигатели
внутреннего
сгорания
Газотурбинные
установки
Котельные
установки
Поршневые
двигатели
6. Неизотермическое течение природного газа по газопроводу
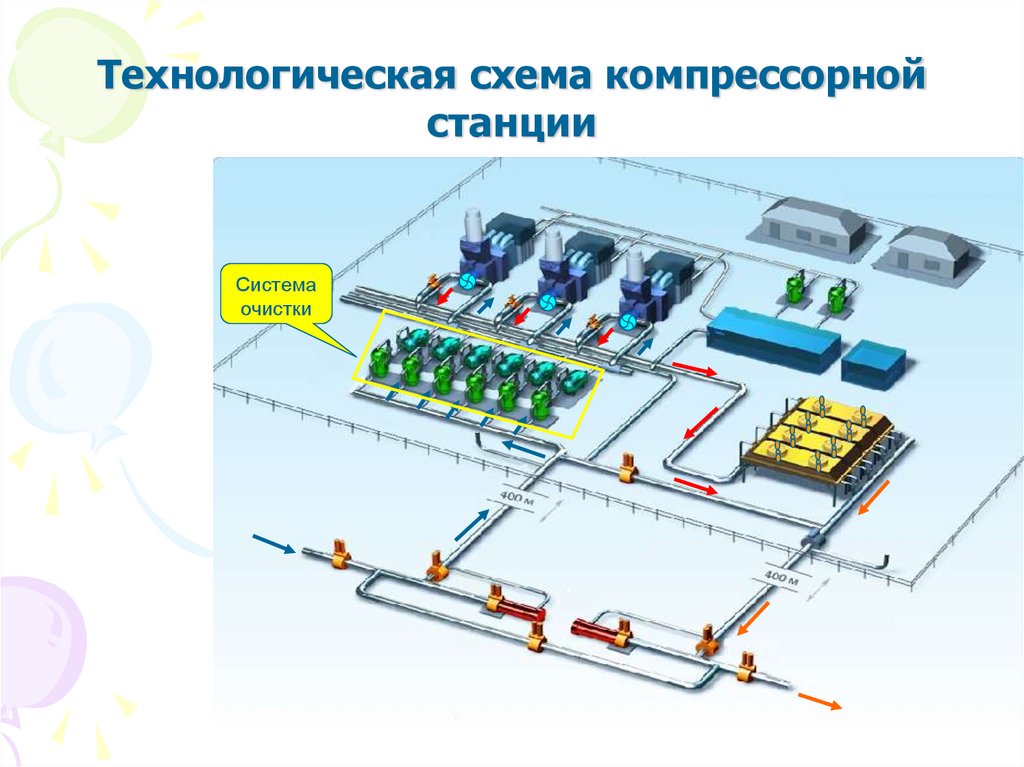
7.
Технологическая схема компрессорнойстанции
Система
очистки
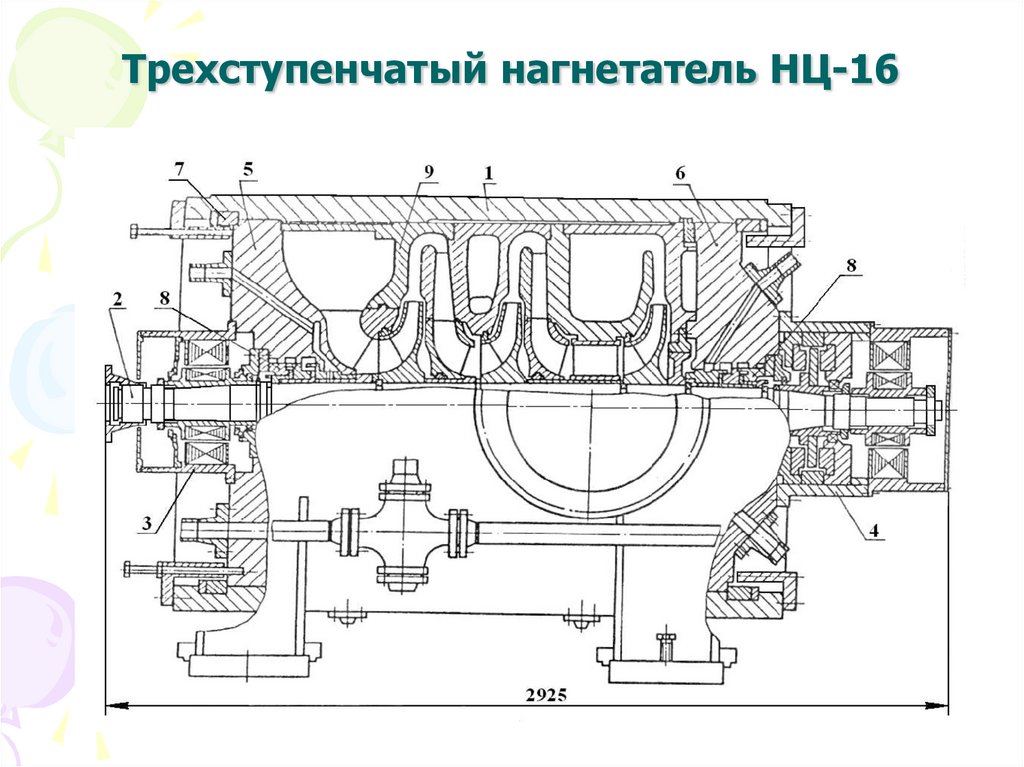
8. Трехступенчатый нагнетатель НЦ-16
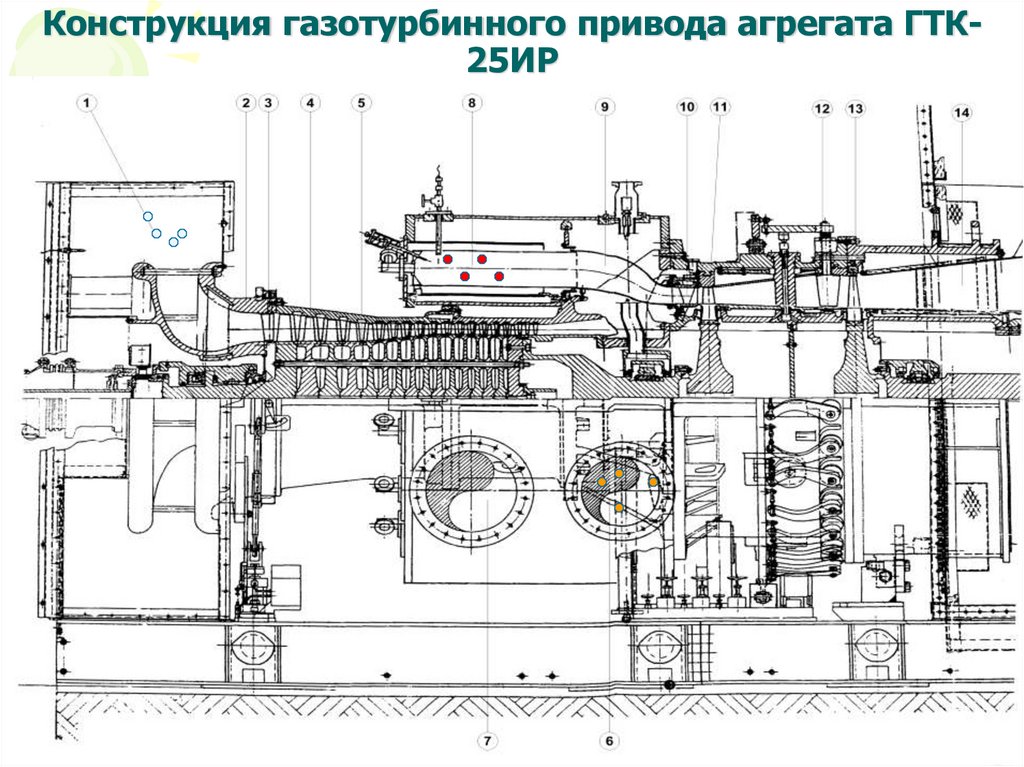
9. Конструкция газотурбинного привода агрегата ГТК-25ИР
Конструкция газотурбинного привода агрегата ГТК25ИР10.
Лопатки ВНА11.
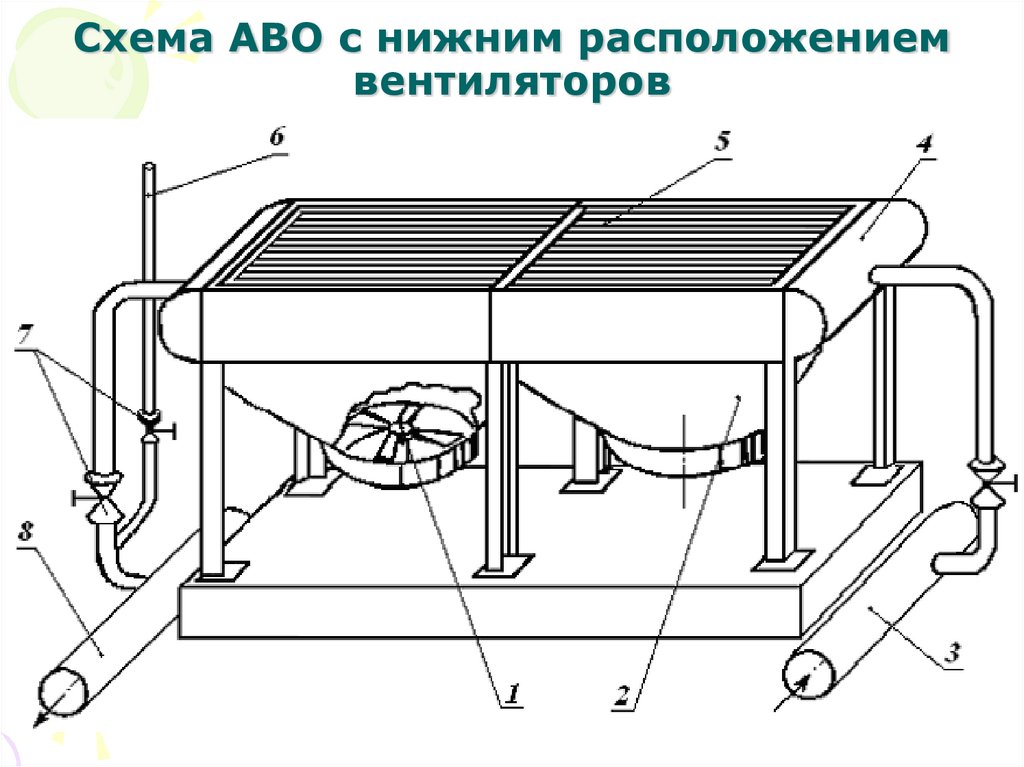
Ротор ОК12. Схема АВО с нижним расположением вентиляторов
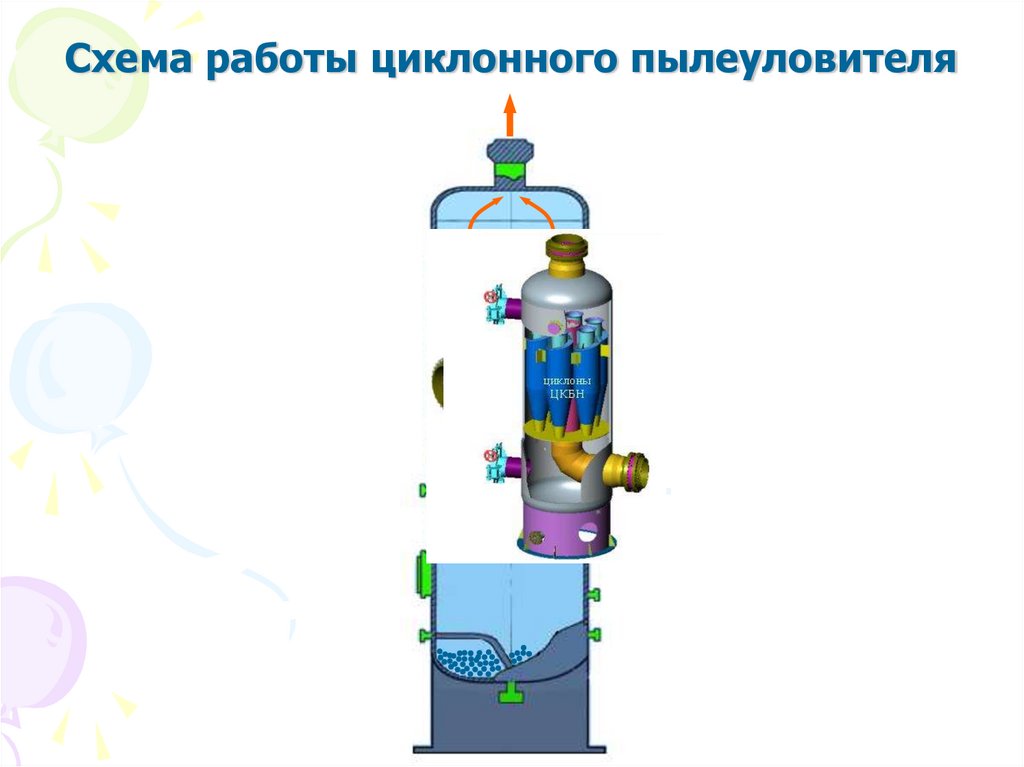
13. Схема работы циклонного пылеуловителя
14. Основные понятия и определения термодинамики
• Объектом изучения термодинамикитермодинамическая система.
является
• Термодинамическая система – это тело или
совокупность тел, находящихся в механическом
и тепловом взаимодействии.
• Совокупность тел, окружающих исследуемую
систему, называется окружающей средой.
• Термодинамическая
система,
которая
не
обменивается веществом с окружающей средой,
называется
закрытой.
Если
же
система
обменивается веществом с окружающей средой,
ее называют открытой.
15.
• К открытым системам следует отнести системысбора и промысловой подготовки природного газа,
магистральные
газопроводы,
компрессорные
станции и их основные технологические системы, а
также
энерготехнологическое
оборудование,
которыми
они
оснащены:
трубопроводы,
дроссельные устройства, сепараторы, абсорберы,
нагнетатели
природного
газа,
газотурбинные
установки, циклонные пылеуловители, фильтрсепараторы, аппараты воздушного охлаждения и т.д.
• Термодинамической системой принято называть
систему,
внутреннее
состояние
которой
определяется значениями определенного количества
независимых переменных – параметрами состояния.
• Если параметры состояния термодинамической
системы не изменяются во времени, то система
находится в равновесном состоянии. Равновесным
состоянием называется такое состояние системы,
которое может сохраняться сколь угодно долго без
внешнего воздействия.
16.
• Равновеснаятермодинамическая
система,
состояние которой определяется значениями двух
независимых переменных, называется простым
телом. К простым телам можно отнести газы, пары,
жидкости, находящиеся в термодинамическом
равновесии и не подверженные химическим
превращениям, а также действию гравитационных
и электромагнитных сил.
• Термодинамическая
система,
в
результате
изменения
состояния
которой
происходят
энергетические
превращения
в
энерготехнологическом оборудовании называется
рабочим телом.
• Природный газ, транспортируемый по МГ, а также
рабочие тела целого ряда энерготехнологических
установок
систем
сбора,
подготовки
и
магистрального транспорта природного газа можно
с высокой степенью достоверности считать
простыми телами.
17.
• Параметры состояния термодинамическойсистемы подразделяются на два класса:
интенсивные
и
экстенсивные.
Интенсивные свойства не зависят от
массы
системы,
а
экстенсивные
–
пропорциональны массе.
• Термодинамическими
параметрами
состояния
называются
интенсивные
параметры, характеризующие состояние
системы.
• К
термодинамическим
параметрам
состояния относятся: удельный объем v,
давление p и температура (t, T).
18.
• Удельный объем v – это объем единицы массывещества, а величина, обратная удельному
объему, определяемая как масса единицы
объема, называется плотностью вещества :
v V / G;
G / V;
v 1 / ,
где V – объем; G – масса вещества.
• Отношение массы вещества G к его молярной
массе
определяет число киломолей (кмоль)
вещества
G G / .
• Объем киломоля вещества или молярный объем
связан
с
удельным
объемом
следующим
соотношением:
v V / G v.
19.
•Абсолютное давлениеесть предел отношения
нормальной составляющей силы к площади, на
которую действует эта сила
Fn F
p lim
.
f 0 f
f n
•Давление в системе СИ измеряется в Паскалях
2
( Па Н / м ).
•Различают барометрическое (атмосферное)
pбар ,
избыточное (манометрическое) p ман и
абсолютное давление pабс. В расчетные соотношения
термодинамики входят только абсолютное давление
исследуемой системы абс , значение которого можно
определить из следующего соотношения:
p
pабс pман pбар .
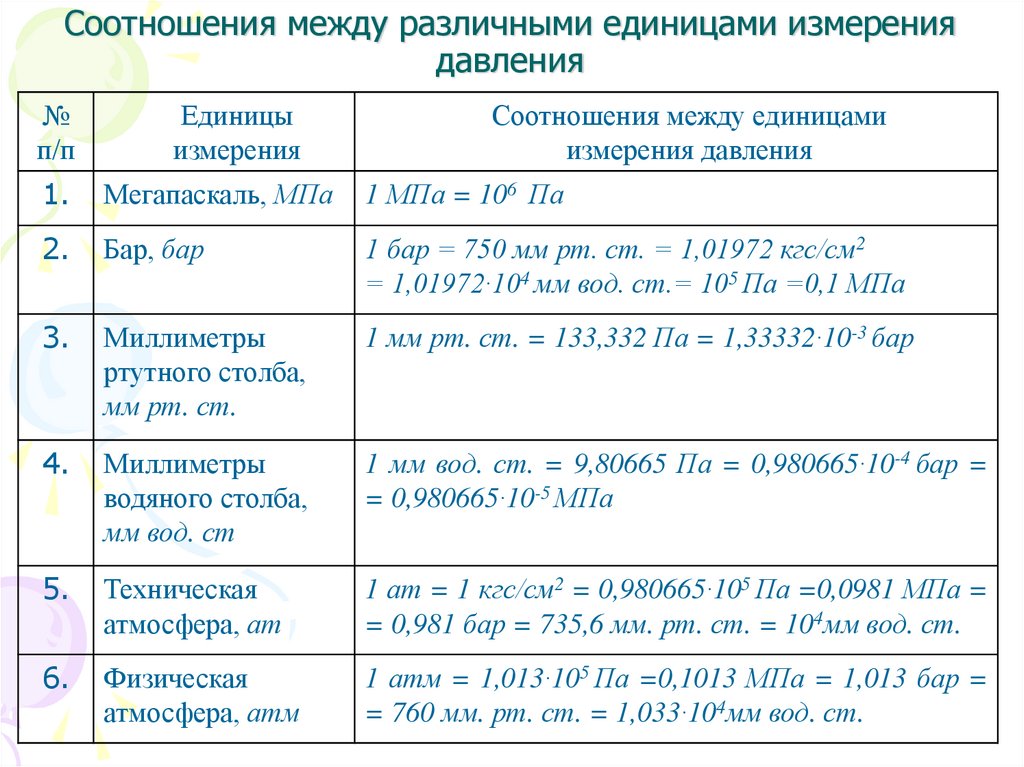
20. Соотношения между различными единицами измерения давления
№п/п
Единицы
измерения
Соотношения между единицами
измерения давления
1.
Мегапаскаль, МПа
1 МПа = 106 Па
2.
Бар, бар
1 бар = 750 мм рт. ст. = 1,01972 кгс/см2
= 1,01972·104 мм вод. ст.= 105 Па =0,1 МПа
3.
Миллиметры
ртутного столба,
мм рт. ст.
1 мм рт. ст. = 133,332 Па = 1,33332·10-3 бар
4.
Миллиметры
водяного столба,
мм вод. ст
1 мм вод. ст. = 9,80665 Па = 0,980665·10-4 бар =
= 0,980665·10-5 МПа
5.
Техническая
атмосфера, ат
1 ат = 1 кгс/см2 = 0,980665·105 Па =0,0981 МПа =
= 0,981 бар = 735,6 мм. рт. ст. = 104мм вод. ст.
6.
Физическая
атмосфера, атм
1 атм = 1,013·105 Па =0,1013 МПа = 1,013 бар =
= 760 мм. рт. ст. = 1,033·104мм вод. ст.
21.
•Температура есть единственная функция состояниятермодинамической
системы,
определяющая
направление самопроизвольного теплообмена между
телами. В термодинамике для измерения температур
используется
международная
стоградусная
0
температурная шкала Цельсия (t, С ) и
шкала абсолютных термодинамических
температур – шкала Кельвина (T, K).
Между температурами по шкале Кельвина и шкале
Цельсия существует следующая связь:
T = t + 273,15 К.
Связь
между
параметрами,
характеризующими
состояние простого тела, называется уравнением
состояния
F (р, v, T) = 0.
22.
•Изменениесостояния
системы
называется
процессом.
•Равновесный
процесс
–
это
непрерывная
последовательность равновесных состояний системы.
•Обратимым
процессом
называется
такой
равновесный
процесс,
который
допускает
возможность возвращения системы в исходное
состояние путем обратного процесса; при этом, в
результате прямого и обратного процессов в системе
и во внешней среде не происходит никаких
изменений.
•Термодинамическим процессом принято считать
обратимый равновесный процесс.
•Любой реальный процесс является в большей или
меньшей
степени
неравновесным.
Однако,
в
принципе,
эта
неравновесность
может
быть
минимизирована за счет уменьшения скорости
осуществления
процесса.
Таким
образом,
равновесный
процесс
является
предельным
случаем неравновесного процесса при стремлении
скорости этого процесса к нулю.
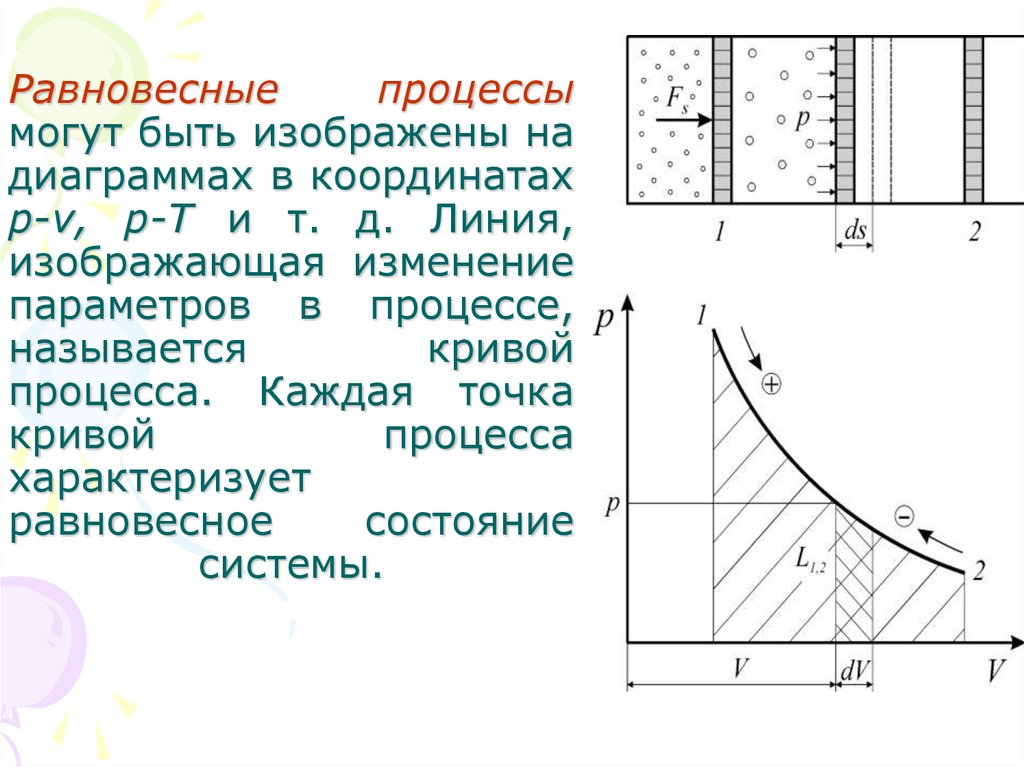
23. Равновесные процессы могут быть изображены на диаграммах в координатах p-v, р-Т и т. д. Линия, изображающая изменение
параметров в процессе,называется
кривой
процесса. Каждая точка
кривой
процесса
характеризует
равновесное
состояние
системы.
24.
Термодинамическая работаПолная термодинамическая работа обратимого
изменения объема простых тел в элементарном
процессе (Дж)
L Fs ds p f ds p dV
и в конечном процессе 1-2
2
L1,2 p dV .
1
Удельная термодинамическая работа обратимого
изменения объема в элементарном процессе (Дж/кг)
L p dV
l
p dv.
G
G
25.
и в конечном процессе 1-22
l1,2 p dv.
1
Работа расширения - положительна
( dv 0 , l 0
),
а работа сжатия – отрицательна
( dv 0 , l 0
).
•Эффективная
термодинамическая
работа
в
элементарном процессе
складывается из работы,
L*
передаваемой внешней среде L вн , и работы, идущей на
изменение кинетической
и потенциальной
G d( c2 / 2 )
G g dz энергии рабочего тела:
2
c
L Lвн G d G g dz;
2
c
L L ( G d G g dz L** ).
2
вн
2
L L L ;
26. Потенциальная (техническая) работа
Потенциальной (технической) работой называетсяработа по перемещению сплошных масс (газа, пара
или жидкости) из области одного давления (p1) в
область другого давления (p2 ), т.е. потенциальная
работа - это работа обратимого изменения давления.
Полная
потенциальная
работа
обратимого
изменения давления простых тел в элементарном
процессе (Дж)
W Vdp
и в конечном процессе 1-2
2
W1,2 V dp.
1
27.
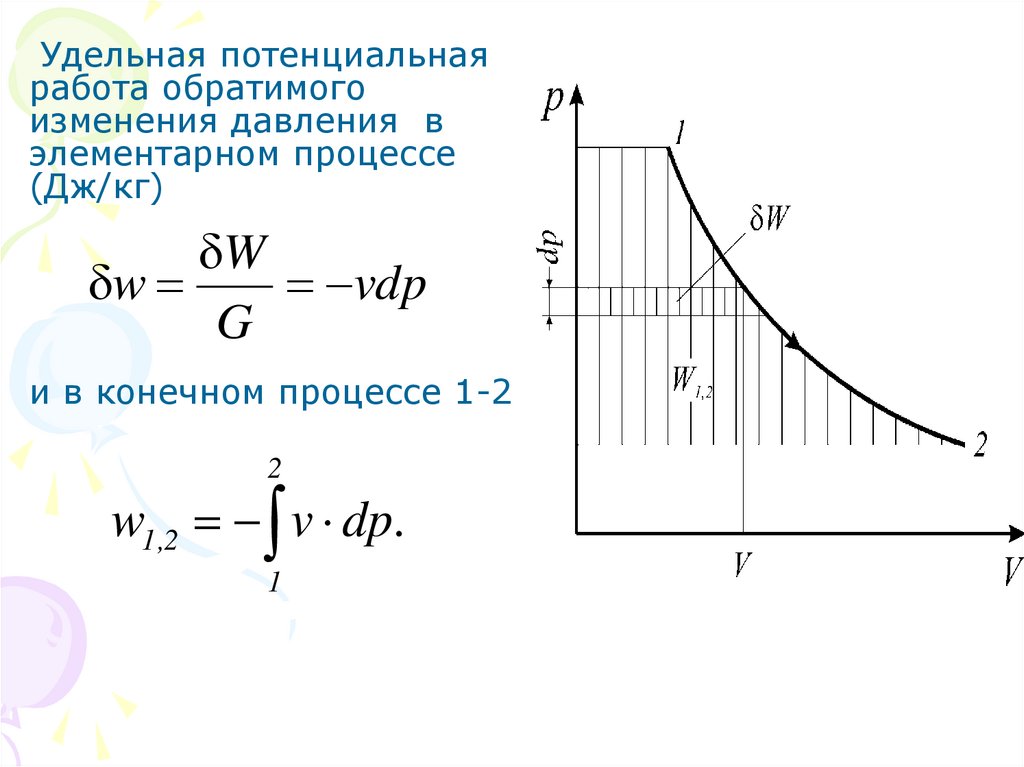
Удельная потенциальнаяработа обратимого
изменения давления в
элементарном процессе
(Дж/кг)
W
w
vdp
G
и в конечном процессе 1-2
2
w1,2 v dp.
1
28.
•Эффективная потенциальная работа в действительномпроцессе перемещения потока жидкости или газа из
области одного в область другого давления W * складывается из работы, передаваемой внешней среде
, и работы, идущей на изменение кинетической
Wвн
энергии потока
G g dz
G d ( c 2 / 2 ) и потенциальной
рабочего тела:
2
c
W Wвн G d G g dz;
2
W W W ** ;
2
c
Wвн W ( G d G g dz W ** ).
2
Необратимые потери работы W ** , связанные с
необратимостью
процесса,
превращается
в
Q
теплоту внутреннего теплообмена
.
29.
•Внутренняя энергия термодинамической системыпредставляет собой полный запас энергии системы и
состоит из энергии поступательного и вращательного
движения молекул, энергии внутримолекулярных
колебаний, потенциальной энергии сил сцепления
между молекулами, внутримолекулярной энергии,
атомной энергии и т.д.
•Внутренняя энергия термодинамической системы U
(Дж) является функцией состояния, а ее изменение в
элементарном процессе не зависит от пути процесса и
является полным дифференциалом dU.
•Удельная внутренняя энергия системы u (Дж/кг)
находится по соотношению
u = U/G.
•Для простых тел внутренняя энергия определяется
как функция двух переменных (р, T; р, v или T, v).
30.
•Теплота – количество энергии, передаваемой отодного тела к другому посредством теплопроводности,
конвективного или лучистого теплообмена. Процесс
передачи теплоты называется теплообменом.
•Количество теплоты Q (Дж), получаемое телом в
результате теплообмена, зависит от вида процесса и
является функцией процесса. В связи с этим,
количество теплоты в элементарном процессе не
является полным дифференциалом Q .
•Удельное количество теплоты в элементарном
процессе q (Дж/кг) находится из выражения
q Q / G.
31.
•Удельной теплоемкостью называется количествотеплоты, которое надо сообщить единице массы,
количества
или
объема
вещества,
чтобы
его
температура повысилась на 1 градус.
•Различают массовую с (Дж/(кг К)), молярную c
3
(Дж/(кмоль К)) и объемную с' ( Дж / ( м К ) )
удельные теплоемкости вещества.
•Связь между массовой, молярной и объемной
удельными теплоемкостями может быть представлена
следующими соотношениями:
c c ;
c c.
•Теплоемкость газов зависит от термодинамического
процесса, в котором подводится или отводится
теплота. Если процесс задан условием z = idem, то
истинная теплоемкость в этом процессе будет
определяться следующим образом:
qz
cz
.
dt
32.
•Экспериментальноеопределение
теплоемкости
обычно проводится в двух процессах: при постоянном
объеме (изохорная теплоемкость cv) и постоянном
давлении (изобарная теплоемкость cp).
•Теплоемкость реального газа зависит от температуры
и давления. Теплоемкость идеального газа зависит
только от температуры.
•Для практических расчетов вводится понятие средней
теплоемкости сzm в интервале температур от t1 до t2,
значение которой принимается неизменной для всего
рассматриваемого интервала температур.
•Выражение для средней удельной теплоемкости
вещества имеет следующий вид:
q1,2
czm
.
t2 t1
33.
• Для ряда веществ, в том числе газов и газовыхсмесей, в определенном интервале температур
истинная теплоемкость изменяется по линейному
закону
cz az bz t.
• Температурная зависимость первой средней
теплоемкости веществ
2
( a b t ) dt
z
czm
z
1
( t2 t1 )
( t1 t2 )
az bz
.
2
• Первая средняя теплоемкость вещества численно
равна истинной теплоемкости при
среднеарифметической температуре процесса.






















 physics
physics








