Similar presentations:
Коррозия металлов
1.
КОРРОЗИЯ МЕТАЛЛОВ2.
ВИДЫ КОРРОЗИИ МЕТАЛЛОВКоррозия металлов (от лат. «corrodere» – разъедать) – гетерогенный
процесс самопроизвольного окисления (разрушения) металлических
материалов за счет их взаимодействия с окислителями из
окружающей среды.
Коррозионные процессы можно классифицировать по трем
признакам: по механизму коррозии, по типу коррозионной среды, по
условиям протекания и характеру разрушения металла:
1. по механизму коррозию
электрохимическую;
подразделяют
на
химическую
и
2. по типу коррозионной среды коррозию подразделяют на газовую,
атмосферную, подземную, морскую, коррозия в неорганических
непроводящих жидкостях и др.
3. по условиям протекания и характеру повреждения коррозию
металлов подразделяют на контактную, сплошную, избирательную,
коррозию по сварке, биологическую коррозию, радиационную
коррозию и т.д.
3.
Для оценки возможности протекания коррозионного процесса сточки зрения термодинамики, в общем случае
рассчитывается
изменение энергии Гиббса ΔGT (ΔGоT); если коррозия протекает по
электрохимическому механизму, то следует оценить величину ЭДС
коррозионного процесса в заданных условиях.
Для большинства металлов величина ΔGT<0 (ΔЕT >0), т.е.
большинство металлов подвержены коррозии, причем этот процесс в
отсутствии кинетических препятствий (нерастворимых защитных
пленок на поверхности, высокой энергии активации реакции и др.)
протекает самопроизвольно. Именно поэтому большинство металлов
присутствуют в окружающей среде в окисленном состоянии – в виде
оксидов, сульфидов и других соединений. В чистом виде встречаются
только благородные металлы (золото, металлы платиновой группы,
серебро). При этом, чем больше величина электродного потенциала
металла, тем большей термодинамической устойчивостью он
обладает.
Величины ΔGT и ΔЕT и их температурные и концентрационные
зависимости будут характеризовать коррозионную устойчивость
металла в заданных условиях.
4.
РОЛЬ ЗАЩИТНЫХ ПЛЕНОК В КОРРОЗИОННЫХ ПРОЦЕССАХИногда даже при ΔGT<0 коррозионные процессы могут протекать с очень
малыми скоростями из-за кинетических затруднений (например, за счет
образования устойчивых оксидных, гидроксидных или солевых пленок). Поэтому
для получения полной информации о поведении металла в коррозионной среде
требуется
сочетание
термодинамического
и
кинетического
подхода.
Большую роль в устойчивости металлов к коррозии играют их оксидные
пленки, выполняющие (или не выполняющие) защитную функцию. Если на
поверхности металла на воздухе (в воде) образуется сплошная оксидная
пленка, обладающая высокой адгезией к металлу, близким к металлу
коэффициентом термического расширения и химической устойчивостью к
коррозионной среде, то доступ окислителя к поверхности металла затрудняется
и
скорость
коррозии
может
стать
ничтожно
малой.
Подобные оксидные пленки образуются на поверхности хрома, алюминия,
никеля, титана и некоторых других металлов, нержавеющих сталей и могут
обеспечивать их коррозионную устойчивость иногда в широком интервале
значений рН. Не следует забывать, что в сильно кислой среде большинство
оксидных пленок металлов теряют устойчивость и не выполняют защитную
функцию.
Оксидная пленка будет обладать защитными свойствами и тормозить
коррозионный процесс, если она: является сплошной, характеризуется высокой
адгезией к поверхности металла, близким КТР, обладает высокой химической
стойкостью к коррозионной среде.
5.
ХИМИЧЕСКАЯ (ГАЗОВАЯ) КОРРОЗИЯ. КОРРОЗИЯ В НЕВОДНЫХ СРЕДАХПри химическом механизме коррозии передача электронов от
восстановителя к окислителю происходит при их непосредственном
контакте. Это главная особенность химического механизма
коррозии. Скорость химической коррозии практически не зависит от
потенциала металла.
Коррозия по химическому механизму протекает, главным образом, в
газовой среде при повышенных температурах в отсутствии влаги, а
также в неводных средах, т.е. в среде неэлектролитов.
Химическую
коррозию
вызывают
следующие
окислители:
сухие газы: F2, Cl2, Br2, O2 и другие с содержанием влаги <0,1 %;
горячие газы: O2, CO2, Н2Опар, NO2 при температурах, исключающих
конденсацию влаги;
жидкие безводные нефтепродукты (бензин,
керосин, мазут, смазочные масла);
безводные органические
растворители (четыреххлористый углерод CCl4, бензол С6Н6 , бензин,
дизельное топливо и другие); расплавленная сера и другие.
В качестве примеров можно привести газовую коррозию металлических
конструкций
в металлургии, газовую коррозию стальных печей
различного назначения, различных двигателей, металлических агрегатов
в химической и нефтехимической промышленности.
6.
ХИМИЧЕСКАЯ (ГАЗОВАЯ) КОРРОЗИЯ. КОРРОЗИЯ В НЕВОДНЫХ СРЕДАХНаиболее распространенным газом в коррозионных средах является кислород,
который окисляет различные по активности металлы с образованием их оксидов,
например:
2Fe + O2= 2FeO,
4Fe +3O2=2Fe3O4 (смешанный оксид), 2Cu + O2= 2CuO.
Процессы газовой коррозии существенно ускоряются, если в среде присутствуют
соединения серы (сжигание каменного угля, нефти и природного газа). В этом
случае происходит образование сульфатов металлов, которые впоследствии
разлагаются, что приводит к дальнейшему окислению металла кислородом.
Очень агрессивной средой по отношению к металлам являются галогены, которые
окисляют их с образованием солей:
2Fe + 3Cl2 → 2FeCl3; 2Al + 3Cl2 → 2AlCl3 .
Химическая коррозия с участием других газов в основном дает оксиды:
Fe + CO2 = FeO + CO; 2Fe + 6H2Oпар= 2Fe(OH)3 + 3H2; 4Fe + 2NO2 = 4FeO + N2
Опасность для металлов при высокой температуре представляет водород: с
одной стороны, он растворяется во многих металлах, в том числе в железе, что
приводит к повышению их хрупкости, а с другой стороны, водород, как
восстановитель, взаимодействует с карбидом железа, содержащемся в стали, что
приводит разупрочнению металла:
Fe3C + 2H2 = 3Fe + CH4.
Таким образом, возрастанию скорости химической коррозии, согласно
химической кинетике,
способствуют: увеличение температуры и
парциального давления газов.
Однако кислород может стать ингибитором коррозии при высоком значении его
парциального давления. Это высокотемпературная пассивация.
7.
ЭЛЕКТРОХИМИЧЕСКИЙ МЕХАНИЗМ КОРРОЗИИЭлектрохимическая коррозия – процесс самопроизвольного окисления
металлов окислителями из окружающей среды в присутствии
электролита.
Протекает:
- в растворах электролитов;
- во влажном воздухе (атмосферная коррозия) за счет образования на
поверхности металлов водяных пленок (конденсата влаги), в которых
растворяются различные газы (CO2, SO2 и др.) и примеси, с образованием
растворов электролитов;
- если существует термодинамическая и кинетическая возможность
протекания анодного процесса (окисления металла) и катодного процесса
(восстановления окислителя), из состава коррозионной среды.
Для электрохимического механизма коррозии характерно протекание двух
электродных реакций - окисления металла и восстановления окислителя которые могут быть пространственно разделены. Необходимо учесть, что
при окислении металла происходит высвобождение электронов на
анодном участке (-) и их перенос на катодный участок (+), где они
используются при восстановлении окислителя, присутствующего в
коррозионной среде.
Скорость электрохимической коррозии зависит от электродного
потенциала металла, а сам процесс коррозии можно описать через работу
соответствующего микро гальванического элемента.
8.
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ. АНОДНЫЕ И КАТОДНЫЕ ПРОЦЕССЫЭлектрохимическая коррозия – возможность и скорость протекания, зависят от
электродных потенциалов металлов.
Анодный процесс - процесс окисления (разрушения) металла имеет вид:
Мe → Мen+ +nе.
В результате анодных процессов металл может растворяться или образовывать
нерастворимые гидроксиды (оксиды) на своей поверхности:
Zn + 2H2O → Zn(OH)2 ↓+ 2 H+ + 2е.
2Ti + 3H2O → Ti2O3 ↓+ 6H+ + 6е.
Катодный процесс определяется не только электродным потенциалом металла,
но и составом коррозионной среды, в частности, значением рН:
а) в кислой среде (при рН <7) обычно восстанавливаются ионы водорода с
образованием молекул Н2 (т.н. водородная деполяризация):
2H+ + 2ē → H2 ↑.
б) в нейтральной (рН ≈7) или слабо щелочной (рН ≥7) среде обычно происходит
восстановление растворенного атмосферного кислорода (т.н. кислородная
деполяризация):
O2 + 2H2O + 4ē → 4OH-–.
При высокой концентрации кислорода О2 он может восстанавливаться также и в
кислой среде:
О2 + 4Н+ +4е→ 2Н2О. Однако, легче в кислой среде восстанавливаются протоны.
9.
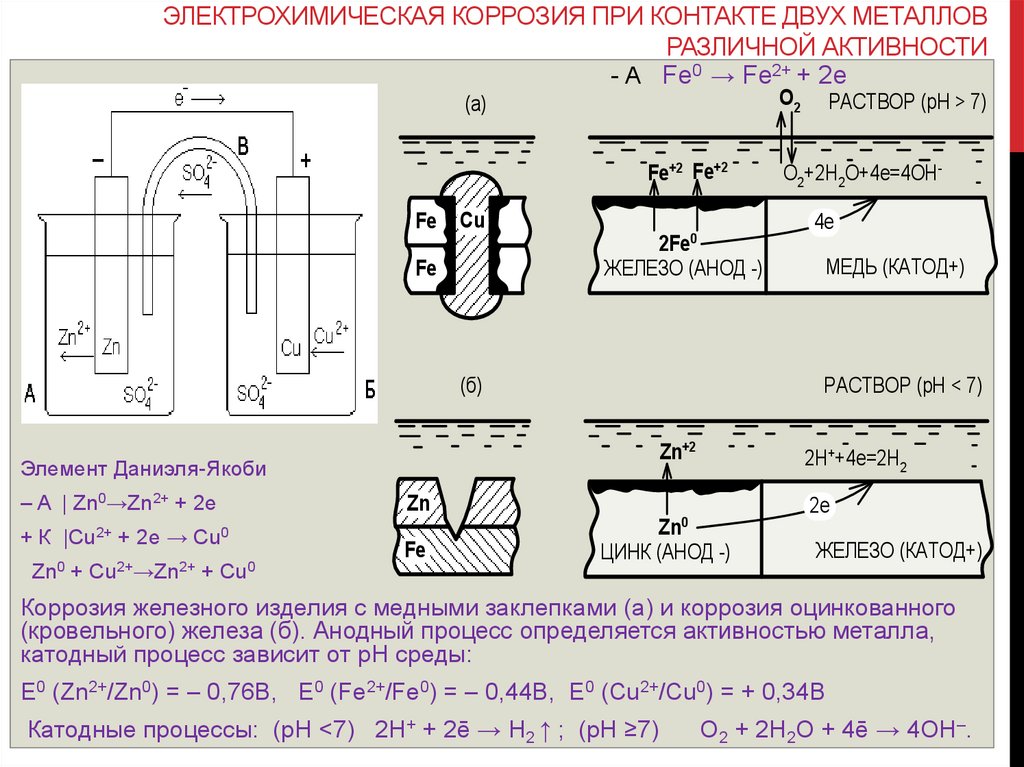
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ ПРИ КОНТАКТЕ ДВУХ МЕТАЛЛОВРАЗЛИЧНОЙ АКТИВНОСТИ
- А Fe0 → Fe2+ + 2е
Fe+2 Fe+2
Fe
Cu
ЖЕЛЕЗО (АНОД -)
(б)
+ К |Cu2+ + 2e → Cu0
Zn0 + Cu2+→Zn2+ + Cu0
Zn+2
2H++4e=2H2
Zn
Fe
МЕДЬ (КАТОД+)
РАСТВОР (pH < 7)
Элемент Даниэля-Якоби
– A | Zn0→Zn2+ + 2e
O2+2H2O+4e=4OH4e
2Fe0
Fe
РАСТВОР (pH > 7)
O2
(a)
Zn0
ЦИНК (АНОД -)
2e
ЖЕЛЕЗО (КАТОД+)
Коррозия железного изделия с медными заклепками (а) и коррозия оцинкованного
(кровельного) железа (б). Анодный процесс определяется активностью металла,
катодный процесс зависит от рН среды:
E0 (Zn2+/Zn0) = – 0,76B, E0 (Fe2+/Fe0) = – 0,44B, E0 (Cu2+/Cu0) = + 0,34B
Катодные процессы: (рН <7) 2H+ + 2ē → H2 ↑ ; (рН ≥7)
O2 + 2H2O + 4ē → 4OH–.
10.
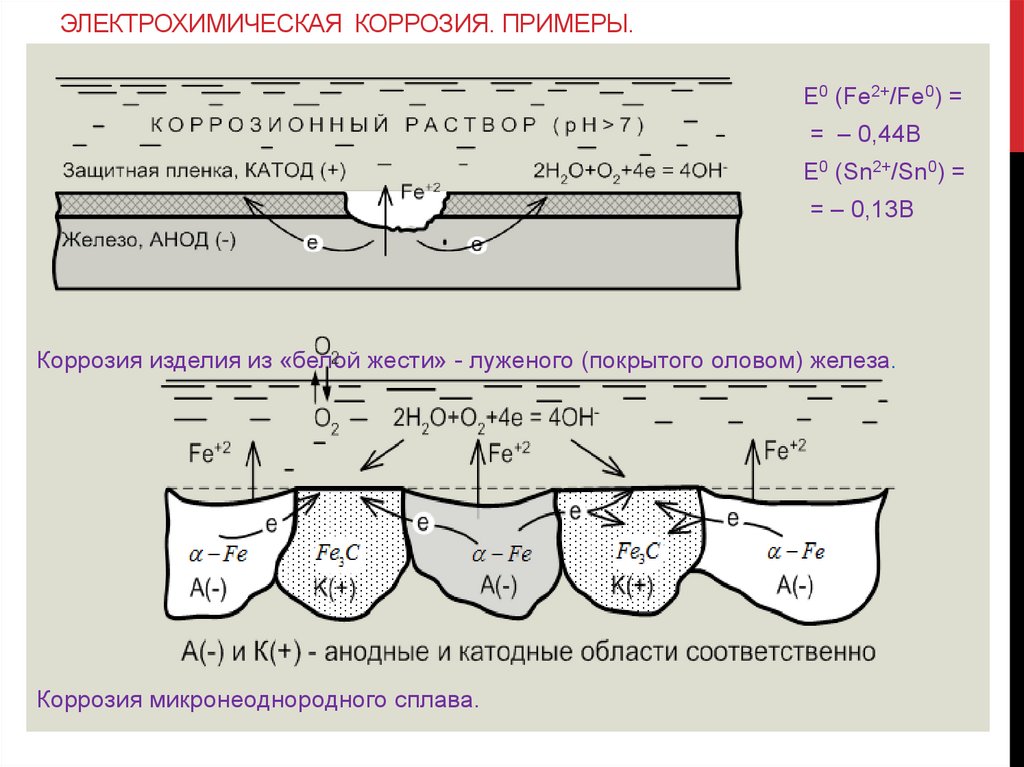
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ. ПРИМЕРЫ.E0 (Fe2+/Fe0) =
= – 0,44B
E0 (Sn2+/Sn0) =
= – 0,13B
Коррозия изделия из «белой жести» - луженого (покрытого оловом) железа.
Коррозия микронеоднородного сплава.
11.
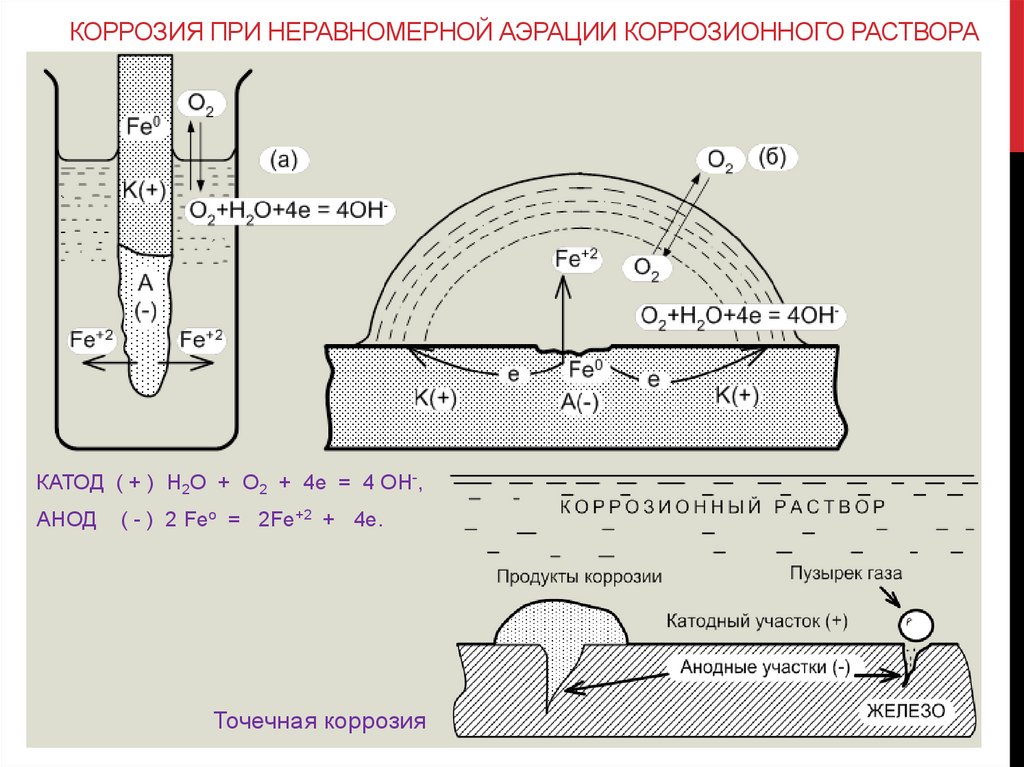
КОРРОЗИЯ ПРИ НЕРАВНОМЕРНОЙ АЭРАЦИИ КОРРОЗИОННОГО РАСТВОРАКАТОД ( + ) Н2О + О2 + 4е = 4 ОН-,
АНОД
( - ) 2 Feo = 2Fe+2 + 4e.
Точечная коррозия
12.
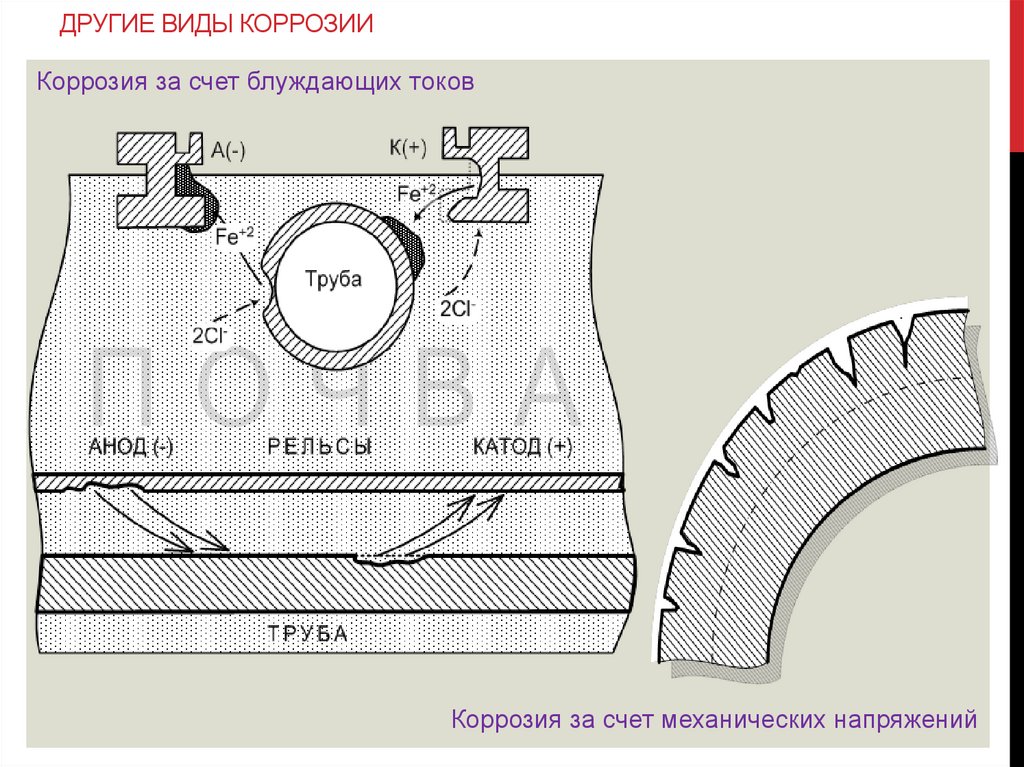
ДРУГИЕ ВИДЫ КОРРОЗИИКоррозия за счет блуждающих токов
Коррозия за счет механических напряжений
13.
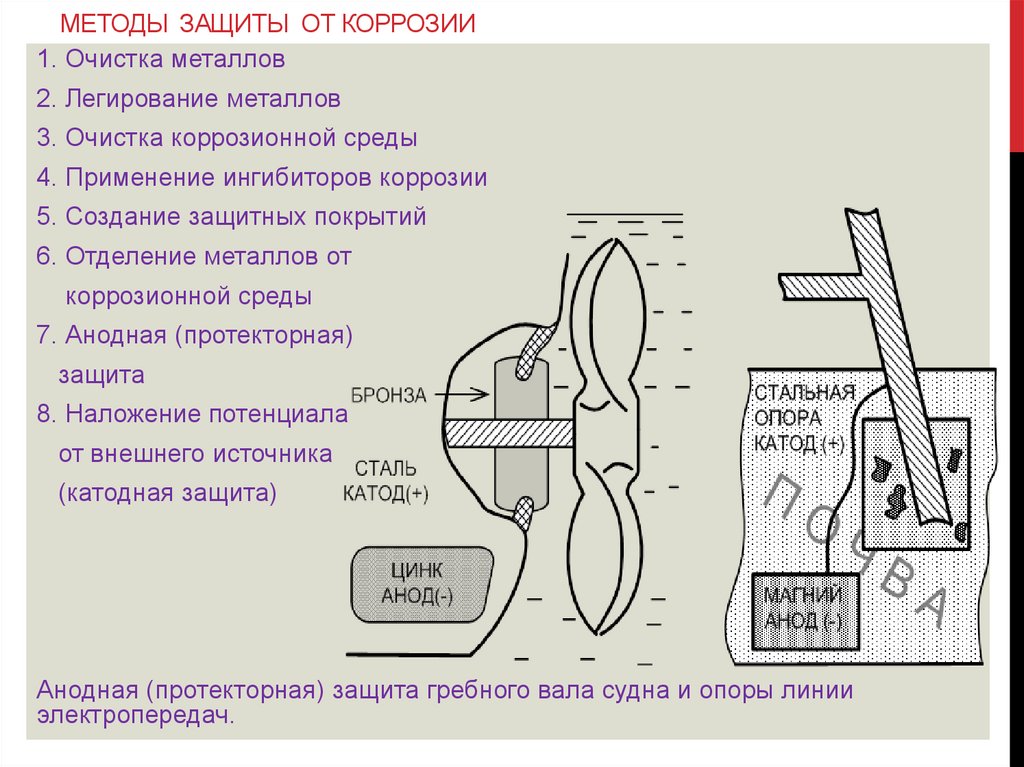
МЕТОДЫ ЗАЩИТЫ ОТ КОРРОЗИИ1. Очистка металлов
2. Легирование металлов
3. Очистка коррозионной среды
4. Применение ингибиторов коррозии
5. Создание защитных покрытий
6. Отделение металлов от
коррозионной среды
7. Анодная (протекторная)
защита
8. Наложение потенциала
от внешнего источника
(катодная защита)
Анодная (протекторная) защита гребного вала судна и опоры линии
электропередач.








 chemistry
chemistry








