Similar presentations:
Коллоидная химия. Адсорбция на границе раствор - твердое тело (лекция 8)
1. Коллоидная химия ИТХТ им. М.В. Ломоносова кафедра НС и ПЯ группы ХХБО-01-03-2022, ХТБО-01-2022
ЛЕКЦИЯ 8Шубенкова Екатерина Гаррьевна
2. Коллоидная химия
ЛЕКЦИЯ 8АДСОРБЦИЯ НА ГРАНИЦЕ
РАСТВОР-ТВЕРДОЕ ТЕЛО.
Межмолекулярные и межфазные
взаимодействия.
Шубенкова Е.Г.
2023
3. План лекции:
1. Смачивание. Краевой угол и теплотасмачивания. Уравнение Юнга. Влияние ПАВ
на смачивание.
2. Когезия и адгезия. Характер разрушения
адгезионного соединения. Условие
адгезионного разрушения. Уравнение Дюпре
для работы адгезии.
3. Связь адгезии и смачивания. Вывод
уравнения Дюпре – Юнга, его анализ.
4. Условие растекания жидкостей.
Коэффициент растекания по Гаркинсу.
5. Межфазное натяжение на границе между
взаимно насыщенными жидкостями. Правило
Антонова.
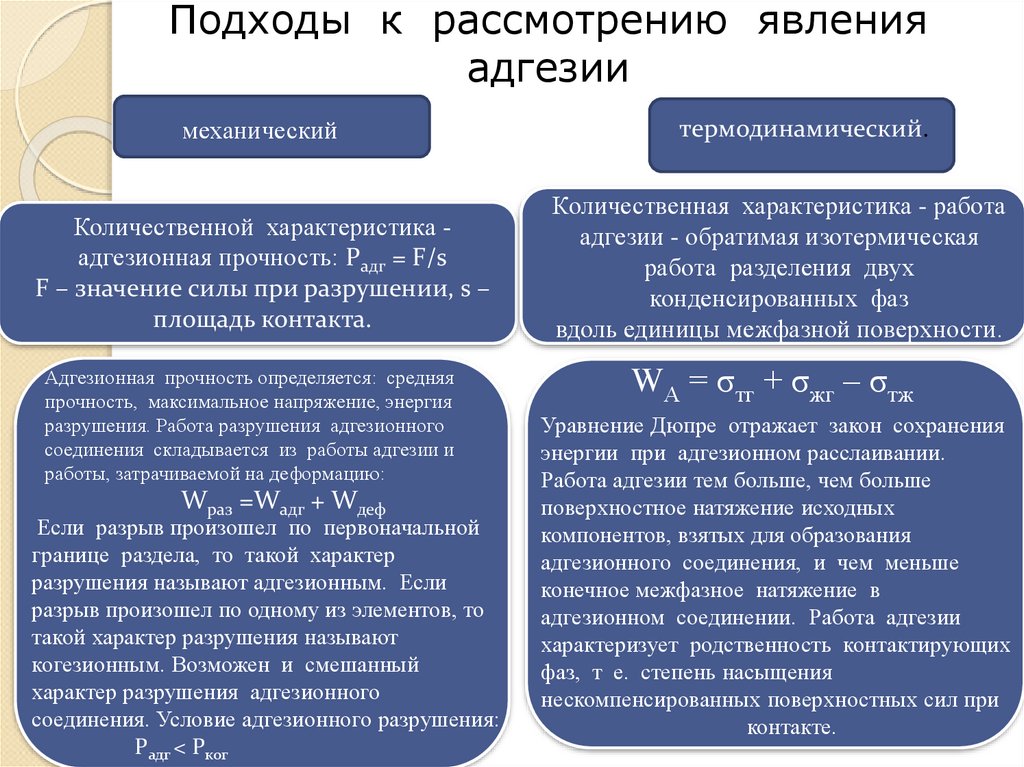
4. Работа адгезии и когезии
5.
Подходы к рассмотрению явленияадгезии
механический
Количественной характеристика адгезионная прочность: Pадг = F/s
F – значение силы при разрушении, s –
площадь контакта.
Адгезионная прочность определяется: средняя
прочность, максимальное напряжение, энергия
разрушения. Работа разрушения адгезионнoгo
соединения складывается из работы адгезии и
работы, затрачиваемой на деформацию:
Wраз =Wадг + Wдеф
Если разрыв произошел по первоначальной
границе раздела, то такой характер
разрушения называют адгезионным. Если
разрыв произошел по одному из элементов, то
такой характер разрушения называют
когезионным. Возможен и смешанный
характер разрушения адгезионного
соединения. Условие адгезионного разрушения:
Pадг < Pког
термодинамический.
Количественная характеристика - работа
адгезии - обратимая изотермическая
работа разделения двух
конденсированных фаз
вдоль единицы межфазной поверхности.
WА = σтг + σжг – σтж
Уравнение Дюпре отражает закон сохранения
энергии при адгезионном расслаивании.
Работа адгезии тем больше, чем больше
поверхностное натяжение исходных
компонентов, взятых для образования
адгезионного соединения, и чем меньше
конечное межфазное натяжение в
адгезионном соединении. Работа адгезии
характеризует родственность контактирующих
фаз, т е. степень насыщения
нескомпенсированных поверхностных сил при
контакте.
6.
Соотношение работ адгезии икогезии на примере растекания
жидкостей
Правило Гаркинса - растекание одной жидкости
по поверхности другой происходит, если прилипание
между двумя жидкостями больше, чем сцепление
молекул растекающейся жидкости (WA > WK).
Коэффициент растекания по Гаркинсу:
φ = WА – WК,
если
φ >0, то происходит растекание, если φ <0,
растекание не происходит.
Способность к растеканию зависит от когезии
наносимой жидкости.
Например,
многие
органические
вещества
растекаются по поверхности воды, а вода, как правило,
не растекается на поверхности органических веществ.
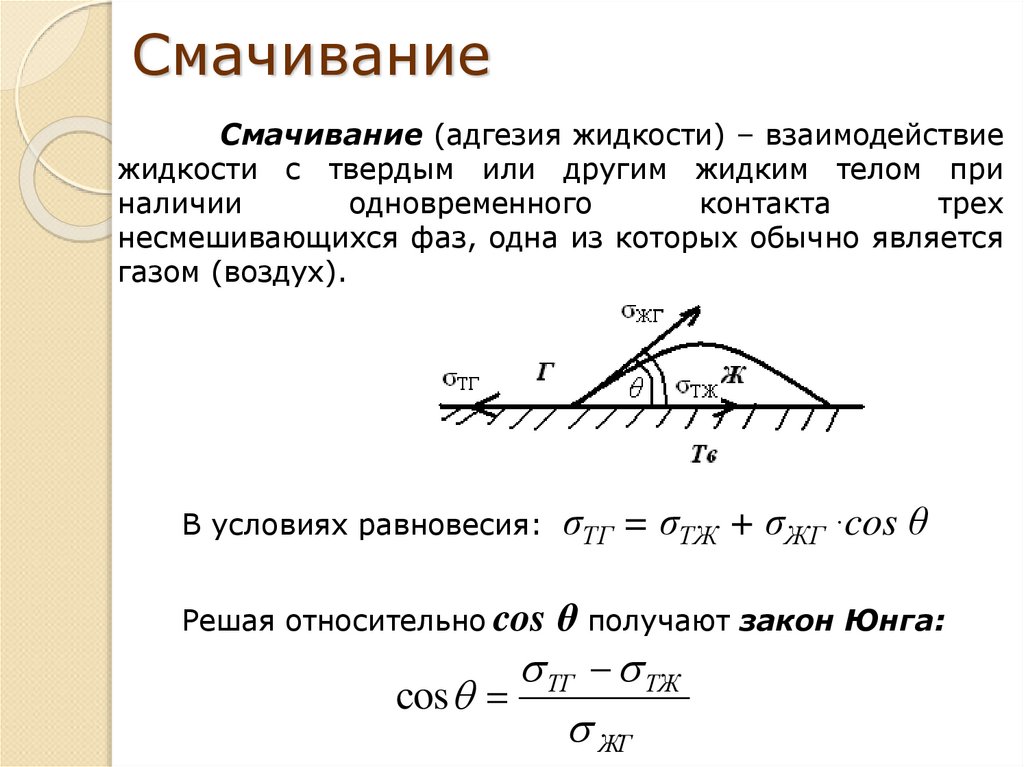
7.
СмачиваниеСмачивание (адгезия жидкости) – взаимодействие
жидкости с твердым или другим жидким телом при
наличии
одновременного
контакта
трех
несмешивающихся фаз, одна из которых обычно является
газом (воздух).
В условиях равновесия:
σТГ = σТЖ + σЖГ ·cos θ
Решая относительно cos θ получают закон Юнга:
ТГ ТЖ
cos
ЖГ
8. Краевой угол ()
Краевой угол ( )Если Ѳ < 900 , то говорят, что твердое тело
смачивается жидкостью.
Если Ѳ = 00 , то полное смачивание капля растекается на
поверхности до образования мономолекулярной пленки
Если Ѳ > 900, то жидкость не смачивает твердое тело.
Если Ѳ = 1800 , то полное несмачивание, капля жидкости
имела бы сферическую форму, если бы не действовала
сила тяжести.
9.
Анализ уравнения Юнга1. Если σТГ> σТЖ, то cos θ > 0, θ < 90°- краевой
угол острый - смачивание. Пример: вода на поверхности
металла, покрытого оксидной пленкой.
2. Если σТГ < σТЖ, то cos θ < 0, θ > 90° - краевой
угол тупой - несмачивание. Пример: вода на парафине
или тефлоне.
3. Если σТГ = σТЖ, то cos θ = 0, θ = 90° - граница
между смачиваемостью и несмачиваемостью.
4. Если σТГ – σТЖ = σЖГ, то cos θ = 1 и θ = 0° полное смачивание (растекание) – капля растекается
в тонкую пленку.
Пример:
ртуть
на
поверхности
свинца, очищенного от оксидной пленки.
10.
Смачивание и полярностьПравило:
лучше
смачивает
жидкость,
которая
ближе
по
смачиваемому материалу.
поверхность
полярности
та
к
По виду избирательного смачивания все твердые
тела делят на две группы:
Гидрофильные (олеофобные) материалы –
лучше
смачиваются
водой,
чем
неполярными
углеводородами: кварц (θ = 0°), малахит (θ = 17°),
силикаты, карбонаты, оксиды и гидроксиды металлов.
Гидрофобные (олеофильные) материалы лучше смачиваются неполярными жидкостями, чем
водой: парафин
(θ = 106°), тефлон (θ = 120°),
графит, уголь.
Флотация - метод обогащения полезных ископаемых,
основанный на их различной смачиваемости (этим методом
обогащается около 90% руд цветных металлов).
11.
Связь краевого угласмачивания и полярности
WA= σТГ+ σЖГ – σТЖ
Отсюда:
уравнение Дюпре.
σ ТГ – σТЖ= WА– σЖГ
Подставим в уравнение Юнга:
ТГ ТЖ WА ЖГ
WА
cos
1
ЖГ
ЖГ
ЖГ
• Если W > σ , то cos θ > 0 , смачивание.
• Если W < σ , то cos θ < 0 , несмачивание.
А
ЖГ
А
ЖГ
Твердые
жидкости.
тела
лучше
смачивают
неполярные
12. Связь краевого угла с работой адгезии и когезии
13. Влияние ПАВ на смачивание
14.
Влияние шероховатости насмачивание
Поверхность реальных твердых тел шероховатая:
Sш > Sгл
Sш
K 1 , где: К – коэффициент шероховатости.
S гл
cos ш K cos - уравнение Венцеля - Дерягина
смачивание (cos θ > 0)
смачивание;
шероховатость улучшает
несмачивание (cos θ < 0), шероховатость улучшает
несмачивание.
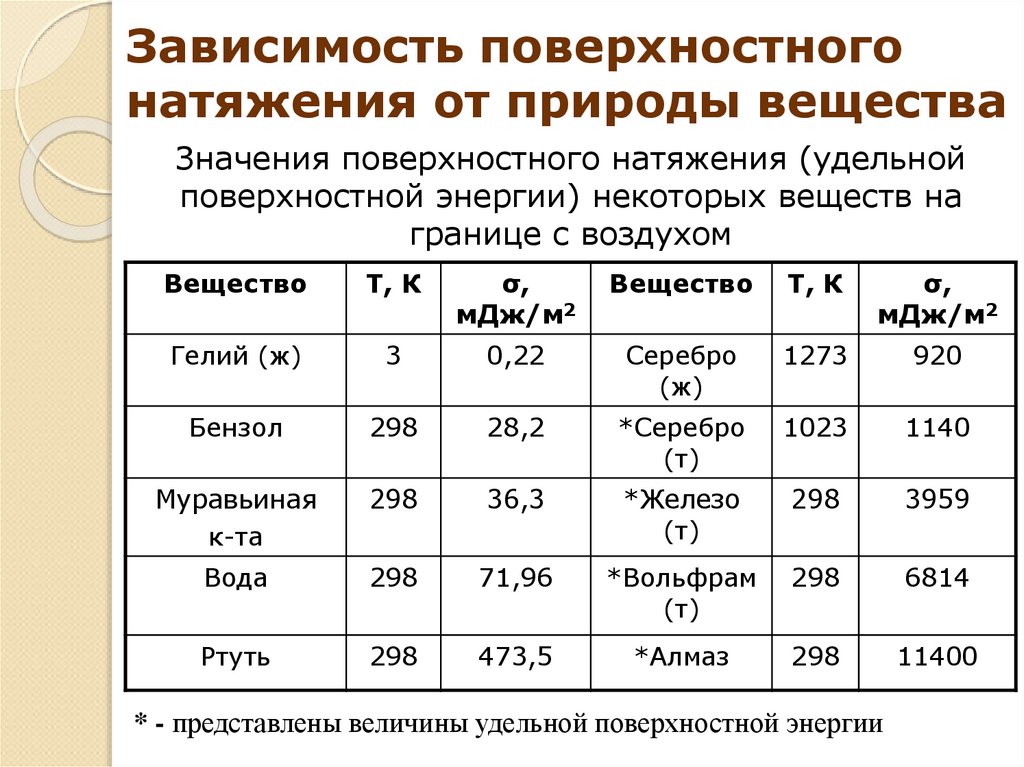
15.
Зависимость поверхностногонатяжения от природы вещества
Значения поверхностного натяжения (удельной
поверхностной энергии) некоторых веществ на
границе с воздухом
Вещество
Т, К
σ,
мДж/м2
Вещество
Т, К
σ,
мДж/м2
Гелий (ж)
3
0,22
Серебро
(ж)
1273
920
Бензол
298
28,2
*Серебро
(т)
1023
1140
Муравьиная
к-та
298
36,3
*Железо
(т)
298
3959
Вода
298
71,96
*Вольфрам
(т)
298
6814
Ртуть
298
473,5
*Алмаз
298
11400
* - представлены величины удельной поверхностной энергии
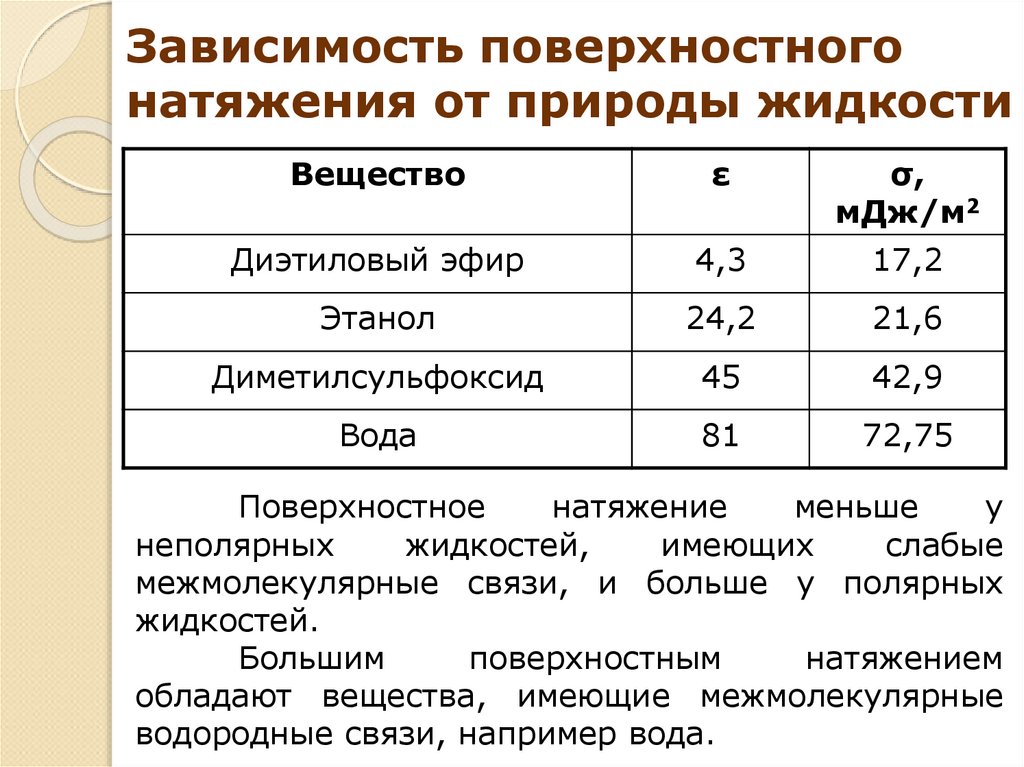
16.
Зависимость поверхностногонатяжения от природы жидкости
Вещество
ε
σ,
мДж/м2
Диэтиловый эфир
4,3
17,2
Этанол
24,2
21,6
Диметилсульфоксид
45
42,9
Вода
81
72,75
Поверхностное
натяжение
меньше
у
неполярных
жидкостей,
имеющих
слабые
межмолекулярные связи, и больше у полярных
жидкостей.
Большим
поверхностным
натяжением
обладают вещества, имеющие межмолекулярные
водородные связи, например вода.
17.
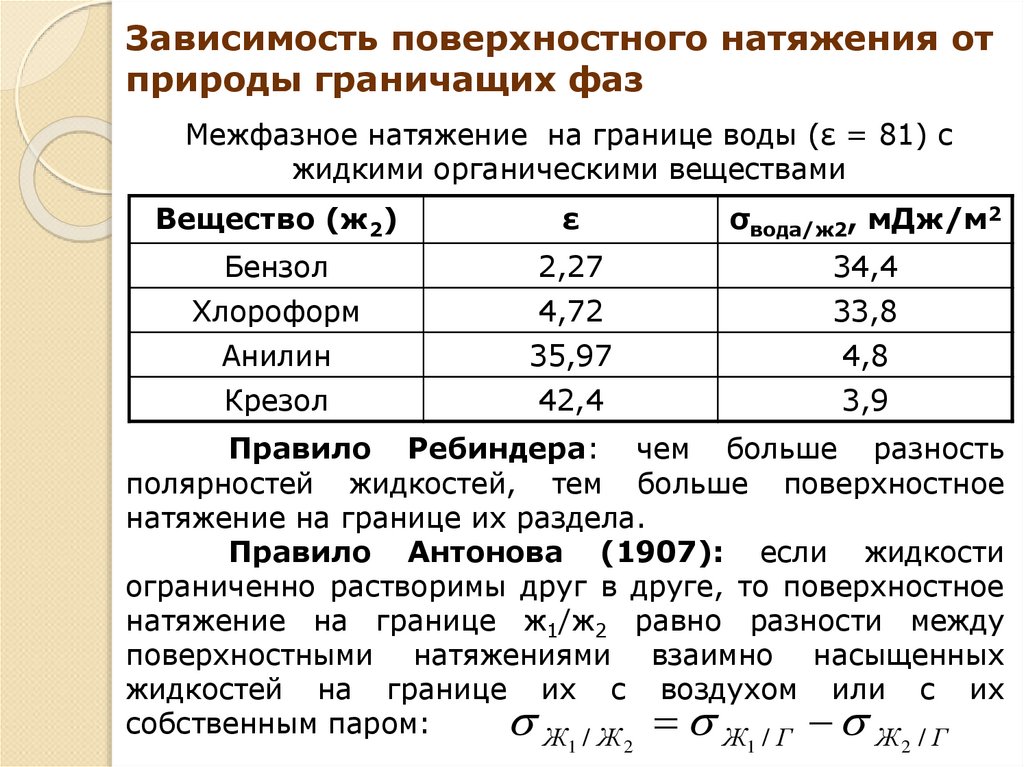
Зависимость поверхностного натяжения отприроды граничащих фаз
Межфазное натяжение на границе воды (ε = 81) с
жидкими органическими веществами
Вещество (ж2)
ε
σвода/ж2, мДж/м2
Бензол
2,27
34,4
Хлороформ
4,72
33,8
Анилин
35,97
4,8
Крезол
42,4
3,9
Правило Ребиндера: чем больше разность
полярностей жидкостей, тем больше поверхностное
натяжение на границе их раздела.
Правило Антонова (1907): если жидкости
ограниченно растворимы друг в друге, то поверхностное
натяжение на границе ж1/ж2 равно разности между
поверхностными натяжениями взаимно насыщенных
жидкостей на границе их с воздухом или с их
собственным паром:
Ж /Ж
Ж /Г
Ж /Г
1
2
1
2
18.
Методы определения поверхностногонатяжения.
Сталагмометрический метод.
При вытекании жидкости из капилляра сталагмометра
вес образующейся капли в момент отрыва капли равен силе,
стремящейся удержать каплю:
V g
2 R
n
Поверхностное натяжение жидкости будет
V g
равно:
V g
const
2 R
Для каждого сталагмометра:
Чтобы
исключить
характеристики
подсчитывают число капель исследуемой
жидкостей:
X H O
2
nH 2O X
n X H 2O
2 R n
сталагмометра,
и стандартной
19.
Методы определения поверхностногонатяжения.
Метод поднятия жидкости в капилляре.
В основе метода лежит уравнение Жюрена:
2 cos
h
gR
На практике θ не известен. В этом случае
принимают, что жидкость полностью смачивает стенки
капилляра (θ = 0°, cos θ = 1), тогда уравнение Жюрена
запишется в виде:
2
h
gR
Отсюда поверхностное натяжение жидкости будет равно:
h gR
2
20.
Методы определения поверхностногонатяжения.
Метод наибольшего давления пузырька
газа.
Метод
основан
на
измерении
избыточного
внутримолекулярного давления Δр, возникающего в
жидкости в момент проскока газового пузырька. По
уравнению Лапласа: Δр=2σ/r.
Измерения
проводят
относительным
способом:
находят наибольшее давление пузырька газа в
стандартной жидкости и в исследуемом растворе:
Н О
2
r pH 2O
2
r p X
X
2
p X
hX
X H 2O
H 2O
pH 2O
hH 2O















 chemistry
chemistry








