Similar presentations:
Коллоидная химия. Адсорбция на границе раствор - твердое тело (лекция 7)
1.
Коллоидная химияИТХТ им. М.В. Ломоносова
кафедра НС и ПЯ
группы ХХБО-01-03-2022,
ХТБО-01-2022
ЛЕКЦИЯ 7
Шубенкова Екатерина Гаррьевна
2.
Коллоидная химияЛЕКЦИЯ 7
АДСОРБЦИЯ НА ГРАНИЦЕ
РАСТВОР-ТВЕРДОЕ ТЕЛО.
Шубенкова Е.Г.
2023
3.
Адсорбция на границетвердое тело - раствор
Особенности адсорбции из растворов
1.
Одновременно
могут
протекать
два
параллельных процесса:
адсорбция
молекул
растворенного
вещества;
адсорбция молекул растворителя.
2. Адсорбироваться будет то вещество, которое в
большей степени будет снижать поверхностное
натяжение адсорбента.
Различают:
молекулярную адсорбцию;
ионную адсорбцию;
ионообменную адсорбцию.
4.
Адсорбция твердыми телами5.
Закономерности адсорбциитвердыми телами из раствора
При
адсорбции
из
раствора
существенную
роль
играет
природа
растворителя и адсорбента. Существует
одно общее правило: чем лучше данный
растворитель смачивает взятый адсорбент,
тем меньше адсорбция растворенного
вещества из данного растворителя на
поверхности адсорбента; и наоборот, если
взятый растворитель плохо смачивает
взятый
адсорбент,
то
адсорбция
растворенных молекул будет достаточно
велика.
6.
Закономерности адсорбциитвердыми телами из раствора
Это объясняется тем, что, когда
растворитель
хорошо
смачивает
поверхность, он сам достаточно сильно
понижает поверхностную энергию и
адсорбция растворенного вещества будет
протекать
хуже.
При плохо смачиваемой поверхности
растворитель почти не адсорбируется на
адсорбенте и происходит адсорбция
растворенного вещества.
7.
Закономерности адсорбциитвердыми телами из раствора
Адсорбция из водных растворов хорошо протекает на
гидрофобных адсорбентах, таких, как уголь, сажа.
Адсорбция из неполярных углеводородных растворов
лучше идет на гидрофильных поверхностях, таких, как
силикагель, глина.
8.
Молекулярная адсорбцияМолекулярная адсорбция – адсорбция
на
поверхности
адсорбента
молекул
неэлектролитов.
Правило уравнивания полярностей
Ребиндера:
вещество
В
будет
адсорбироваться на границе раздела фаз А/С,
если оно будет уравнивать полярности этих
фаз:
А B C
или
À B C
Адсорбат
должен
занимать
промежуточное значение по полярности между
полярностью
адсорбента
и
полярностью
растворителя.
9.
Правило уравнивания полярностейРебиндера:
адсорбция растворенного вещества на
твердой поверхности будет тем больше, чем
больше
разность
полярностей
между
растворителем и адсорбентом, и наоборот, чем
ближе по своей природе адсорбент к
растворителю, тем меньше адсорбируется
растворенное вещество из этого растворителя
на данном адсорбенте.
10.
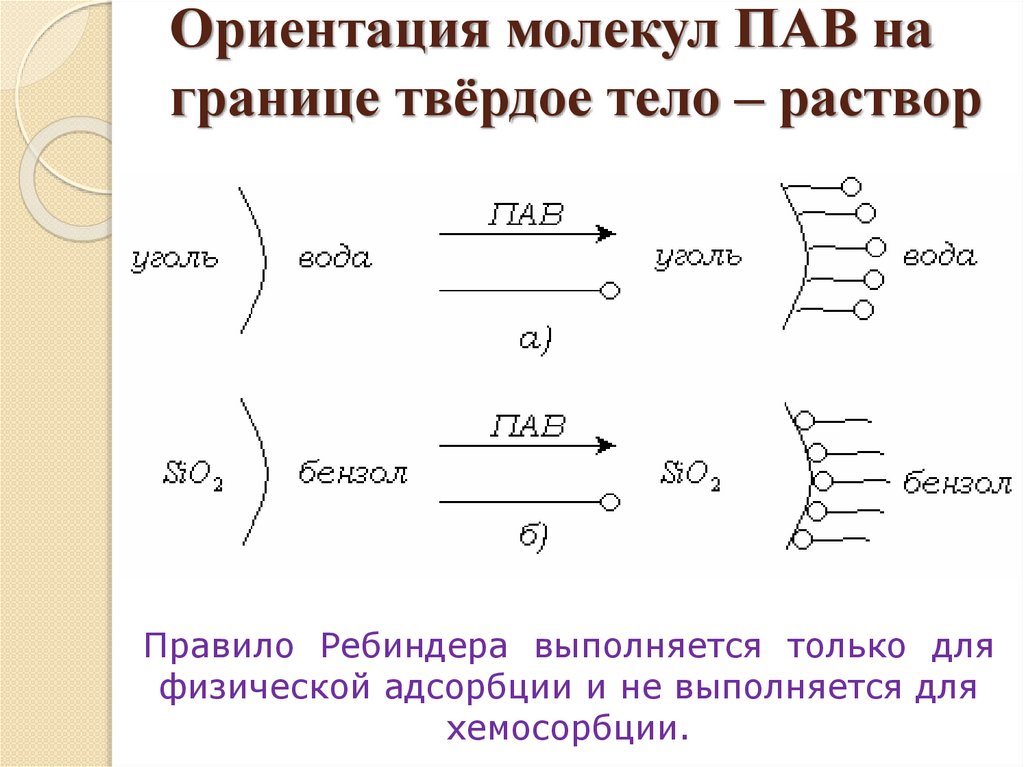
Ориентация молекул ПАВ награнице твёрдое тело – раствор
Правило Ребиндера выполняется только для
физической адсорбции и не выполняется для
хемосорбции.
11.
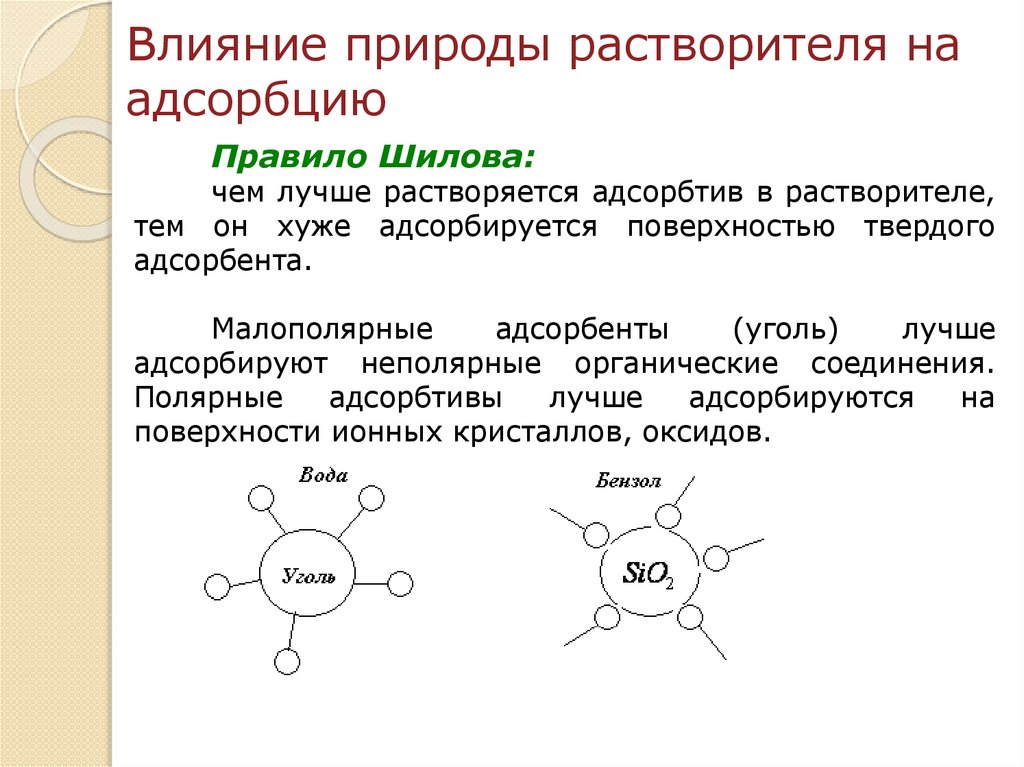
Влияние природы растворителя наадсорбцию
Правило Шилова:
чем лучше растворяется адсорбтив в растворителе,
тем он хуже адсорбируется поверхностью твердого
адсорбента.
Малополярные
адсорбенты
(уголь)
лучше
адсорбируют неполярные органические соединения.
Полярные
адсорбтивы
лучше
адсорбируются
на
поверхности ионных кристаллов, оксидов.
12.
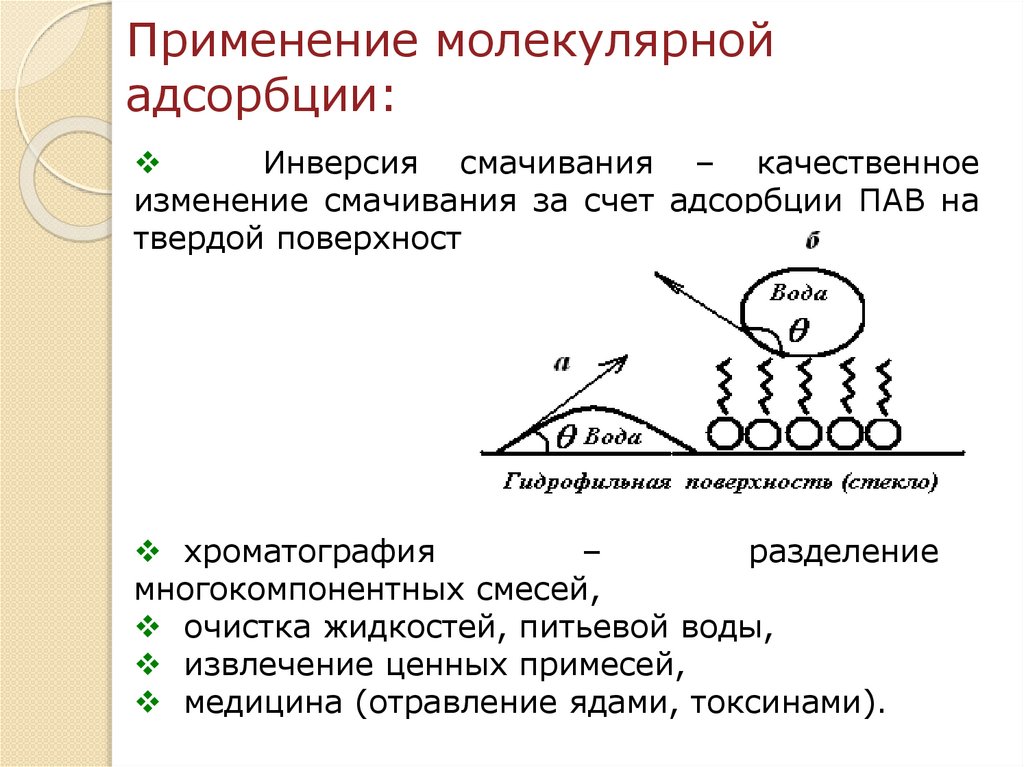
Применение молекулярнойадсорбции:
Инверсия смачивания – качественное
изменение смачивания за счет адсорбции ПАВ на
твердой поверхности.
хроматография
–
разделение
многокомпонентных смесей,
очистка жидкостей, питьевой воды,
извлечение ценных примесей,
медицина (отравление ядами, токсинами).
13.
Ионная адсорбцияИонная адсорбция – адсорбция сильных электролитов из
водных растворов, обусловленная химическими и электростатическими
силами.
Ионы избирательно адсорбируются
состоящих из ионов или полярных молекул.
на
поверхностях,
Правило избирательной адсорбции Пескова – Фаянса
На твердой поверхности адсорбента в первую очередь
адсорбируются ионы, которые:
входят в состав кристаллической решетки адсорбента;
способны достраивать кристаллическую решетку адсорбента;
изоморфны с ионами адсорбента.
Влияние природы ионов на их адсорбционную
способность
Ионы адсорбируются тем лучше:
чем больше заряд иона;
чем больше радиус иона;
чем больше поляризуемость иона.
14.
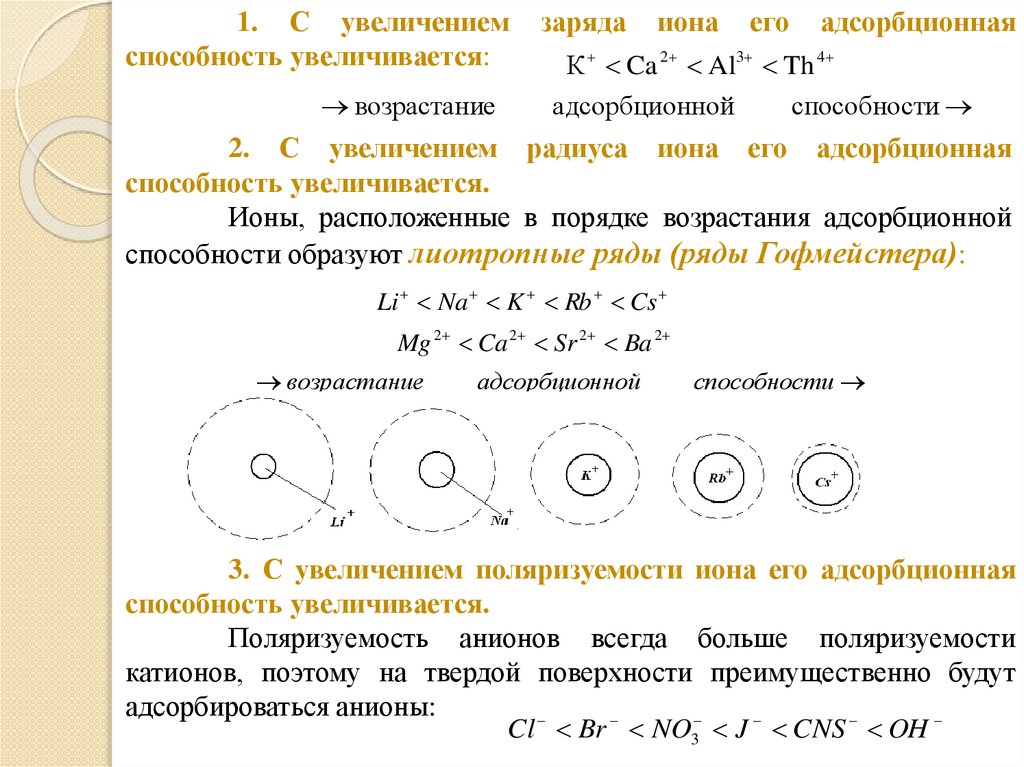
1. С увеличениемспособность увеличивается:
возрастание
заряда
иона
его
адсорбционная
К Ca 2 Al3 Th 4
адсорбционной
способности
2. С увеличением радиуса иона его адсорбционная
способность увеличивается.
Ионы, расположенные в порядке возрастания адсорбционной
способности образуют лиотропные ряды (ряды Гофмейстера):
Li Na K Rb Cs
Mg 2 Ca 2 Sr 2 Ba 2
возрастание
адсорбционной
способности
3. С увеличением поляризуемости иона его адсорбционная
способность увеличивается.
Поляризуемость анионов всегда больше поляризуемости
катионов, поэтому на твердой поверхности преимущественно будут
адсорбироваться анионы:
Cl Br NO3 J CNS OH
15.
Ионообменная адсорбция. Ионныйобмен
Ионообменная адсорбция - процесс обмена ионов между
раствором и ионообменником (сорбентом).
Ионообменники
(иониты)
–
высокомолекулярные
полиэлектролиты, состоящие из синтетического нерастворимого
каркаса с привитыми функциональными группами кислотного (SO3Н, -COOН, и др.) и основного ( =NH, -NH2 и др.) характера.
Особенности ионообменной адсорбции
специфична,
каждый
адсорбент
(ионит)
обменивается
определенными типами ионов;
не всегда обратима;
протекает более медленно, чем молекулярная адсорбция;
часто меняется рН среды.
16.
Уравнение изотермы ионного обменаБ.П.Никольского
Г11 z
C11 z
1
–
константа обмена, зависит от
способности ионов к адсорбции на данном
адсорбенте
k
При z1=z2 =1 уравнение упрощается:
Г 21 z 2
Г1
Г2
k
k
Применение ионного обмена
1
C 21 z 2
C1
C2
1. Обессоливание (деминерализация) воды – удаление СаCl2,
МgCl2 и т.д. Процесс обессоливание состоит в пропускании засоленной
воды через колонки, заполненные катионитом в Н+ - форме и
анионитом в ОН- - форме: 2 Kat H CaCl2 Kat2 Ca 2 2 HCl
An OH HCl An Cl H 2O
2. Опреснение воды на морских судах и космических кораблях:
Kat Н NaCl Kat Na HCl
An OH HCl An Cl H 2O
3. Очистка сточных вод – удаление ионов тяжелых металлов (Zn2+,
Cd2+, Pb2+, Cu2+):
2Kat Na Pb2 Kat2 Pb2 2 Na
17.
Адсорбция на пористыхадсорбентах
Пористые адсорбенты – твердые тела,
внутри которых имеются поры, обуславливающие
наличие внутренней межфазной поверхности.
Адсорбция на пористых телах значительно
выше
адсорбции
на
ровной
поверхности.
Увеличение пористости сорбента приводит к
увеличению Sуд и обеспечивает конденсацию пара
при давлениях меньших, чем для ровной
поверхности.
Пористые сорбенты широко применяются в
промышленности: в гетерогенном катализе, при
улавливании выбросов предприятий (экология) и
т.д.
18.
Классификация пористыхсорбентов по размерам пор
(М.М. Дубинина)
• макропористые тела (r > 200 нм), для
количественного описания используют уравнения
Лэнгмюра;
• мезопористые (переходнопористые) тела (r = 2
– 200 нм), в порах - полимолекулярная
адсорбция, которая заканчивается капиллярной
конденсацией (силикагели, алюмогели), процесс
адсорбции описывается теориями Поляни и БЭТ;
• микропористые тела (r = 0,5 – 2 нм) –
молекулярные сита (цеолиты, алюмосиликаты,
активированные
угли,
обладающие
строго
регулярной кристаллической структурой).
19.
Адсорбция зависит от:1) взаимодействия твердого тела с растворителем;
2) твердого тела с адсорбатом ;
3) адсорбата с растворителем.
Межмолекулярные взаимодействия в жидкой
фазе имеют решающее значение.
Взаимодействие
адсорбента
и
среды,
характеризуется теплотой смачивания и определяет
условия смачивания, растекания, адгезии и когезии.
Эти явления сопровождают друг друга, и каждое из них
вносит вклад в межфазное взаимодействие.
Величину адсорбции из растворов определяют по
разности концентрации вещества в растворе до
адсорбции
и
после
установления равновесия,
определенной
подходящим аналитическим методом
(весовым,
объемным,
спектральным,
рефрактометрическим):
А = (( Спр. –Ср)·V) / m
20.
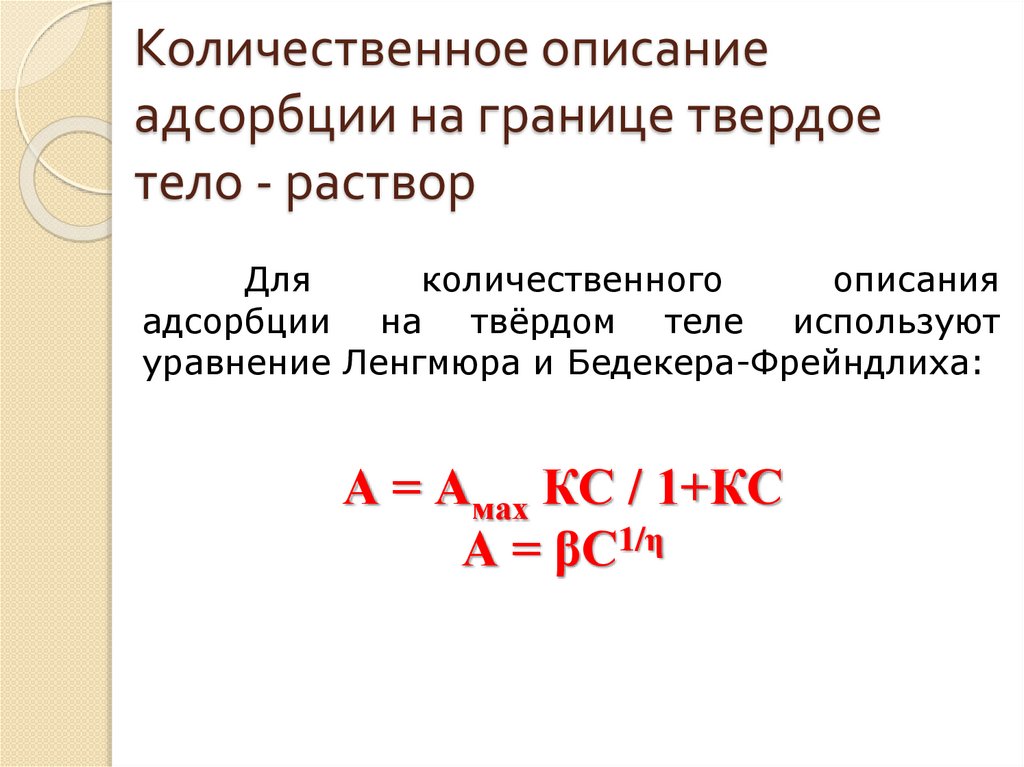
Количественное описаниеадсорбции на границе твердое
тело - раствор
Для
количественного
описания
адсорбции на твёрдом теле используют
уравнение Ленгмюра и Бедекера-Фрейндлиха:
А = Амах КС / 1+КС
А = βС1/η















 chemistry
chemistry








