Similar presentations:
Коллоидная химия. Адсорбция на границе раствор - газ (лекция 6)
1. Коллоидная химия ИТХТ им. М.В. Ломоносова кафедра НС и ПЯ группы ХХБО-01-03-2021 ХТБО-01-02-2021
ЛЕКЦИЯ 6Шубенкова Екатерина Гаррьевна
2. Коллоидная химия
ЛЕКЦИЯ 6АДСОРБЦИЯ НА ГРАНИЦЕ РАСТВОР-ГАЗ.
ПОВЕРХНОСТНО АКТИВНЫЕ ВЕЩЕСТВА (ПАВ).
Шубенкова Е.Г.
2023
3. План лекции:
1. Вывод адсорбционного уравнения Гиббса дляразбавленных растворов, его анализ.
2. Уравнение Шишковского, связь с его помощью
уравнений Ленгмюра и Гиббса.
3. Классификация веществ по влиянию на поверхностное
натяжение. Изотермы поверхностного натяжения.
Изотермы адсорбции.
4. Правило уравнивания полярностей Ребиндера.
5. Поверхностная активность по Ребиндеру. Графическое
определение поверхностной активности.
6. Влияние на адсорбцию на границе раствор-газ
строения и размера молекул ПАВ. Правило Траубе, его
аналитическое выражение и физическое обоснование.
Обращение правила Траубе при адсорбции из водных и
углеводородных растворов.
7. Строение адсорбционных пленок на жидкой
поверхности. Диаграммы состояния поверхностных
пленок.
8. Вывод уравнение состояния двухмерного газа.
Уравнение Фрумкина для реального двухмерного газа.
4.
Вспомним основные понятия иопределения
Движущей силой адсорбции является стремление системы
уменьшить свою поверхностную энергию за счет уменьшения
поверхностного натяжения.
S
G S
Адсорбция
–
процесс
самопроизвольного
перераспределения компонентов системы между поверхностным
слоем и объемной фазой.
На любой границе раздела существует «поверхностный
слой» – переходная область от одной объемной фазы к другой.
Поверхностный слой имеет очень малую толщину (всего несколько
молекул), но в нем сосредоточен весь избыток поверхностной
энергии.
В
однокомпонентных
системах
при
формировании
поверхностного слоя происходит изменение его структуры (сгущение,
уплотнение), которые часто называют автоадсорбцией.
В многокомпонентных системах в поверхностный слой
предпочтительнее переходит тот компонент, который сильнее
уменьшает межфазное (поверхностное) натяжение.
5. Особенности адсорбции на границе раздела фаз жидкость-газ
на границе раздела фаз нет активных центров,поверхность жидкости гладкая;
молекулы адсорбата свободно перемещаются по
поверхности адсорбента (жидкости).
В
результате
адсорбции
на
поверхности
жидкости оказывается то вещество, которое в большей
степени будет снижать ее поверхностное натяжение.
Адсорбция вещества на поверхности жидкости
связана с величиной поверхностного натяжения
фундаментальным уравнением адсорбции Гиббса.
6.
ВЫВОД АДСОРБЦИОННОГОГИББСА
УРАВНЕНИЯ
Уравнение выражает количественную связь адсорбции с
поверхностным натяжением. Запишем фундаментальное
уравнение Гиббса для плоского поверхностного слоя
dF ds S dT i dNi
S
S
S
(1)
- введем внутреннюю энергию
S
S
S
F
U
T
S
поверхностного слоя:
- продифференцируем
dF S dU S T dS S S S dT (2)
это уравнение
S
- приравняем правые части dU S ds T dS i dNi (3)
(4) U S s S T dN S продифференцируем (4)
i
i
dU S ds S d T ds S S S dT i dNi Ni d i (5)
S
- объединим
S
S
S
d
S
dT
N
d
i
i 0
(3) и (5)
общий вид адсорбционного уравнения Гиббса
S
(6)
7.
ВЫВОД АДСОРБЦИОННОГОГИББСА
УРАВНЕНИЯ
При Т=const уравнение Гиббса принимает вид:
s d N iS d i 0 |: s
N iS
т.к. Г i
, следовательно
S
d Г i d i 0
(7)
– мера избыточного содержания компонента в
поверхностном слое, мера адсорбции, т. е. величина
гиббсовой адсорбции.
d Г i d i ,
(8)
Получили выражение, связывающее величину
поверхностного натяжения с концентраций адсорбата.
Для системы. состоящей из двух компонентов:
растворителя (1) и растворенного вещества (2) можно
записать:
d Г1d 1 Г 2d 2
В разбавленном растворе
d 1 0 , тогда:
d Г 2 d 2
8. Фундаментальное адсорбционное уравнения Гиббса
d Г i d ii
Фундаментальное
адсорбционное уравнение
Гиббса
Уравнение
теоретически
применимо
к
любой границе раздела фаз, но в основном
используется для границ раздела: г-ж и ж-ж, т.к.
поверхностное натяжение для этих границ
раздела легко определяется из опыта.
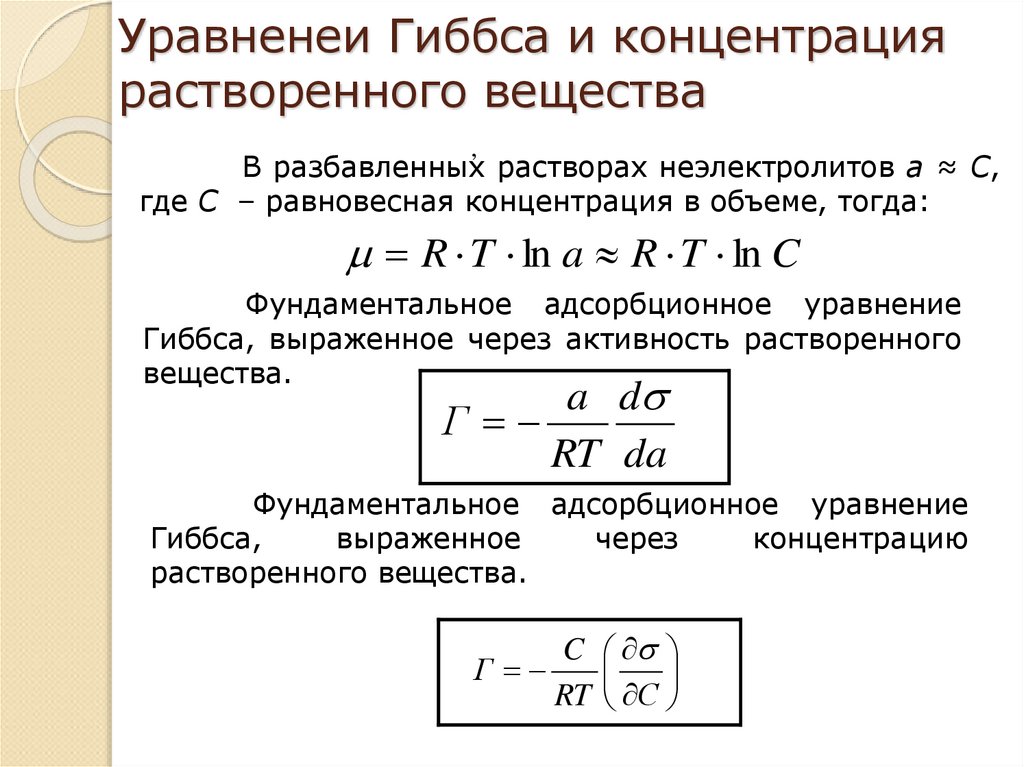
9. Уравненеи Гиббса и концентрация растворенного вещества
,В разбавленных растворах неэлектролитов а ≈ С,
где С – равновесная концентрация в объеме, тогда:
R T ln a R T ln C
Фундаментальное адсорбционное уравнение
Гиббса, выраженное через активность растворенного
вещества.
a d
Г
RT da
Фундаментальное адсорбционное уравнение
Гиббса,
выраженное
через
концентрацию
растворенного вещества.
C
Г
RT С
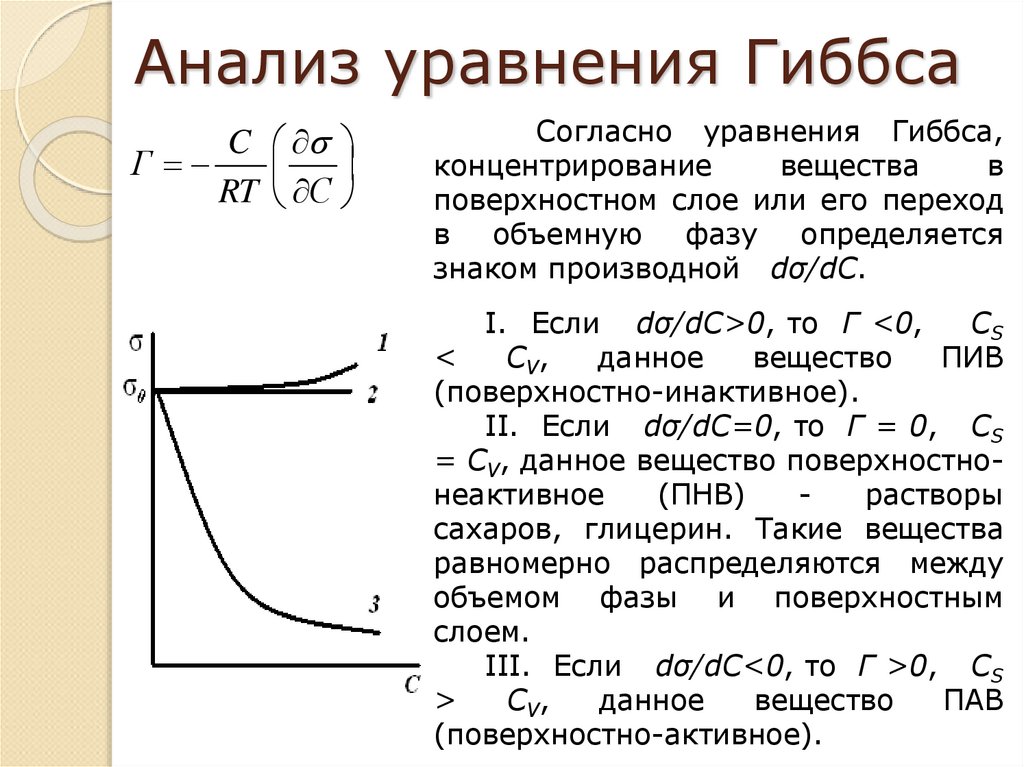
10. Анализ уравнения Гиббса
CГ
RT С
Согласно уравнения Гиббса,
концентрирование
вещества
в
поверхностном слое или его переход
в объемную фазу
определяется
знаком производной dσ/dС.
I. Если dσ/dC>0, то Г <0,
СS
<
CV,
данное
вещество
ПИВ
(поверхностно-инактивное).
II. Если dσ/dC=0, то Г = 0, СS
= CV, данное вещество поверхностнонеактивное
(ПНВ)
растворы
сахаров, глицерин. Такие вещества
равномерно распределяются между
объемом фазы и поверхностным
слоем.
III. Если dσ/dC<0, то Г >0, СS
>
CV,
данное
вещество
ПАВ
(поверхностно-активное).
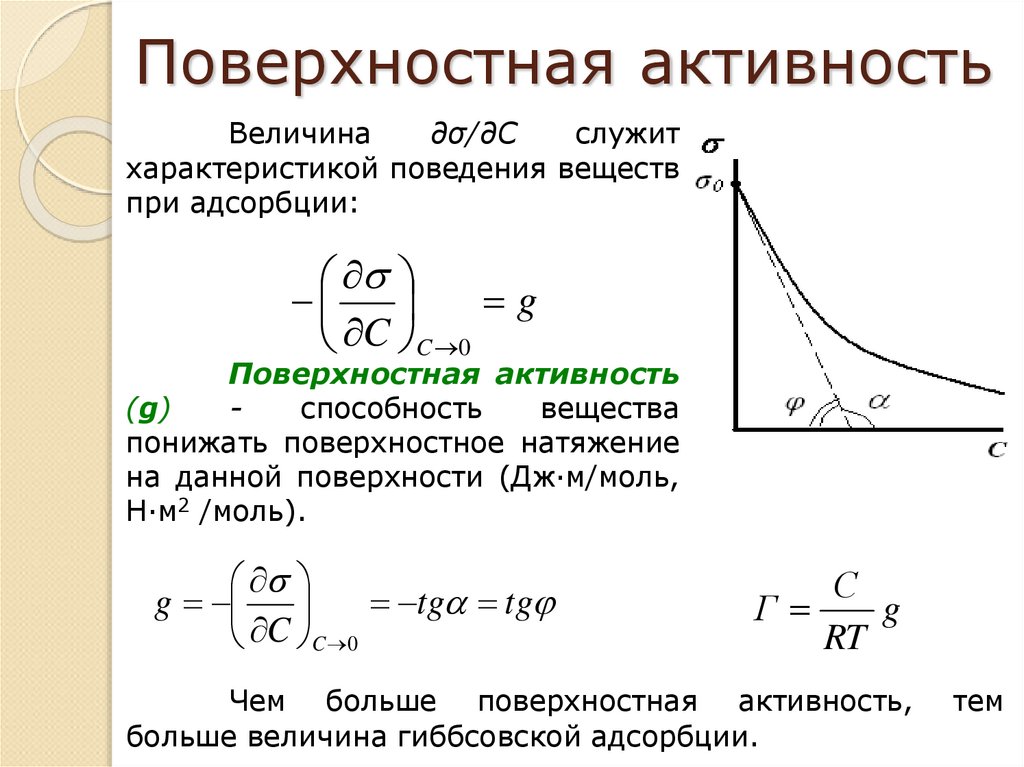
11. Поверхностная активность
Величина∂σ/∂С
служит
характеристикой поведения веществ
при адсорбции:
g
C C 0
Поверхностная активность
(g)
способность
вещества
понижать поверхностное натяжение
на данной поверхности (Дж·м/моль,
Н·м2 /моль).
g
tg tg
C C 0
С
Г
g
RT
Чем больше поверхностная активность,
больше величина гиббсовской адсорбции.
тем
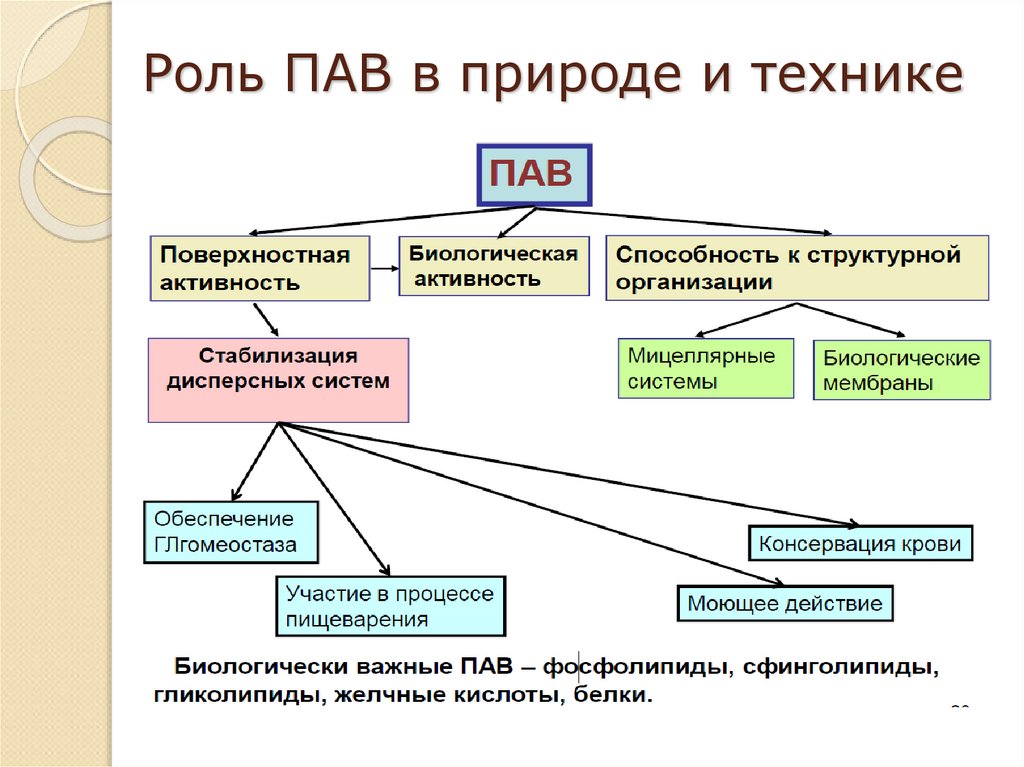
12. Поверхностно-активные вещества (ПАВ)
13. Анализ уравнения Гиббса
14.
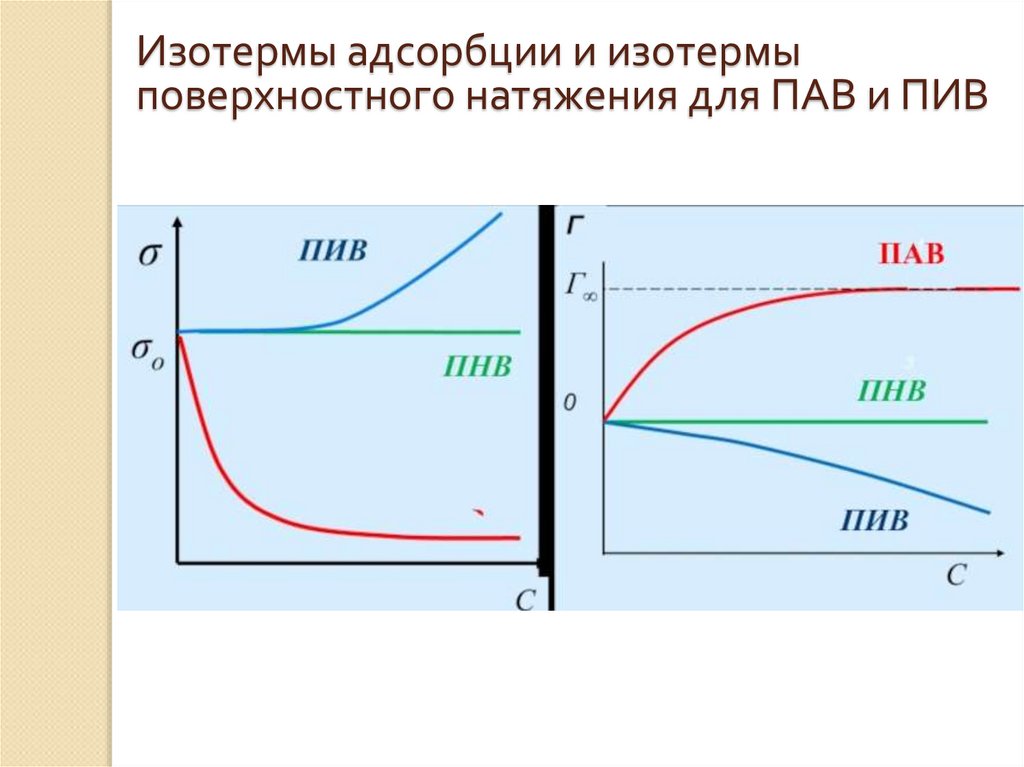
Изотермы адсорбции и изотермыповерхностного натяжения для ПАВ и ПИВ
15. Сравнительная характеристика ПАВ и ПИВ
Поверхностно-активные веществаа) σПАВ < σ0;
б) ПАВ сравнительно малорастворимы и менее полярны, чем чистый
растворитель;
в) Молекулы ПАВ имеют дифильное строение, т.е. состоят из
гидрофильной (полярная группа) и гидрофобной (углеводородная цепь,
радикал) группировок – полярные органические вещества. В качестве
полярных групп могут выступать: -OH, -COOH, -NH2, -CN, -NO, -CHO, SO2H.
Поверхностно-инактивные вещества
а) σПИВ > σ0;
б) ПИВ хорошо растворимы в растворителе и более полярны, чем чистый
растворитель;
в) ПИВ – электролиты, ионы которых окружены сольватной оболочкой,
препятствующей выходу иона в поверхностный слой.
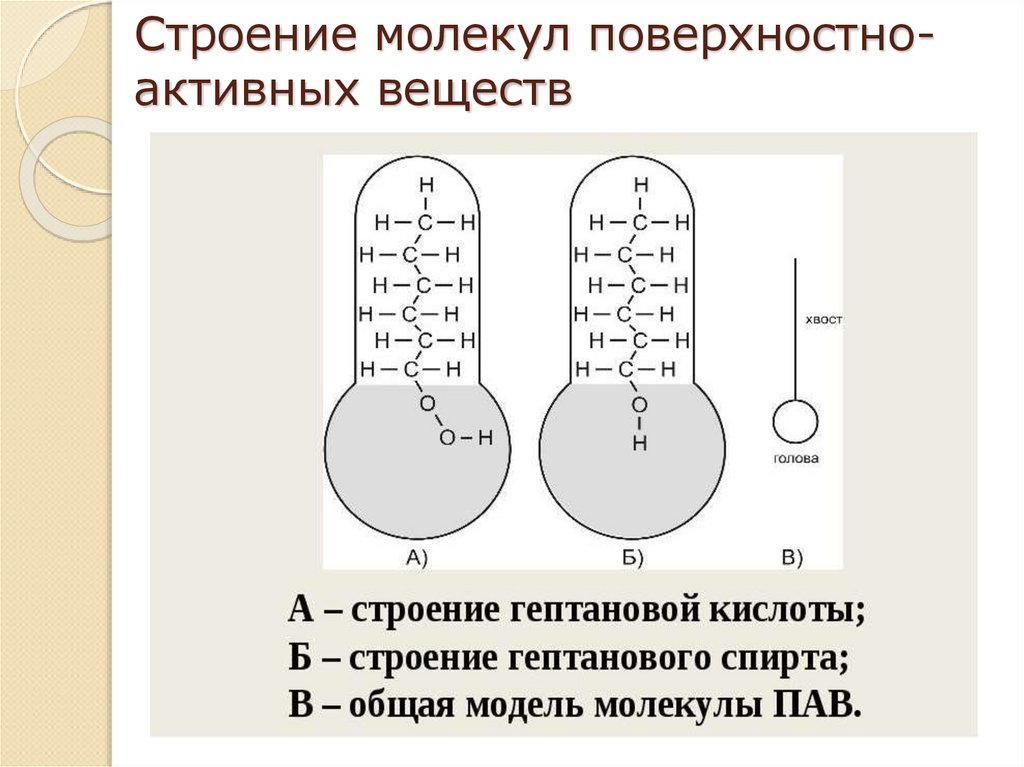
16. Строение молекул поверхностно-активных веществ
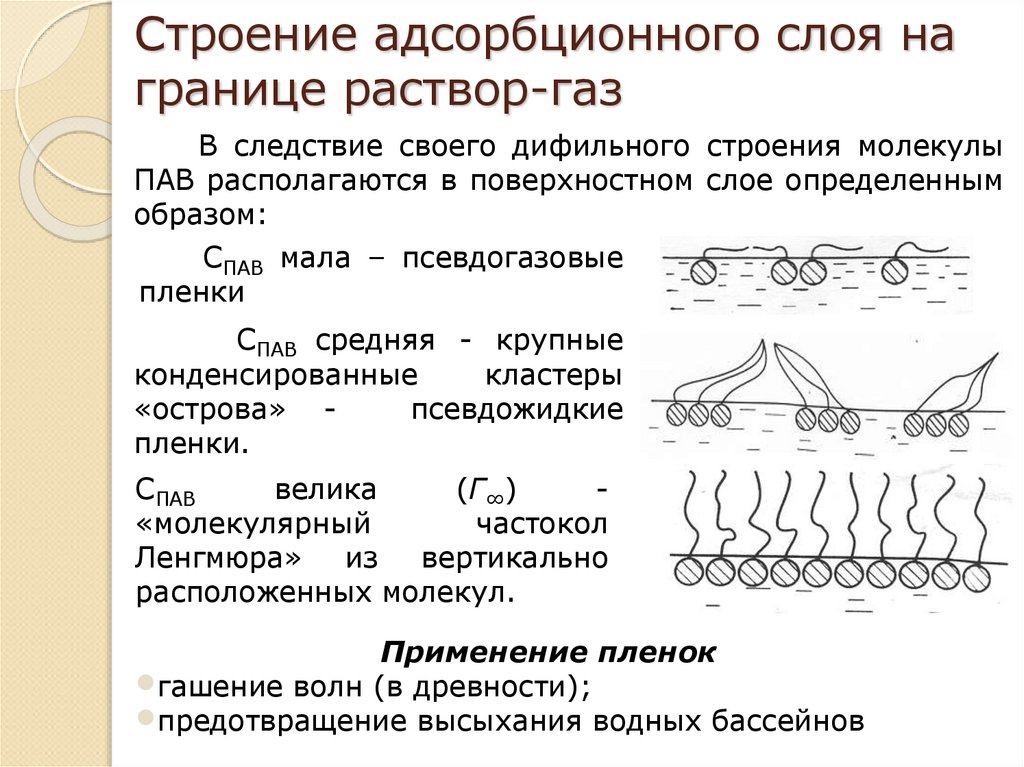
Строение молекул поверхностноактивных веществ17. Строение адсорбционного слоя на границе раствор-газ
В следствие своего дифильного строения молекулыПАВ располагаются в поверхностном слое определенным
образом:
СПАВ мала – псевдогазовые
пленки
СПАВ средняя - крупные
конденсированные
кластеры
«острова» псевдожидкие
пленки.
СПАВ
велика
(Г∞)
«молекулярный
частокол
Ленгмюра» из вертикально
расположенных молекул.
Применение пленок
•гашение волн (в древности);
•предотвращение высыхания водных бассейнов
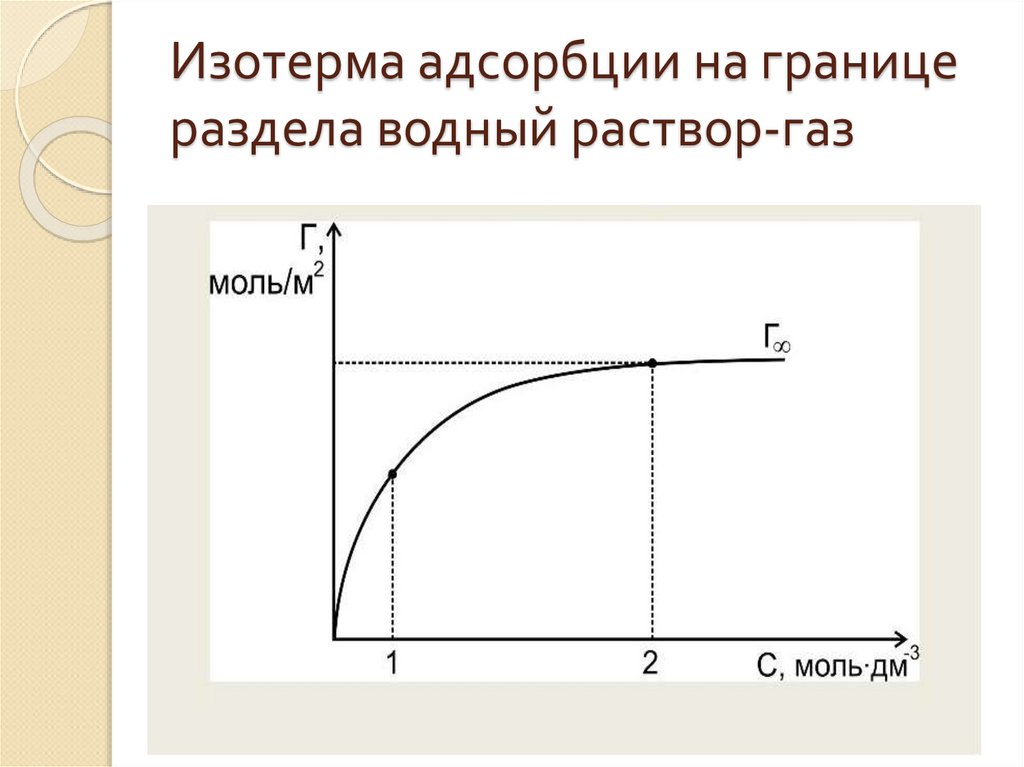
18. Изотерма адсорбции на границе раздела водный раствор-газ
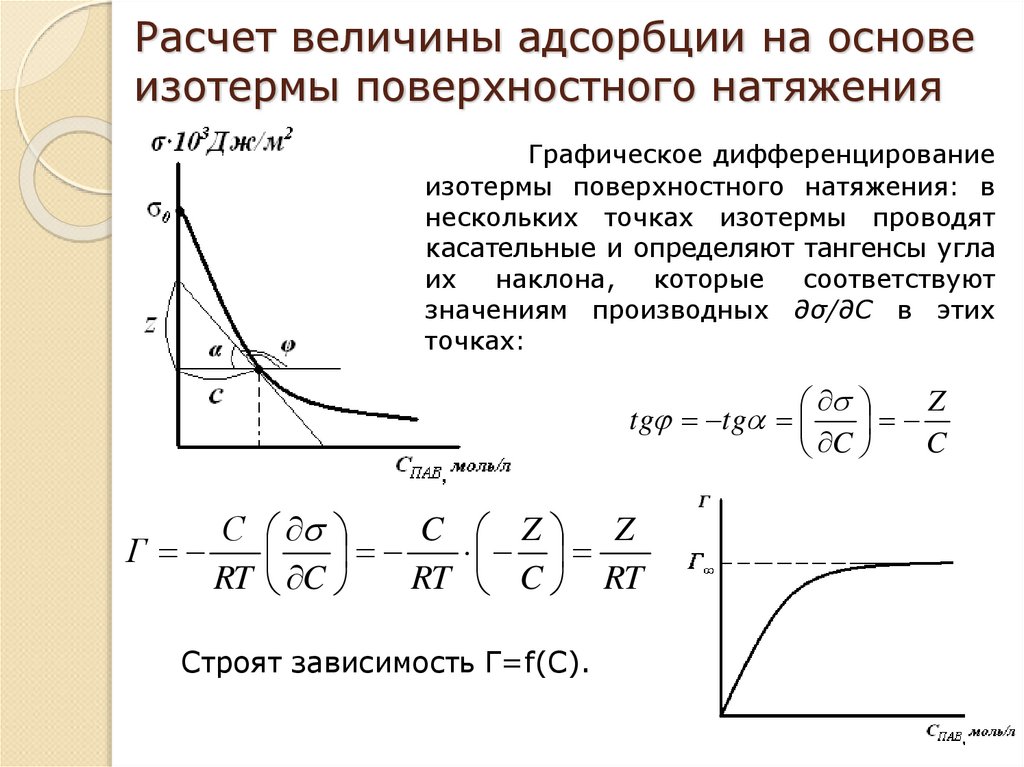
19. Расчет величины адсорбции на основе изотермы поверхностного натяжения
Графическое дифференцированиеизотермы поверхностного натяжения: в
нескольких точках изотермы проводят
касательные и определяют тангенсы угла
их
наклона,
которые
соответствуют
значениям производных ∂σ/∂С в этих
точках:
Z
tg tg
C
C
С
C Z Z
Г
RT C
RT C RT
Строят зависимость Г=f(C).
20. Применимость уравнения Ленгмюра к адсорбции на границе жидкость-газ. Расчет молекулярных параметров ПАВ.
1. Уравнение Лэнгмюраприводят к линейному
виду:
С
1
1
С
Г
Г К Г
2. Строят изотерму
адсорбции в линейных
координатах:
3. Определяют параметры
К и Г∞:
4. Определяют площадь
молекулы ПАВ в
поверхностном слое (S0):
5. Определяют длину
молекулы ПАВ - толщину
поверхностного слоя (δ):
S0
1
Г N A
Г М
21.
Эмпирическое уравнениеБ.А.Шишковского (1908)
0 kC
СПАВ мала:
СПАВ средние:
0 В ln( 1 AC)
где: В - константа для всего гомологического ряда, А – константа
для данного ПАВ.
Чтобы выяснить физический смысл констант в уравнении
Шишковского, продифференцируем уравнение по концентрации:
d ( 0 ) d [ B ln( 1 AC )]
dC
dC
d
AB
dC 1 AC
d
1
B
A
dC
1 AC
Уравнение Шишковского в
дифференциальной форме
22.
Подставим уравнение Шишковского в дифференциальнойформе в уравнение Гиббса:
С
С
BA B
AC
Г
RT С
RT 1 AC RT 1 AC
Отсюда: А = К,
В = Г∞RT.
Физический смысл констант в уравнении Шишковского
•константа В определяет предельную адсорбцию (независимо
от длины углеводородного радикала в гомологическом ряду,
каждая молекула занимает одну и туже площадь в
поверхностном слое);
•константа А - равновесный характер адсорбции (константа
равновесия).
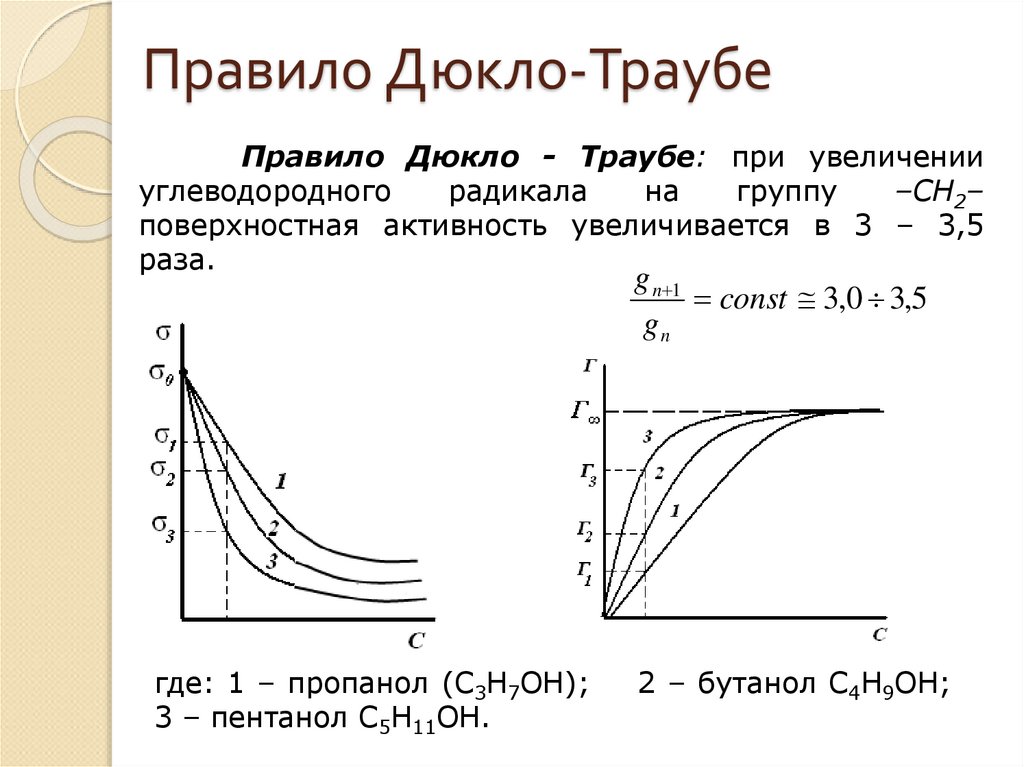
23. Правило Дюкло-Траубе
Правило Дюкло - Траубе: при увеличенииуглеводородного
радикала
на
группу
–СН2–
поверхностная активность увеличивается в 3 – 3,5
раза.
g n 1
const 3,0 3,5
gn
где: 1 – пропанол (С3Н7ОН);
3 – пентанол С5Н11ОН.
2 – бутанол С4Н9ОН;
24. Границы применимости правила Дюкло-Траубе
1. Выполняется только для полярногорастворителя. Если растворитель не полярный,
то с увеличением углеводородного радикала
поверхностная активность ПАВ уменьшается
(обращение правила).
2.
Применимо
в
области
малых
концентраций ПАВ в растворе (если «частокол
Лэнгмюра», то с увеличением длины радикала
количество ПАВ
в поверхностном слое не
меняется).
3. Правило выполняется при комнатной
температуре, т.к. с увеличением температуры
происходит десорбция ПАВ в объем раствора.
4. Не выполняется на тонкопористых
адсорбентах.
25.
Работа адсорбцииРабота адсорбции (Wадс) – работа перемещения 1 моль ПАВ
из объема раствора в поверхностный слой при Т=const.
Wадс G S RT ln K
где: ΔGS – свободная поверхностная энергия, К – константа
адсорбционного равновесия.
Рассчитаем разность работ адсорбции для двух соседних членов
гомологического ряда:
W2 W1 RT ln K n 1 RT ln K n RT ln
K n 1
8,314 298 ln 3,5 3000 Дж / моль
Kn
Таким образом, для перевода каждой –СН2– группы из
поверхностного слоя в объемную фазу надо затратить около 3 кДж/моль
работы.
25
26.
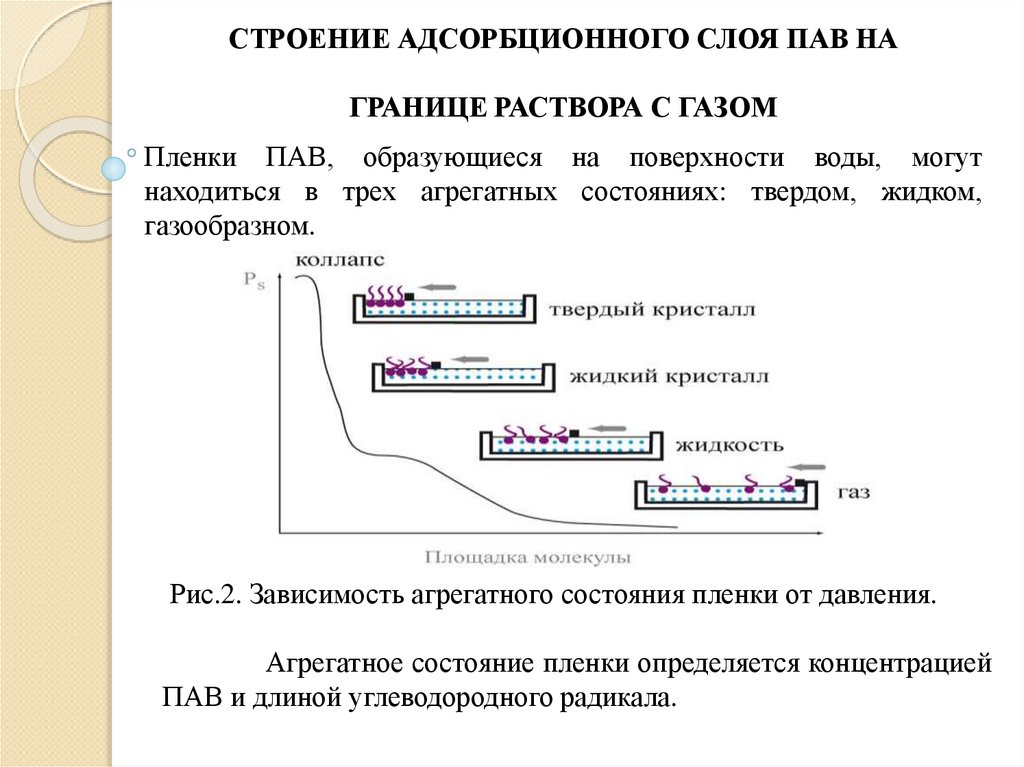
СТРОЕНИЕ АДСОРБЦИОННОГО СЛОЯ ПАВ НАГРАНИЦЕ РАСТВОРА С ГАЗОМ
Пленки ПАВ, образующиеся на поверхности воды, могут
находиться в трех агрегатных состояниях: твердом, жидком,
газообразном.
Рис.2. Зависимость агрегатного состояния пленки от давления.
Агрегатное состояние пленки определяется концентрацией
ПАВ и длиной углеводородного радикала.
27.
УРАВНЕНИЕ СОСТОЯНИЯ ДВУМЕРНОГО ГАЗАВ двумерном газе действует поверхностное давление, которое
является
растягивающим,
в
противоположность
поверхностному
натяжению, сжимающему поверхность. Это давление равно
0
При малом содержании ПАВ, т.е. в состоянии двумерного газа
После дифференцирования получим:
0 K C
d d K dC
Подставим уравнение (1) в уравнение Гиббса:
C
d
C K
Г
R T dC
R T
R T
Площадь, занимаемую одним молем ПАВ, обозначим через s м . Тогда
1
Г
sм
1
sм R T
sм R T
Это уравнение состояния двумерного газа аналогично уравнению
состояния идеального газа
P V R T
28.
Уравнение ФрумкинаДля
реального
двумерного
газа
справедливо
уравнение
Фрумкина,
аналогичное уравнению Ван-дер Ваальса:
(
s
2
м
) (s м ) R T
- константа взаимодействия молекул ПАВ в
поверхностном слое,
- эффективная площадь сечения молекулы.
29.
ДИАГРАММЫ СОСТОЯНИЯПОВЕРХНОСТНЫХ ПЛЕНОК
Фазовое состояние поверхностных пленок
описывается диаграммой состояния или
изотермой сжатия, которая может быть
построена в координатах
Каждое
состояние
монослоя
характеризуется s м
, которая
определяется ориентацией молекул, и
зависит от адгезионных и когезионных
свойств системы.
a
Участки:
- соответствует двумерному газу
b
- конденсация растянутой жидкой пленкой
c
- сжатие пленки
d
- фазовый переход
e - конденсированная (твердая) пленка
f
- разрушение мономолекулярной пленки
30.
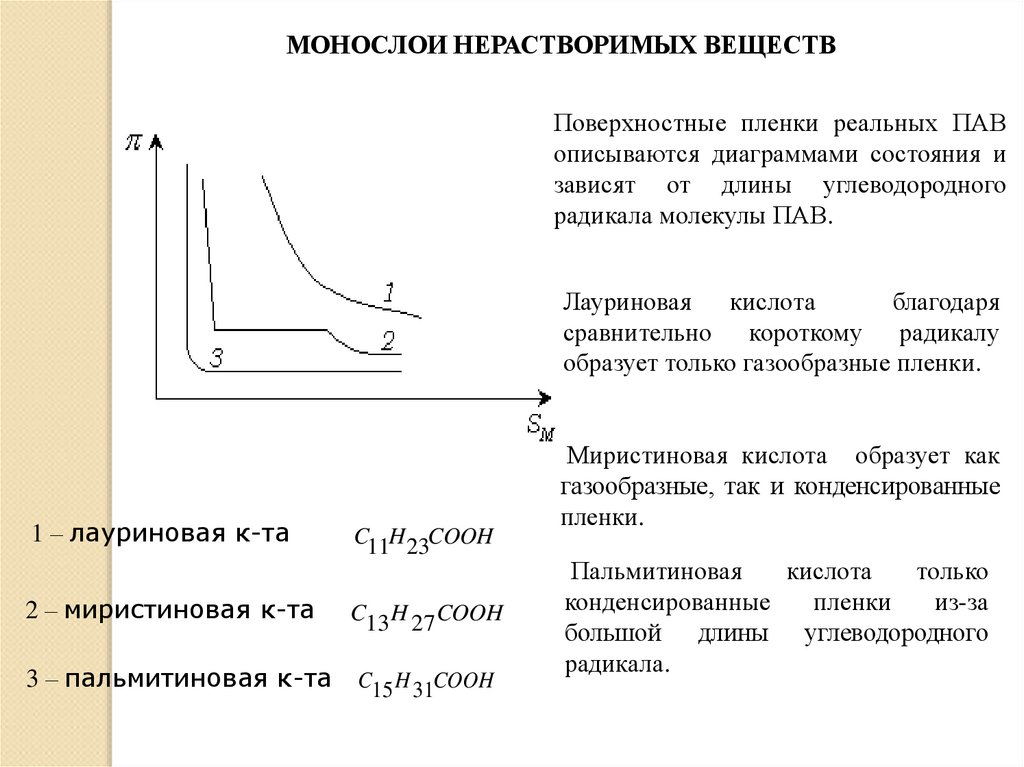
МОНОСЛОИ НЕРАСТВОРИМЫХ ВЕЩЕСТВПоверхностные пленки реальных ПАВ
описываются диаграммами состояния и
зависят от длины углеводородного
радикала молекулы ПАВ.
Лауриновая кислота
благодаря
сравнительно короткому радикалу
образует только газообразные пленки.
1 – лауриновая к-та
2 – миристиновая к-та
C11H 23COOH
C13 H 27 COOH
3 – пальмитиновая к-та C15 H 31COOH
Миристиновая кислота образует как
газообразные, так и конденсированные
пленки.
Пальмитиновая
кислота
только
конденсированные
пленки
из-за
большой длины углеводородного
радикала.



















 chemistry
chemistry








