Similar presentations:
Коллоидная химия. Мономолекулярная адсорбция Ленгмюра
1. Коллоидная химия
Коллоидная система – это микрогетерогенная система,состоящая из двух и более фаз.
Дисперсионная среда
Дисперсная фаза
Дисперсность (D) – раздробленность частиц
1
D
a
а – диаметр частиц
Свободная поверхностная энергия – избыточная энергия
поверхностного слоя
GS S
– поверхностное натяжение
S – площадь поверхности
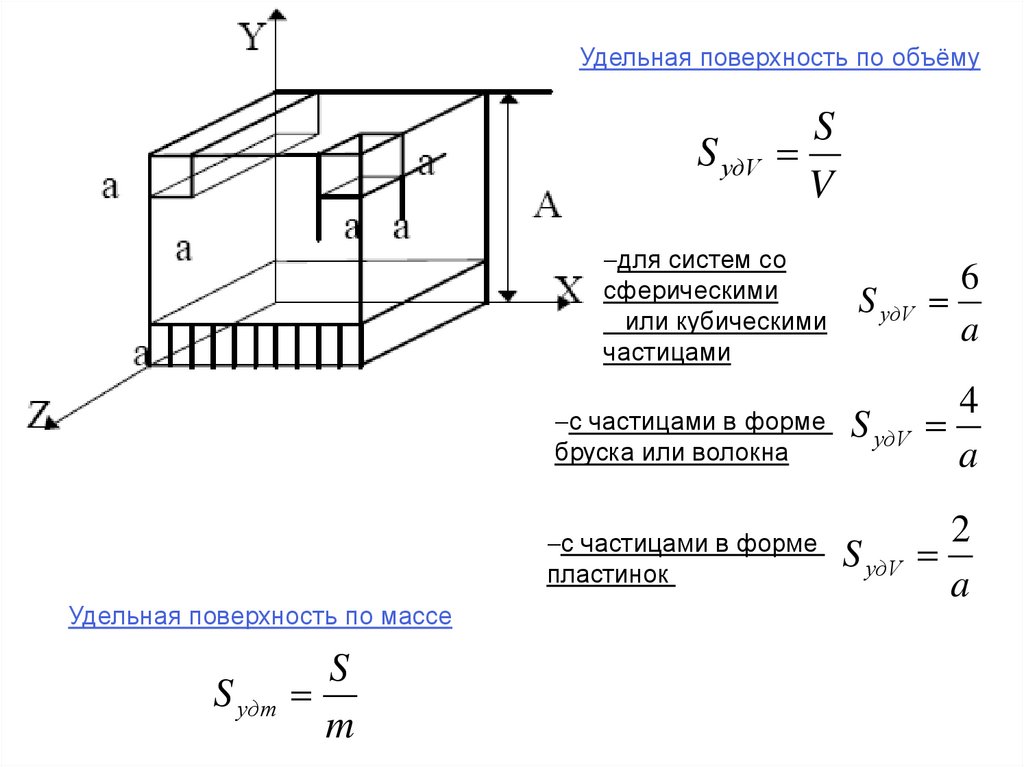
2.
Удельная поверхность по объёмуS
S удV
V
Удельная поверхность по массе
S
S удm
m
для систем со
сферическими
или кубическими
частицами
6
S удV
a
с частицами в форме
бруска или волокна
4
S удV
a
с частицами в форме
пластинок
2
S удV
a
3. Классификация коллоидных систем
• по размеруКоллоидные системы
Размер частиц, см
Грубодисперсные
10-4
Системы промежуточной дисперсии
10-4 – 10-5
Высокодисперсные системы
10-5 – 10-7
• по межфазному взаимодействию
Лиофильные системы – сильное взаимодействие между
средой и фазой
Лиофобные системы – отсутствуют взаимодействия между
средой и фазой
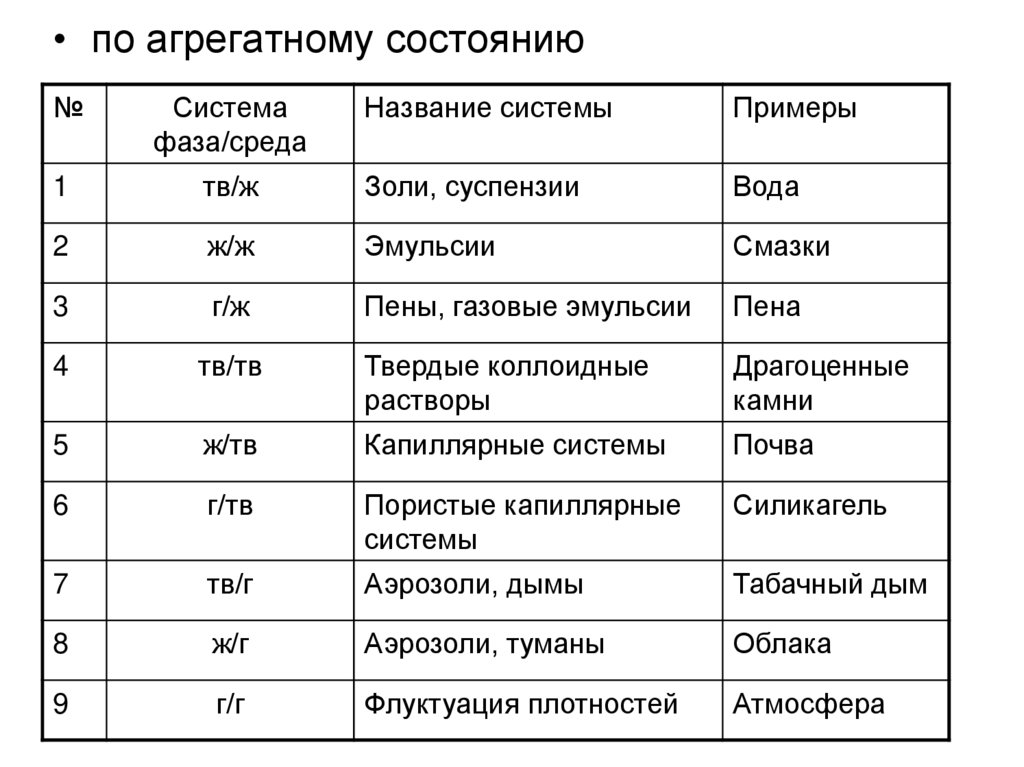
4.
• по агрегатному состоянию№
Система
фаза/среда
Название системы
Примеры
1
тв/ж
Золи, суспензии
Вода
2
ж/ж
Эмульсии
Смазки
3
г/ж
Пены, газовые эмульсии
Пена
4
тв/тв
Твердые коллоидные
растворы
Драгоценные
камни
5
ж/тв
Капиллярные системы
Почва
6
г/тв
Пористые капиллярные
системы
Силикагель
7
тв/г
Аэрозоли, дымы
Табачный дым
8
ж/г
Аэрозоли, туманы
Облака
9
г/г
Флуктуация плотностей
Атмосфера
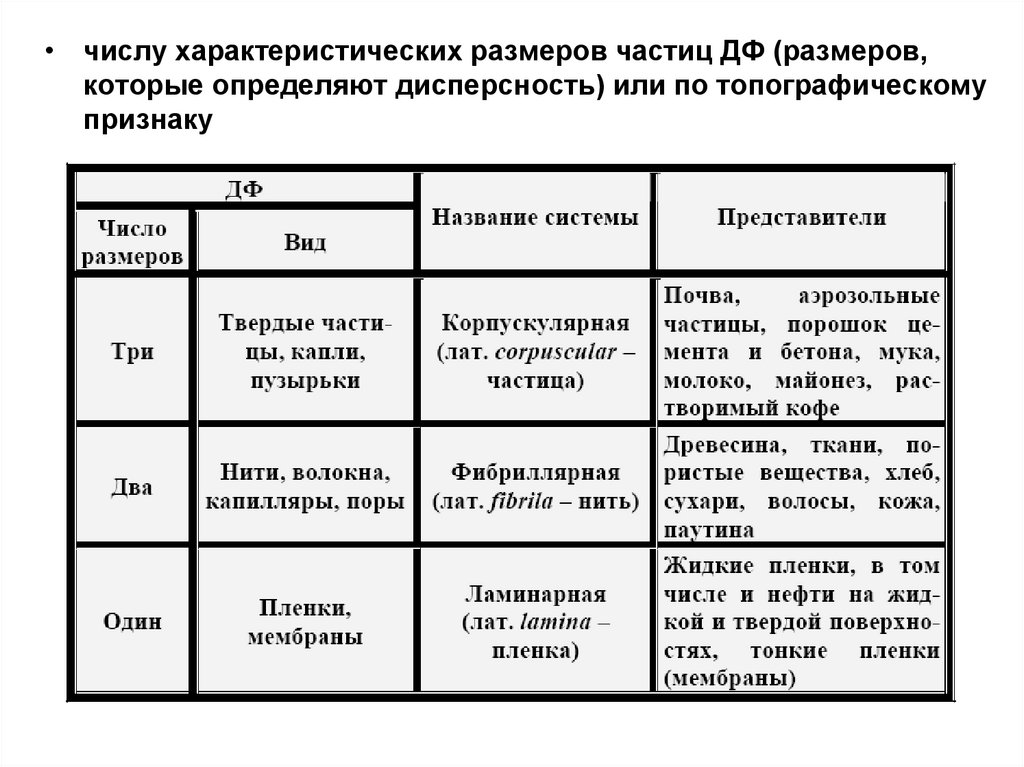
5.
• числу характеристических размеров частиц ДФ (размеров,которые определяют дисперсность) или по топографическому
признаку
6.
• по степени взаимодействия частиц ДФ1.
Свободнодисперсные, в которых частицы ДФ не связаны между
собой и могут свободно перемещаться. Такие системы не
оказывают сопротивления сдвиговому усилию, обладают
текучестью и всеми остальными свойствами, характерными для
обычных жидкостей. Вязкость их определяется в основном
вязкостью дисперсионной среды. Это аэрозоли, разбавленные
суспензии и эмульсии, лиозоли.
2. Связнодисперсные, в которых одна из фаз структурно закреплена
и не может перемещаться свободно. Частицы образуют сплошной
пространственный каркас. К этому классу относятся гели и студни,
пены, капиллярнопористые тела, твердые растворы.
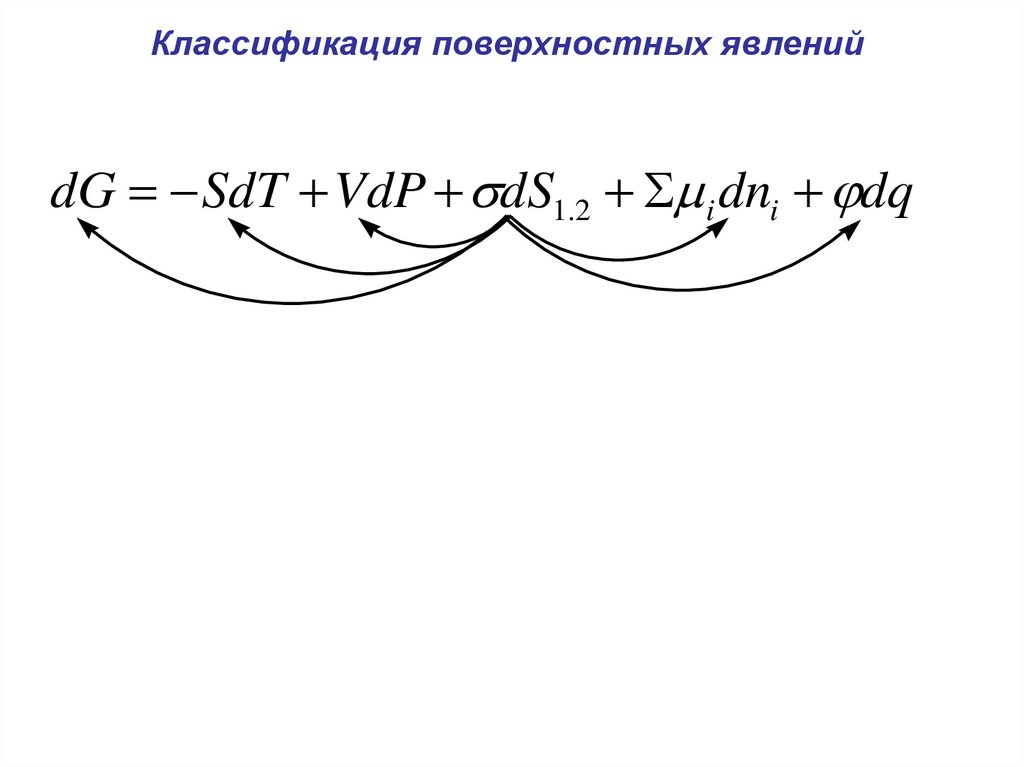
7.
Классификация поверхностных явленийdG SdT VdP dS1.2 i dni dq
8. поверхностное натяжение
9.
Уравнение ЭтвешаУравнение Сагдена
Уравнение Гиббса — Гельмгольца
10. Адгезия, Когезия
Wа = σ12 + σ 13– σ32 (уравнение Дюпре)Wк = 2σ12
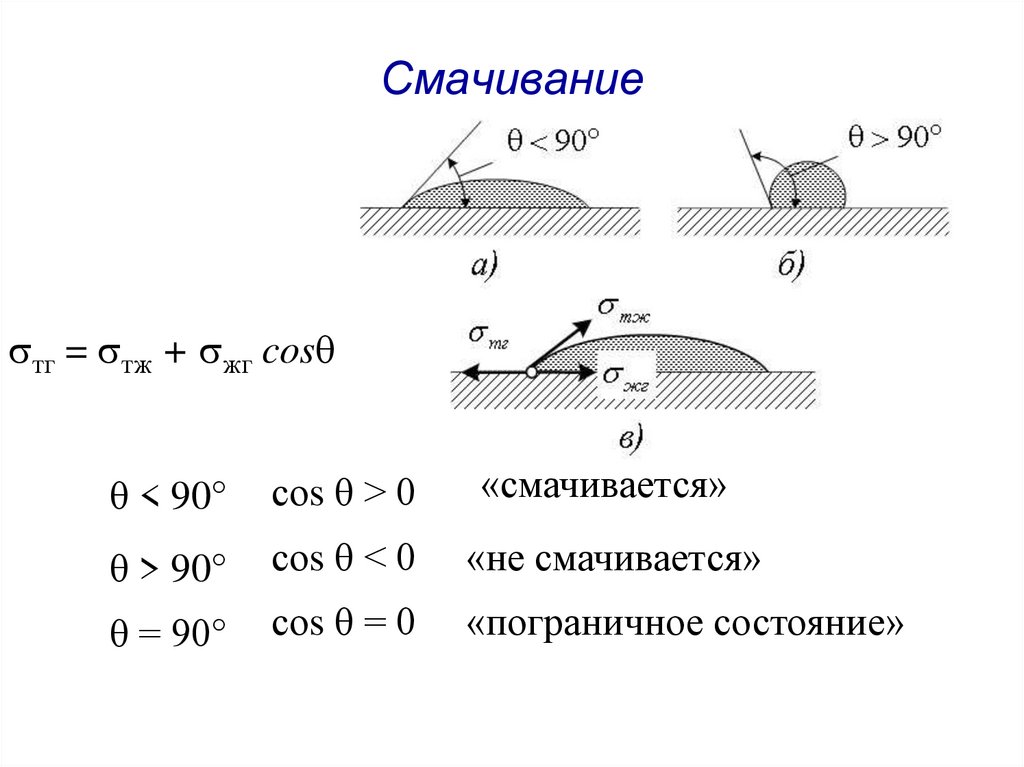
11. Смачивание
тг = тж + жг cosзакон Юнга
θ < 90°
соs θ > 0
«смачивается»
θ > 90°
соs θ < 0
«не смачивается»
θ = 90°
соs θ = 0
«пограничное состояние»
12.
уравнение Дюпре — ЮнгаWa = 21 (1 + cos )
Растекание жидкости
σ3,1 σ2,3 + σ2,1
Wa Wk
f = σ3,1 - σ2,3 - σ2,1
f = Wa - Wk
коэффициент растекания
по Гаркинсу
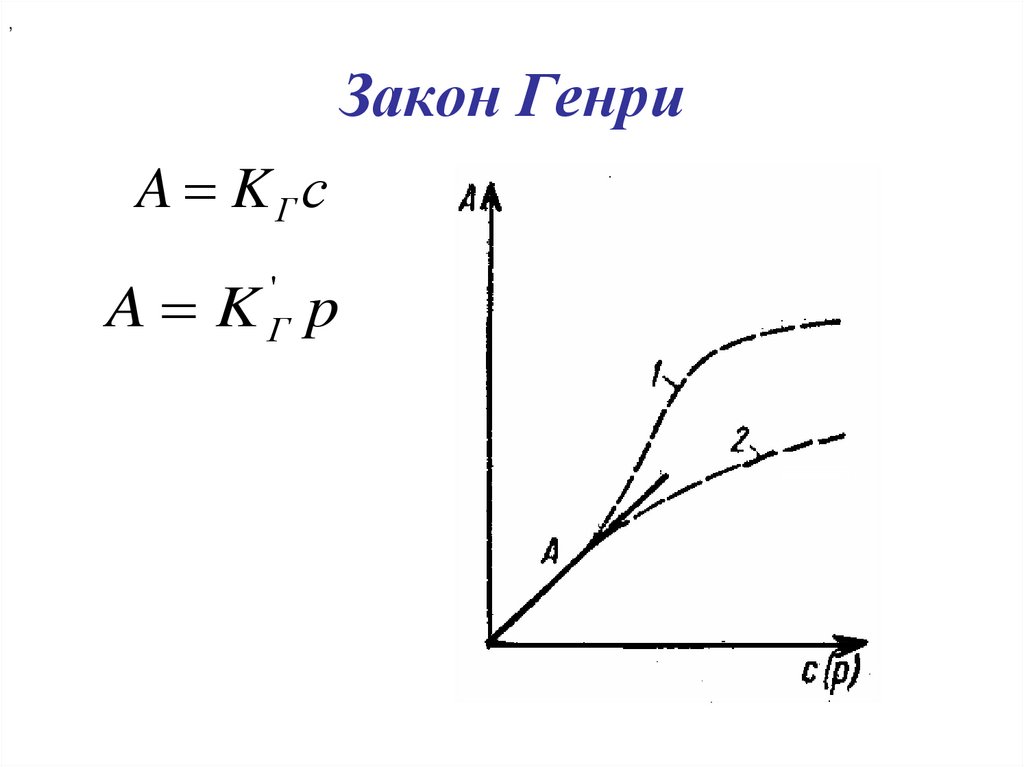
13. Закон Генри
,Закон Генри
A KГс
A K p
'
Г
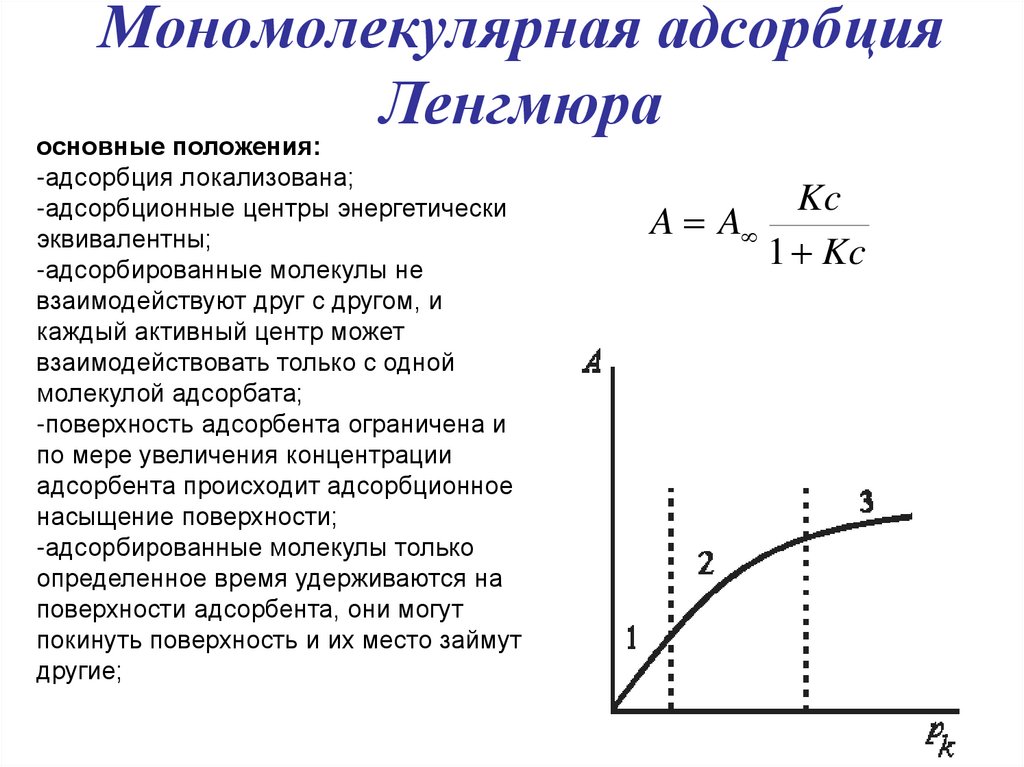
14. Мономолекулярная адсорбция Ленгмюра
основные положения:-адсорбция локализована;
-адсорбционные центры энергетически
эквивалентны;
-адсорбированные молекулы не
взаимодействуют друг с другом, и
каждый активный центр может
взаимодействовать только с одной
молекулой адсорбата;
-поверхность адсорбента ограничена и
по мере увеличения концентрации
адсорбента происходит адсорбционное
насыщение поверхности;
-адсорбированные молекулы только
определенное время удерживаются на
поверхности адсорбента, они могут
покинуть поверхность и их место займут
другие;
Kc
A A
1 Kc
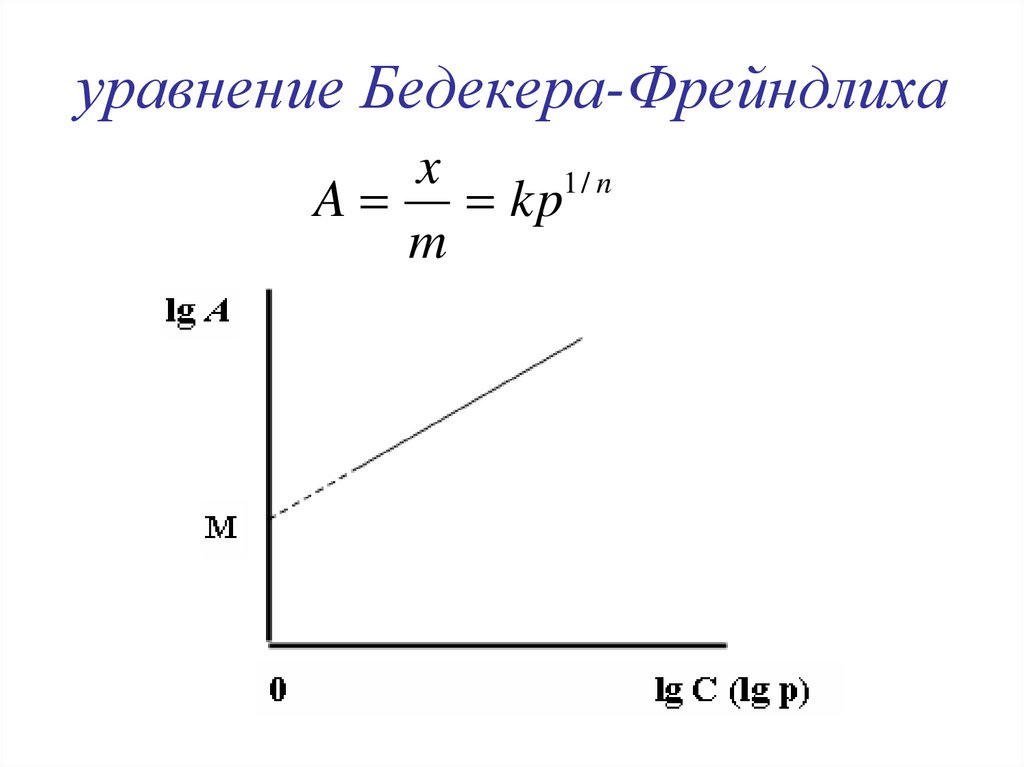
15. уравнение Бедекера-Фрейндлиха
x1/ n
A kp
m
16. Гиббсовская адсорбция
d Г i d ic d
RT dc
фундаментальное
адсорбционное уравнение
Гиббса
P d
RT dP
g
RT Г
c c 0
c c 0
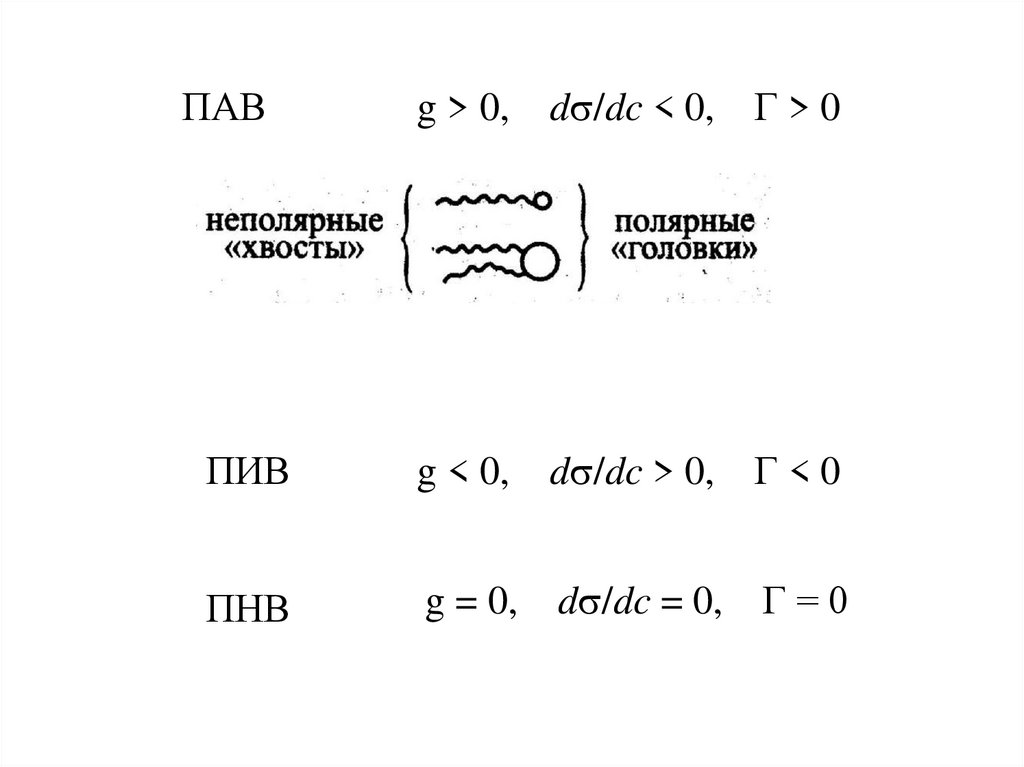
17.
ПАВg > 0,
d /dc < 0,
Г>0
ПИВ
g < 0,
d /dc > 0,
Г<0
ПНВ
g = 0, d /dc = 0, Г = 0
18.
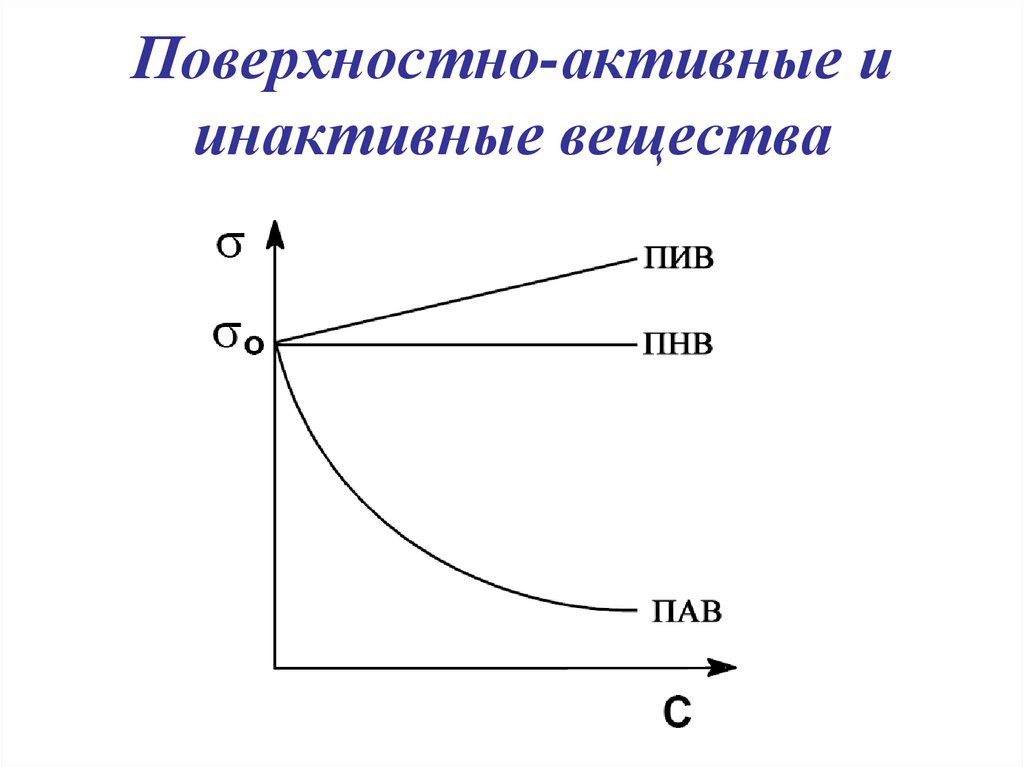
19. Поверхностно-активные и инактивные вещества
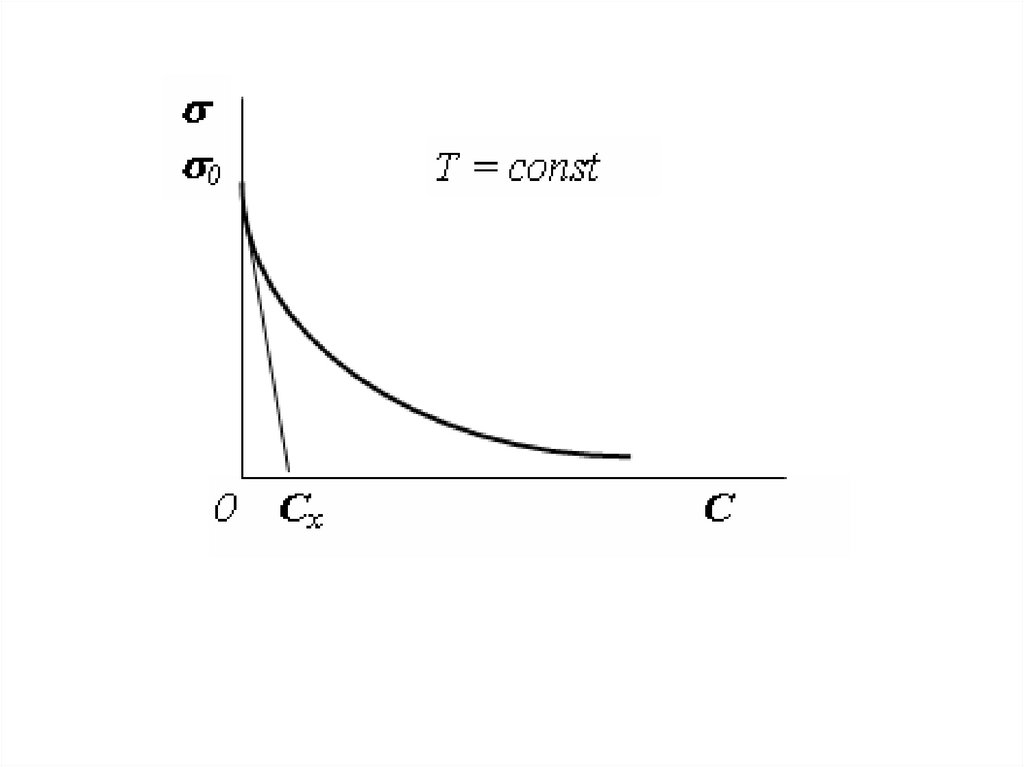
20. уравнение Шишковского
Kcc d
à A
1 Kc
RT dc
Kdc
d A RT
1 Kc
c
Kdc
d A RT 0 1 Kc
0
0 A RT ln 1 Kc
21.
22.
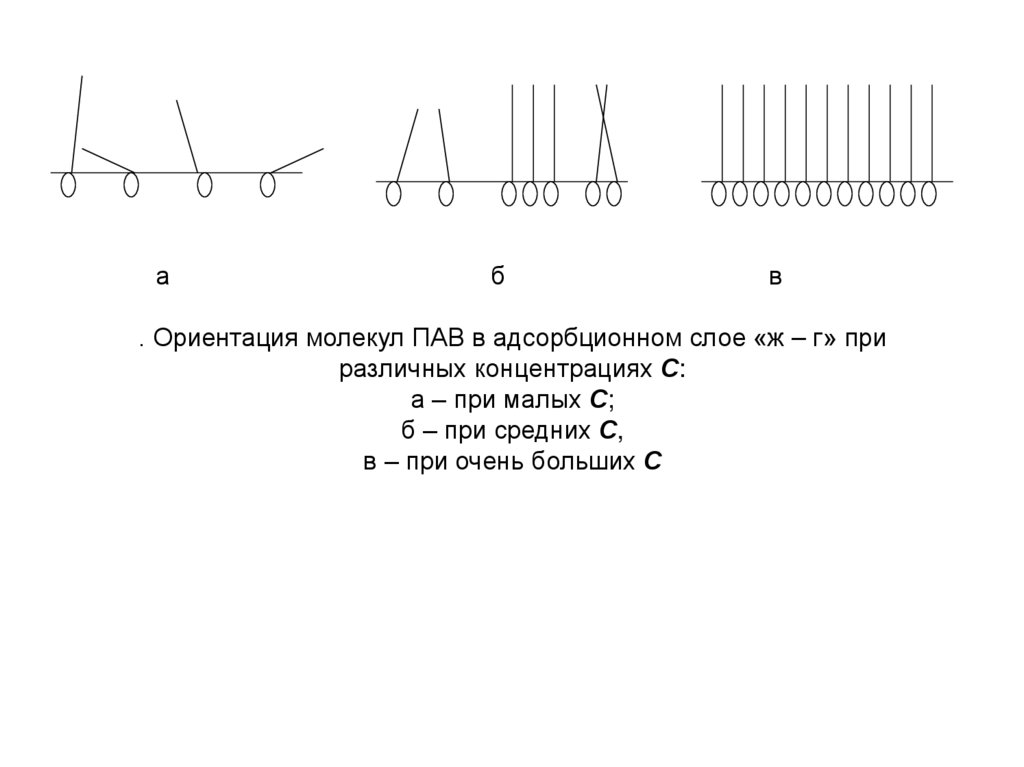
аб
в
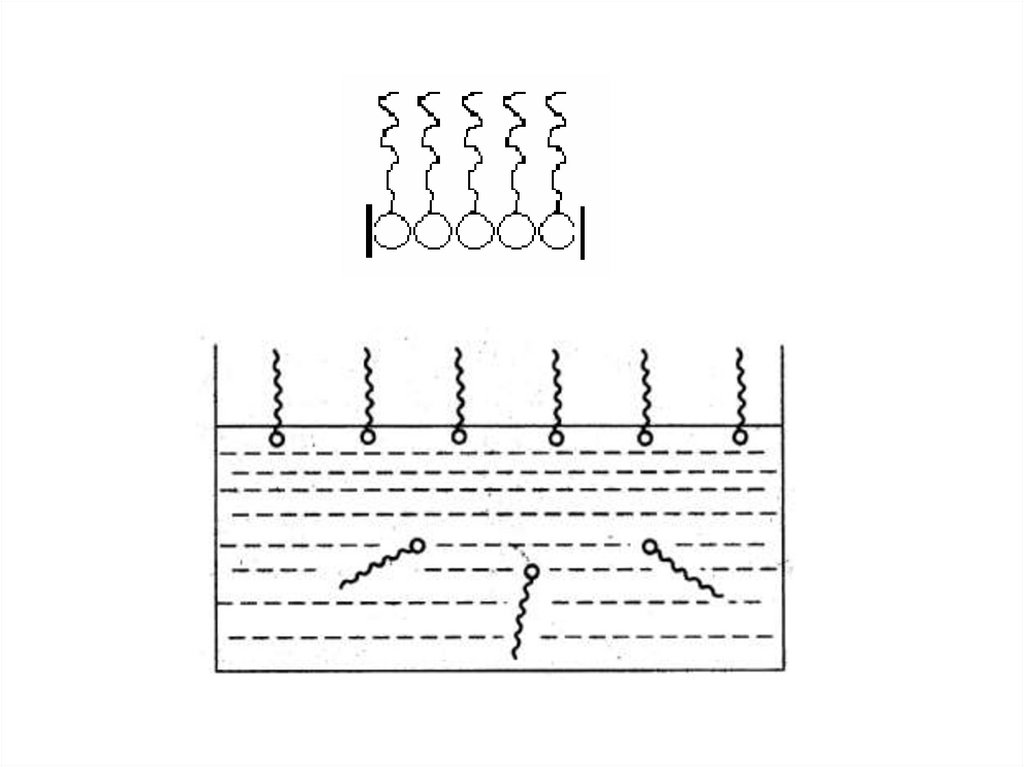
. Ориентация молекул ПАВ в адсорбционном слое «ж – г» при
различных концентрациях С:
а – при малых С;
б – при средних С,
в – при очень больших С
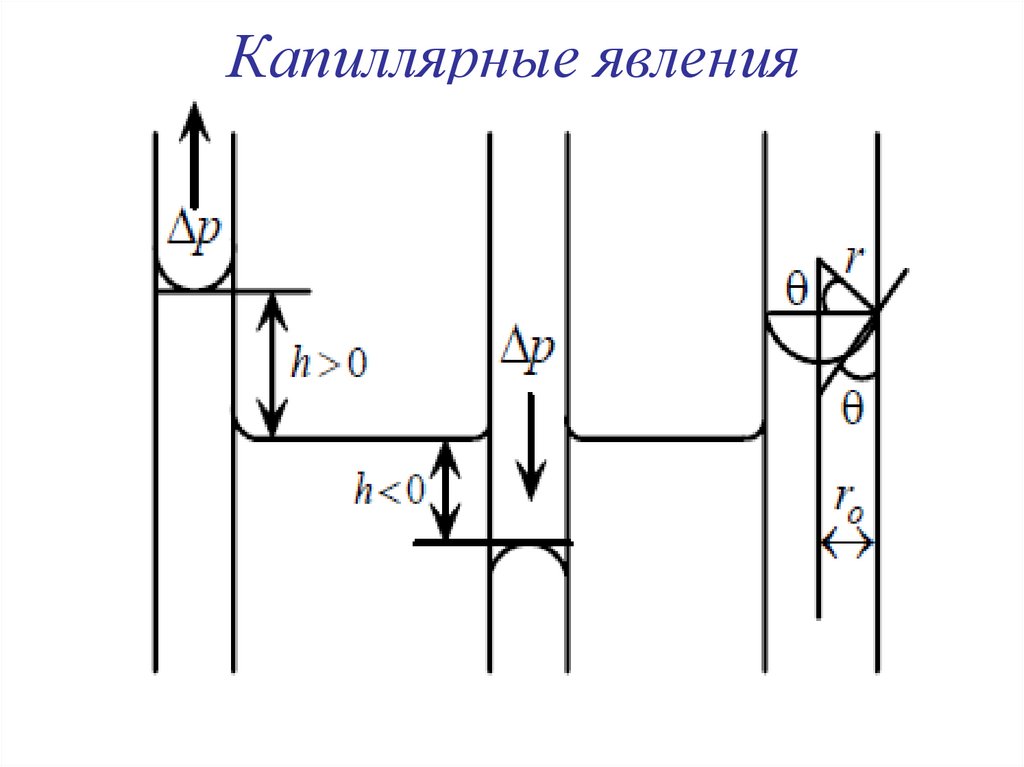
23. Капиллярные явления
24.
давление ЛапласаУравнение Жюрена
25.
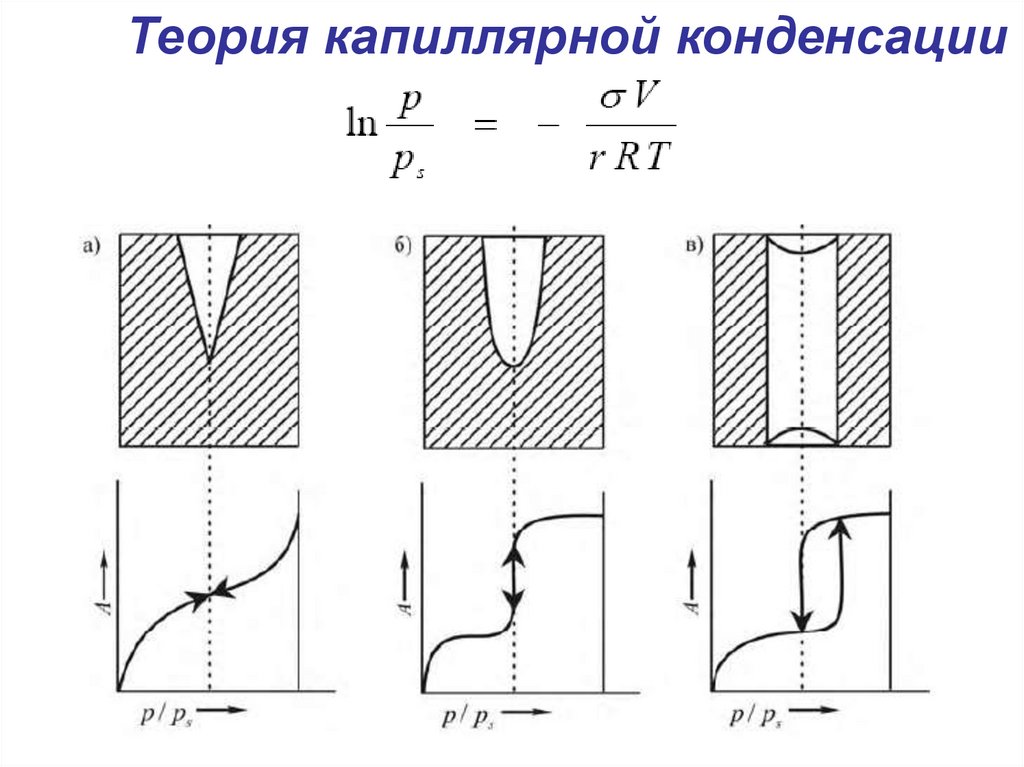
уравнение Кельвина (Томсона)2 V м
pr
ln
p
rRT
26.
Теория капиллярной конденсации27. Теория Поляни
• Основные постулаты:• Адсорбция обусловлена исключительно
физическими силами взаимодействия.
• На поверхности адсорбента нет активных
центров, а адсорбционные силы образуют
непрерывное силовое поле.
• Адсорбционные силы действуют на
расстояниях, бóльших, чем размеры
отдельных молекул, и образуют
адсорбционный объем.
• Действие адсорбционных сил по мере
удаления от поверхности уменьшается и на
некотором расстоянии становится равным
нулю.
• Притяжение данной молекулы поверхностью
адсорбента не зависит от наличия в
адсорбционном пространстве других молекул,
вследствие чего возможна полимолекулярная
адсорбция.
28. Теория полимолекулярной адсорбции БЭТ
Основные положения:На поверхности адсорбента имеется определенное число активных
центров.
Взаимодействием адсорбированных молекул в первом и последующих
слоях пренебрегают.
Каждая молекула первого слоя может стать активным центром для
адсорбции образования последующих слоев.
Предполагается, что во втором и последующих слоях все молекулы
имеют такую же сумму статистических состояний, как и жидкости.
29. Ионная адсорбция
лиотропные ряды или ряды ГофмейстераLi+<Na+ <К+ <Rb+< Cs+
Mg2+ < Са2+< Sr2+ <Ва2+
Cl-<Br- <NO3- <I- < NCS
К+ << Са2+ <<Al3+ <<Th4+
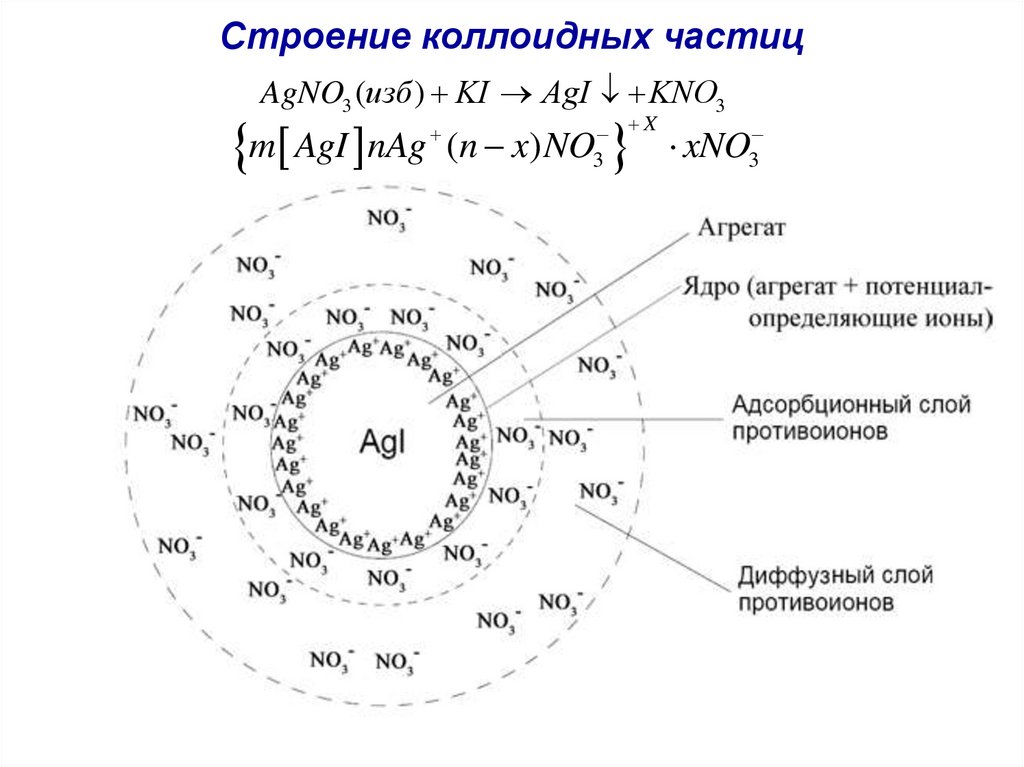
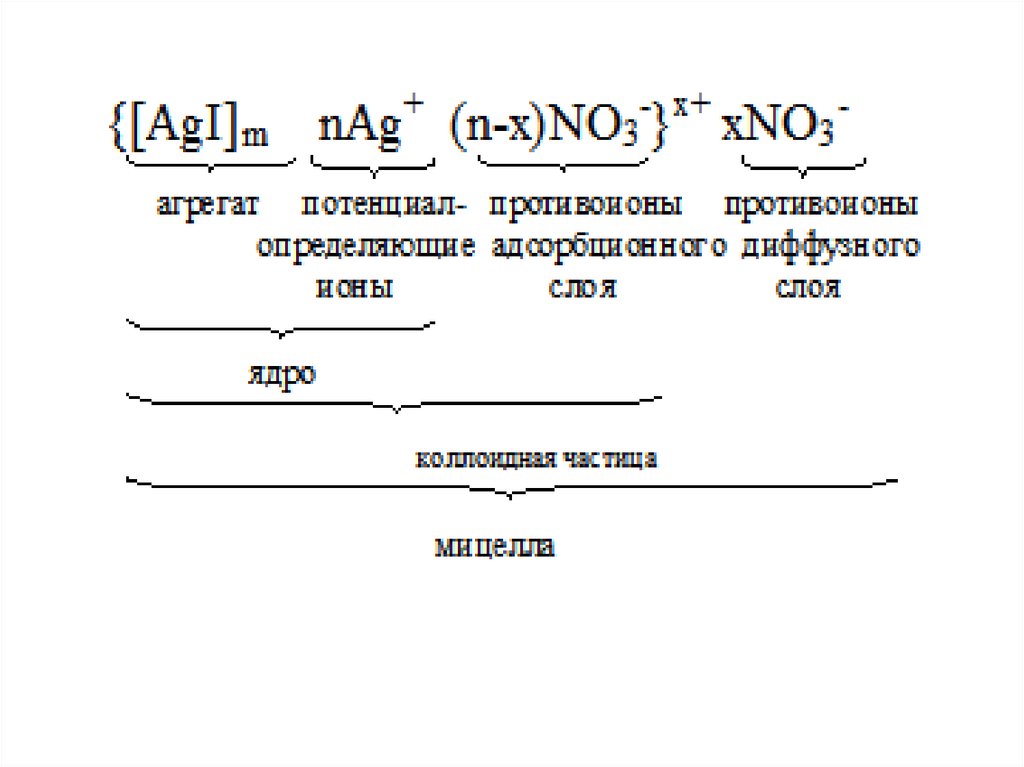
30. Строение коллоидных частиц
AgNO3 (изб ) KI AgI KNO3m AgI nAg (n x) NO
X
3
xNO3
31.
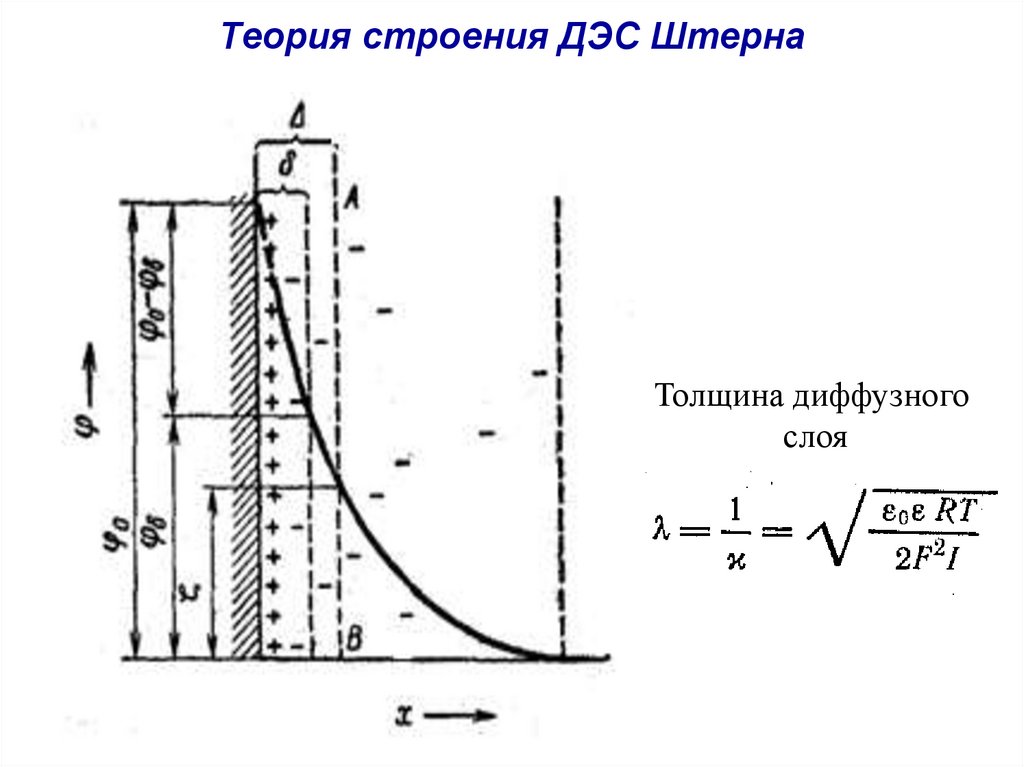
32. Теория строения ДЭС Штерна
Толщина диффузногослоя
33.
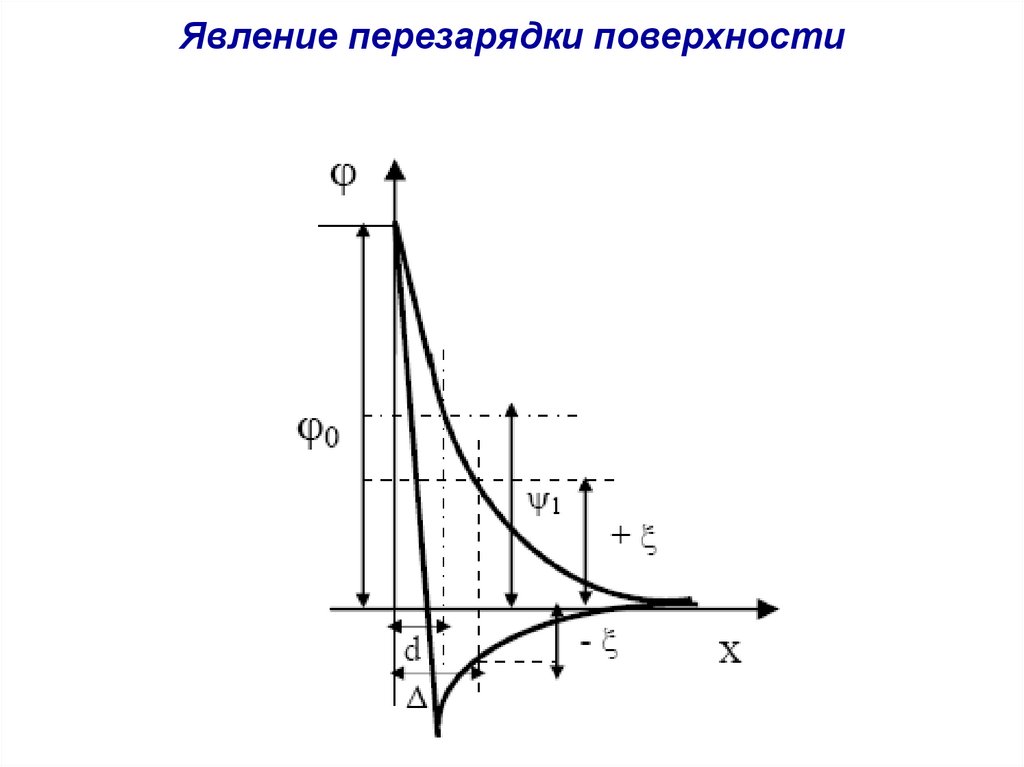
Явление перезарядки поверхности34.
уравнение Гельмгольца – СмолуховскогоЭлектрофоретическая
подвижность
Потенциал электроосмоса
0 I
Потенциал течения
U
0 p
35.
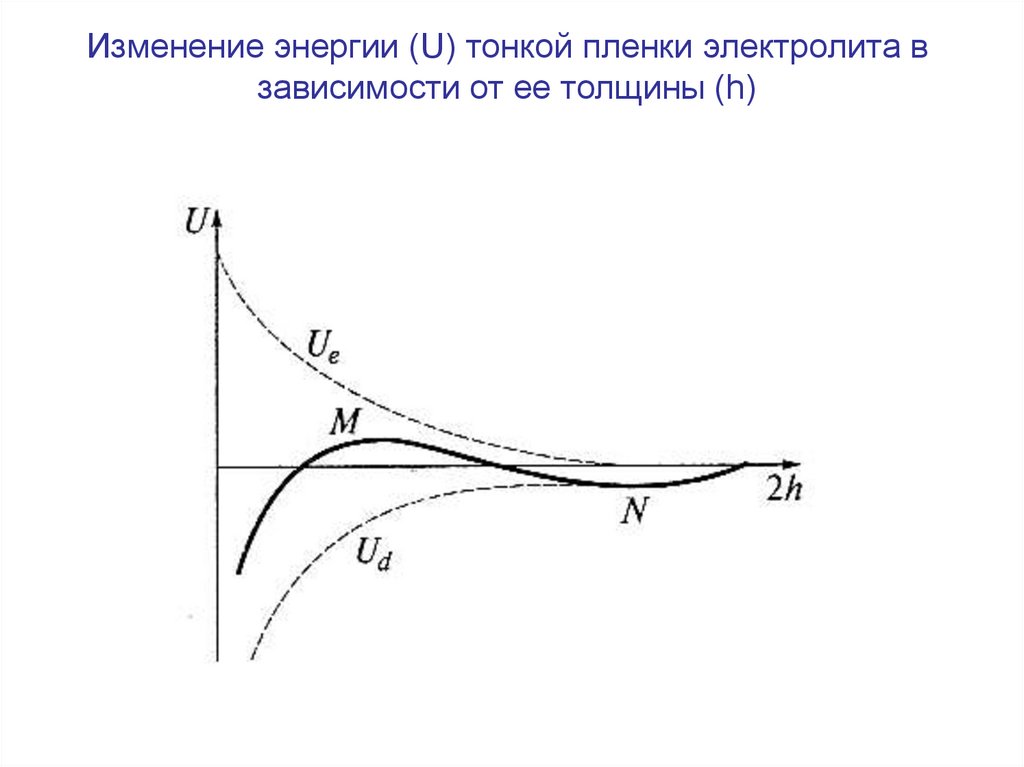
Изменение энергии (U) тонкой пленки электролита взависимости от ее толщины (h)















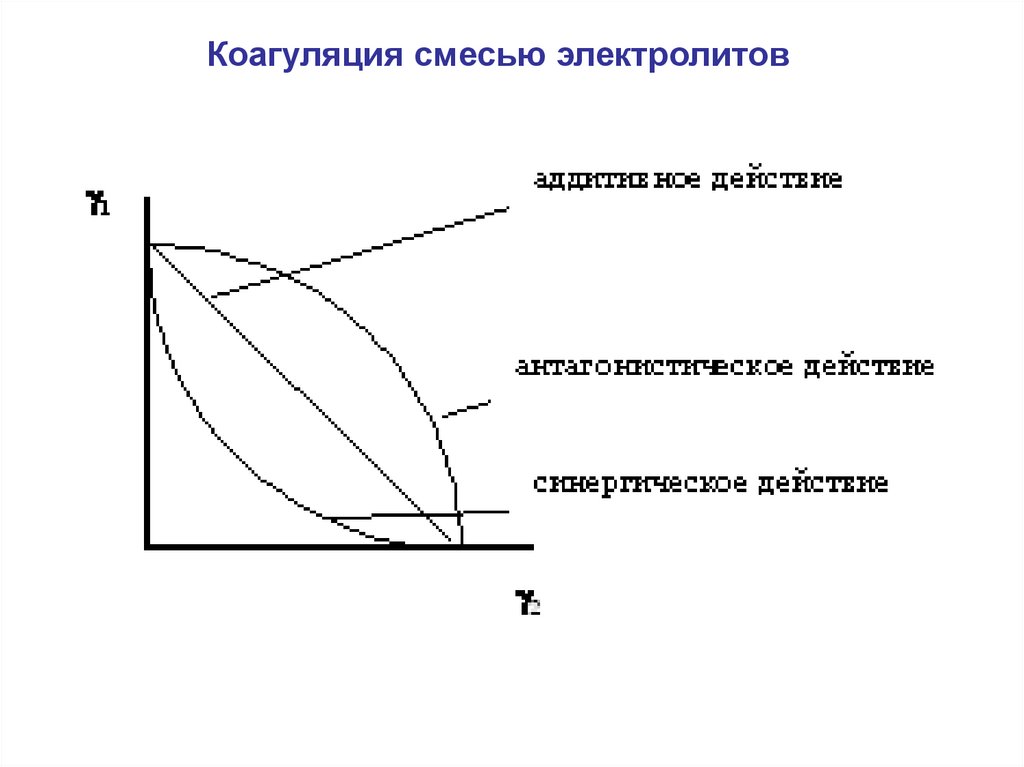

 chemistry
chemistry








