Similar presentations:
Адсорбция на границе раствор - газ
1.
Коллоидная химияЛекция 2
Адсорбция на границе раствор – газ.
Коллоидные ПАВ
.
Буканова Е.Ф.
Москва - 2020
2.
План лекции1.Понятие об адсорбции. Причины адсорбции. Количественные характеристики
адсорбции.
2. Вывод адсорбционного уравнения Гиббса для разбавленных растворов, его анализ.
3. Поверхностная активность по Ребиндеру. Графическое определение поверхностной
активности.
4. Влияние на адсорбцию на границе раствор-газ строения и размера молекул ПАВ.
Правило Траубе, его аналитическое выражение и физическое обоснование.
5. Строение адсорбционных пленок на жидкой поверхности. Диаграммы состояния
поверхностных пленок.
6. Вывод уравнение состояния двухмерного газа. Уравнение Фрумкина для реального
двухмерного газа.
7. Классификация ПАВ по химическому строению.
8. Коллоидные поверхностно - активные вещества. Мицеллообразование, строение
мицелл в водной и углеводородной среде.
9. Критическая концентрация мицеллообразования (ККМ). Методы определения ККМ.
Влияние различных факторов на величину ККМ в полярных и неполярных средах.
10. Влияние температуры на растворимость ионогенных ПАВ. Диаграмма состояния
системы. Точка Крафта.
11. Влияние температуры на растворимость неионогенных ПАВ. Точка помутнения и
точка высаливания.
3.
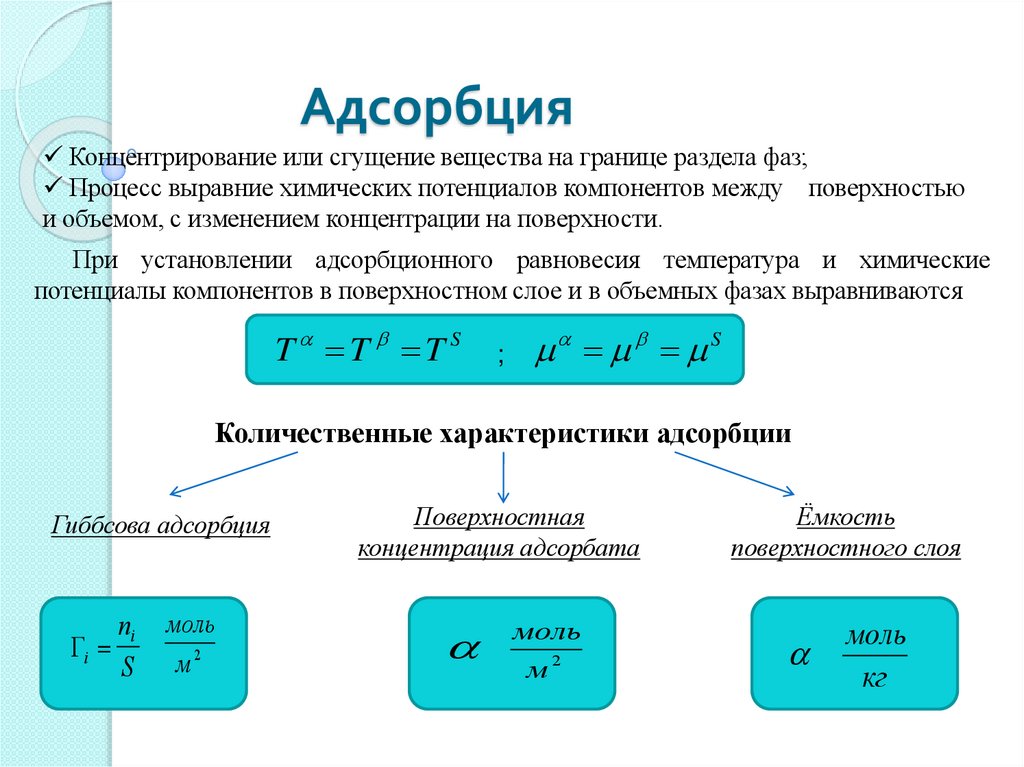
АдсорбцияКонцентрирование или сгущение вещества на границе раздела фаз;
Процесс выравние химических потенциалов компонентов между поверхностью
и объемом, с изменением концентрации на поверхности.
При установлении адсорбционного равновесия температура и химические
потенциалы компонентов в поверхностном слое и в объемных фазах выравниваются
T T T S
;
S
Количественные характеристики адсорбции
Гиббсова адсорбция
ni
i
S
моль
м2
Поверхностная
концентрация адсорбата
моль
м2
Ёмкость
поверхностного слоя
моль
кг
4.
ВЫВОД АДСОРБЦИОННОГО УРАВНЕНИЯ ГИББСА- выражает количественную связь адсорбции с поверхностным натяжением
Запишем фундаментальное уравнение Гиббса для плоского поверхностного слоя
dF ds S dT i dni
S
S
введем внутреннюю энергию поверхностного слоя
продифференцируем это уравнение
приравняем правые части
S
(1)
F S U S T S S
dF S dU S T dS S S S dT
dU S ds T dS i dni
U S s S T i dni
S
(2)
S
(3)
продифференцируем его
(4)
dU S ds S d T ds S S S dT i dni ni d i (5)
S
совместим (4) и (5)
S d S S dT i dni 0
S
общий вид адсорбционного уравнения Гиббса
S
(6)
5.
при Т=const уравнение Гиббса принимает вид:s d N iS d i 0 |: s
d Г i d i 0
(7)
N iS – мера избыточного содержания компонента в поверхностном слое,
т.к. Г i
S
мера адсорбции, т. е. величина гиббсовой адсорбции.
d Г i d i
для бинарной системы:
(8)
,
d Г1 d 1 Г 2 d 2
(9)
где индекс 1 относится к растворителю, 2 – к растворенному веществу.
При таком выборе разделяющей поверхности можно считать, что адсорбция
растворителя отсутствует
d Г d
6.
Перейдем к концентрации:R T ln a R T ln C , где С – равновесная концентрация в объеме.
d R T ln C
dC
d Г R T
C
С d
Г
R T dC
(10)
7.
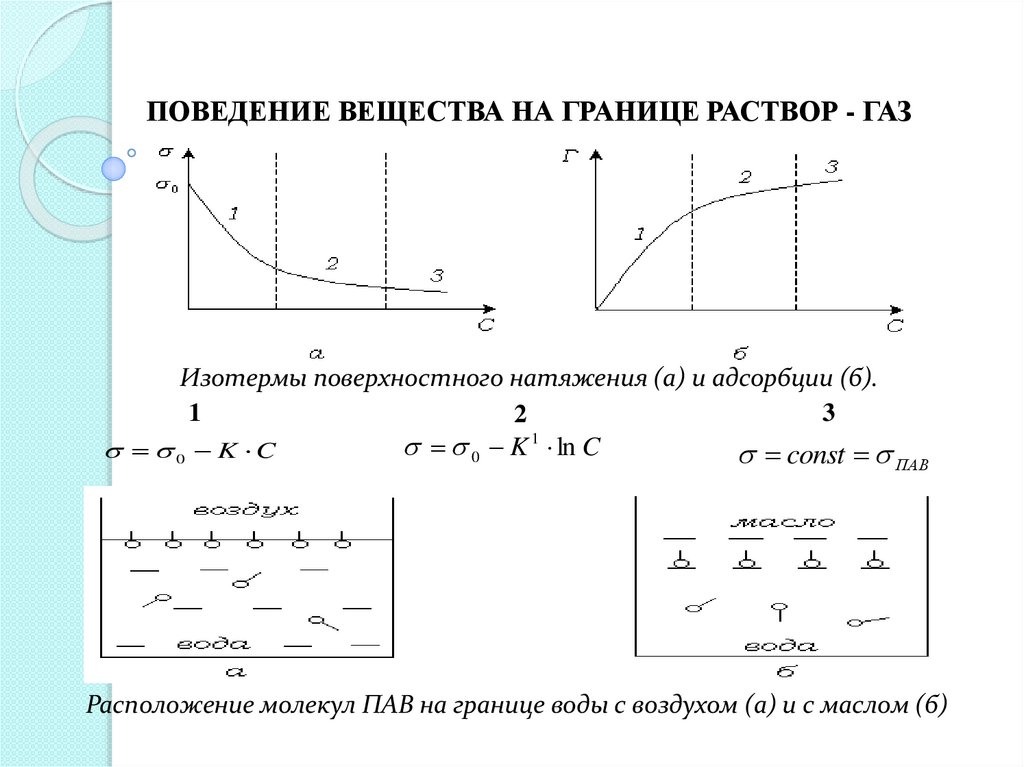
ПОВЕДЕНИЕ ВЕЩЕСТВА НА ГРАНИЦЕ РАСТВОР - ГАЗИзотермы поверхностного натяжения (а) и адсорбции (б).
1
3
2
1
0 K ln C
0 K C
const
ПАВ
Расположение молекул ПАВ на границе воды с воздухом (а) и с маслом (б)
8.
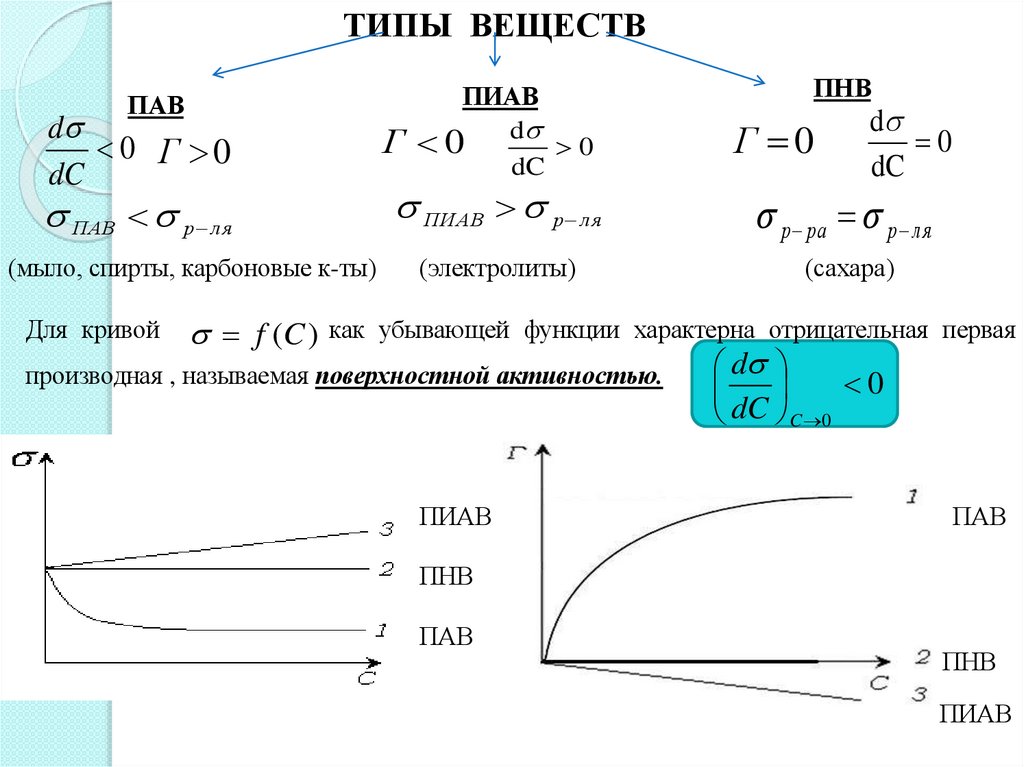
ТИПЫ ВЕЩЕСТВПАВ
d
0 Г 0
dC
ПАВ р л я
(мыло, спирты, карбоновые к-ты)
ПИАВ
Г 0 d 0
dC
ПНВ
Г 0
d
0
dC
ПИАВ р л я
р ра р ля
(электролиты)
(сахара)
f (C ) как убывающей функции характерна отрицательная первая
d
производная , называемая поверхностной активностью.
Для кривой
0
dC C 0
ПИАВ
ПАВ
ПНВ
ПАВ
ПНВ
ПИАВ
9.
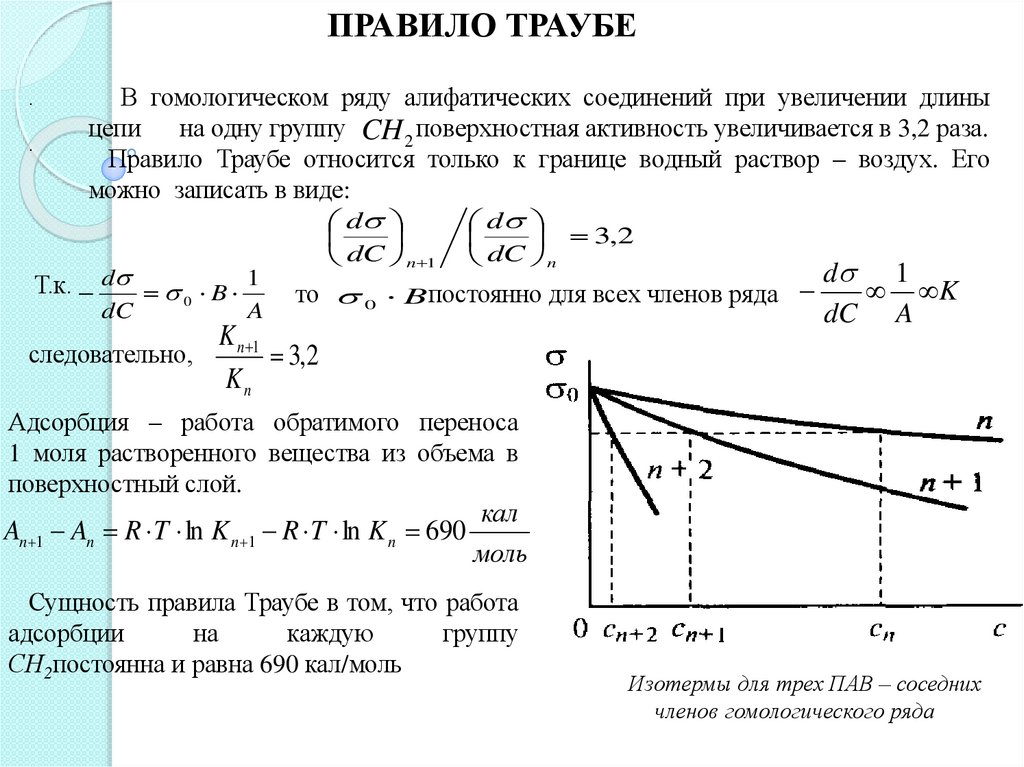
ПРАВИЛО ТРАУБЕ.
.
В гомологическом ряду алифатических соединений при увеличении длины
цепи на одну группу CH 2 поверхностная активность увеличивается в 3,2 раза.
Правило Траубе относится только к границе водный раствор – воздух. Его
можно записать в виде:
d
d
Т.к. d 0 B 1
dC n 1
3,2
dC n
то 0 Bпостоянно для всех членов ряда
dC
A
следовательно,
K n 1
3,2
Kn
d 1
K
dC A
Адсорбция – работа обратимого переноса
1 моля растворенного вещества из объема в
поверхностный слой.
An 1 An R T ln K n 1 R T ln K n 690
кал
моль
Сущность правила Траубе в том, что работа
адсорбции
на
каждую
группу
СН2постоянна и равна 690 кал/моль
Изотермы для трех ПАВ – соседних
членов гомологического ряда
10.
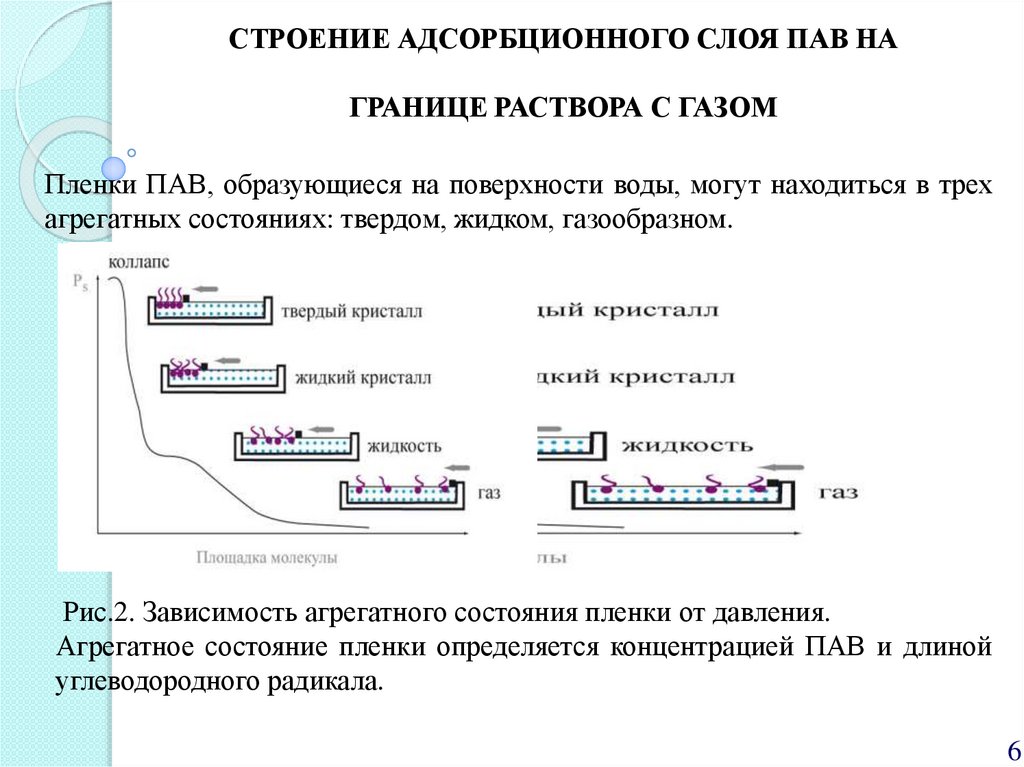
СТРОЕНИЕ АДСОРБЦИОННОГО СЛОЯ ПАВ НАГРАНИЦЕ РАСТВОРА С ГАЗОМ
Пленки ПАВ, образующиеся на поверхности воды, могут находиться в трех
агрегатных состояниях: твердом, жидком, газообразном.
Рис.2. Зависимость агрегатного состояния пленки от давления.
Агрегатное состояние пленки определяется концентрацией ПАВ и длиной
углеводородного радикала.
6
11.
УРАВНЕНИЕ СОСТОЯНИЯ ДВУМЕРНОГО ГАЗАВ двумерном газе действует поверхностное давление, которое является
растягивающим, в противоположность поверхностному натяжению,
сжимающему
поверхность. Это давление равно
0
0 K C
При малом содержании ПАВ, т.е. в состоянии двумерного газа
После дифференцирования получим:
d d K dC
Подставим уравнение (1) в уравнение Гиббса:
C
d
C K
Г
R T dC
R T
R T
Площадь, занимаемую одним молем ПАВ, обозначим через
1
Г
sм
1
sм R T
. Тогдаs м
sм R T
Это уравнение состояния двумерного газа аналогично уравнению газа
P V R T
12.
Для реального двумерного газа справедливо уравнениеФрумкина, аналогичное уравнению Ван-дер Ваальса:
(
где
s
2
м
) (s м ) R T
- константа взаимодействия молекул ПАВ в поверхностном слое,
- эффективная площадь сечения молекулы.
13.
ДИАГРАММЫ СОСТОЯНИЯ ПОВЕРХНОСТНЫХ ПЛЕНОКФазовое состояние поверхностных пленок
описывается диаграммой состояния или
изотермой сжатия, которая может быть
построена в координатах
Каждое состояние монослоя хар-ся
определенной ориентацией молекул,
sм
зависящей от
адгезионных и
когезионных свойств систем.
a
Участки:
- соответствует двумерному газу
b
- конденсация растянутой жидкой пленкой
c
- пленка сжимания
d
- фазовый переход
e - конденсированная (твердая) пленка
f
- разрушение мономолекулярной пленки
14.
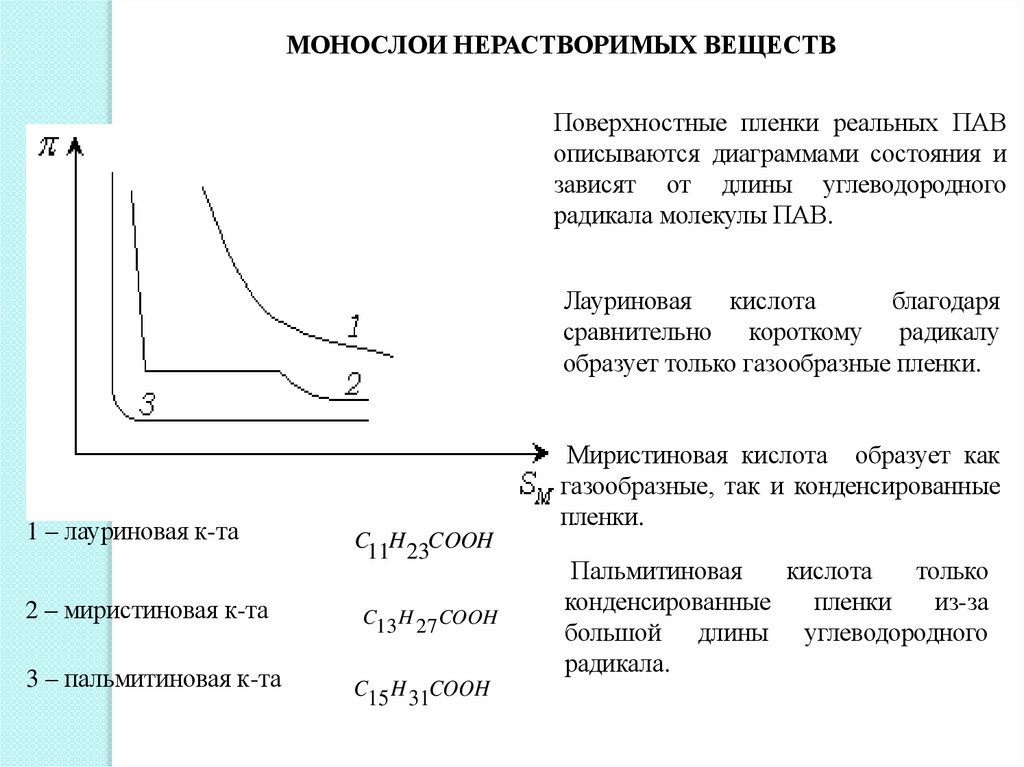
МОНОСЛОИ НЕРАСТВОРИМЫХ ВЕЩЕСТВПоверхностные пленки реальных ПАВ
описываются диаграммами состояния и
зависят от длины углеводородного
радикала молекулы ПАВ.
Лауриновая кислота
благодаря
сравнительно короткому радикалу
образует только газообразные пленки.
1 – лауриновая к-та
2 – миристиновая к-та
3 – пальмитиновая к-та
Миристиновая кислота образует как
газообразные, так и конденсированные
пленки.
C11H 23COOH
C13 H 27 COOH
C15 H 31COOH
Пальмитиновая
кислота
только
конденсированные
пленки
из-за
большой длины углеводородного
радикала.
15.
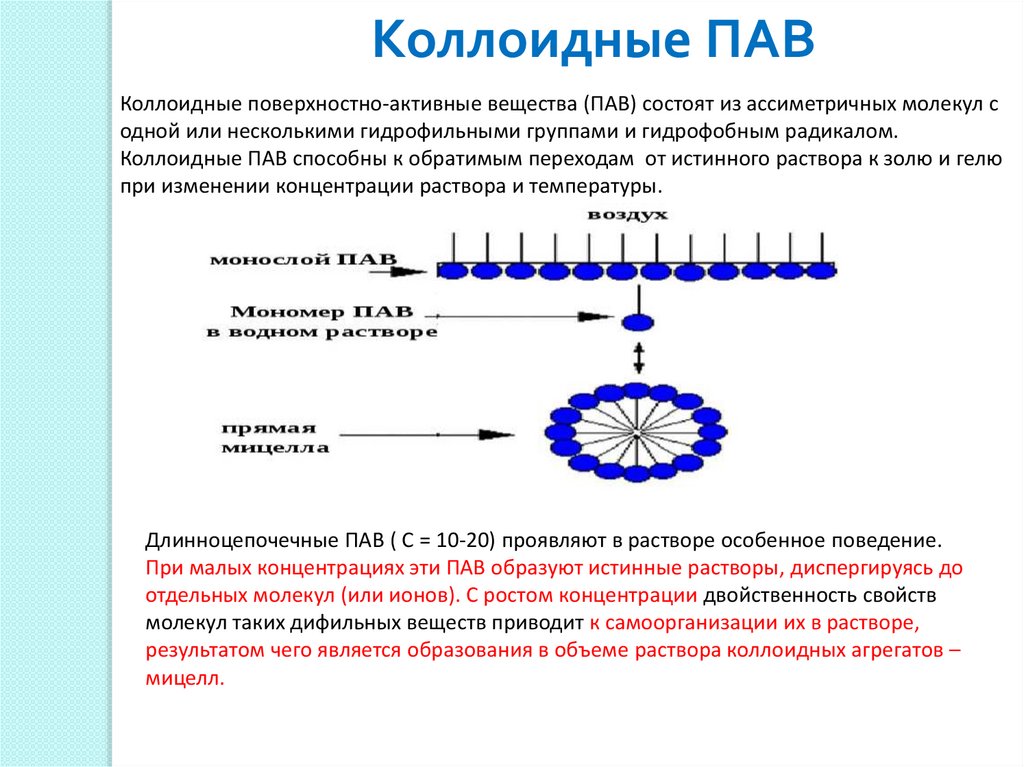
Коллоидные ПАВКоллоидные поверхностно-активные вещества (ПАВ) состоят из ассиметричных молекул с
одной или несколькими гидрофильными группами и гидрофобным радикалом.
Коллоидные ПАВ способны к обратимым переходам от истинного раствора к золю и гелю
при изменении концентрации раствора и температуры.
Длинноцепочечные ПАВ ( С = 10-20) проявляют в растворе особенное поведение.
При малых концентрациях эти ПАВ образуют истинные растворы, диспергируясь до
отдельных молекул (или ионов). С ростом концентрации двойственность свойств
молекул таких дифильных веществ приводит к самоорганизации их в растворе,
результатом чего является образования в объеме раствора коллоидных агрегатов –
мицелл.
16.
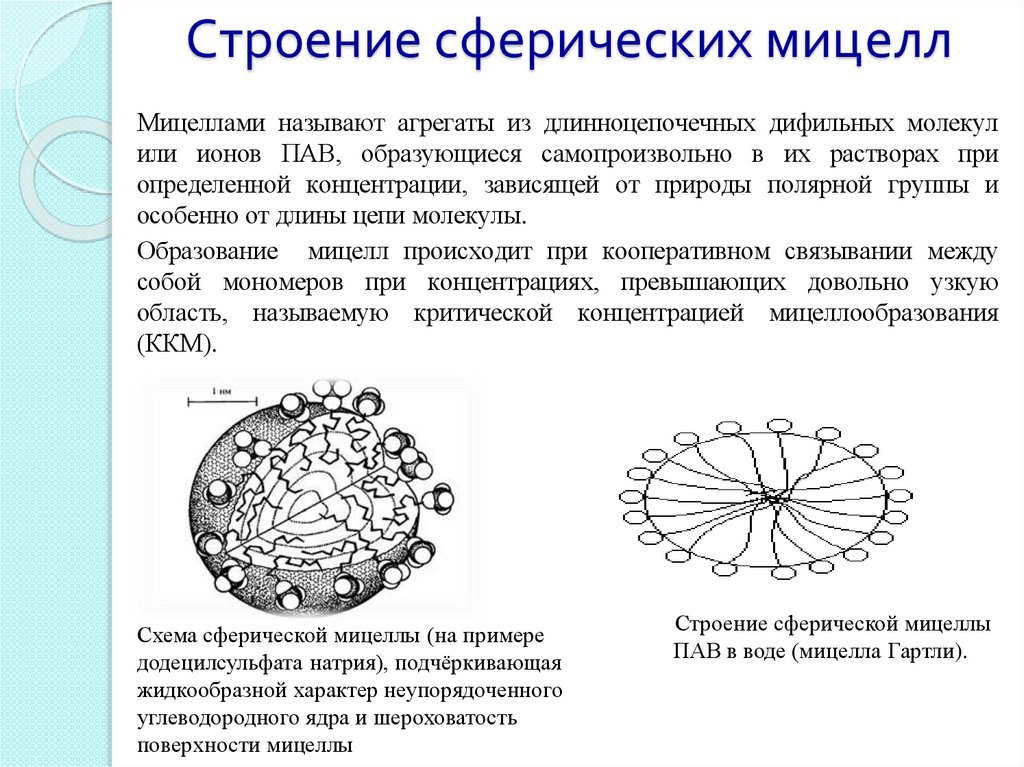
Строение сферических мицеллМицеллами называют агрегаты из длинноцепочечных дифильных молекул
или ионов ПАВ, образующиеся самопроизвольно в их растворах при
определенной концентрации, зависящей от природы полярной группы и
особенно от длины цепи молекулы.
Образование мицелл происходит при кооперативном связывании между
собой мономеров при концентрациях, превышающих довольно узкую
область, называемую критической концентрацией мицеллообразования
(ККМ).
Схема сферической мицеллы (на примере
додецилсульфата натрия), подчёркивающая
жидкообразной характер неупорядоченного
углеводородного ядра и шероховатость
поверхности мицеллы
Строение сферической мицеллы
ПАВ в воде (мицелла Гартли).
17.
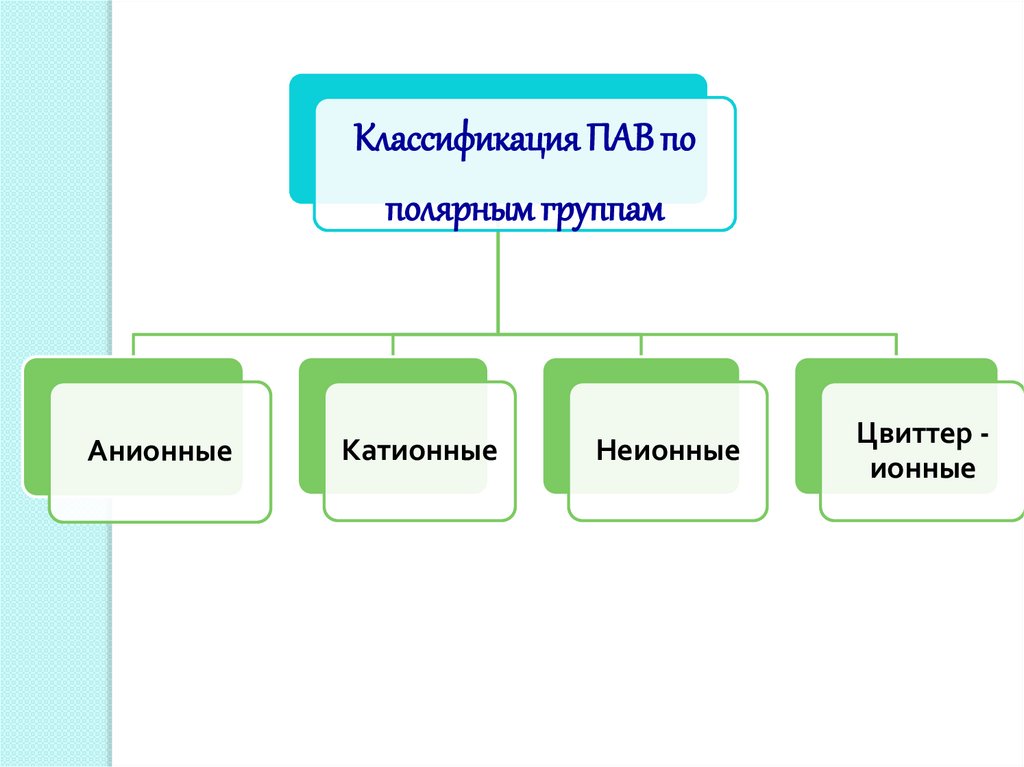
Классификация ПАВ пополярным группам
Анионные
Катионные
Неионные
Цвиттер ионные
18.
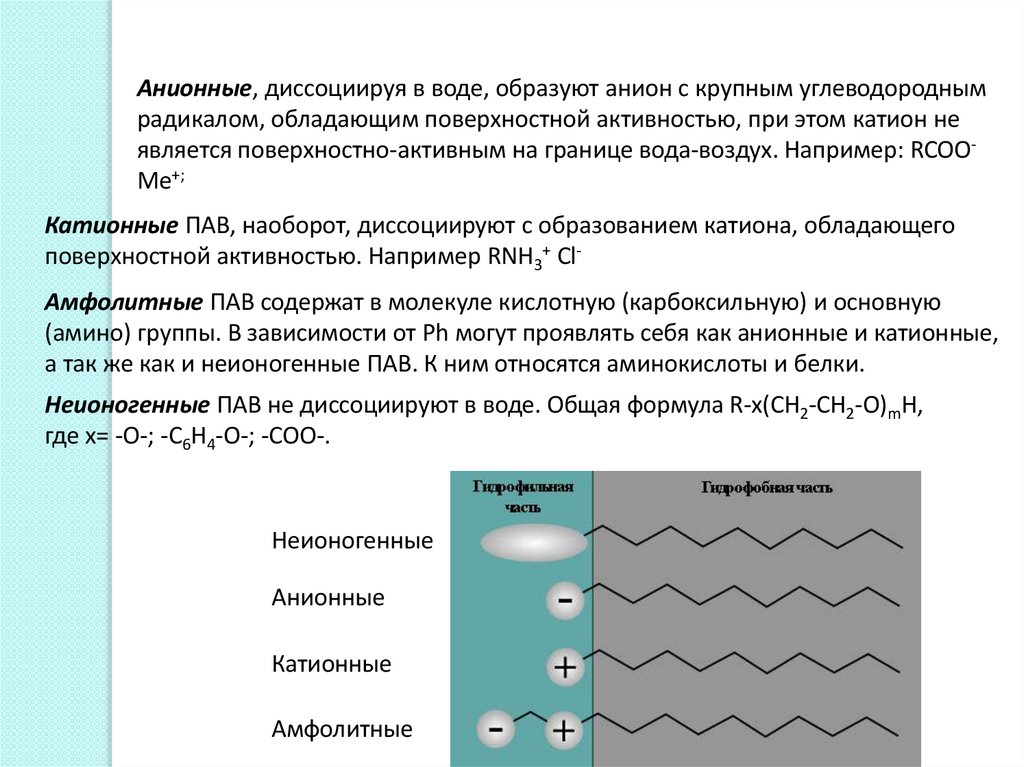
Анионные, диссоциируя в воде, образуют анион с крупным углеводороднымрадикалом, обладающим поверхностной активностью, при этом катион не
является поверхностно-активным на границе вода-воздух. Например: RCOOMe+;
Катионные ПАВ, наоборот, диссоциируют с образованием катиона, обладающего
поверхностной активностью. Например RNH3+ ClАмфолитные ПАВ содержат в молекуле кислотную (карбоксильную) и основную
(амино) группы. В зависимости от Ph могут проявлять себя как анионные и катионные,
а так же как и неионогенные ПАВ. К ним относятся аминокислоты и белки.
Неионогенные ПАВ не диссоциируют в воде. Общая формула R-x(CH2-CH2-O)mH,
где x= -O-; -C6H4-O-; -COO-.
Неионогенные
Анионные
Катионные
Амфолитные
19.
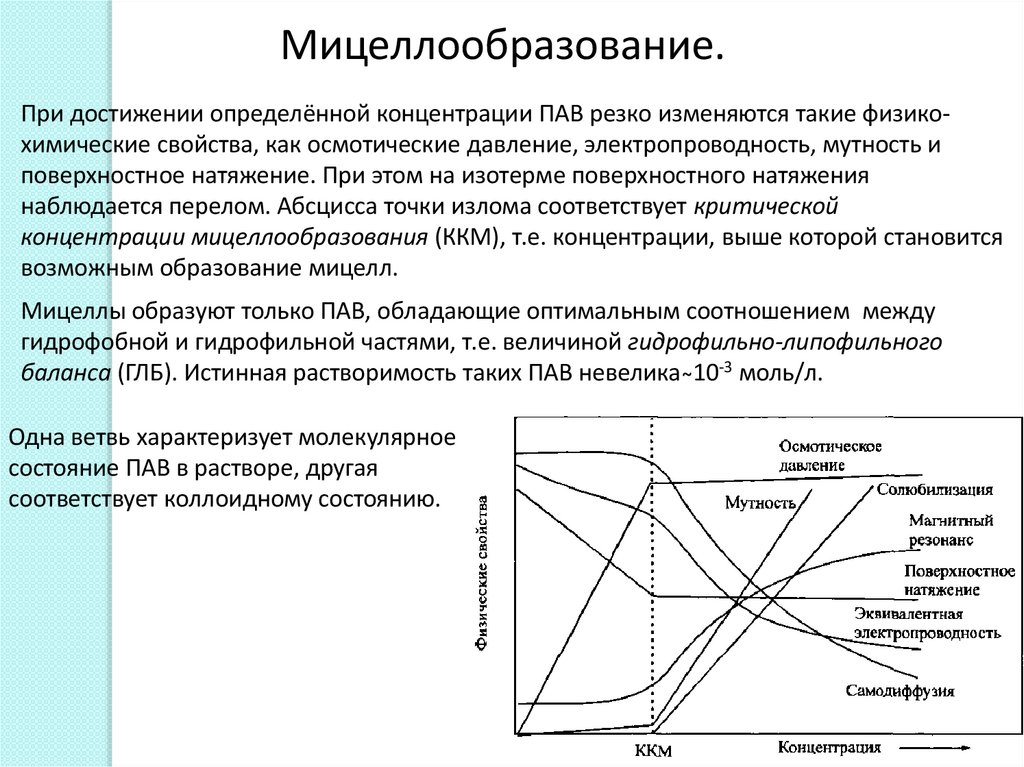
Мицеллообразование.При достижении определённой концентрации ПАВ резко изменяются такие физикохимические свойства, как осмотические давление, электропроводность, мутность и
поверхностное натяжение. При этом на изотерме поверхностного натяжения
наблюдается перелом. Абсцисса точки излома соответствует критической
концентрации мицеллообразования (ККМ), т.е. концентрации, выше которой становится
возможным образование мицелл.
Мицеллы образуют только ПАВ, обладающие оптимальным соотношением между
гидрофобной и гидрофильной частями, т.е. величиной гидрофильно-липофильного
баланса (ГЛБ). Истинная растворимость таких ПАВ невелика ̴10-3 моль/л.
Одна ветвь характеризует молекулярное
состояние ПАВ в растворе, другая
соответствует коллоидному состоянию.
20.
ККМ – наиболее важная характеристика ПАВ, связанная сгидрофильно-липофильным балансом молекул ПАВ и
использующаяся при рассмотрении всех вопросов практического
использования ПАВ.
Величина ККМ зависит от:
строения молекулярного ПАВ;
присутствия в растворе различных веществ;
температуры.
21.
Для ПАВ с одной полярной группой кооперативность мицеллобразованиярастет (ККМ уменьшается) с ростом длины алкильной цепи в ряду гомологов.
Зависимость ККМ в водной среде от числа углеводородных атомов в
алкильной цепи выражается полулогарифмической зависимостью:
RT ln KKM = А – Вn
где А – постоянная, характеризующая энергию растворения
функциональных групп;
В – постоянная, характеризующая энергию растворения, приходящуюся
на одну группу СН2;
n – число групп СН2.
Физический смысл этих констант установлен К.Шинодой:
А содержит вклад в свободную энергию мицеллообразования гидрофильной
группы ПАВ,
В – инкремент группы –СН2 - равный (1,0-1,4 ) КТ.
Чем длиннее углеводородная цепь, тем больше окажется выигрыш энергии
и тем меньше концентрация ПАВ необходима для образования мицелл.
Величина ККМ уменьшается с ростом длины цепи.
22.
При равном количестве углеродных атомов кооперативность уменьшается, ККМ растет:При циклизации цепи:
для n-тетрадецилсульфонат натрия С14Н29SО3Na ККМ=2,5ммоль/л,
для n-октибензолсульфонат натрия C8H17C6H4SO3Na
ККМ=11 ммоль/л.
При введении в углеводородный радикал двойных связей, полярных групп:
(стеарат натрия C17H35COONa – 0,18 моль/м3;
олеат натрия С8Н17СН=СН(СН2)7СООNa – 1,1 моль/л;
рицинолеат натрия СН3(СН2)3СН(ОН)СН2СН=СН(СН2)7СООNa – 75,2 моль/ м3.
Увеличение ККМ связано с тем, что введение ароматических циклов, кратных
связей, полярных групп, гетероатомов приводит к уменьшению гидрофобности
радикала.
При переходе к перфторуглеродной цепи наблюдается резкое снижение ККМ.
Величина ККМ октилсульфоната натрия С8Н17SО3Na составляет 177 моль/ м3, а для
перфтороктилсульфоната С8F17SО3Na ККМ - 8,5 моль/ м3.
Это связано с тем, что фторированные ПАВ значительно более гидрофобны и обладают
высокой поверхностной активностью, чем углеводородные аналоги.
23.
Введение электролитов в раствор ПАВ всегда снижает величину ККМ, т.к.:• электролит частично дегидратирует полярные группы ионов ПАВ, т. к.
связывает воду за счет гидратации своих ионов. Понижение гидратации ионов
ПАВ повышает их склонность к ассоциации.
• добавленный электролит понижает эффективную степень диссоциации
поверхностно-активного элемента, как в истинном растворе, так и в
мицеллярном состоянии.
Характер влияния зависит от размера углеводородного радикала органического
вещества.
Длинноцепочечные спирты понижают ККМ, причем степень снижения
увеличивается при увеличении молекулярной массы спирта. Увеличенный размер
мицелл и вязкость растворов ПАВ эти факты объясняются образованием смешанных
мицелл ПАВ + спирт.
Низкомолекулярные добавки (метанол, ацетон, диоксан) повышают ККМ и понижают
мицеллярную массу коллоидных ПАВ.
24.
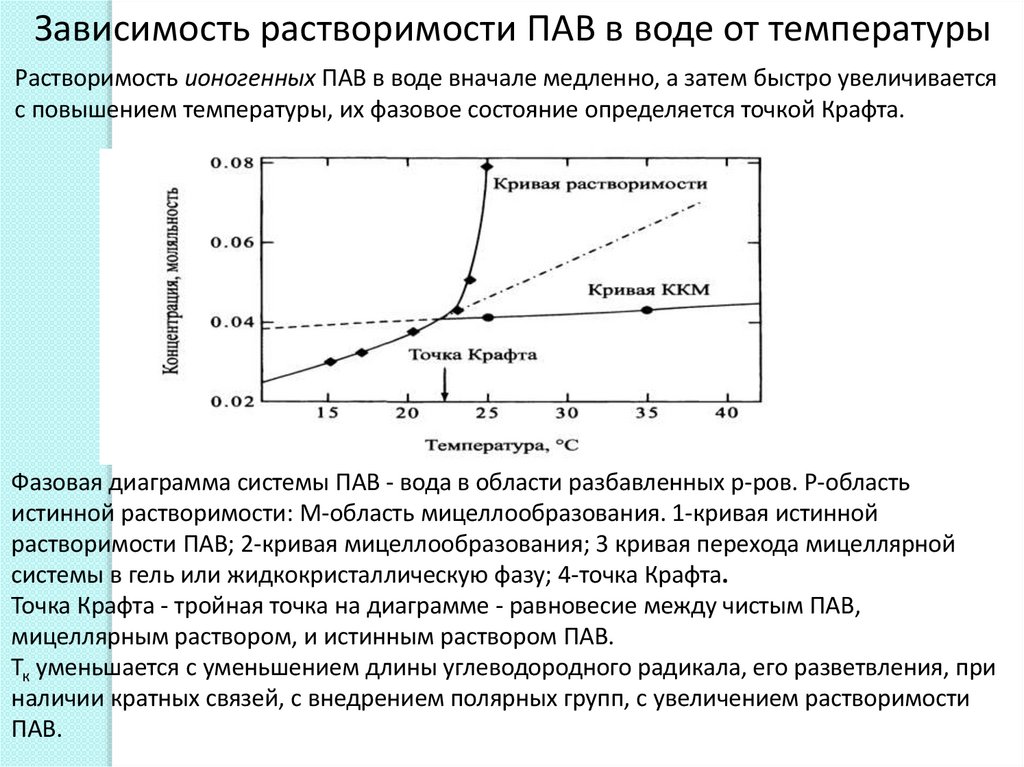
Зависимость растворимости ПАВ в воде от температурыРастворимость ионогенных ПАВ в воде вначале медленно, а затем быстро увеличивается
с повышением температуры, их фазовое состояние определяется точкой Крафта.
Фазовая диаграмма системы ПАВ - вода в области разбавленных р-ров. Р-область
истинной растворимости: М-область мицеллообразования. 1-кривая истинной
растворимости ПАВ; 2-кривая мицеллообразования; 3 кривая перехода мицеллярной
системы в гель или жидкокристаллическую фазу; 4-точка Крафта.
Точка Крафта - тройная точка на диаграмме - равновесие между чистым ПАВ,
мицеллярным раствором, и истинным раствором ПАВ.
Тк уменьшается с уменьшением длины углеводородного радикала, его разветвления, при
наличии кратных связей, с внедрением полярных групп, с увеличением растворимости
ПАВ.
25.
Растворы неионогенных ПАВ обладают специфической способностьюсущественно изменять свои физико-химические свойства при нагревании.
Растворимость НПАВ уменьшается с повышением температуры, для них
характерна точка помутнения. Растворимость таких ПАВ обусловлена
образованием гидратов, вследствие возникновения водородных связей. При
нагревании происходит дегидратация молекул ПАВ, т.е. уменьшение их
растворимости, что приводит к агрегации молекул и к появлению
опалесценции, а затем и к помутнению раствора. При дальнейшем
нагревании этого раствора происходит укрупнение частиц вплоть до
выделения капелек ПАВ в виде отдельной фазы, то есть их “высаливание”.
26.
Мицеллообразование в неводных средахВ растворах ПАВ в неполярных средах образуются мицеллы с
противоположной ориентацией молекул. При формировании
таких обратных мицелл полярные группы объединяются в
гидрофильное ядро, а углеводородные радикалы, обращенные
в сторону родственной им неполярной среды, образуют
олеофильную
оболочку,
экранирующую
внутреннюю
гидрофильную часть мицеллы от контакта с углеводородной
средой.
Числа агрегации оставляют 3 – 40.
Схематическое изображение
мицеллы ПАВ в неполярной
среде
27.
Оценка дифильных свойств ПАВОдной из характеристик дифильных свойств ПАВ является гидрофильнолипофильный баланс (ГЛБ), характеризующий соотношение масс гидрофильной
полярной группы и липофильного радикала. Шкала чисел ГЛБ была предложена
Гриффином в 1949 г.
ГЛБ является эмпирической величиной, для олеиновой кислоты ГЛБ выбрано
равным 1, для олеата натрия- 18. чем выше гидрофильность, тем выше число
ГЛБ, которое изменяется от 1 до 40.
Число ГЛБ рассчитывают по формуле:
Где ГЛБ см – число ГЛБ смеси ПАВ, обеспечивающее получение устойчивой
эмульсии стандартного масла, WA – количество эмульгатора А с неизвестным
ГЛБ, WB – количество эмульгатора с неизвестным ГЛБ.
При значении ГЛБ от 1 до 4, ПАВ не растворяются и не диспергируются в воде,
при значении от 8 до 10 образуют в воде стабильные дисперсии типа молока, а
выше 13 – прозрачные растворы.
По значению ГЛБ можно определить область применения ПАВ:
эмульгаторы - 3÷6, смачиватели - 7÷9, моющие вещества - 13 ÷15.
28.
Число ГЛБ для данного ПАВ можно рассчитать по аддитивной формуле, знаячисла ГЛБ для каждой структурной единицы.
ГЛБ ПАВ=7+∑(ГЛБ)Г + ∑(ГЛБ)Л
(Метод Девиса)
Значения чисел ГЛБ для некоторых радикалов
Числа ГЛБ для некоторых распространенных ПАВ
29.
Число ГЛБ рассчитывают по формуле:значению
ГЛБ можно определить
Где ГЛБсм – число ГЛБ По
смеси
ПАВ, обеспечивающее
получение устойчивой эмульсии
область
применения
ПАВ: эмульгаторы
стандартного масла, WA
– количество
эмульгатора
А с неизвестным
ГЛБ, WB – количество
3÷6, смачиватели
- 7÷9, моющие вещества эмульгатора с неизвестным
ГЛБ.
13 ÷15.
При значении ГЛБ от 1 до 4, ПАВ не растворяются и не диспергируются в воде, при
значении от 8 до 10 образуют в воде стабильные дисперсии типа молока, а выше 13 –
прозрачные растворы.
По значению ГЛБ можно определить область применения ПАВ: эмульгаторы - 3÷6,
смачиватели - 7÷9, моющие вещества - 13 ÷15.

















 chemistry
chemistry








