Similar presentations:
Соединения серы и их значение
1. Тема: Соединения серы и их значение
2. Цели урока:
Рассмотреть свойства важнейшихсоединений серы – сероводорода и её
солей, оксидов серы, сероводородной и
сернистой кислот
Обратить внимание на качественные
реакции сульфид-ионов S2- и сульфитионов SО32-
3. Сероводород Н2S-2(низшая степень окисления)
-2Сероводород Н2S (низшая степень
окисления)
Физические свойства:
Бесцветный газ с запахом тухлых яиц,
ядовит
Предельно допустимая концентрация в
воздухе 10мг/м3
Водный раствор – сероводородная
кислота
4. Пятигорск – природный музей минеральных вод
Cероводородные источники с давних времёнприменялись для лечения различных заболеваний.
Их включали в программы лечения болезней
желудочно-кишечного тракта, кожных и других.
В г. Пятигорск на Северном Кавказе работают
несколько санаториев, в которых применяют эти
источники
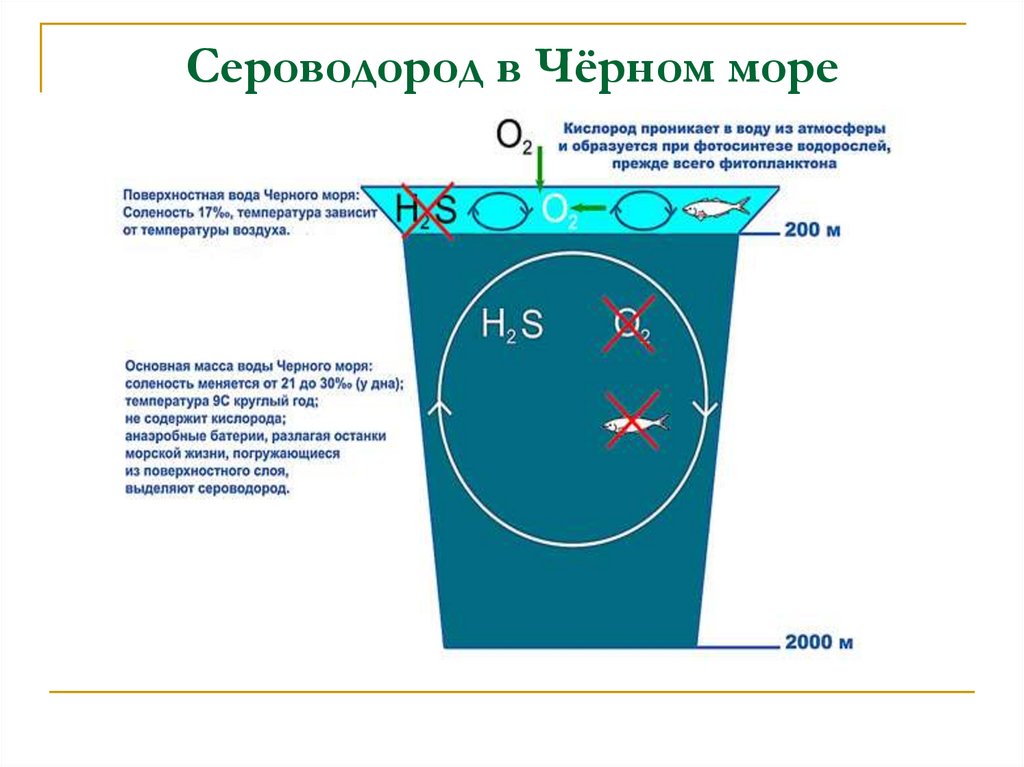
5. Сероводород в Чёрном море
6. Н2S-2 – сероводород (в ОВР только восстановитель)
-2Н2S – сероводород
(в ОВР только восстановитель)
Химические свойства:
1.Реакция взаимодействия с кислородом
2Н2S + O2 →2 S↓ + 2Н2O
недостаток кислорода
2Н2S + 3O2 → 2SО2+ 2Н2O
избыток кислорода
7. Н2S-2 - восстановитель
-2Н2S - восстановитель
2. Реакция взаимодействия с растворами
галогенов:
2Н2S
-2
0
0
+I2 = 2S ↓ + 2Н+1I-1
йод
8. Н2S – сероводородная кислота
Неустойчивая, на свету мутнеет.Слабый
электролит
2,5 объёма Н2S растворяются в 1 объёме
Н 2О
Н2S↔Н++ НS- гидросульфид-ион
НS- ↔ Н++ S2- сульфид- ион
Надо нарисовать вместо одной стрелки с
двумя направлениями две по образцу
9. Cоли: гидросульфиды и сульфиды В природе – 200 минералов-сульфидов
Сульфиды свинца (галенит или свинцовыйблеск РbS),
ртути (киноварь HgS),
железа (пирит или железный колчедан
FeS2)
цинка ( cфалерит ZnS)
10. Качественная реакция на сульфид-ион S2-
Качественная реакция на сульфидион S2В пробирку с раствором соли сульфиданатрия Na2S прилейте 1-2 мл раствора
соли хлорида меди(II) СuCl2.
Что наблюдаете?
Рассмотрите реакцию с точки зрения ТЭД,
запишите уравнение реакции в трех видах.
11. Качественная реакция на сульфид-ион S2-
Реактив – ион меди Cu2+
Na2S + СuCl2 →2NaCl + СuS↓(черный осадок)
2Na+ +S2- +Cu2+ + 2Cl- →2Na++ 2Cl- + СuS↓
Cu2+ + S2- → СuS↓
12. S+4O2-оксид серы (IV),сернистый газ(промежуточная степень окисления)
13. «Последний день Помпеи»
К. П. Брюллов14. S+4O2-оксид серы (IV),сернистый газ(промежуточная степень окисления)
Физические свойства:бесцветный газ с резким запахом, ядовит.
Предельно допустимая концентрация в
воздухе 0,06мг/л
Получение.
S0 +O2 = S+4O2 ↑
15. Химические свойства:
S+4O2 – может быть восстановителем1.Реакция взаимодействия с кислородом
(получение SO3)
+4
2S
+6
0
O2 + O2 → 2S O3
(кислотный, бесцветная жидкость)
2. Реакция взаимодействия с углеродом (сера –
окислитель)
S O2 +С S +С O2
+4
0→
0
+4
16. СОЕДИНЕНИЯ СЕРЫ
сернистый газ используют для –отбеливания шерсти, шелка, бумаги, в
качестве консервирующего средства для
сохранения свежих продуктов и
приготовления сухофруктов
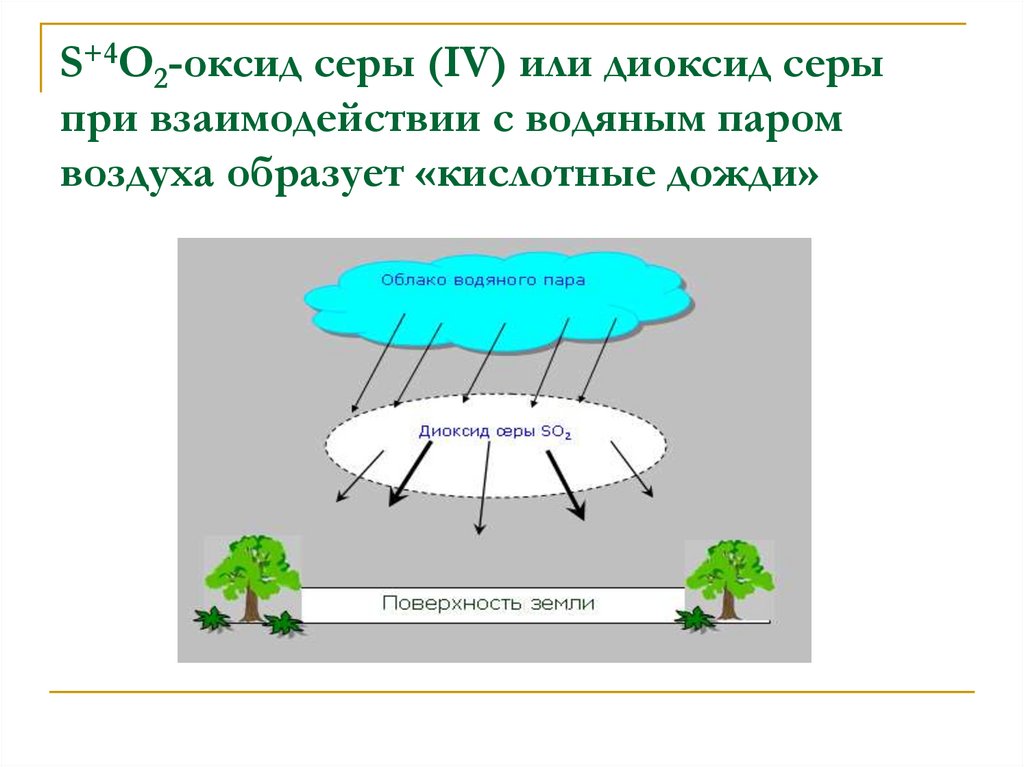
17. S+4O2-оксид серы (IV) или диоксид серы при взаимодействии с водяным паром воздуха образует «кислотные дожди»
18. H2S+4О3- сернистая кислота
Существует только в растворе, непрочноесоединение
40 объёмов SО2 может раствориться в 1 V
Н2О
SО2 +Н2О ↔Н2 SО3 (стрелки надо нарисовать
две – влево и вправо друг над другом
Н2 SО3 ↔Н+ + НSО3- гидросульфит - ион
НSО3- ↔ Н+ + SО32- сульфит – ион
19. Качественная реакция на сульфит-ион SО32-
Качественная реакция на сульфитион SО32 Na2SО3 +2НСl→ 2NaСl + Н2SО32Na+ + SО32- +2Н+ +2Сl- →
2Na+ +2Сl- + Н2О+ SО2
2Н+ + SО32-→ Н2О+ SО2

















 chemistry
chemistry








