Similar presentations:
Сера и ее соединения
1. Тема урока: «Сера и её соединения»
Аллотропные видоизменения серыВ природе сера встречается в свободном
состоянии
и в виде соединенийFeS2(пирит) CuS(медный блеск)
ZnS(цинковая обманка) CaSO4.2H2O(гипс)
Na2SO4.10H2O(мирабилит, глауберова соль)
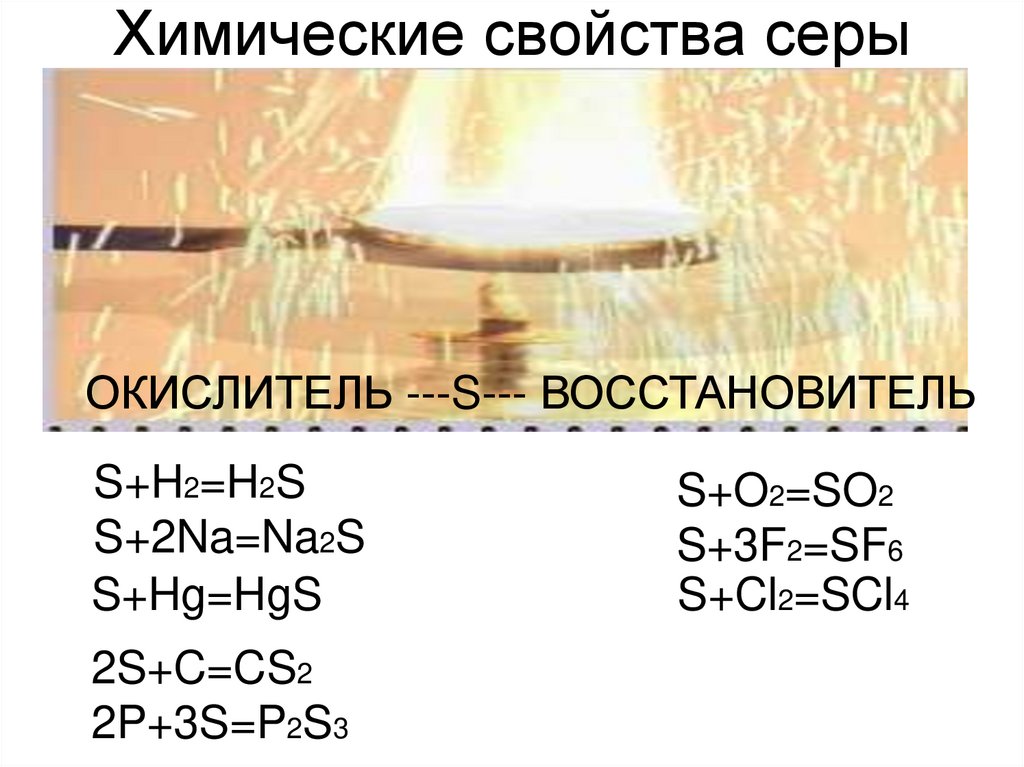
2. Химические свойства серы
ОКИСЛИТЕЛЬ ---S--- ВОССТАНОВИТЕЛЬS+H2=H2S
S+2Na=Na2S
S+Hg=HgS
2S+C=CS2
2P+3S=P2S3
S+O2=SO2
S+3F2=SF6
S+Cl2=SCl4
3. Сероводород H2S
Газообразное вещество с неприятнымзапахом тухлых яиц, тяжелее воздуха,
Ядовит- разрушает гемоглобин крови,
в одном объёме воды растворяется 2,5 объёма
сероводорода
В природе встречается
в минеральных источниках,
вулканических газах, образуется
При гниении органических
веществ
4. Химические свойства сероводорода
Н2S+Br2=2HBr+S Более активный неметаллвытесняет серу )
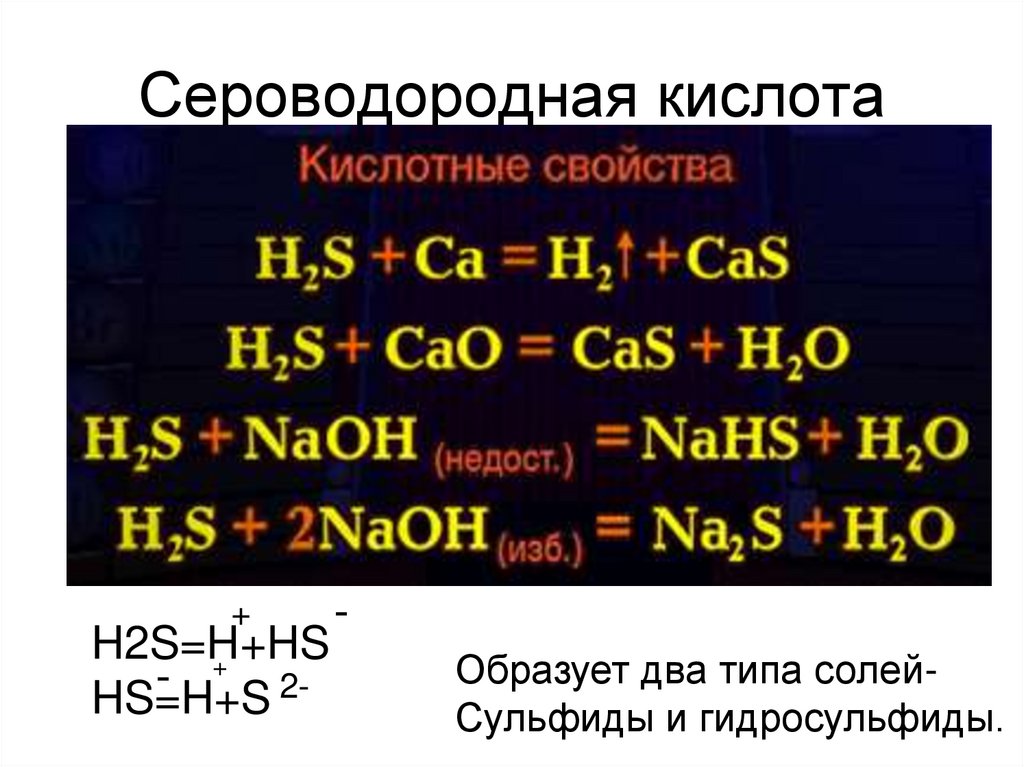
5. Сероводородная кислота
+H2S=H+HS
+
HS=H+S 2-
Образует два типа солейСульфиды и гидросульфиды.
6. Качественная реакция на сульфид-ион
Pb(NO3)2+ H2S=PbS+2HNO3ЧЁРНЫЙ ОСАДОК
7. Осуществите превращение
Sзадача
Определить m
H2S
SO2
SO2,полученного при
горении 16г S 2,24 л кислорода
1)S
ZnS
H2S
2)Закончить уравнения реакций:
S+Mg=
H2S+O2=
S+Al=
H2S+NaOH=
S+O2=
Na2S+Cu(NO3)2=
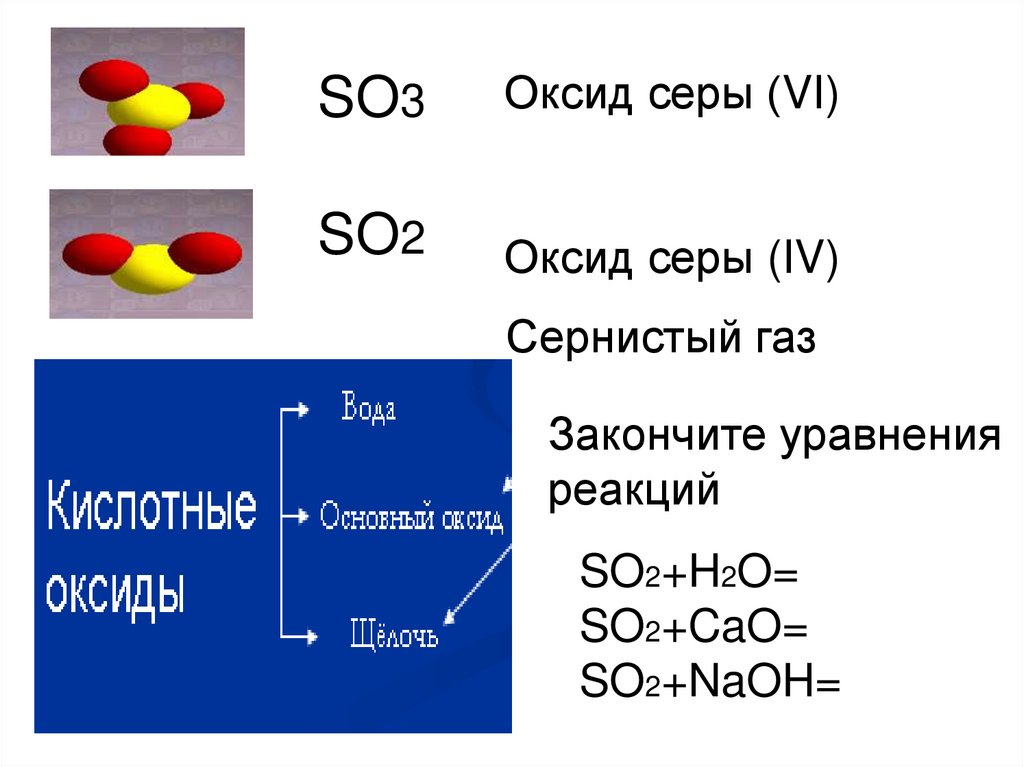
8.
SO3Оксид серы (VI)
SO2
Оксид серы (IV)
Сернистый газ
Закончите уравнения
реакций
SO2+H2O=
SO2+CaO=
SO2+NaOH=
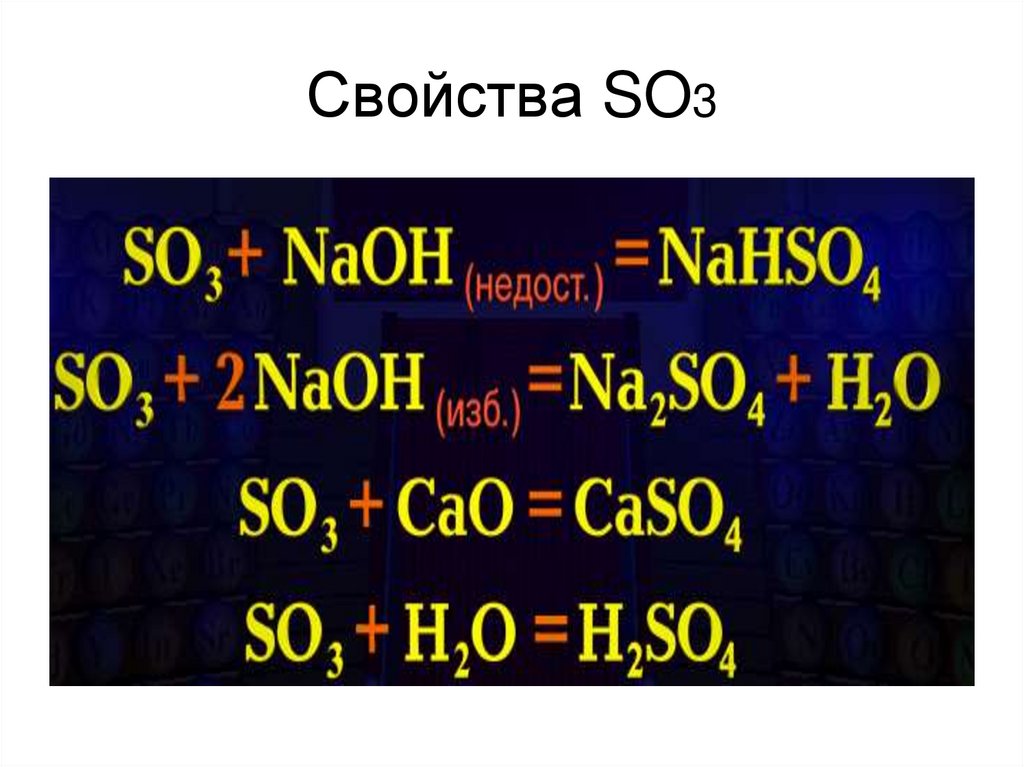
9. Свойства SO3
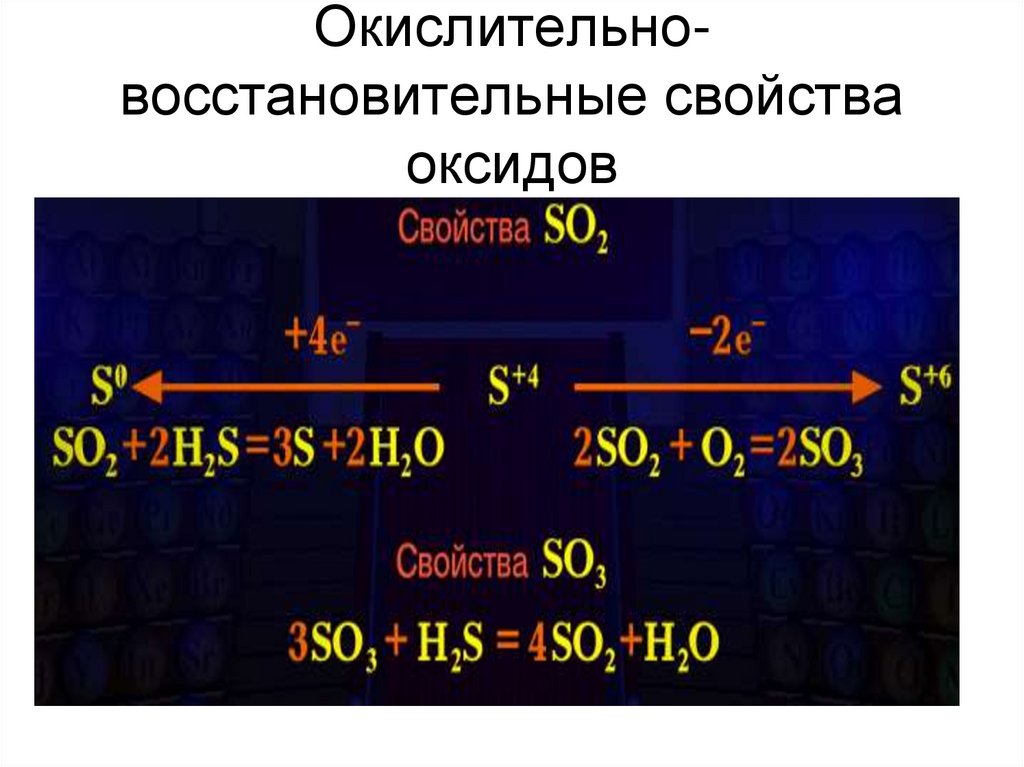
10. Окислительно-восстановительные свойства оксидов
Окислительновосстановительные свойстваоксидов
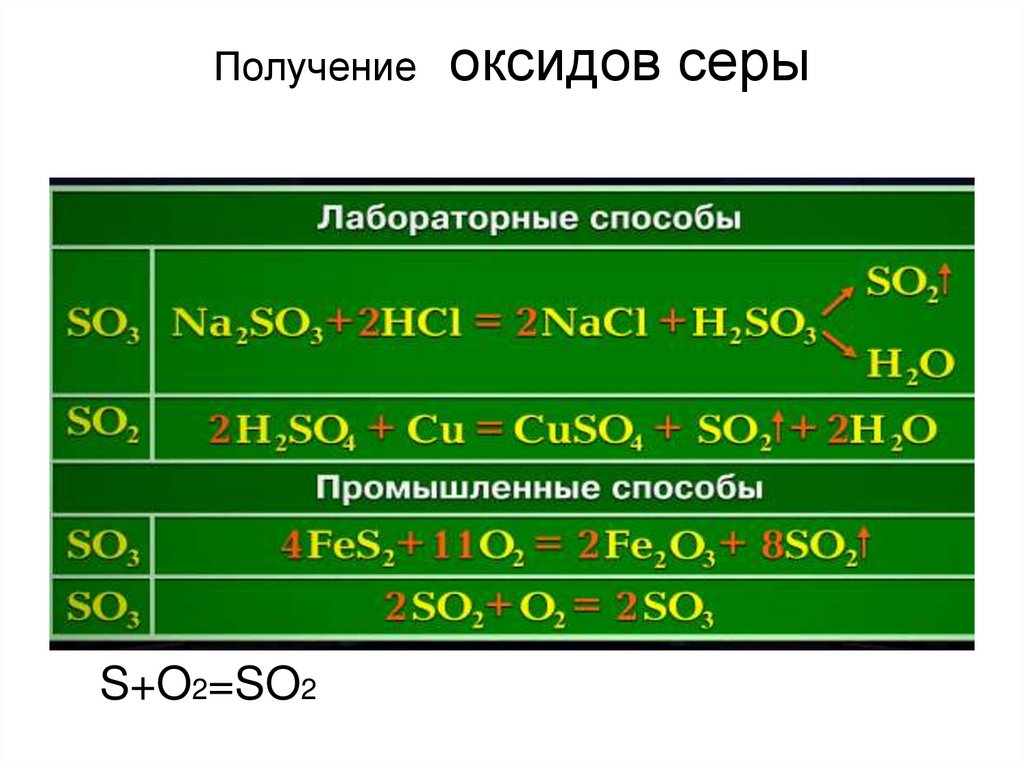
11. Получение оксидов серы
ПолучениеS+O2=SO2
оксидов серы
12. СЕРНАЯ КИСЛОТА H2SO4 (общие свойства кислот)
13. Взаимодействие с металлами
Раствор серной кислотыреагирует с металлами,
стоящими до водорода в
ряду активности. При этом
образуется водород и
соль.
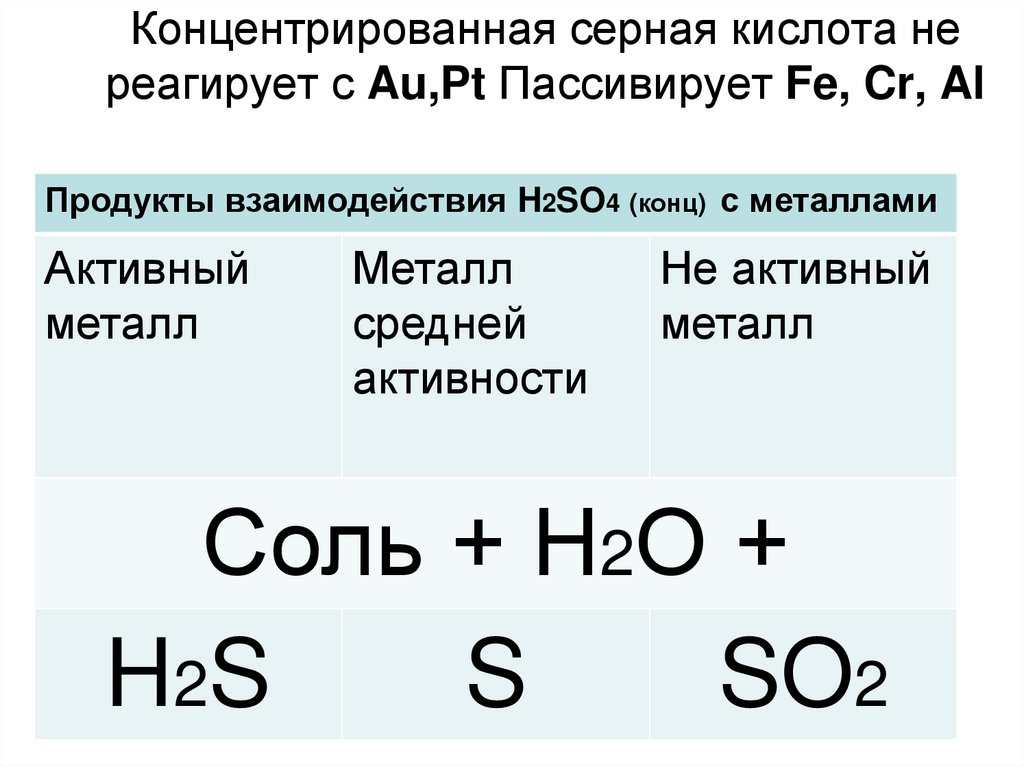
14. Концентрированная серная кислота не реагирует с Au,Pt Пассивирует Fe, Cr, Al
Продукты взаимодействия H2SO4 (конц) с металламиАктивный
металл
Металл
средней
активности
Не активный
металл
Соль + Н2О +
H2S
S
SO2
15. Качественная реакция на сульфаты
H2SO4+BaCI2 = BaSO4 ↓+ 2HCI









 chemistry
chemistry








