Similar presentations:
Соединения серы. Химические свойства
1. СОЕДИНЕНИЯ СЕРЫ
2. СЕРОВОДОРОД H2S
• Бесцветный газ• С резким запахом
• Ядовит
• Растворим в воде (образуется
сероводородная кислота)
3. Химические свойства
Сильный восстановитель (-e)Горит
В избытке кислорода:
2 H2S + 3O2 = 2SO2 + 2H2O
В недостатке кислорода:
2 H2S + O2 = S + 2H2O
4. Химические свойства
Слабая кислотаH2S + CaO =
H2S + NaOH =
Качественная реакция на сероводород и
сульфиды – взаимодействие с солями
меди – образуется черный осадок CuS:
H2S + CuSO4 =
5. Оксид серы (IV) SO2
• Бесцветный газ• С резким запахом
• Растворим в воде (образуется
неустойчивая сернистая кислота)
6. Химические свойства
1. Кислотный оксидРеагирует с водой:
SO2 + H2O =
Реагирует со щелочами:
SO2 + NaOH =
Реагирует с основными оксидами:
SO2 + CaO =
7. Химические свойства:
2. Восстановительные свойства (-е):2 SO2 + O2 = 2SO3
3. Окислительные свойства (+е):
SO2 + 2 H2S = 3S + 2H2O
4. Качественная реакция на сернистую
кислоту и сульфиты – взаимодействие с
солями бария – образуется белый
осадок BaSO3, растворимый в кислотах:
Na2SO3 + BaCl2 =
8. Оксид серы (VI) SO3
• Бесцветная жидкость• Хорошо растворим в воде (образуется
серная кислота)
9. Химические свойства
Кислотный оксидРеагирует с водой:
SO3 + H2O =
Реагирует со щелочами:
SO3 + КOH =
Реагирует с основными оксидами:
SO3 + ВаO =
10. Серная кислота H2SO4
• Бесцветная маслянистая тяжелаяжидкость
• Сильное водоотнимающее средство
11. Химические свойства
1. Разбавленной серной кислоты:а) С металлами:
Zn + H2SO4 =
б) С оксидами металлов (основными и
амфотерными)
CuO + H2SO4 =
в) С основаниями:
NaOH + H2SO4 =
г) С солями:
Na2CO3 + H2SO4 =
12. Химические свойства
Качественная реакция на серную кислотуи сульфаты – взаимодействие с солями
бария – образуется белый осадок
BaSO4, нерастворимый в кислотах:
K2SO4 + BaCl2 =
13. Химические свойства
2. Концентрированной серной кислоты:а) Реагирует с металлами:
Cu + H2SO4 = CuSO4 + SO2 + H2O
Zn + H2SO4 = ZnSO4 + H2S + H2O
Al, Fe, Cr пассивируются (не реагируют) в
концентрированной серной кислоте при
комнатной температуре.
14. Химические свойства
б) Реагирует с неметаллами:C + H2SO4 = CO2 + SO2 + H2O
в) Сильное водоотнимающее средство
H2SO4(конц.)
C12H22O11 12C + 11H2O
(C12H22O11 + 2H2SO4 = 11C + 2SO2 + CO2 + 13H2O)
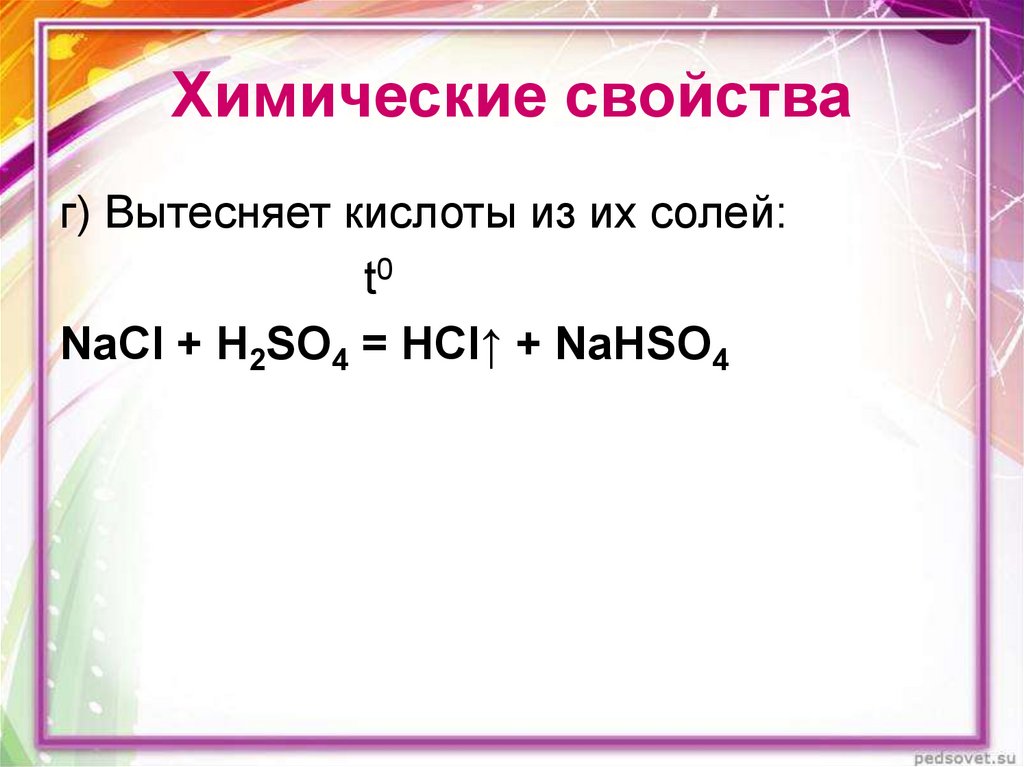
15. Химические свойства
г) Вытесняет кислоты из их солей:t0
NaCl + H2SO4 = HCl↑ + NaHSO4
16. Производство серной кислоты
1. Получение SO24FeS2 + 11O2 = 8SO2 + 2Fe2O3
2. Получение SO3
V2O5
2SO2 + O2 = 2SO3
3. Получение H2SO4
SO3 + H2O = H2SO4















 chemistry
chemistry








