Similar presentations:
Основные соединения серы
1.
Основныесоединения серы
2.
•Решите загадкуДвойняшки с разным характером
Мы – братья, но совсем не схожи,
Оба газы, но разные по норовистости.
Один из нас – кислый, другой – едкий,
Оба опасны при больших концентрациях.
Один из нас образует кислоту,
Другой – ангидрид серной.
Кто мы?
3. Тема урока: Соединения серы
ТЕМА УРОКА: СОЕДИНЕНИЯ СЕРЫ•Цели обучения в соответствии с
учебной программой:
•9.2.1.13 - сравнивать физические
и химические свойства оксидов
серы (IV) и (VI) и объяснять
физиологическое
воздействие
диоксида серы
•9.4.2.1 - объяснять причины
возникновения и экологическое
воздействие кислотных дождей
Ценность воспитания:
Закон и порядок
4. Н2S - сероводород
Н2S - СЕРОВОДОРОДГидрид серы
(ковалентная полярная
связь)
Влияние сероводорода на организм:
Сероводород не только скверно пахнет, он еще и чрезвычайно
ядовит. При вдыхании этого газа в большом количестве быстро
наступает паралич дыхательных нервов, и тогда человек перестает
ощущать запах – в этом и заключается смертельная опасность
сероводорода.
Насчитывается множество случаев отравления вредным газом,
когда пострадавшими были рабочие, на ремонте трубопроводов.
Этот газ тяжелее, поэтому он накапливается в ямах, колодцах,
откуда быстро выбраться не так-то просто.
5.
СЕРОВОДОРОДбесцв. газ с резким запахом тухлых яиц
Термически неустойчив, плохо растворим в воде.
Лучше, чем в воде, сероводород растворим в
органических растворителях; температура
кипения - 60,35 °С, плотность 0,938 г/см3 (-81 °С)
Водный раствор – сероводородная
кислота(слабая)
Получение сероводорода
1. Н2+S=H2S↑
2. FeS + 2HCl → FeCl2 + H2S↑
6.
ХИМИЧЕСКИЕ СВОЙСТВА1.Сероводород окисляется- горит синим пламенем:
при недостатке O2
2H2S + O2 → 2S + 2H2O
б.при избытке O2
2H2S + 3O2 → 2SO2 + 2H2O
2.Сероводород проявляет восстановительные свойства
а. взаимодействует с бромной и хлорной водой
H2S + Br2 → S + 2HBr
H2S + Сl2 → S + 2HCl
3.Серебро при контакте с сероводородом чернеет:
4Ag + 2H2S + O2 → 2Ag2S↓ + 2H2O
Потемневшим предметам можно вернуть блеск. Для этого в эмалированной
посуде их кипятят с раствором соды и алюминиевой фольгой. Алюминий
восстанавливает серебро до металла, а раствор соды удерживает ионы серы.
7.
1.H2S является очень слабой кислотой:H2S → H+ + HS- (первая ступень, образуется гидросульфид - ион)
HS- → 2H+ + S2- (вторая ступень)
2.Взаимодействует с основаниями:
H2S + 2NaOH(избыток) → Na2S + 2H2O
8. SO2 - серный газ
SO2 - СЕРНЫЙ ГАЗSO2 - диоксид серы,
оксид серы (IV)
(ковалентная полярная
связь)
Бесцветный газ с резким запахом; хорошо растворим в воде
(в 1V H2O растворяется 40V SO2 при н.у.);
t°пл. = -75,5°C; t°кип. = -10°С.
9. Получение
ПОЛУЧЕНИЕ1)
При сжигании серы в кислороде:
S + O2 → SO2
2)
Окислением сульфидов:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
3) Обработкой солей сернистой кислоты минеральными
кислотами:
Na2SO3 + 2HCl → 2NaCl + SO2 + H2O
4) При окислении металлов концентрированной серной
кислотой:
Cu + 2H2SO4(конц) → CuSO4 + SO2 + 2H2O
5) 2SO3 <—> 2SO2 +O2 (температура, катализатор)
10.
Химические свойства диоксида серы1. Реакция взаимодействия с кислородом
(получение SO3)
2SO2 + O2= 2SO3 (кислотный, бесцветная летучая
жидкость). Катализатор платина.
Диоксид серы - восстановитель
2. Реакция взаимодействия с углеродом
SO2 +С =S +СO2
Диоксид серы — окислитель
3. взаимодействует с водой
SO2 + H2O = H2SO3
11. S+6O3 – оксид серы (VI), кислотный оксид (высшая степень окисления серы)
S+6O3 – ОКСИД СЕРЫ (VI),КИСЛОТНЫЙ ОКСИД
(ВЫСШАЯ СТЕПЕНЬ ОКИСЛЕНИЯ СЕРЫ)
S+6O3- бесцветная жидкость
S+6O3 + Н2О =Н2 S+6O4
серная кислота
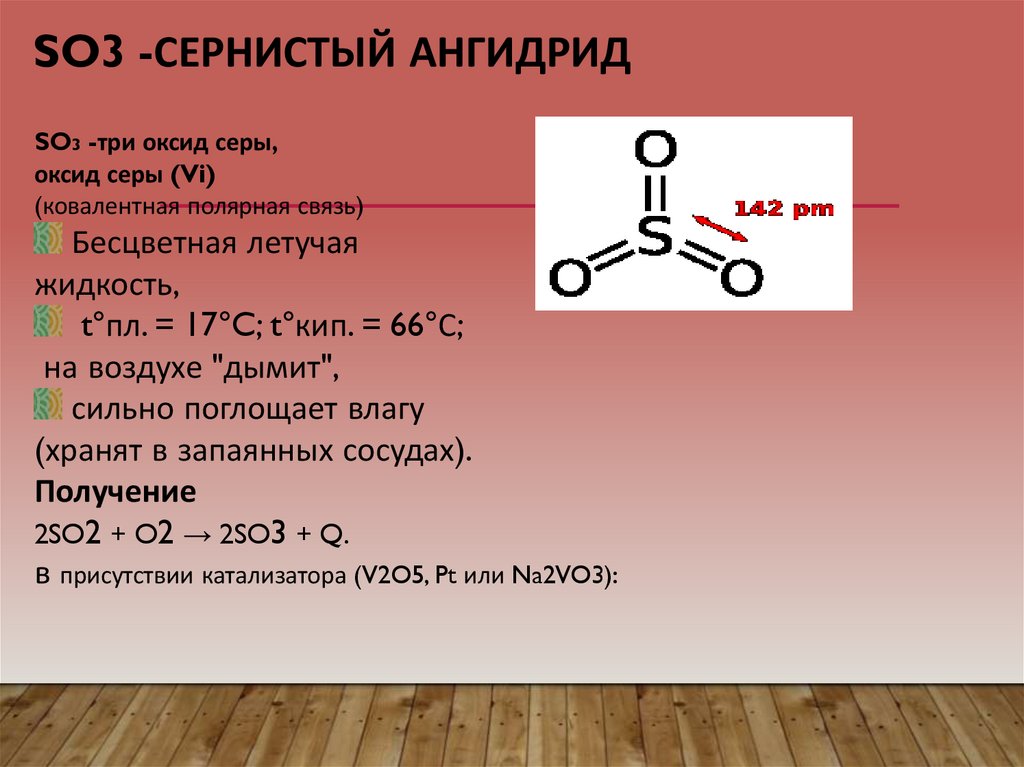
12. SO3 -сернистый ангидрид
SO3 -СЕРНИСТЫЙ АНГИДРИДSO3 -три оксид серы,
оксид серы (Vi)
(ковалентная полярная связь)
Бесцветная летучая
жидкость,
t°пл. = 17°C; t°кип. = 66°С;
на воздухе "дымит",
сильно поглощает влагу
(хранят в запаянных сосудах).
Получение
2SO2 + O2 → 2SO3 + Q.
в присутствии катализатора (V2O5, Pt или Na2VO3):
13.
SO3 — типичный кислотный оксид, ангидридсерной кислоты.
1. Кислотно-основные: При взаимодействии с водой
образует серную кислоту:
SO3 + H2O → H2SO4.
Взаимодействует с основаниями:
2KOH + SO3 → K2SO4 + H2O,
основными оксидами:
CaO + SO3 → CaSO4,
c амфотерными оксидами:
3SO3 + Al2O3 → Al2(SO4)3.
SO3 растворяется в 100%-й серной кислоте, образуя
олеум:
H2SO4 (100 %) + SO3 → H2S2O7.
14.
Загрязнение воздуха оксидаминеметаллов, особенно оксидами серы и
азота, приводит к образованию
кислотных дождей. Эти оксиды могут
попадать в атмосферу из естественных
источников – например, при извержении
вулканов или при разложении
органических веществ. Но кроме того, они
образуются и при горении ископаемого
горючего: угля, нефти и природного газа.
15.
Кислоты попадают на землю вместе с дождем, снегом илиградом (так называемое «влажное осаждение»). Даже на
большом расстоянии от источника загрязнения дождь имеет
слабокислую реакцию.
16.
Кислотная среда ускоряет рост грибков и бактерий, оказывая при этом вредноевлияние на растения. Некоторые растения способны преобразовывать оксид
серы (IV) в другие соединения, которые скапливаются в кончиках листьев.
Отравленные листья увядают и опадают.
17.
Кислотные дожди также разрушают здания, памятникии металлические конструкции.
18.
Кислотные дожди воздействуют на пигменты, входящие всостав красок
19. Заполнение таблицы
ЗАПОЛНЕНИЕ ТАБЛИЦЫSO2 сернистый газ или оксид серы (IV)
SO3 сернистый ангидрид или оксид
серы (VI)
20.
ДЗЗадание
№1
Задание
№2
Задание
№3
Задание
№4
• Осуществите превращения:
• Cu2S → SO2 → SO3 → H2SO4 → Na2SO4
• C
какими
веществами
будет
взаимодействовать разбавленная серная
кислота: Ag, FeS, Zn(NO3)2, Fe, CO2,
Al(OH)3,
MgO,
BaCl2?
Приведите
уравнения возможных реакций.
• Hg + H2SO4 (конц) = SO2 + … + …
• Расставьте
коэффициенты
методом
электронного баланса.
• 1 кг технической серы, содержащей 4%
примесей, сожгли в 896 л (н.у.)
кислорода.
Определите
массу
полученного оксида серы (IV).


















 chemistry
chemistry








