Similar presentations:
Cоединения серы и их значение
1. Тема:Cоединения серы и их значение.
2.
Почему геохимик А.Е.Ферсман назвалсеру «двигателем химической
промышленности»?
3. Цели урока:
Рассмотреть свойства важнейшихсоединений серы – сероводорода и её
солей, оксидов серы, сероводородной и
сернистой кислот
Освоить навык определения ионов S2- и
сульфит-ионов SО32Развить способность эффективно
использовать знаковые системы,
наблюдения, сравнения, делать выводы
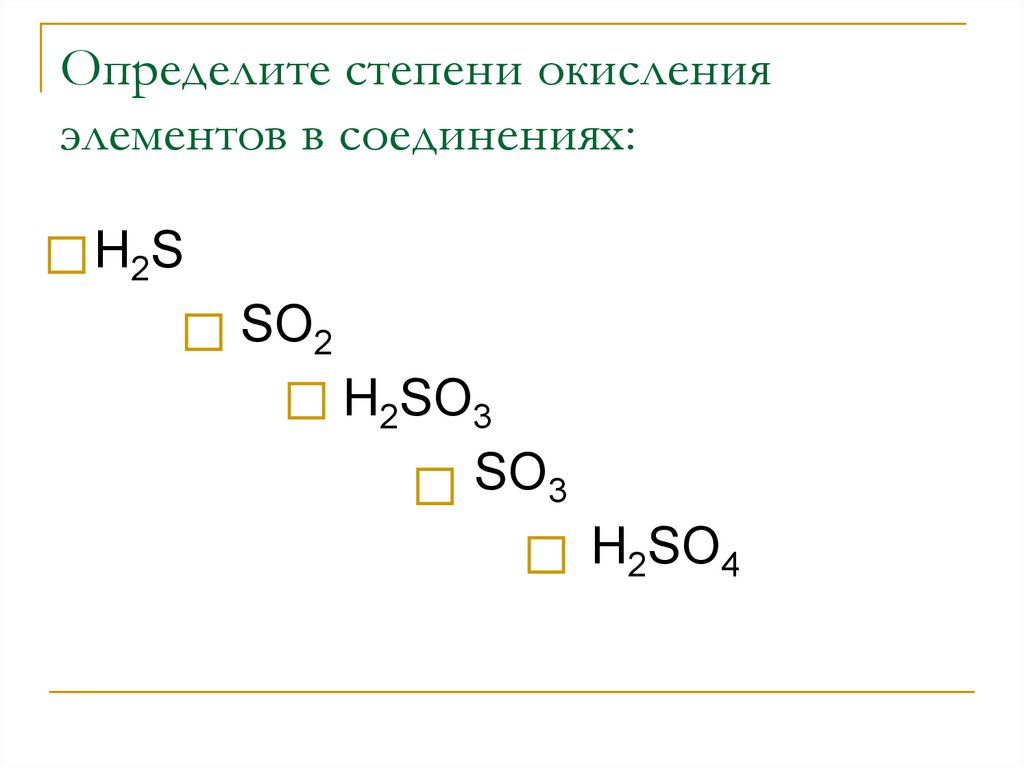
4. Определите степени окисления элементов в соединениях:
Н2SSO2
Н2SO3
SO3
Н2SO4
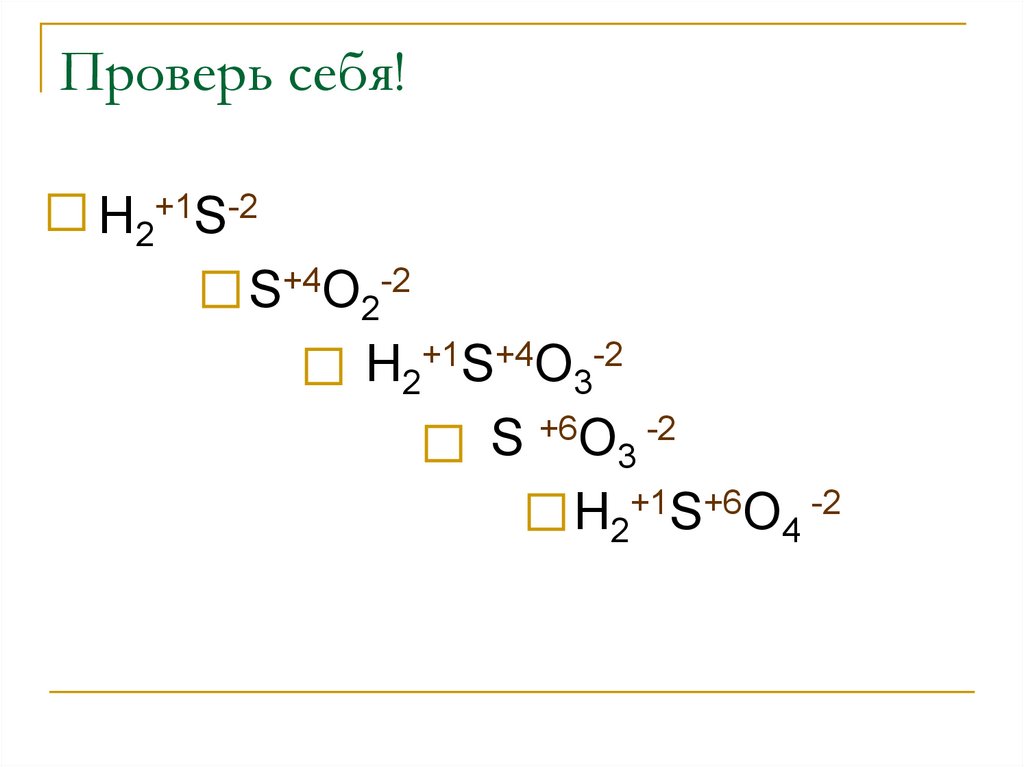
5. Проверь себя!
Н2+1S-2S+4O2-2
Н2+1S+4O3-2
S +6O3 -2
Н2+1S+6O4 -2
6.
7.
Н2 SВст речает ся в природе в сост аве нефт и,
природного газа, вулканического газа и
в горячих ист очниках. . Кроме т ого, он
образует ся при разложении белков
погибших живот ных и раст ений, а т акже
при гниении пищевых от бросов.
8.
Сероводород нередко входит в составвулканических газов. Являясь сильным ядом,
он часто вызывает массовую гибель
животных. На склоне одного из вулканов о.
Ява есть глубокая и обширная впадина, со
дна которой из подземных источников
беспрерывно струится сероводород. Эта
впадина получила название Долины смерти,
так как ее дно устлано скелетами животных и
людей, попавших в зону отравляющего
действия сероводорода.
8
9. Пятигорск – природный музей минеральных вод
Однако несмотря на свое пагубное действие на человека, сероводородиспользуют и в медицинских целях. Являясь составной частью
природных вод, он определяет их лечебные свойства. Купание в
сероводородных ваннах вызывает легкое раздражение кожи,
расширение кровеносных сосудов и тем самым оказывает
целительное действие при ревматизме и других болезней.
Особенно славятся сероводородные лечебные источники Мацесты
и Пятигорска.
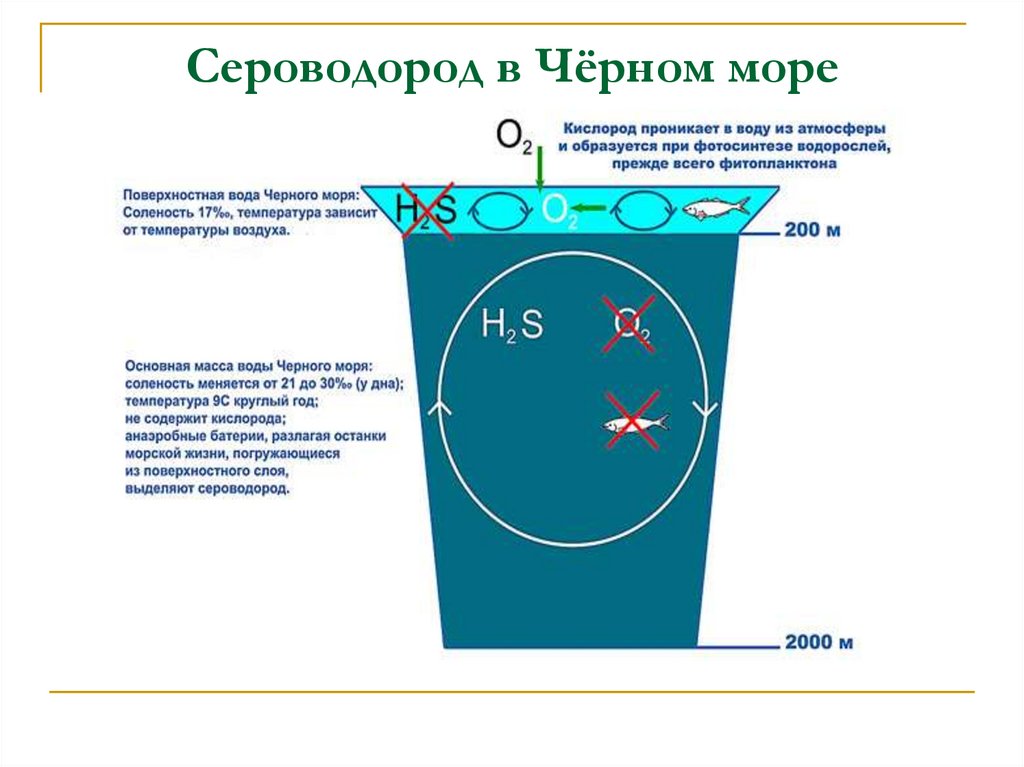
10. Сероводород в Чёрном море
11. Сероводород Н2S-2(низшая степень окисления)
Физические свойства:Бесцветный газ с запахом тухлых яиц,
ядовит.
Предельно допустимая концентрация в
воздухе 10мг/м3
Водный раствор – сероводородная
кислота
12. Н2S-2 - сероводород
-2Н2S - сероводород
Химические свойства:
1.Реакция взаимодействия с кислородом
Н2S-2 – восстановитель
А) 2Н2S-2 + O20 = 2S0↓ + 2Н2O-2
недостаток
Б)
2Н2S-2 + 3O20= 2S+4О2+ 2Н2O-2
избыток
2. Реакция взаимодействия с растворами галогенов:
2Н2S-2 +I20 = 2S0↓ + 2Н+1I-1
йод
13. Отравляющее действие сероводорода объясняется тем, что он разрушает гемоглобин, превращая содержащееся в нем железо в сульфид.
Цвет крови изменяется: изкрасной она становится черно-зеленой.
Качественная реакция
Pb 2 S 2 PbS
Чёрного цвет а
13
14.
• Загрязнение атмосферы вызывает почернениеповерхности картин, написанных масляными
красками, в состав которых входят свинцовые
белила. Одной из основных причин потемнения
художественных картин старых мастеров было
использование свинцовых белил, которые за
несколько веков, взаимодействуя со следами
сероводорода в воздухе (образуются в небольших
количествах при гниении белков; в атмосфере
промышленных регионов и др.) превращаются
в PbS.
15. Сероводородная кислота
В воде сероводород мало раст ворим,водный раст вор H2S являет ся очень слабой
кислот ой:
H2S → HS− + H+
С основаниями реагирует :
H2S + 2NaOH = Na2S + 2H2O
(обычная соль, при избыт ке NaOH)
H2S + NaOH = NaHS + H2O
(кислая соль, при от ношении 1:1)
15
16. Cоли: гидросульфиды и сульфиды В природе – 200 минералов-сульфидов
Сульфиды свинца (галенит или свинцовыйблеск РbS),
ртути (киноварь HgS),
железа (пирит или железный колчедан
FeS2)
цинка ( cфалерит ZnS)
17.
18.
SO2СЕРНИСТЫЙ ГАЗ
Нахождение в природе
Оксид серы (lV) – сернистый газ,
являющийся одним из главных
загрязнителей атмосферного воздуха,
кислотный оксид, очень хорошо
растворимый в воде, образует слабую
сернистую кислоту
19. ФИЗИЧЕСКИЕ СВОЙСТВА
бесцветный газ с характернымрезким удушливым запахом
(запах загорающейся спички);
хорошо растворяется в воде с
образованием нестойкой
сернистой кислоты; под
давлением сжижается при
комнатной температуре;
ядовит; обесцвечивает многие
красители, убивает
микроорганизмы.
19
20. «Последний день Помпеи»
К. П. Брюллов21. Химические свойства:
SO21.Реакция взаимодействия с кислородом
(получение SO3)
2S+4O2+O20=2S+6O3(кислотный,бесцветная жидкость)
2. Реакция взаимодействия с углеродом
S+4O2 +С0 =S0 +СO2
22. Оксид серы (IV) ПРИМЕНЕНИЕ
В пищевой промышленностииспользуется как консервант (Е220) .
Используются при производстве
многих продуктов и полуфабрикатов,
а также для дезинфекции тары.
Негативно влияет на функции почек.
Раздражитель дыхательных путей,
может вызвать приступ астмы;
23.
24. H2S+4О3- сернистая кислота
Существует только в растворе, непрочноесоединение
Н2 SО3 ↔Н+ + НSО3- гидросульфит - ион
НSО3- ↔ Н+ + SО32- сульфит – ион
25. Качественная реакция на сульфит-ион SО32-
Качественная реакция на сульфитион SО32+22Н + SО3 = Н2О+ SО2↑
26. Применение сернистой кислоты H2SO3
Сернистая кислота и её соли применяют каквосстановители, для беления шерсти, шелка и
других материалов, которые не выдерживают
отбеливания с помощью сильных окислителей
(хлора).
Сернистую кислоту применяют при
консервировании плодов и овощей.
Гидросульфит кальция Са(HSO3)2 (сульфитный
щелок) используют для переработки древесины в
так называемую сульфитную целлюлозу (раствор
гидросульфита кальция растворяет лигнин —
вещество, связывающее волокна целлюлозы, в
результате чего волокна отделяются друг от
друга; обработанную таким образом древесину
используют для получения бумаги).
27.
28. S+6O3 Серный ангидрид Серный газ оксид серы (VI), кислотный оксид
В обычных условиях легколетучая бесцветнаяжидкость с удушающим запахом. При
температурах ниже 16,9 °C застывает с
образованием белых кристаллов.
На воздухе "дымит", сильно поглощает влагу
(хранят в запаянных сосудах)
29. Оксид серы (VI) Физические свойства
В обычных условиях легколетучаябесцветная жидкость с удушающим
запахом. При температурах ниже 16,9 °C
застывает с образованием белых
кристаллов.
29
30. ХИМИЧЕСКИЕ СВОЙСТВА
При взаимодействии с водой образует сернуюкислоту:
SO3 + H2O → H2SO4.
Растворяется в 100%-й серной кислоте, образуя
олеум:
H2SO4 (100 %) + SO3 → H2S2O
30
31.
Проявляет свойства типичного кислотногооксида:
Взаимодействует с основаниями:
2KOH + SO3 → K2SO4 + H2O,
основными оксидами:
CaO + SO3 → CaSO4,
c амфотерными оксидами:
3SO3 + Al2O3 → Al2(SO4)3.
31




























 chemistry
chemistry








