Similar presentations:
Функции белков. Chapter 5
1.
ФУНКЦИИБЕЛКОВ
(CHAPTER 5)
The presentation is
prepared by Ali Tilek
2.
В гл. 4 мы показали, что функция фибриллярных белков в качестве структурных
элементов клеток и тканей зависит от устойчивых, длительных взаимодействий между
идентичными полипептидными цепями
В данной главе мы увидим, что функции многих других белков реализуются через
взаимодействия со множеством различных молекул. Большинство этих
взаимодействий мимолетны, тем не менее они могут быть основой сложных
физиологических процессов, таких как перенос кислорода, иммунные реакции и
сокращение мышц (эти три темы мы рассмотрим более подробно).
На данных примерах можно проиллюстрировать ключевые принципы
функционирования белков:
3.
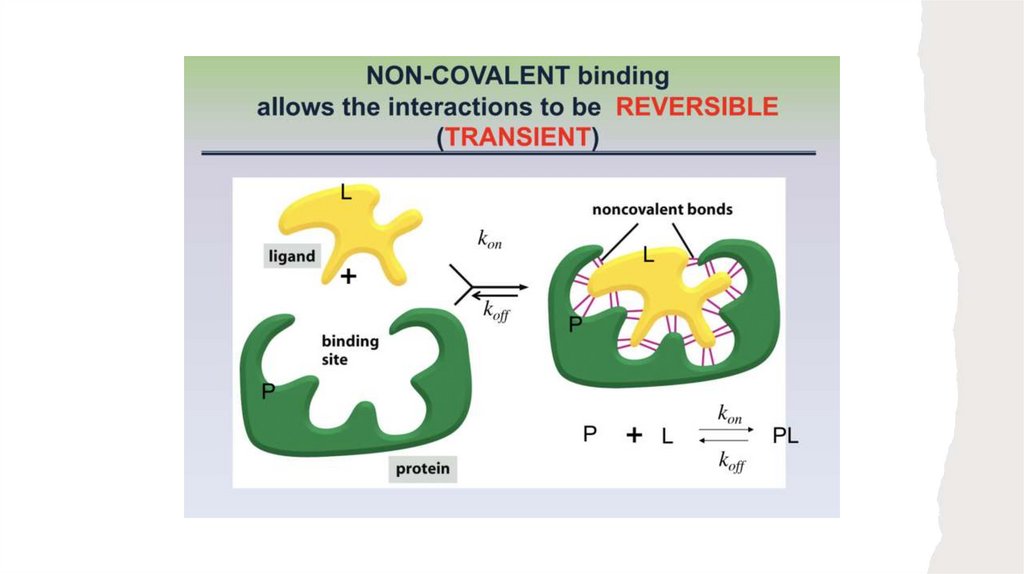
1) В функционировании многих белков важную роль играет обратимое связываниедругих молекул. Молекула, которая обратимо связывается с белком, называется
лигандом. Лигандом может быть любая молекула, в том числе и другой белок.
Краткосрочность взаи- модействия белка с лигандом имеет важнейшее значение для
жизни, поскольку позволяет организму быстро и обратимо реагировать на изменение
внешних условий и метаболи- ческих процессов.
2) Участок связывания лиганда на молекуле белка называется центром связывания; он
подходит соответствующему лиганду по размеру, форме, заряду, а также по
гидрофильности (гидрофобности). Кроме того, это взаимодействие является
специфическим: белок связывается всего с одним или несколькими типами молекул из
множества окружающих его самых разных соединений. Молекула белка может иметь
центры связывания для нескольких различных лигандов.
4.
5.
6.
3) Молекулы белков обладают большой гибкостью. Изменения их конформации могут
быть едва различимыми и являться результатом внутримолекулярных колебаний и
незначительных перемещений аминокислотных остатков в молекуле. Подобные
изменения конформации иногда называют «дыханием» белка. Однако возможны и
довольно резкие изме- нения конформации, при которых основные структурные
элементы могут сдвигаться на несколько нанометров. Специфические
конформационные изменения очень часто играют ключевую роль в функционировании
белка.
4) Связывание белка с лигандом часто сопряжено с конформационными изменениями
в молекуле белка, в результате которых достигается лучшая совместимость лиганда с
центром связывания, а следовательно, и более надежное связывание. Структурные
перестройки, которыми сопровождается взаимодействие белка с лигандом, называют
индуцированным соответствием.
7.
8.
5) В белках, состоящих из нескольких субъединиц, конформационные изменения в
одной субъединице часто влекут за собой изменения в другой субъединице
6) Взаимодействие лигандов с белками может регулироваться, что обычно
достигается посредством специфических взаимодействий с еще одним или
несколькими лигандами. Эти дополнительные лиганды могут вызывать
конформационные изменения в молекуле белка, влияющие на связывание первого
лиганда.
Говоря о функциях белков, следует отдельно остановиться на ферментах. Ферменты
связывают другие молекулы и способствуют их превращениям, т. е. катализируют
реак- ции. Молекулы, подвергающиеся изменениям в ферментативных реакциях,
называют не лигандами, а субстратами, а участок молекулы фермента, где протекает
ферментативная реакция, называют каталитическим или активным центром.
9.
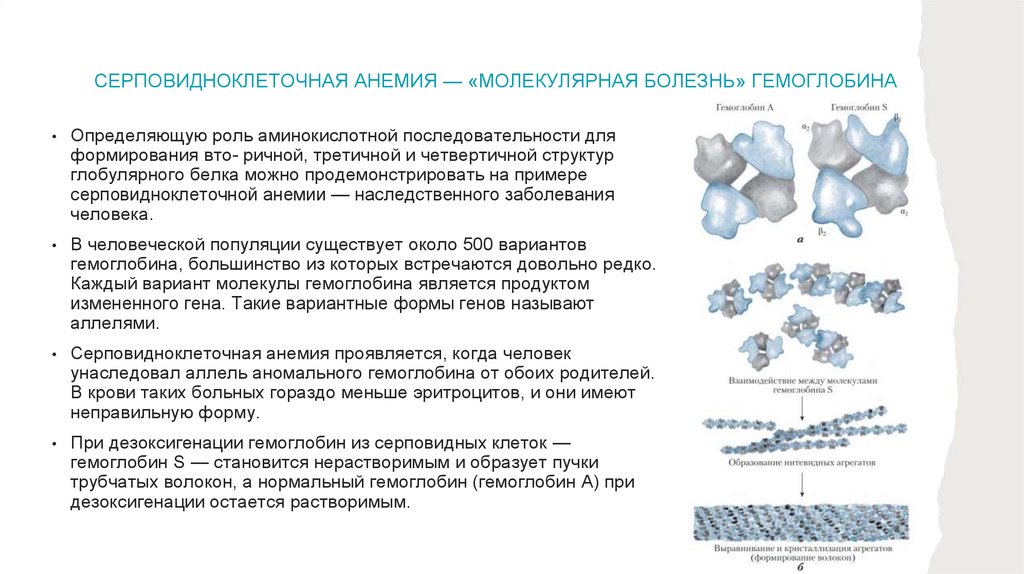
ОБРАТИМОЕ СВЯЗЫВАНИЕ БЕЛКОВ С ЛИГАНДАМИ: БЕЛКИ,СВЯЗЫВАЮЩИЕ КИСЛОРОД
Возможно, миоглобин и гемоглобин являются наиболее хорошо изученными белками;
для них впервые была определена трехмерная структура. Наши сегодняшние знания
об этих белках — результат исследований, которые на протяжении нескольких
десятилетий проводили тысячи биохимиков. Важно отметить, что на примере этих
белков можно проиллюстрировать практически все ключевые аспекты основного
биохимического процесса — обратимого связывания лиганда с белком. Эти
классические модельные белки могут многое рассказать о том, как белки
функционируют.
10.
КИСЛОРОД СВЯЗЫВАЕТСЯС ПРОСТЕТИЧЕСКОЙ ГРУППОЙ — ГЕМОМ
Кислород из-за двойной ковалентной связи является неполярным и плохо
растворяется в воде
Также диффузия на расстояния свыше несколько миллиметров
неэффективна
Поэтому в ходе эволюции появились белки которые транспортируют кислород
в большие расстояния
Однако боковая цепь ни одной аминокислоты не годится для обратимого
связывания молекулы кислорода.
Поэтому многоклеточные организмы используют для транспорта кислорода
ионы металлов, чаще всего железа.
11.
В присутствии свободных ионов железа образуются очень реакционно-способные
соединения кислорода, такие как гидроксильные радикалы, вызывающие повреждения ДНК
и других макромолекул. Поэтому клетки используют железо в связанной форме, в которой
оно менее активно.
У многоклеточных организмов, особенно тех, в которых комплекс железа с кислородом
должен переноситься на большие расстояния, железо часто встроено в связанную с
белком простетическую группу — гем.
Гем представляет собой сложную циклическую структуру, называемую
протопорфирином, с которой связан ион железа Fe2+
Атом железа имеет шесть координационных связей: четыре связи с атомами азота в
составе плоского порфиринового кольца и две связи, направленные перпендикулярно
плоскости порфиринового кольца. Координационная связь с электронодонорными атомами
азота препятствует окислению гемового железа до состояния Fe3+. Железо в форме Fe2+
обратимо связывает молекулу кислорода, а железо в форме Fe3+ не связывает кислород.
Гем обнаружен в целом ряде белков, отвечающих за перенос кислорода, а также в
некоторых белках, участвующих в окислительно-восстановительных реакциях, например в
цитохромах
12.
13.
14.
15.
В гемовой группе, не связанной с белком, Fe2+ имеет две свободные координационные
связи. Взаимодействие молекулы О2 с двумя молекулами гема (или двумя свободными
ионами Fe2+) может привести к необратимому превращению Fe2+ в Fe3+. В
гемсодержащих белках эта реакция не происходит, поскольку каждый гем спрятан
глубоко внутри белковой структуры и доступ к двум свободным координационным
связям железа затруднен. Одна из этих связей направлена на атом азота боковой
цепи остатка His. Другая служит центром связывания молекулярного кислорода (О2)
При связывании кислорода свойства гемового железа изменяются; это, в частности,
служит причиной изменения темно-красной окраски венозной крови на светло-красную
окраску богатой кислородом артериальной крови. Некоторые небольшие молекулы,
такие как монооксид углерода (СО) и монооксид азота (NO), имеют более высокое
сродство к гемовому железу, чем молекула кислорода. При связывании с гемом
молекулы СО происходит высвобождение О2, вот почему СО (угарный газ) так
токсичен для аэробных организмов. Окружая и изолируя гем, кислородсвязывающие
белки регулируют доступ к нему СО и других небольших молекул.
16.
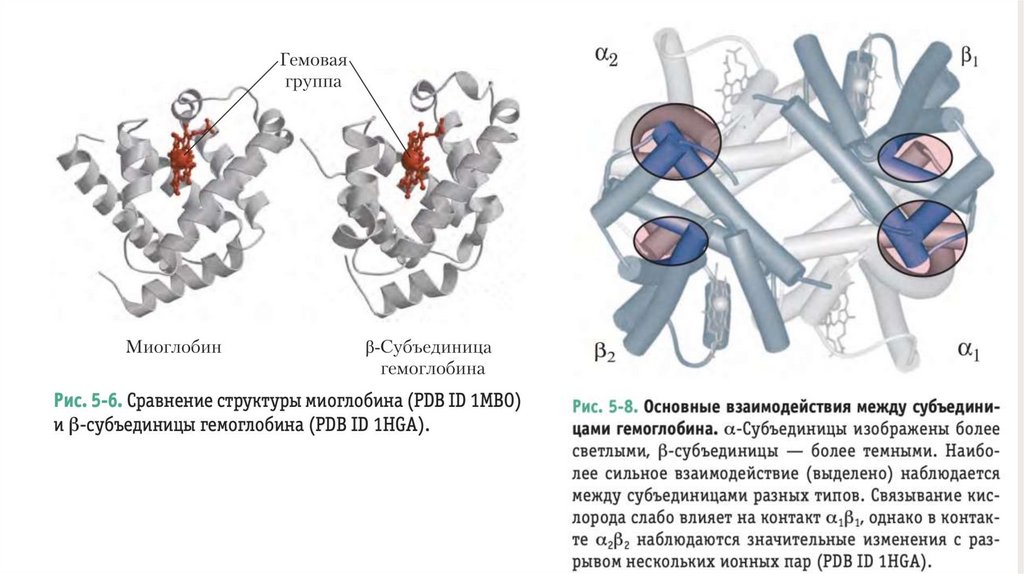
В МИОГЛОБИНЕ ОДИН УЧАСТОКСВЯЗЫВАНИЯ КИСЛОРОДА
Миоглобин (Mb) имеет молекулярную массу 16700
и является сравнительно несложно устроенным
кислородсвязывающим белком, обнаруженным
практически у всех млекопитающих
преимущественно в мышечной ткани
Особенно богаты миоглобином мышцы морских
млекопитающих, например тюленей и китов
Аналогичные миоглобину белки очень широко
распространены и встречаются даже у некоторых
одноклеточных организмов.
Он является типичным представителем
семейства глобинов, все члены которого имеют
сходные первичную и третичную структуры.
17.
Полипептидная цепь миоглобина образует восемь альфа-спиральных участков,
соединенных петлями
В молекуле миоглобина остаток гистидина, связанный координационной связью с
гемовым железом, обозначен как His93 (93-й аминокислотный остаток, считая от Nконца полипептидной цепи миоглобина); иначе он же обозначается как His F8 (восьмой
остаток в альфа-спирали F)
18.
КОЛИЧЕСТВЕННОЕ ОПИСАНИЕ ВЗАИМОДЕЙСТВИЙ БЕЛКОВ СЛИГАНДАМИ
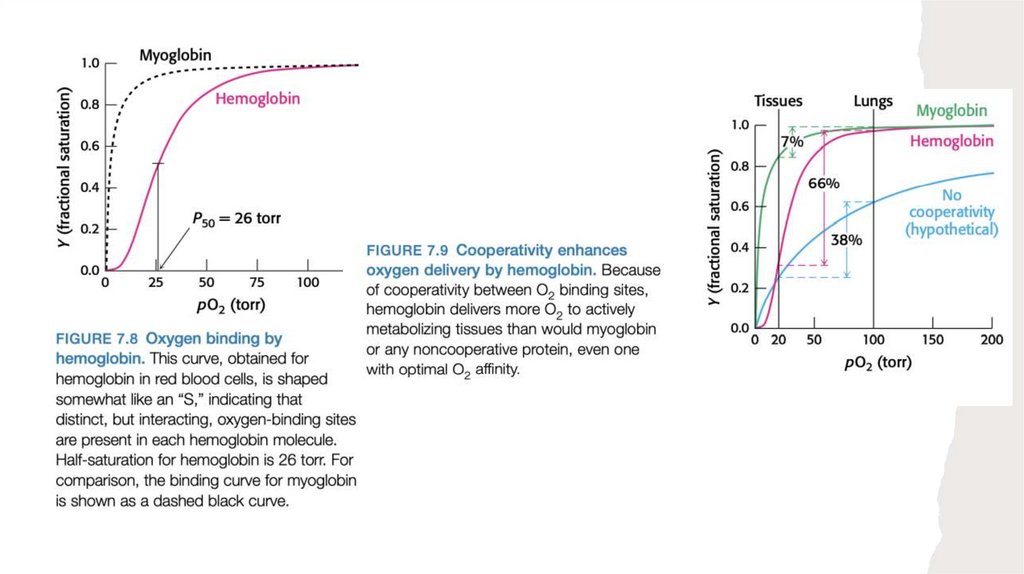
Для выполнения своей функции миоглобин должен быть способен не только
связывать кислород, но и высвобождать его по мере необходимости.
При многих химических процессах происходят подобного рода обратимые
взаимодействия белка и лиганда. Таким образом, количественное описание взаимодействия белка и лиганда является ключевым моментом многих биохимических
исследований.
В общем случае обратимое связывание белка (Р) и лиганда (L) может быть описано
простой обратимой реакцией:
Эта реакция характеризуется константой равновесия Ka
19.
20.
где ka и kd — это константы скорости. Константа Ka — константа ассоциации (не путайте
с константой диссоциации кислоты), описывающая равновесие между комплексом и
составляющими его компонентами в свободном состоянии. Константа ассоциации измеряется в М–1; чем больше значение этой константы, тем выше сродство лиганда и
белка.
Константа равновесия Kа равна отношению скоростей прямой (образование комплекса) и
обратной (диссоциация комплекса) реакций
Реакция образования комплекса описывается константой скорости ka, а реакция
диссоциа- ции — константой скорости kd
константы скорости являются константами пропорциональности, определяющими долю
вещества, реагирующего за данный промежуток времени.
Если в реакции участвует одна молекула, как при диссоциации
это реакция первого порядка, а соответствующая константа скорости (kd) имеет
размерность обратного времени (с–1)
Если реагируют две молекулы, как при образовании комплекса
такая реакция называется реакцией второго порядка, а размерность соответствующей
константы скорости (ka) — M–1 с–1.
21.
Константы равновесия принято обозначать заглавной буквой K, а константы скорости
— строчной k
Если обе части уравнения умножить на концентрацию лиганда, видно, что отношение
кон- центраций связанного и свободного белка прямо пропорционально концентрации
свободного лиганда:
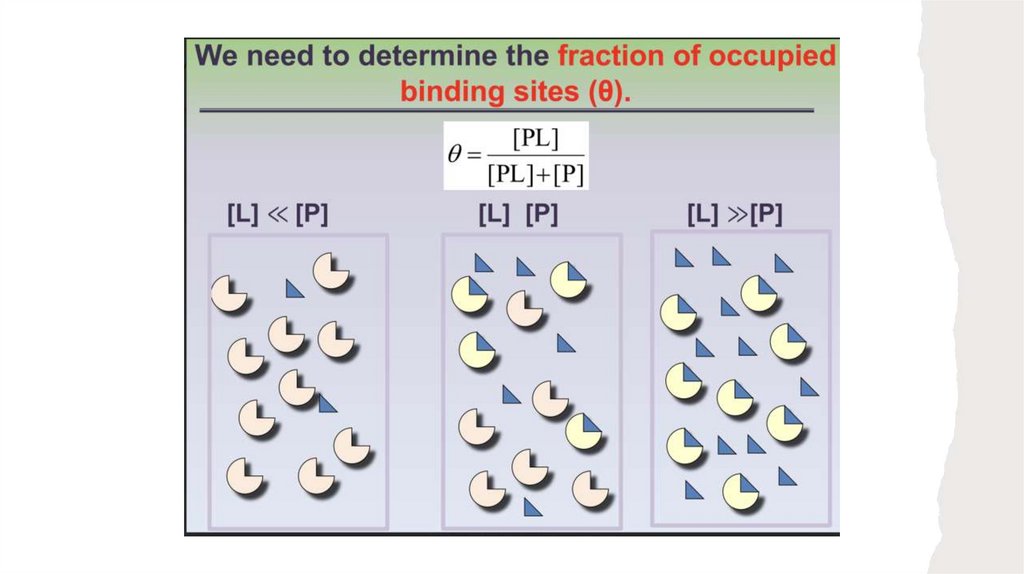
Если концентрация лиганда многократно превышает количество центров связывания
лиганда на молекулах белка, то связывание лиганда с белком практически не влияет
на концентрацию свободного (несвязанного) лиганда, т. е. [L] остается постоянной. Это
допущение применимо к большинству лигандов, связывающихся с белками в клетке, и
значительно упрощает наши вычисления
Теперь мы можем ввести параметр ((тета), отражающий долю занятых центров
связывания лиганда в молекуле белка:
22.
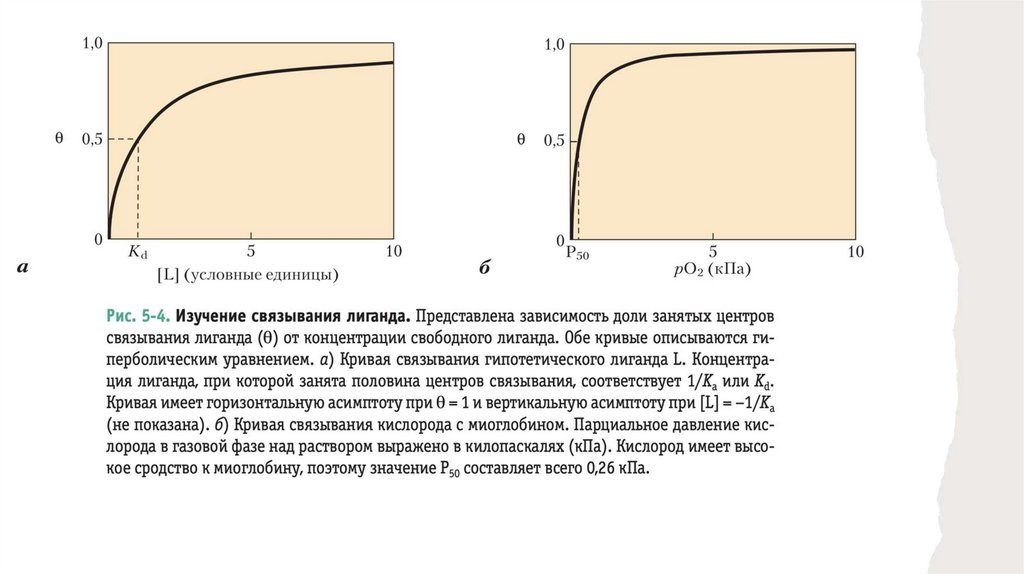
• Значение Ka можно определить из графика зависимости от концентрации свободноголиганда ([L])
• Графиком любого уравнения вида x = y/(y + z) является гипербола, таким образом,




































































 biology
biology








