Similar presentations:
Обмен железа и его нарушения
1. Федеральное государственное бюджетное научное учреждение «Научно-исследовательский институт медицины труда» имени академика
Измерова Н.Ф.Федерального агенства научных организаций
Обмен железа и его нарушения
к.м.н. Цидильковская Э.С.
2.
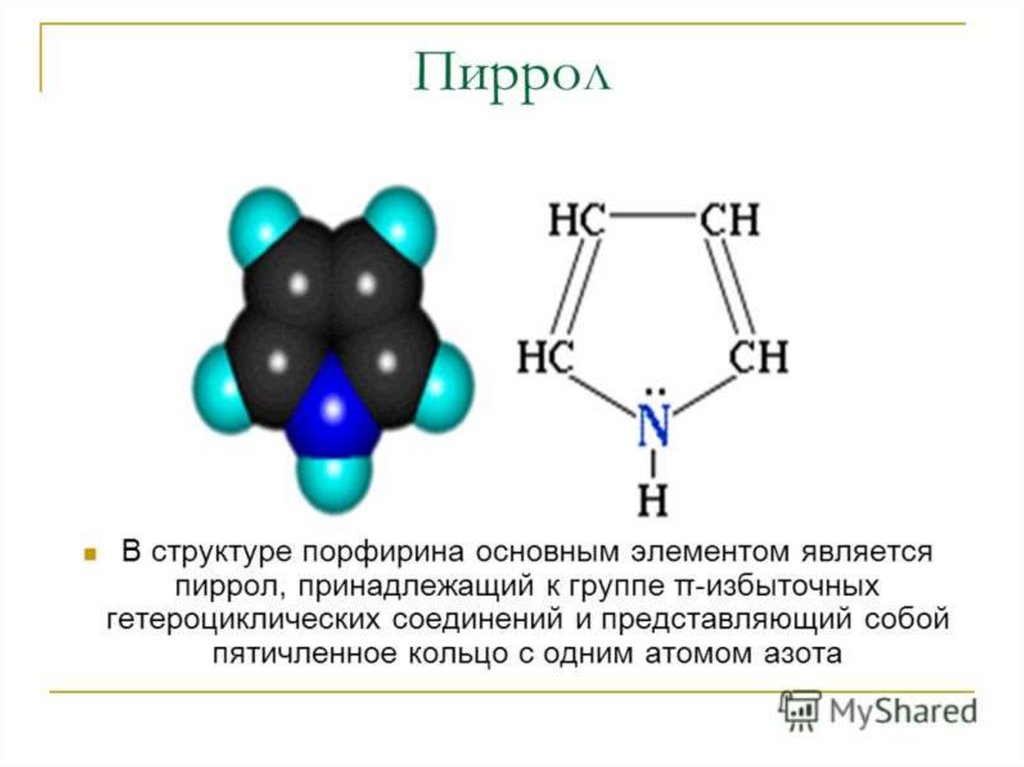
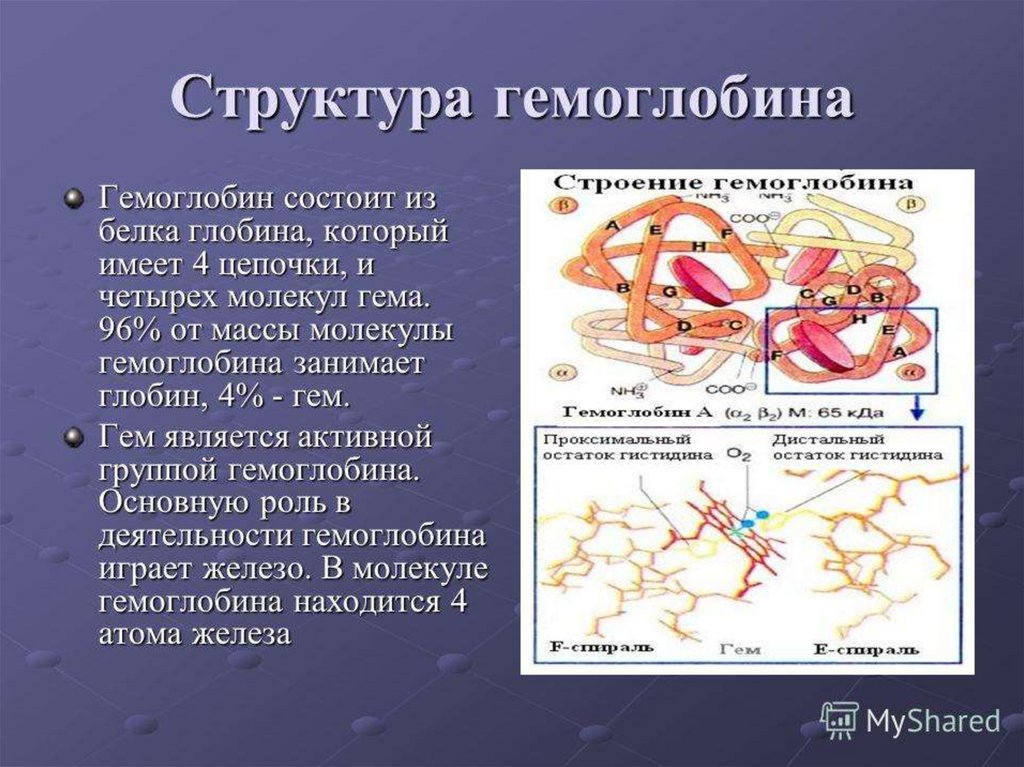
ЖелезоВходит в состав гемоглобина (включено в состав
молекулы гема), где выполняет важнейшую функцию связывание и доставка кислорода клеткам организма
человека.
Поэтому железо необходимо для синтеза и
функционирования гемоглобина.
3.
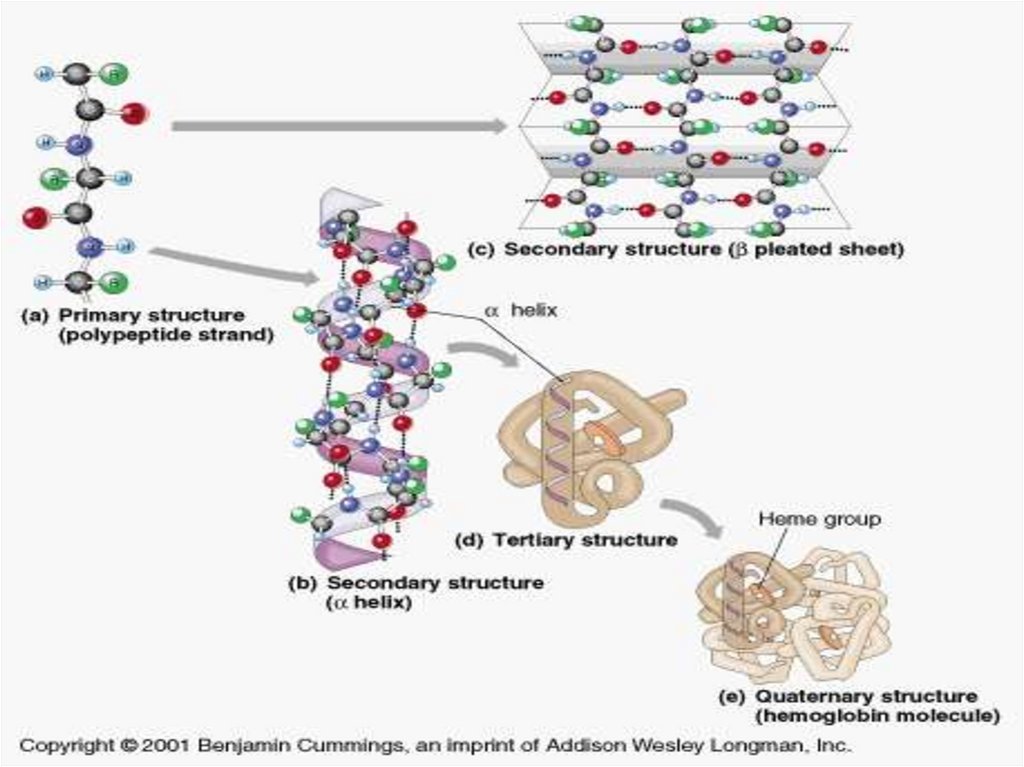
Основная биологическая рольгемоглобина
1. Участие в газообмене между организмом и внешней
средой - обеспечивает перенос кровью кислорода от
легких к тканям и транспорт углекислоты от тканей к
легким.
2. Буферные свойства гемоглобина - образуются мощные
гемоглобинная и оксигемоглобинная буферные
системы крови, способствующие, поддержанию
кислотно-щелочного равновесия в организме
4.
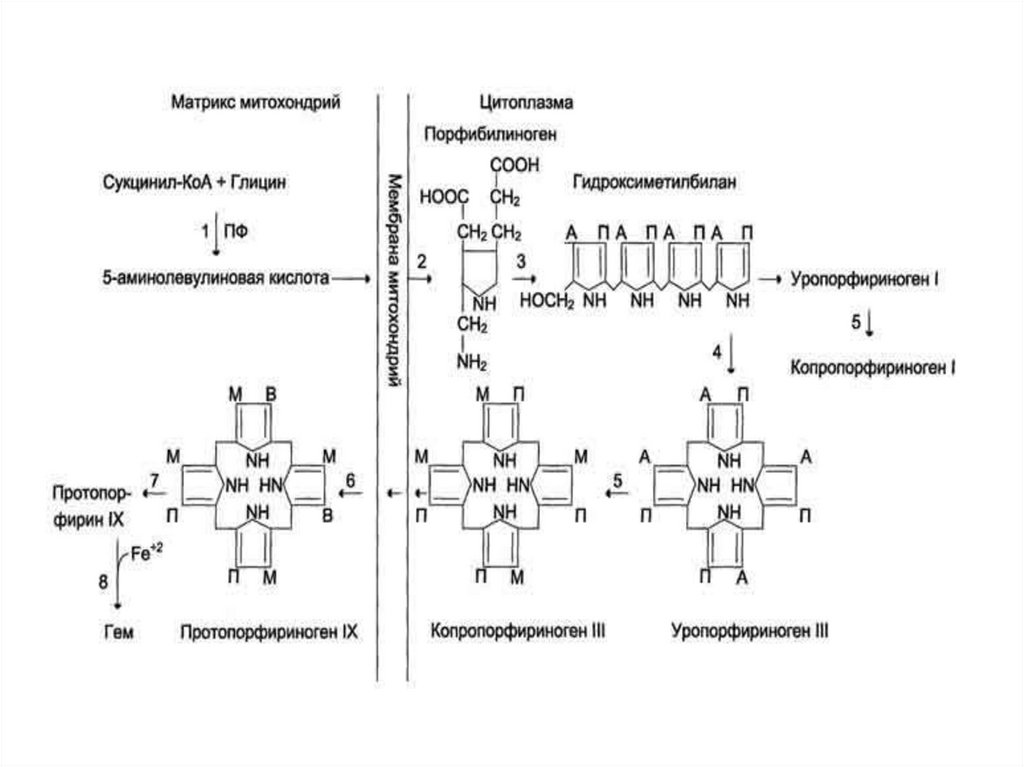
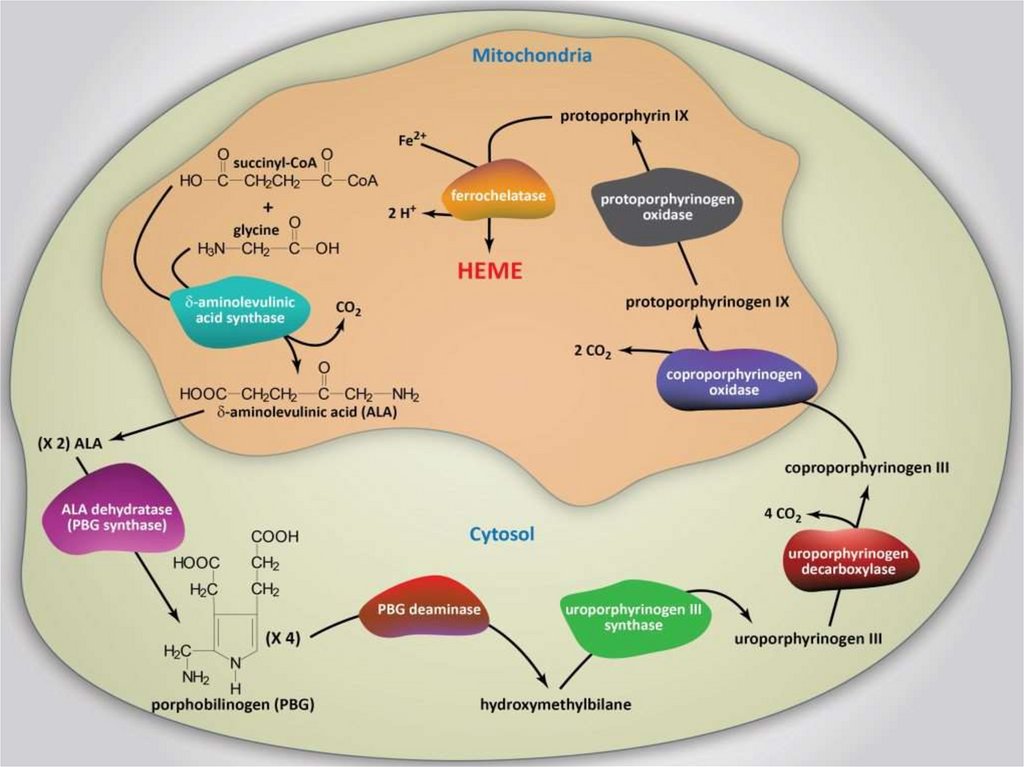
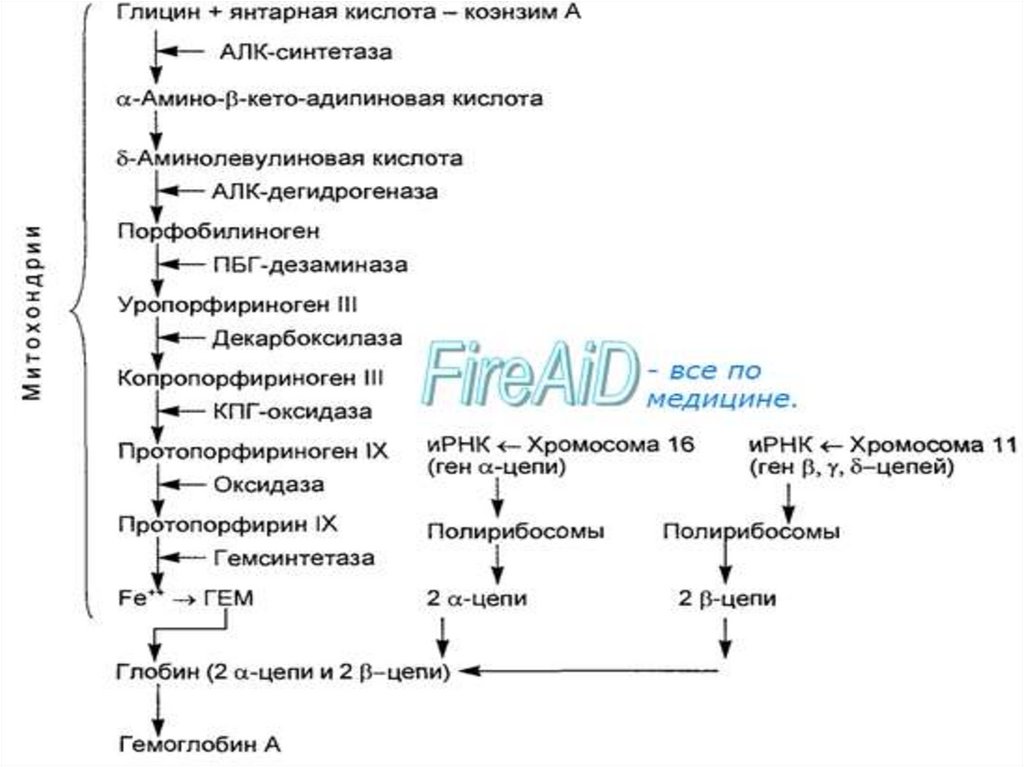
Синтез гемоглобина1. Происходит в кроветворных органах, причем гем и
глобин синтезируются по отдельности. Затем
соединяются, и образуется третичная и четвертичная
структура гемоглобина.
2. Гем синтезируется во всех тканях, но с наибольшей
скоростью в костном мозге и печени. В костном
мозге гем необходим для синтеза гемоглобина в
ретикулоцитах, в гепатацитах - для образования
цитохрома Р450.
5.
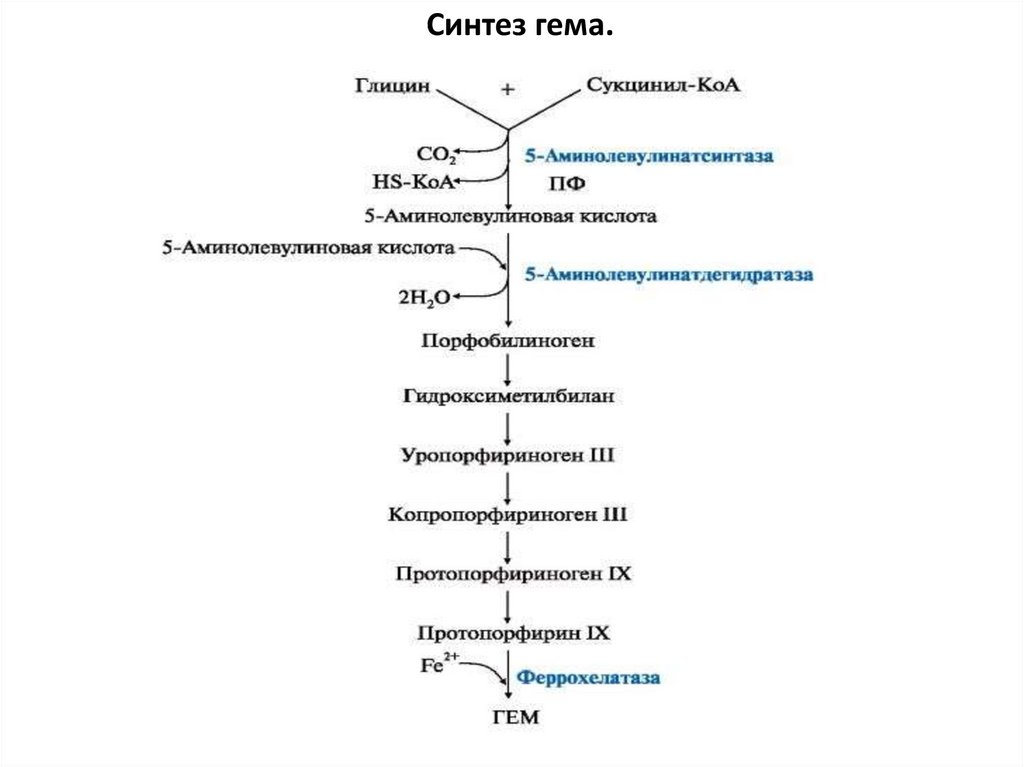
Синтез гема.6.
7.
8.
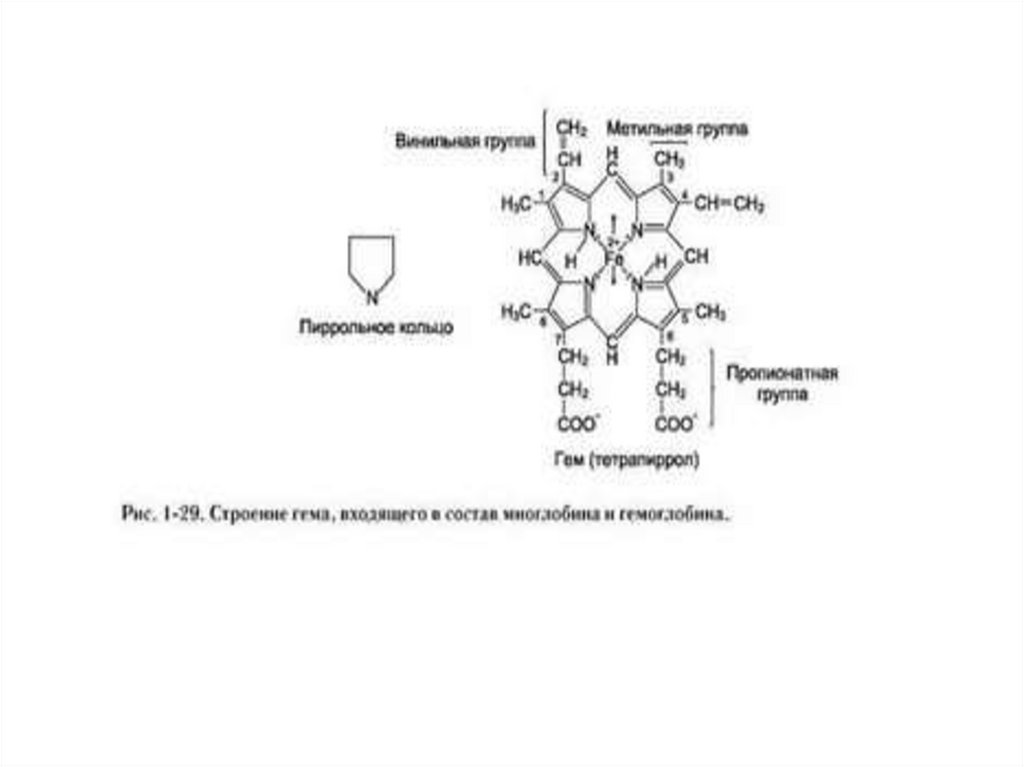
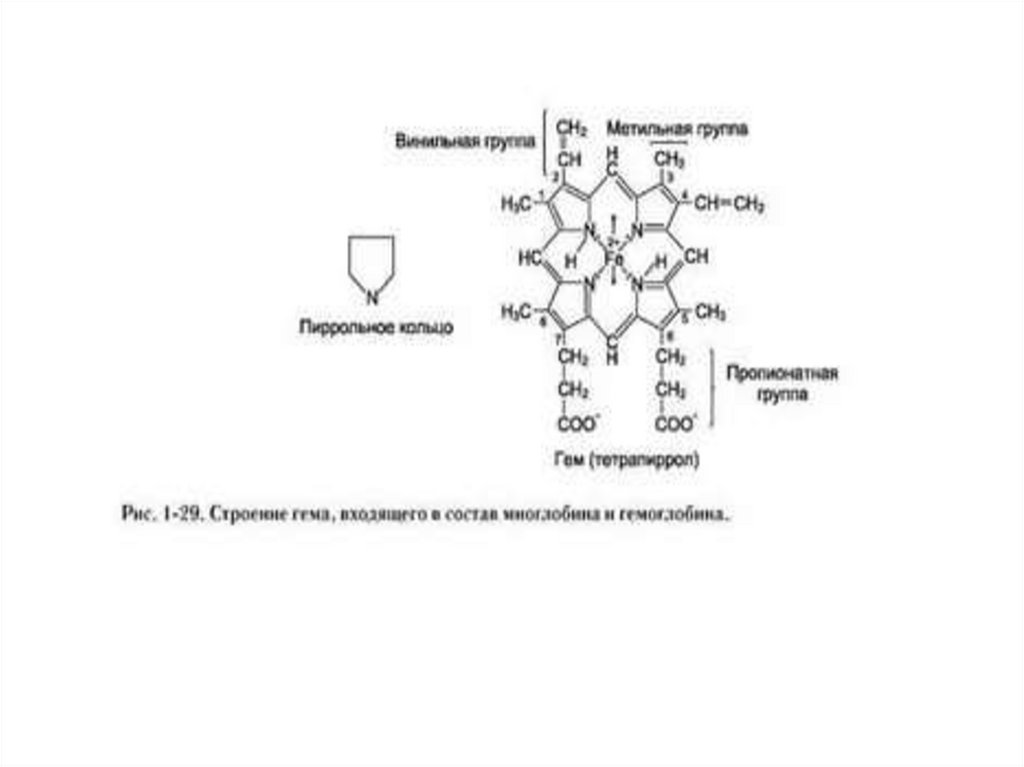
Гем (C34H32O4N4)комплексное соединение протопорфирина IX с
двухвалентным железом. Железо находится в центре
протопорфиринового ядра и связано с четырьмя атомами
азота пиррольных ядер: две связи координационные и две
связи с замещением водорода.
Координационное число железа равно 6, две
валентности остаются неиспользованными:
• одна из них реализуется при связывании гема с глобином,
• ко второй присоединяется кислород или другие лиганды —
CO, F+, азиды, вода
9.
10.
11.
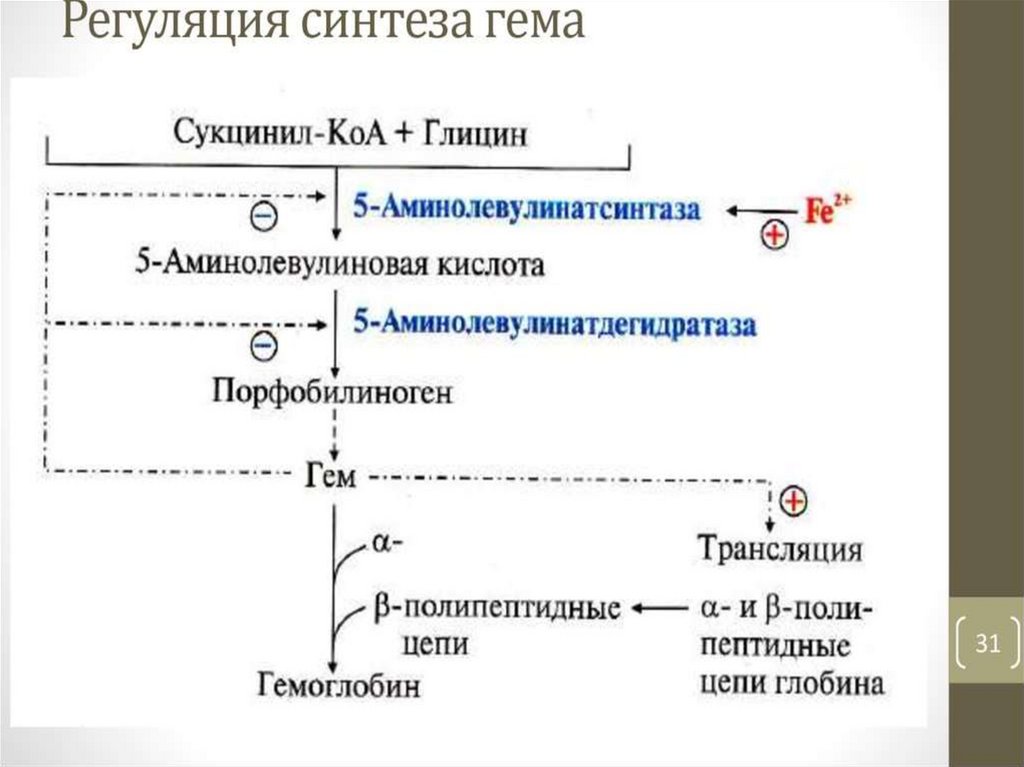
Регуляция биосинтеза гемаРегуляторный фермент - пиридоксальзависимая
аминолевулинатсинтаза. Гем по принципу отрицательной
обратной связи ингибирует аминолевулинатсинтазу и
аминолевулинатдегидратазу и является индуктором
трансляции цепей гемоглобина.
Скорость реакции регулируется:
1) аллостерически (гем-аллостерический ингибитор)
12.
2) на уровне трансляции фермента (синтез фермента на этапетрансляции регулирует железо):
на участке инициации мРНК имеется последовательность
нуклеотидов, образующая шпилечную петлю, которая называется
железочувствительным элементом,
взаимодействие железа с ним вызывает снижение сродства этого
белка к мРНК, кодирующей аминолевулинатсинтазу.
При низких концентрациях железа железосвязывающий
белок присоединяется к железочувствительному элементу,
находящемуся на 5'-нетранслируемом конце мРНК, и трансляция
аминолевулинатсинтазы тормозится.
13.
1. Ферменты синтеза гема аллостерическиингибируются гемом и гемоглобином.
2. Синтез пептидных цепей глобина происходит
только в присутствии гема. При низкой
концентрации гема синтез глобина замедляется.
3. Синтез гема и глобина происходит
координированно, ни один из этих компонентов не
образуется в избыточном или недостаточном
количестве.
14.
15.
16.
Синтез цепей глобина осуществляется на полирибосомахэритробластов и контролируется генами:
11-й хромосомы (β, γ, δ-цепи)
16-й хромосомы (α-цепи).
17.
Глобин белок типа альбуминов, содержит в своей молекуле четыреполипептидные цепи:
• 2 α-цепи, содержащие по 141 остатков аминокислот,
• 2 β-цепи, содержащие по 146 остатков аминокислот.
• Т. о., белковый компонент молекулы гемоглобина
построен из 574 остатков различных аминокислот.
• N-концевые остатки в α– и β –цепях - остатки валина.
• C-концевые остатки α –цепей - остатки аргинина,
а β -цепей — гистидина.
• Предпоследнее положение в каждой из цепей - остатки
тирозина.
18.
19.
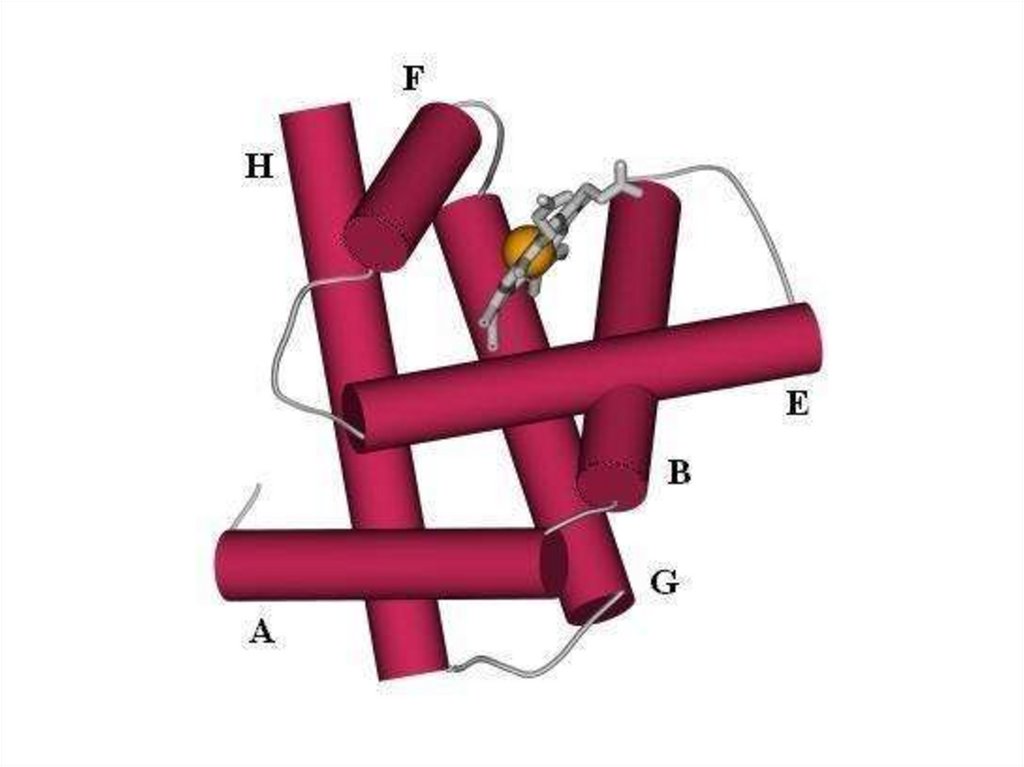
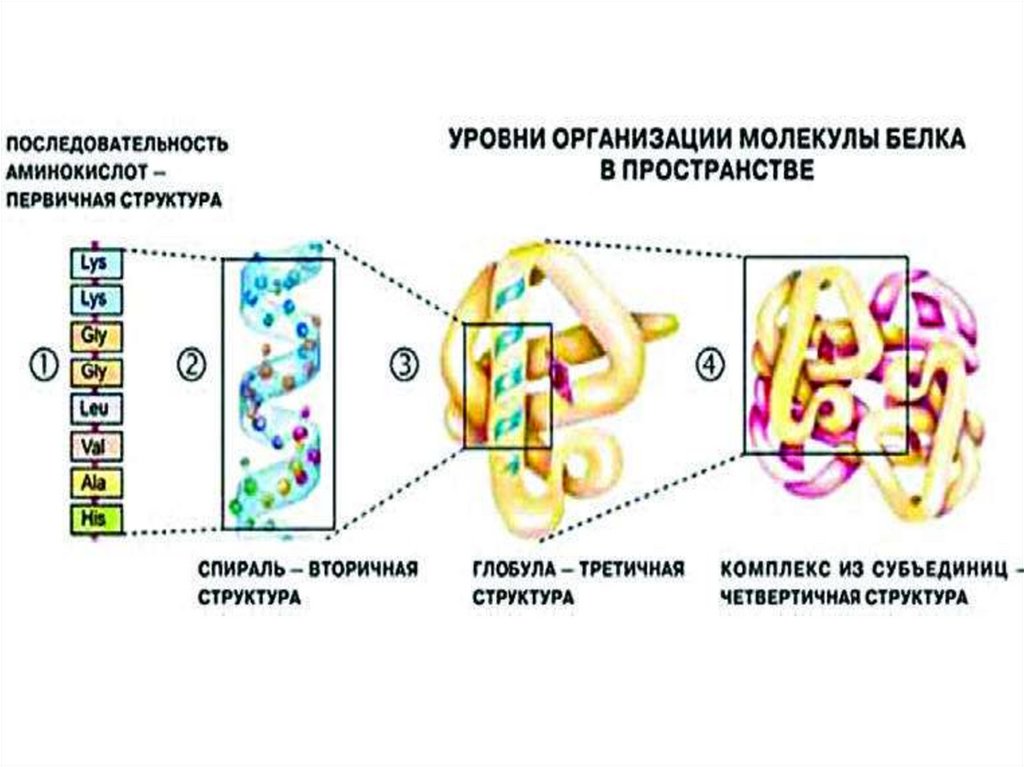
Пространственная (вторичная) структура глобинаα- и β-цепи содержат спиральные сегменты различной
длины, которые построены по принципу α-спиралей
α -цепь имеет 7, а β -цепь — 8 спиральных сегментов,
соединенных неспиральными участками.
Спиральные сегменты, начиная с N-конца, обозначаются
буквами латинского алфавита (А, В, С, D, E, F, G, Н),
Неспиральные участки или углы поворота спиралей
имеют соответствующее обозначение (АВ, ВС, CD, DE и т. д.).
Неспиральные участки на аминном (N) или
карбоксильном (С) конце цепи глобина обозначают
соответственно NA или НС.
Аминокислотные остатки нумеруются в каждом
сегменте и в скобках дается нумерация данного остатка от Nконца цепи.
20.
21.
Третичная структура цепей глобинаСпиральные и неспиральные участки определенным
образом уложены в пространстве –
почти идентично у – α и β-цепей, несмотря на значительные
различия в их первичной структуре.
Это обусловлено специфическим расположением
полярных и гидрофобных групп аминокислот, приводящим к
скоплению неполярных групп во внутренней части глобулы с
образованием гидрофобного ядра. Полярные группы белка
обращены к водной среде, находясь с ней в контакте.
22.
Внутри каждой цепи глобина недалеко отповерхности находится гидрофобная впадина («гемовый
карман») - располагается гем, ориентируясь так, что его
неполярные заместители направлены во внутрь молекулы,
входя в состав гидрофобного ядра.
В результате возникает:
• ок. 60 неполярных контактов между гемом и глобином
• 1-2 полярных (ионных) контакта гема с α– и β-цепями, в
которых участвуют остатки пропионовой к-ты гема,
выходящие наружу из гидрофобного «кармана».
23.
Расположение гема в гидрофобнойвпадине глобина обеспечивает возможность
обратимого присоединения кислорода к Fe2+
гема без окисления последнего до Fe3+
24.
Некоторые аминокислотные остатки, окружающие гем вгидрофобной впадине, относятся к числу инвариантных
аминокислот, т. е. аминокислот, одинаковых для различных
видов животных и существенных для функции Г. :
1. остатки гистидина, «проксимальный гистидин» (87-я
позиция в α- и 92-я позиция в β-цепях),
2. «дистальный гистидин» (58-я позиция в α - и 63-я
позиция в β –цепях)
3. остаток валина Е-11 (62-я позиция в α -цепи и 67-я
позиция в β -цепи).
25.
Связь между так наз. проксимальным гистидином и железомгема является единственной хим. связью между ними (реализуется пятая
координационная связь атома Fe2+ гема) и непосредственно влияет на
присоединение кислорода к гему.
«Дистальный» гистидин непосредственно не связан с гемом и
участия в фиксировании кислорода не принимает. Его значение состоит в
стабилизации атома Fe2+ против необратимого окисления , за счет
образования водородной связи между кислородом и азотом.
Остаток валина (Е-11) является регулятором скорости
присоединения кислорода к гемам:
в β-цепях он стерически расположен так, что занимает то место, куда
должен присоединиться кислород, вследствие чего оксигенация
начинается с α-цепей.
26.
27.
Белковая часть и простетическая группа молекулыгемоглобина оказывают друг на друга сильное влияние:
• Глобин изменяет многие свойства гема, придавая ему
способность к связыванию кислорода.
• Гем обеспечивает-
- устойчивость глобина к действию кислот, нагреванию,
расщеплению ферментами,
- обусловливает особенности кристаллизационных
свойств гемоглобина
28.
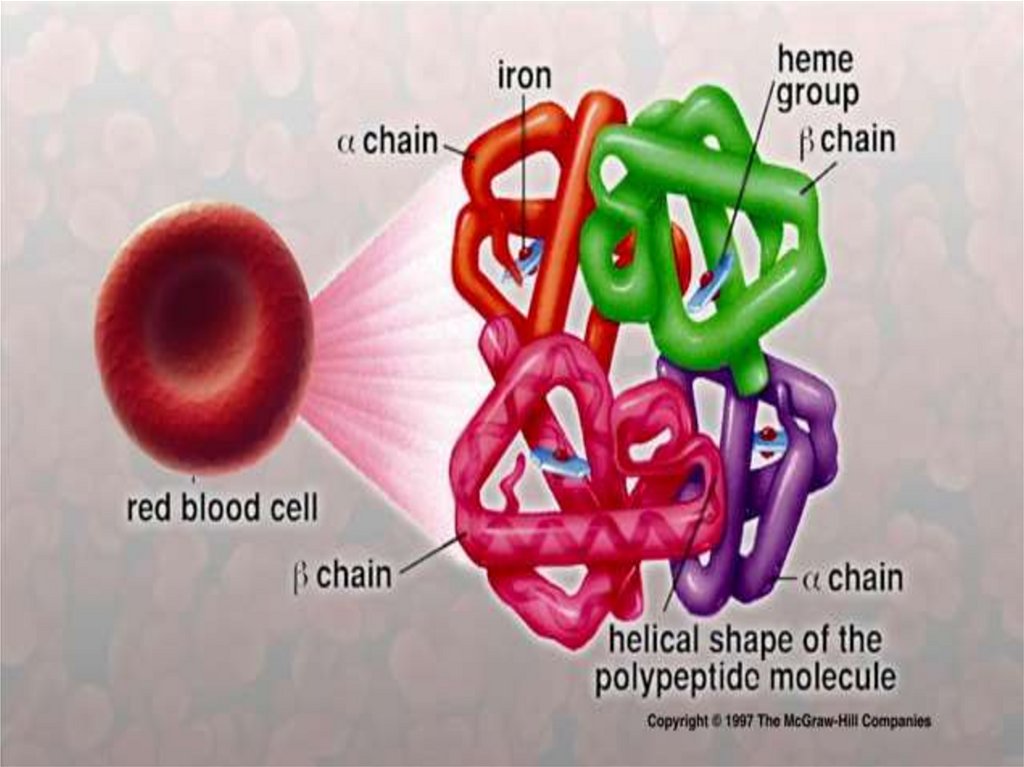
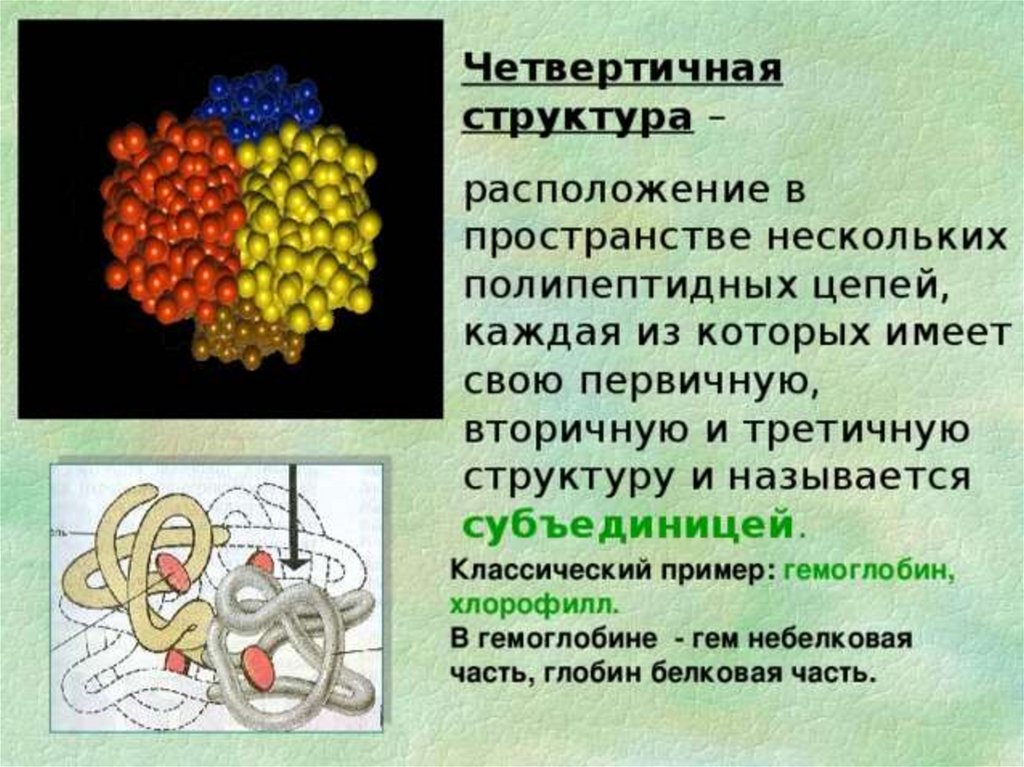
Четвертичная структура гемоглобинаПолипептидные цепи с присоединенными к ним
молекулами гема образуют четыре основные части —
субъединицы молекулы гемоглобина:
α– и β-цепи располагаются по углам тетраэдра вокруг
оси симметрии, причем α– цепи лежат поверх β -цепей и
как бы втискиваются между ними, а все четыре гема далеко
удалены друг от друга.
В целом образуется тетрамерная сфероидная
частица с размерами 6,4 X 5,5 х 5,0 нм.
29.
30.
1. Четвертичная структура стабилизирована солевымисвязями между α—α- и β-β-цепями и двумя видами
контактов между α и β-цепями (α1-β1 и α2-β2).
2. Контакты α1-β1 наиболее обширны, в них участвуют
34 аминокислотных остатка, большинство
взаимодействий неполярно.
3. Контакт α2-β2 включает 19 аминокислотных
остатков, большинство связей также неполярно, за
исключением нескольких водородных связей.
31.
32.
33.
Гемоглобины, синтезирующиеся в периодвнутриутробного развития плода:
1.
Эмбриональный гемоглобин (HbE) синтезируется в
эмбриональном желточном мешке через несколько
недель после оплодотворения. Представляет собой
тетрамер 2α- и 2ς-цепей. Через 2 нед после
формирования печени плода в ней начинает
синтезироваться HbF, который к 6 месяцам замещает
эмбриональный гемоглобин.
2. HbF - фетальный гемоглобин, синтезируется в печени и
костном мозге плода до периода его рождения. Имеет
тетрамерную структуру, состоящую из 2α- и 2γ -цепей.
34.
Гемоглобин FОбладает на 20—30 % большим сродством к O2, чем HbA,
что способствует лучшему снабжению плода кислородом.
• При рождении ребенка до 50—80 % гемоглобина у него
представлены HbF и 15—40 % — типом А - начинает
синтезироваться в клетках костного мозга на 8-м месяце
развития плода.
• HbF заменяется на HbA в первые месяцы после рождения,
а к 3 годам уровень HbF снижается до 2 %.
• Характеризуется значительной устойчивостью к тепловой
денатурации, на чем основаны методы определения его
содержания в крови.
35.
Гемоглобины взрослого человека1. HbA взрослого человека, составляющий 95—98%
гемоглобина крови, содержит 2 α- и 2 β-цепи;
2. HbA2 - малая фракция Г., достигающая максимального
содержания 2,0—2,5%, содержит 2 α- и 2 σ-цепи;
3. Hb1c - гемоглобин А, модифицированный ковалентным
присоединением к нему глюкозы (гликозилированный
гемоглобин).
36.
Гликозилированный гемоглобин• Норма - 4,0-6,2%.
• Измерение Hb1c - показатель среднесуточной
концентрации глюкозы в крови за два предшествующих
месяца.
• Определение Hb1c используют для контроля за
лечением больных сахарным диабетом.
Увеличение Hb1c:
- до 8-10% - хорошо компенсированный,
- до 10-12% - частично компенсированный,
- свыше 12% - некомпенсированный сахарный диабет.
37.
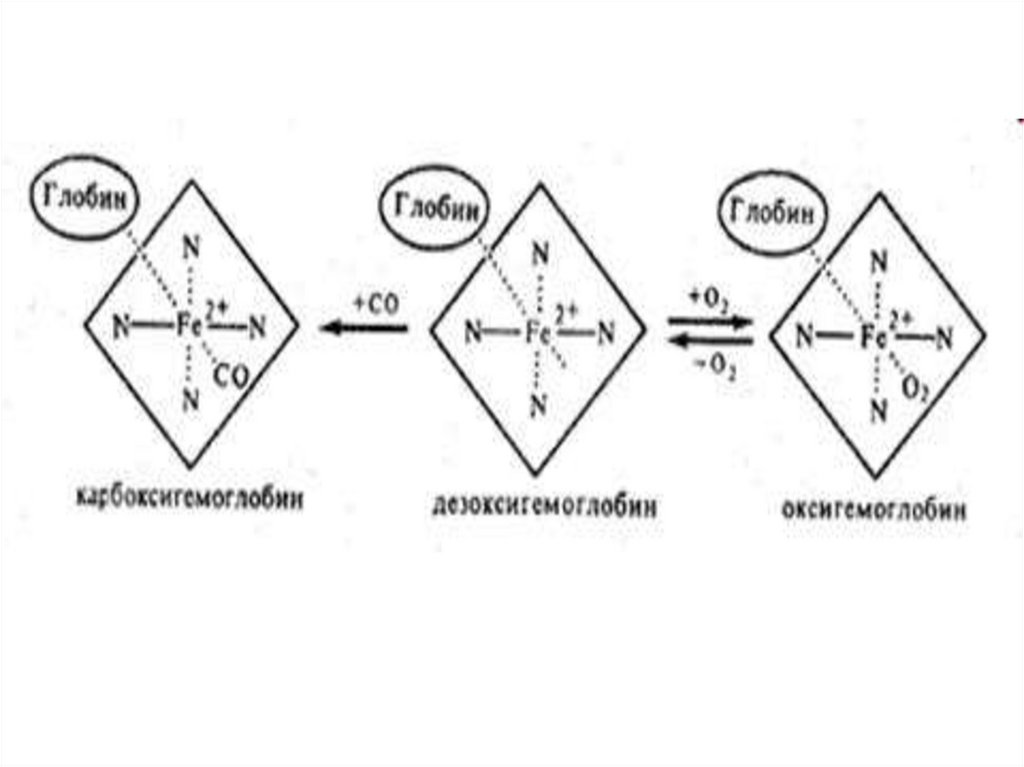
В зависимости от величины валентности атома железа гемаи типа лиганда в молекуле гемоглобин может находиться в
нескольких формах.
1. восстановленный Г. (дезокси-Hb) имеет Fe2+ со свободной
шестой валентностью, при присоединении к нему O2
образуется
2. оксигенированная форма Г. (HbO2)
3. При действии на HbO2 окислителей (феррицианид калия,
нитриты, хиноны) - окисление Fe2+ до Fe3+ - образуется
метгемоглобин, неспособный к переносу O2.
38.
39.
Метгемоглобин1. В зависимости от величины pH среды различают кислую
и щелочную форму метгемоглобина, содержащих в
качестве шестого лиганда H2O или OH-группу.
2. В крови здоровых людей концентрация
метгемоглобина составляет 0,83+0,42% .
3. Метгемоглобин обладает способностью прочно
связывать фтористый водород, синильную кислоту и
другие вещества. Этим его свойством пользуются в мед.
практике для спасения людей, отравленных синильной
кислотой.
40.
Присоединение кислорода к четырем гемамгемоглобина происходит последовательно:
1. Первая молекула кислорода соединяется с гемом
очень медленно, ее сродство невелико, т.к. требуется
разорвать солевые контакты в молекуле
дезоксигемоглобина.
2. Присоединение первой молекулы кислорода
увеличивает сродство к нему оставшихся трех гемов, и
дальнейшая оксигенация Г. происходит значительно
быстрее (оксигенация четвертого гема происходит в
500 раз быстрее, чем первого).
41.
Катаболизм гемоглобинаЭритроциты - время жизни примерно 120 дней.
При физиологических условиях в организме взрослого
человека разрушается около 1-2x1011 эритроцитов в
сутки - в ретикулоэндотелиальных клетках селезёнки,
лимфатических узлов, костного мозга и печени.
При старении эритроцитов снижается содержание
сиаловых кислот в составе гликопротеинов плазматической
мембраны. Изменённые углеводные компоненты
гликопротеинов мембран эритроцитов связываются
рецепторами клеток РЭС, и эритроциты «погружаются» в них
эндоцитозом.
Распад эритроцитов начинается с распада
гемоглобина на гем и глобин и последующего гидролиза
ферментами лизосом белковой части гемоглобина.
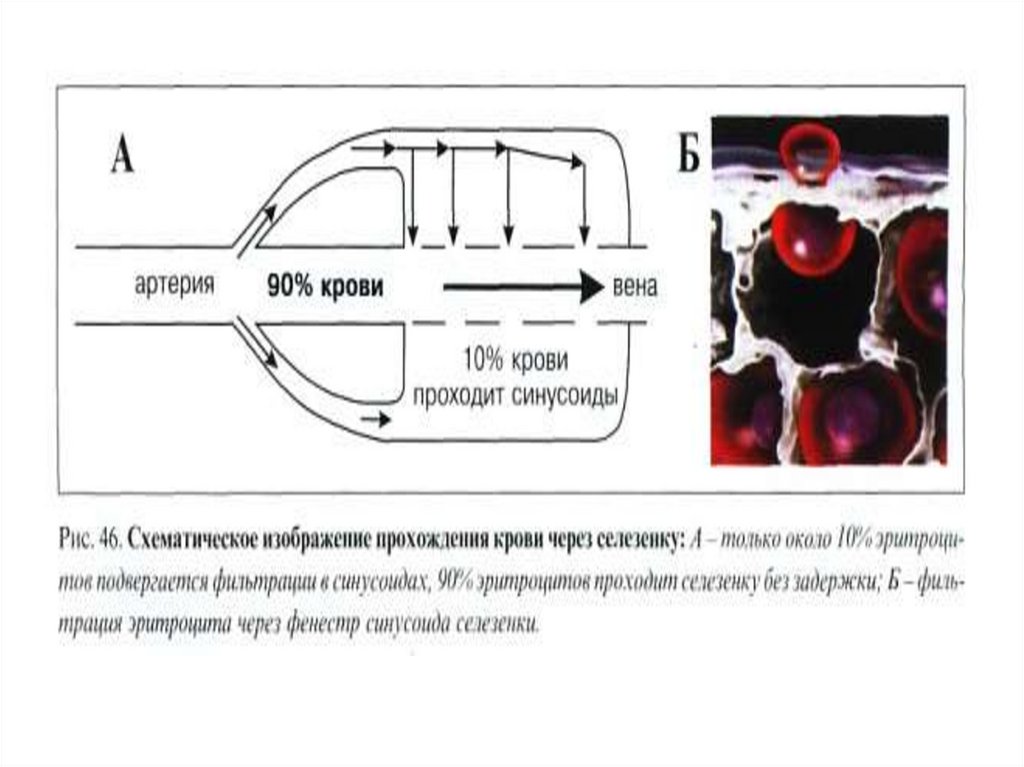
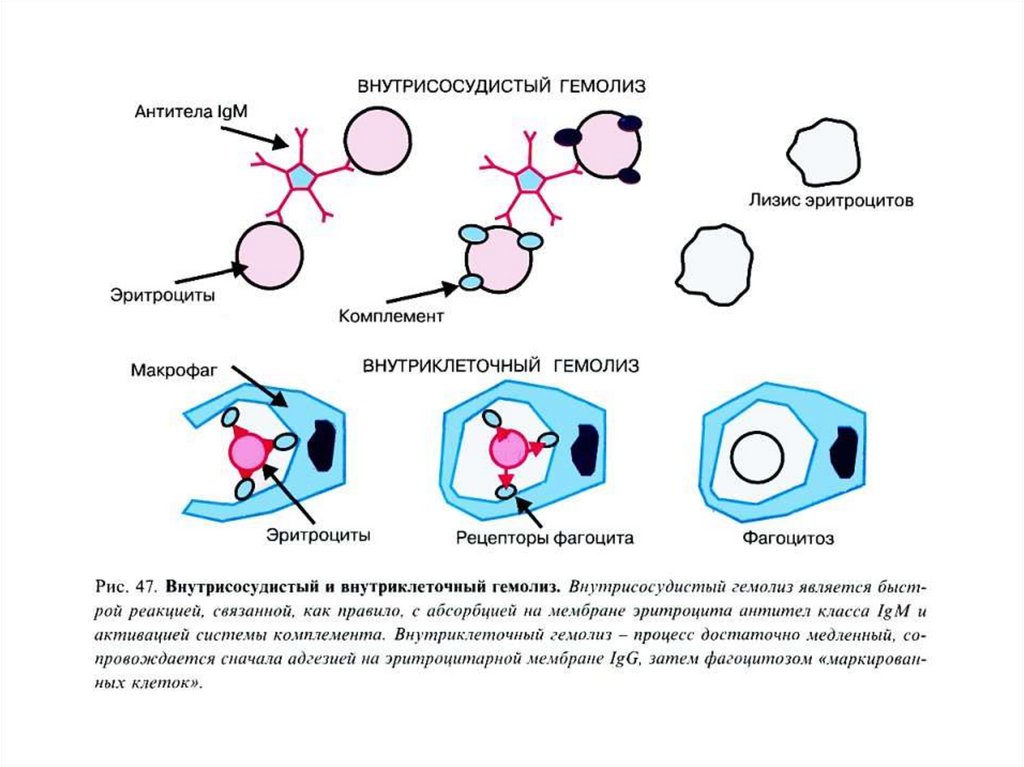
42. Внутриклеточный гемолиз
Эритроциты разрушаются путем фрагментации(эритрокариорексиса) с последующим лизисом и
эритрофагоцитозом в органах РЭС, преимущественно в
селезенке, частично в печени.
В макрофагах РЭС заканчивается разрушение эритроцита
(внутриклеточный гемолиз).
В нормальном организме с помощью внутриклеточного
гемолиза разрушается почти 90% эритроцитов.
43.
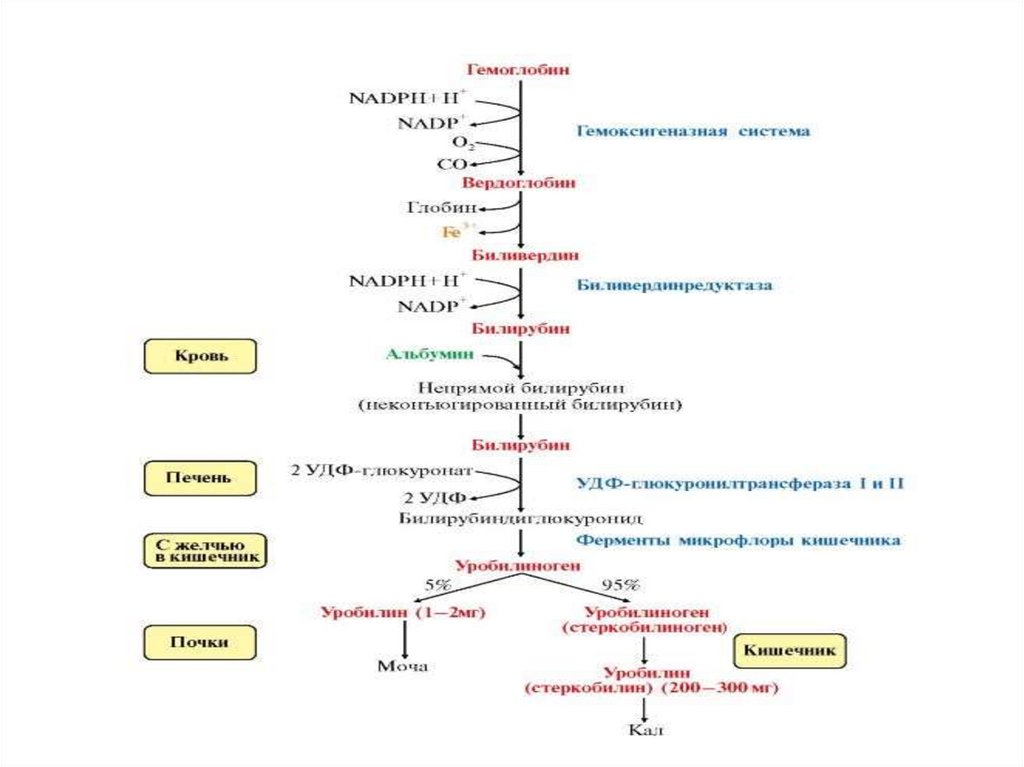
44. Механизм распада гемоглобина
• Отщепление молекулы глобина и железа• Под действием гемоксигеназы происходит окисление α-метиновой
связи, при этом гем теряет свою цикличность, образуя линейную
структуру – биливердин.
• Путем ферментативного восстановление γ-метиновой связи
биливердин-редуктазой биливердин превращается в билирубин.
• Билирубин связывается с альбумином и поглощается гепатоцитами.
• Конъюгация с глюкуроновой кислотой под действием
уридилдифосфат (УДФ)-глюкуронилтрансферазы с образованием
конъюгированного билирубина в виде моно- и диглюкуронидов.
• Конъюгированный билирубин выделяется из гепатоцита с желчью в
виде комплексов с фосфолипидами, холестерином и солями желчных
кислот.
45.
• В желчных путях под влиянием дегидрогеназ происходитобразование уробилиногена, мезобилирубина и др.
• Уробилиноген в 12-перстной кишке всасывается энтероцитом и
с током крови воротной вены возвращается в печень, где
окисляется до дипирролов.
• Остальной билирубин и его производные поступают в
кишечник, в котором последовательно восстанавливаются β- и
σ-метиновые связи, и превращается в стеркобилиноген,
который в толстой кишке подвергается окислению в
стеркобилин выделяется с калом.
• Небольшая часть всасывается в кровь и через геморраидальные
вены и нижнюю полую вену поступает в почки и выводится с
мочой.
46.
47.
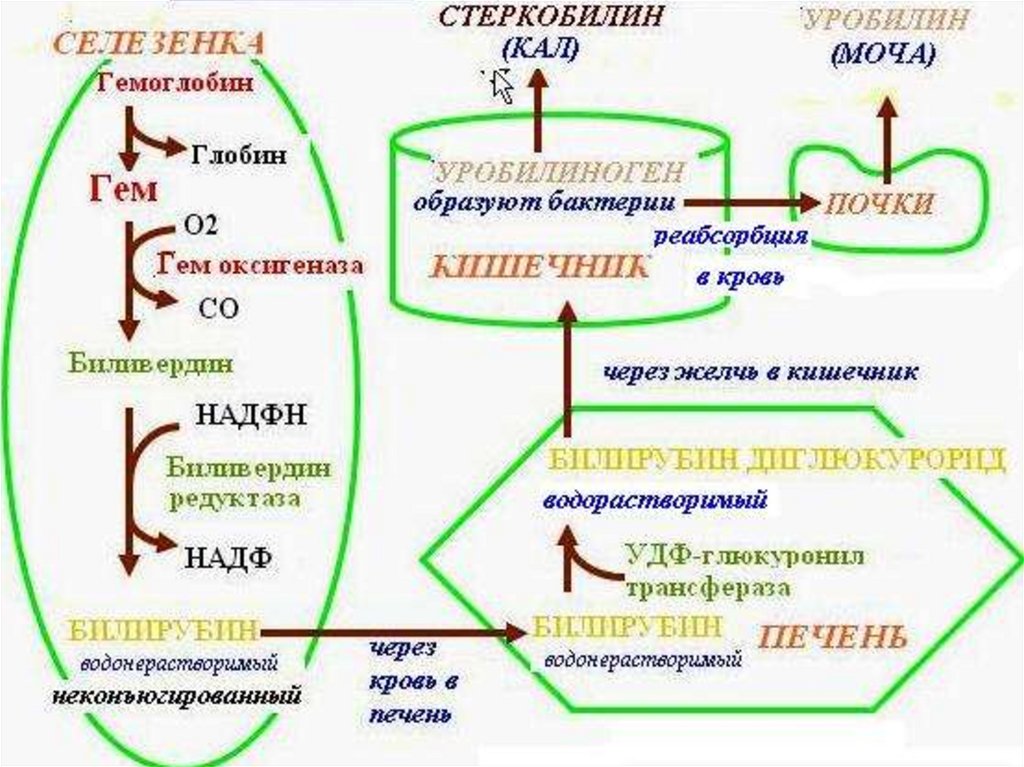
Распад гема1) Разрыв метинового мостика между 1-м и 2-м
пиррольными ядрами порфиринового кольца с
одновременным окислением двухвалентного железа в
трехвалентное.
Образуется пигмент вердоглобин.
48.
2) Вердоглобин окисляется под действием НАДФН2зависимой гемоксигеназы теряет железо (Fe+2> Fe+3) иглобин, уходит вода и СО, порфириновое кольцо
разворачивается в цепи и образуется желчный пигмент
желто-зеленого цвета - биливердин.
3) Под действием НАДФН2-зависимой биливердинредуктазы биливердин ферментативным путем
восстанавливается в красно-желтый пигмент - билирубин
(свободный, неконъюгированный, нерастворимый)
49.
50.
Метаболизм билирубинаСвободный, неконьюгированный билирубин
нерастворим в воде, поэтому в крови транспортируется в
комплексе с альбумином.
Для определения свободного билирубина в крови
необходимо предварительное осаждение белка спиртом
(непрямая реакция Ван-Дер-Берга). Только после этого
билирубин вступает во взаимодействие с диазореактивом,
поэтому его называют непрямым билирубином.
Свободный (непрямой) билирубин не проходит через
почечный барьер и в мочу не попадает.
51.
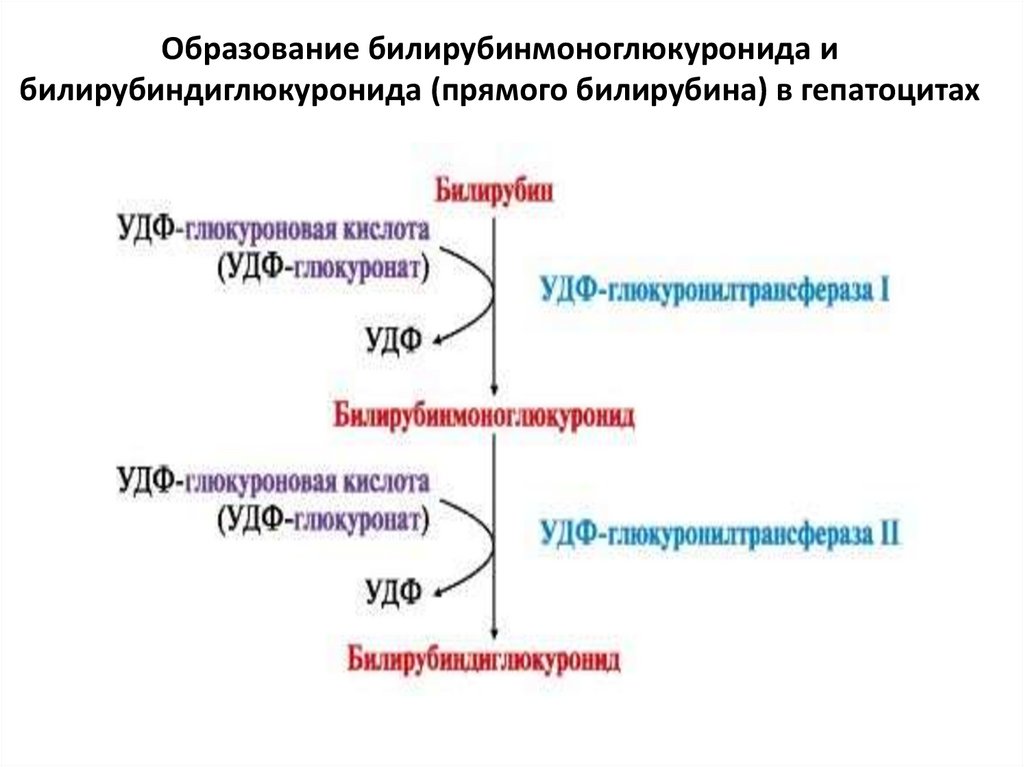
4) В печени непрямой билирубин соединяется (конъюгирует)с УДФ-глюкуроновой кислотой под действием УДФглюкуронилтрансферазы с образованием
глюкуронид билирубина - прямого, связанного,
конъюгированного, билирубина:
• растворим в воде, дает прямую реакцию с диазореактивом
(прямая реакция Ван-Дер-Берга).
• это нормальный компонент желчи, попадающий в кровь в
очень небольшом количестве.
• может проходить через почечный барьер, но в крови его
очень мало, поэтому в моче он не определяется обычными
лабораторными методами.
52.
Образование билирубинмоноглюкуронида ибилирубиндиглюкуронида (прямого билирубина) в гепатоцитах
53.
5) Вместе с желчью прямой билирубин попадает в тонкийкишечник.
6) в кишечнике от него отщепляется глюкуроновая кислота (глюкуронидаза)
7) восстановление прямого билирубина с образованием:
5-уробилиногена > 1-уробилиногена > 1-стеркобилиногена.
8) Уробилиногены реабсорбируются в кишечнике и
включаются в энтеропеченочную и экстрапеченочную
циркуляцию; в почках окисляются в уробилин; выводятся с
мочой.
9) Стеркобилиноген не всасывается, при контакте с воздухом
окисляется в стеркобилин и выводится с калом.
54.
55.
Распределение желчных пигментов в нормекровь: общий билирубин - 8,55-20,52 мкмоль/л,
непрямой (свободный) билирубин - 6,41-15,40 мкмоль/л,
прямой (связанный) билирубин - 0-5,1 мкмоль/л;
желчь: прямой (связанный) билирубин;
кал: стеркобилиноген;
моча: уробилиноген - 0,5-3,4 мг/сут
прямой билирубин - отс
56. Лабораторные признаки повышенного внутриклеточного гемолиза
Увеличение содержания:• в крови неконъюгированного билирубина
• стеркобилина кала
• уробилина мочи
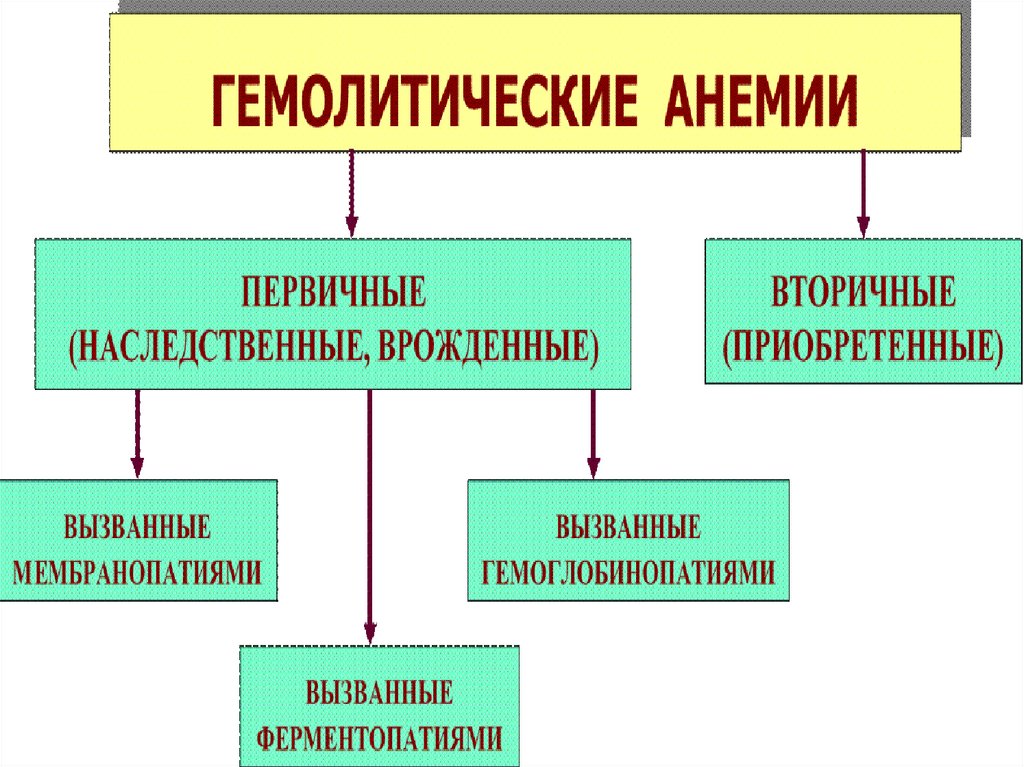
57. Патологический внутриклеточный гемолиз
• Наследственная неполноценность мембраны эритроцита(эритроцитопатии)
• Нарушение синтеза гемоглобина и ферментов
(гемоглобинопатии, энзимопатии)
• Изоиммунологический конфликт по групповой и Rhпринадлежности крови матери и плода
• Избыточное количество эритроцитов (физиологическая
желтуха новорожденного, эритробластоз новорожденнон,
эритремия – при количестве эритроцитов более 6-7х10
12/л).
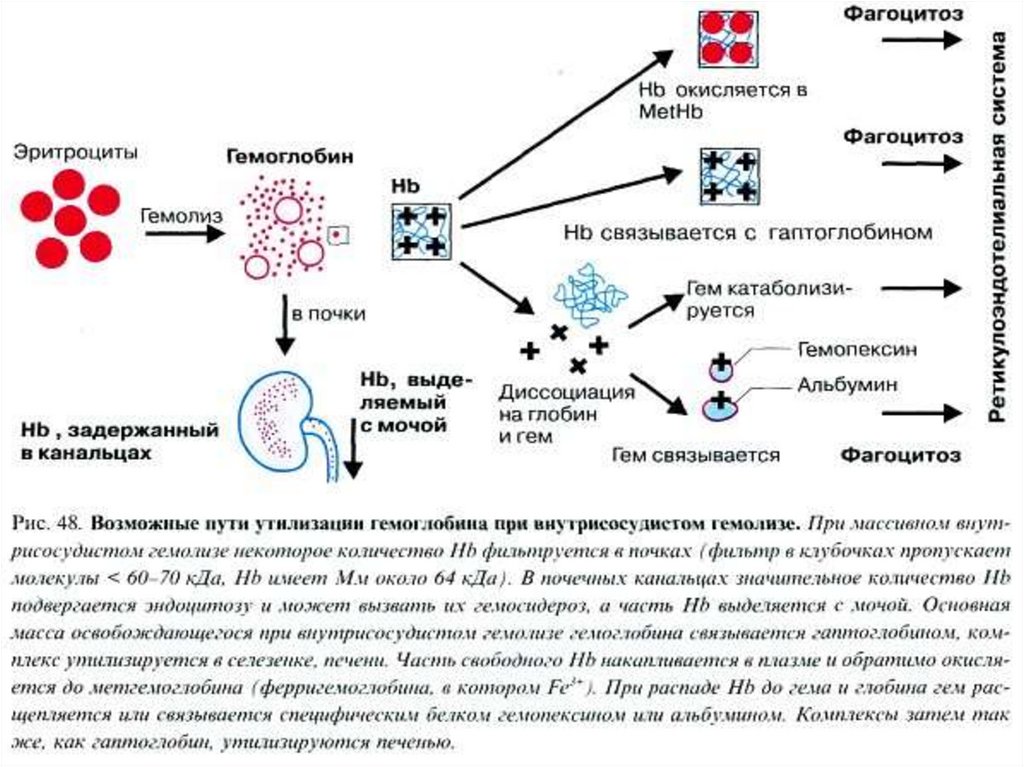
58. Внутрисосудистый гемолиз
Внутрисосудистый гемолиз – физиологический распадэритроцитов непосредственно в кровотоке (10%).
• Освобожденный гемоглобин связывается с белком
плазмы – гаптоглобином (α2-глобулин).
• Поглощается РЭС и разрушается
59.
60.
61. Лабораторные признаки внутрисосудистого гемолиза
• Гемоглобинемия• Гемоглобинурия
• Гемосидеринурия
62. Патологический внутрисосудистый гемолиз
Токсические
Механические
Радиационные
Инфекционные
Иммуно- аутоиммунные повреждения мембраны
эритроцитов
• Дефицит витаминов
• Паразиты крови
63.
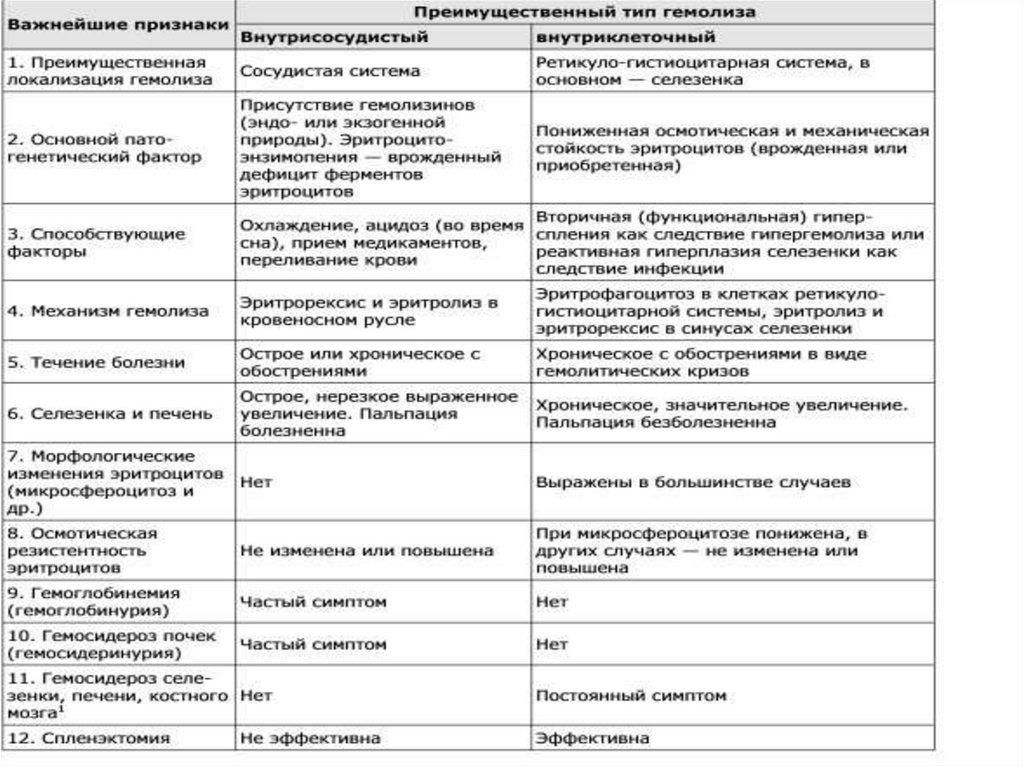
Таблица 7. Сравнительная характеристика внутриклеточного и внутрисосудистого гемолизаПризнаки гемолиза
Внутрисосудистый
Внутриклеточный
Локализация гемолиза
Сосудистая система
РЭС
Патогенетический фактор
Гемолизины, энзимопатия
эритроцитов
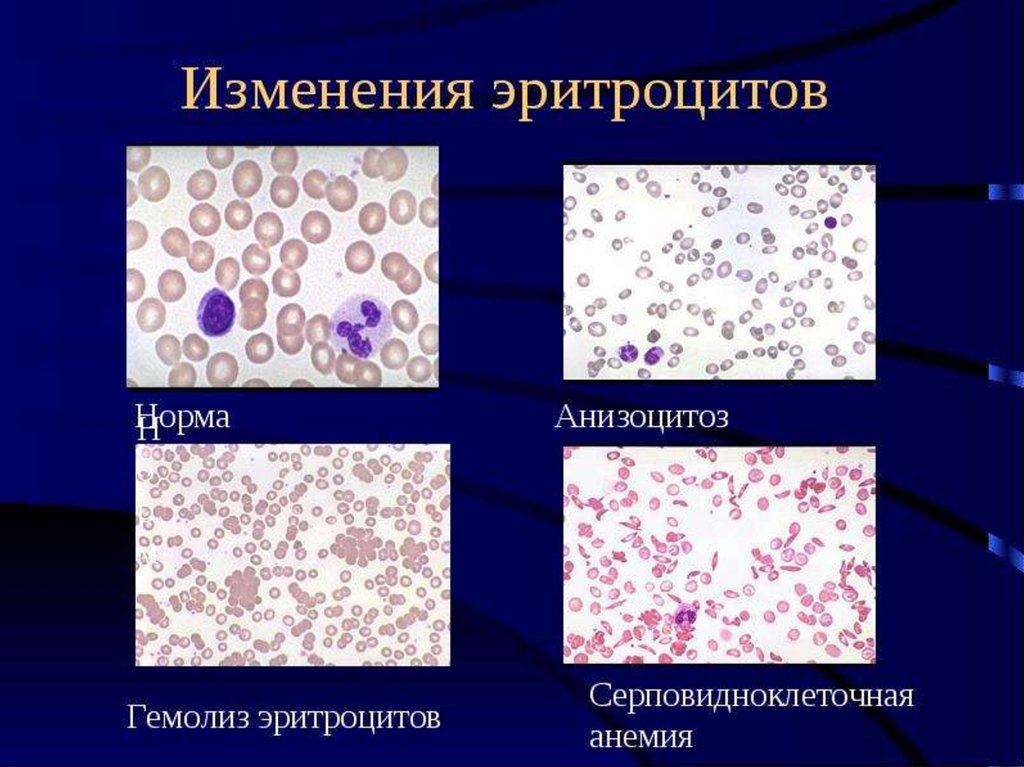
Аномалия формы эритроцитов
Гепатоспленомегалия
Незначительная
Значительная
Морфологические изменения
эритроцитов
Анизоцитоз
Микросфероцитоз, овалоцитоз,
мишеневидные,
серповидноклеточные и др.
Локализация гемосидероза
Канальцы почек
Селезенка, печень, костный мозг
Лабораторные признаки гемолиза Гемоглобинемия
Гемоглобинурия
Гемосидеринурия
Гипербилирубинемия
Повышение стеркобилина в кале
и уробилина в моче
64.
65.
66.
67. Наследственные гемолитические анемии, обусловленные нарушением синтеза глобиновых цепей (гемоглобинопатии)
68.
Нарушения синтеза белковой части гемоглобина –качественные и количествные гемоглобинопатии
В настоящее время известно около 300 вариантов НЬА,
имеющих в первичной структуре α- или β-цепей лишь
небольшие изменения:
1. Почти не влияют на функцию белка и здоровье человека.
2. Снижают функцию белка и особенно в экстремальных
ситуациях снижают возможность адаптации человека.
3. Вызывают значительные нарушения функций НbА и
развитие анемии, что приводит к тяжёлым клиническим
последствиям.
Выявление аномальных гемоглобинов проводят с помощью
электрофореза гемоглобина на ацетате целлюлозы
69.
70.
71.
72.
73.
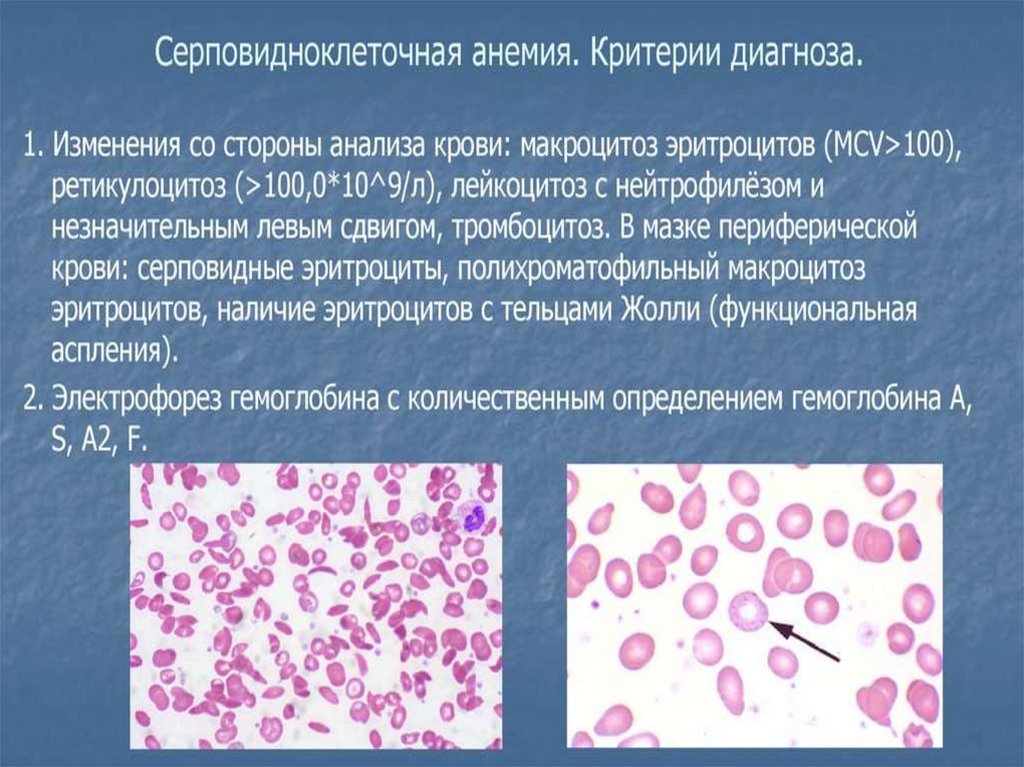
74. Периферическая кровь
Невыраженная нормохромная анемия
При гемолитическом кризе:
- резкое падение Hb и Ht
- ретикулоцитоз
- полихроматофилия
- нормобластоз
- тельца Жолли
- серповидные и мишеневидные эритроциты
- базофильная пунктация
- пойкилоцитоз
- лейкоцитоз со сдвигом влево
- тромбоцоз
- гипербилирубинемиа (непрямой)
- повышенное содержание свободного гемоглобина
- снижение концентрации гаптоглобина
75.
76.
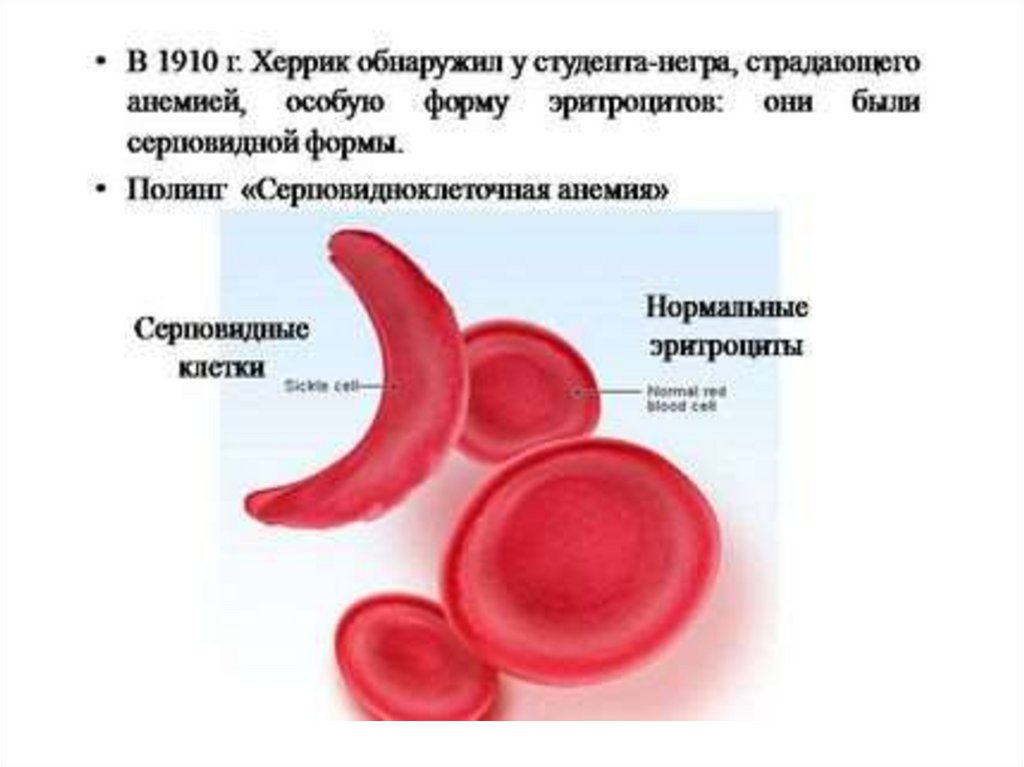
• Серповидность устанавливается в пробе сметабисульфатом натрия или при наложении
жгута на основание пальца (снижение доступа
кислорода).
• Окончательный диагноз устанавливается после
электрофореза, где наблюдается 90% HbS, 2-10%
HbF, HbA отсутствует.
77.
Высокая частота гена HbS среди жителей Африкиобусловлена тем, что гетерозиготы менее чувствительны к
малярии, чем люди с нормальным гемоглобином A.
Plasmodium falciparum - возбудитель малярии, облигатную
часть своего жизненного цикла проводит в эритроцитах.
Эритроциты гетерозиготных по HbS людей имеют
более короткий срок жизни, чем нормальные эритроциты,
возбудитель малярии не успевает закончить необходимую
стадию развития. Это создаёт избирательное преимущество
для гетерозиготных по HbS людей в тех областях, где
малярия вызывает гибель многих людей.
78.
Гемоглобин М - метгемоглобинВариант HbА - мутация в гене α- или β-цепи –
замена гистидина на тирозин
Fe2+ окисляется в Fe3+ и стабилизируется в этой форме –
образуется метгемоглобин
Вместо О2 к Fe3+ присоединяется Н2О. Обычно изменения
затрагивают либо α-, либо β-цепи, в результате гемоглобин
может переносить не более двух молекул О2.
У гетерозиготных людей - цианоз, связанный с нарушением
транспорта О2.
Гомозиготность по этому гену - летальный исход.
79. Гемолитические анемии, обусловленные носительством аномальных гемоглобинов C, D, E
• В НbС глютаминовая кислота в положении 6заменена лизином, что ведет к его
кристаллизации.
• В НbЕ - глютаминовая кислота в положении 26
заменена лизином,
• в НbD - глютаминовая кислота в положении 121
заменена на глутамин.
80. Гемолитические анемии, обусловленные носительством аномальных нестабильных гемоглобинов
Замена аминокислот в НbА в α- или β-цепях вызывает появлениеаномального нестабильного гемоглобина
молекулярная нестабильность
денатурация и преципитация гемоглобина внутри эритроцита
преципитированный Нb прикрепляется к мембране эритроцита
разрушение эритроцита, появление телец Гейнца, нарушение
эластичности и проницаемости клеточной мембраны
при прохождении через селезенку эритроциты теряют часть
мембраны, а затем разрушаются.
81.
82.
83.
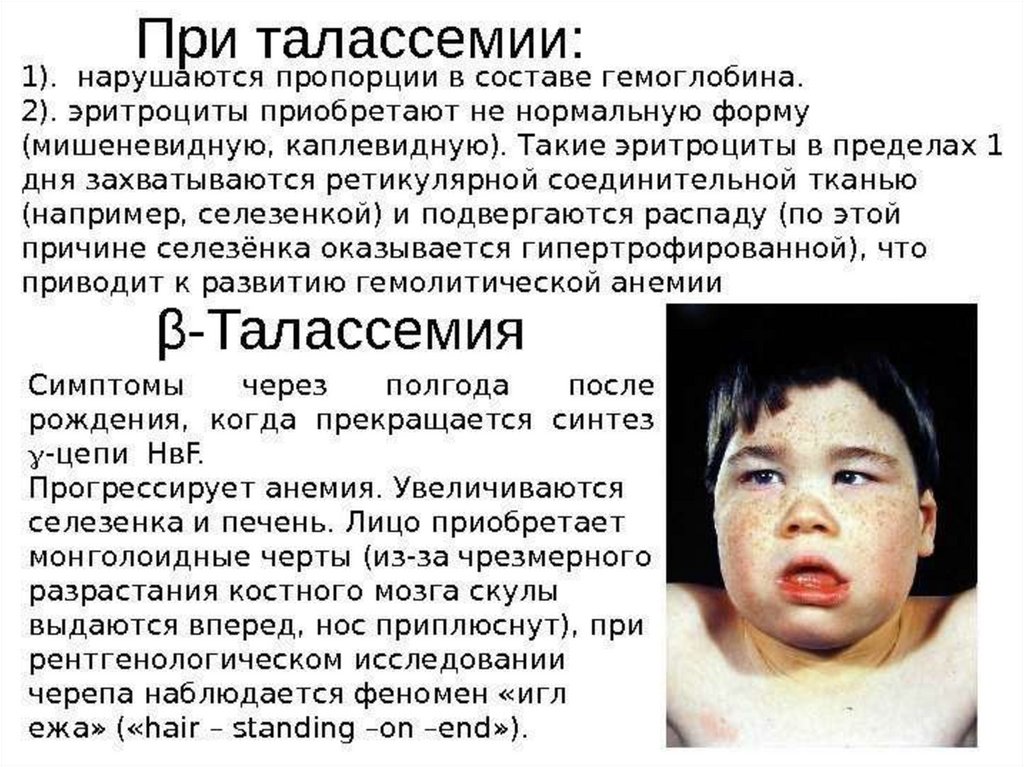
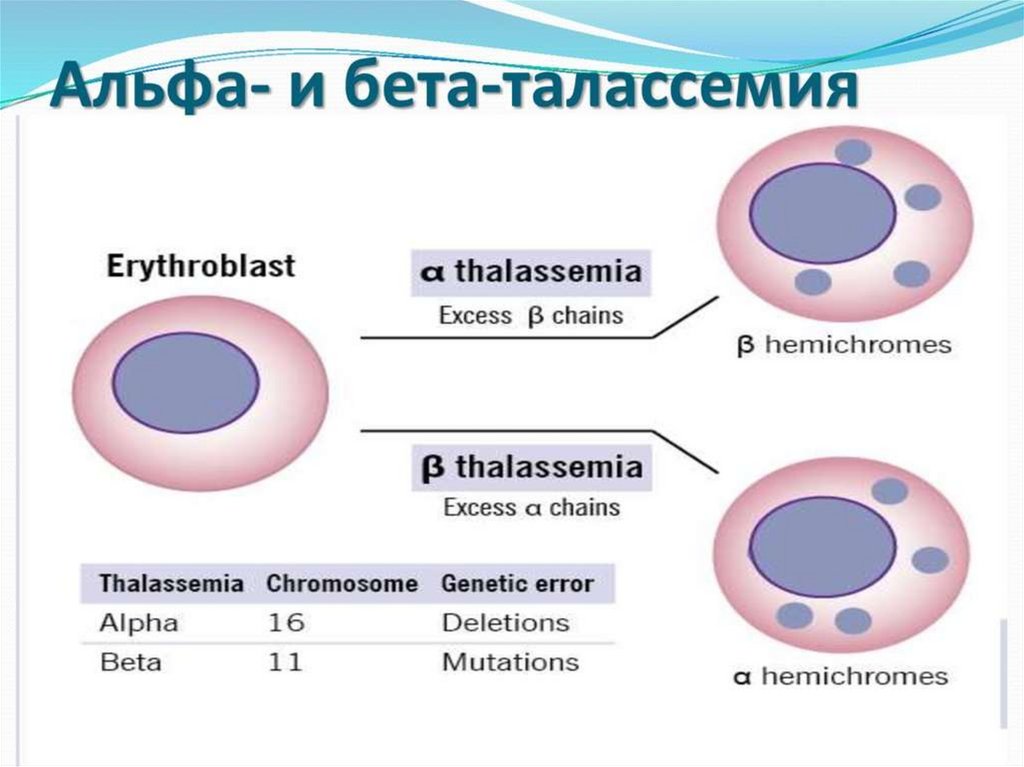
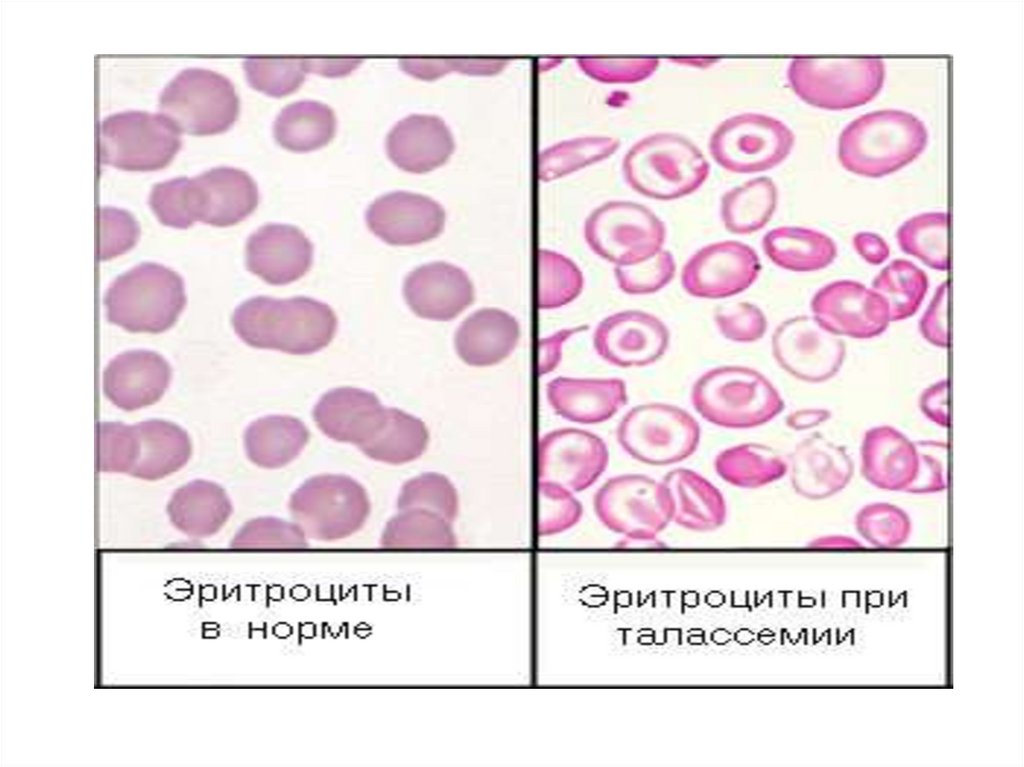
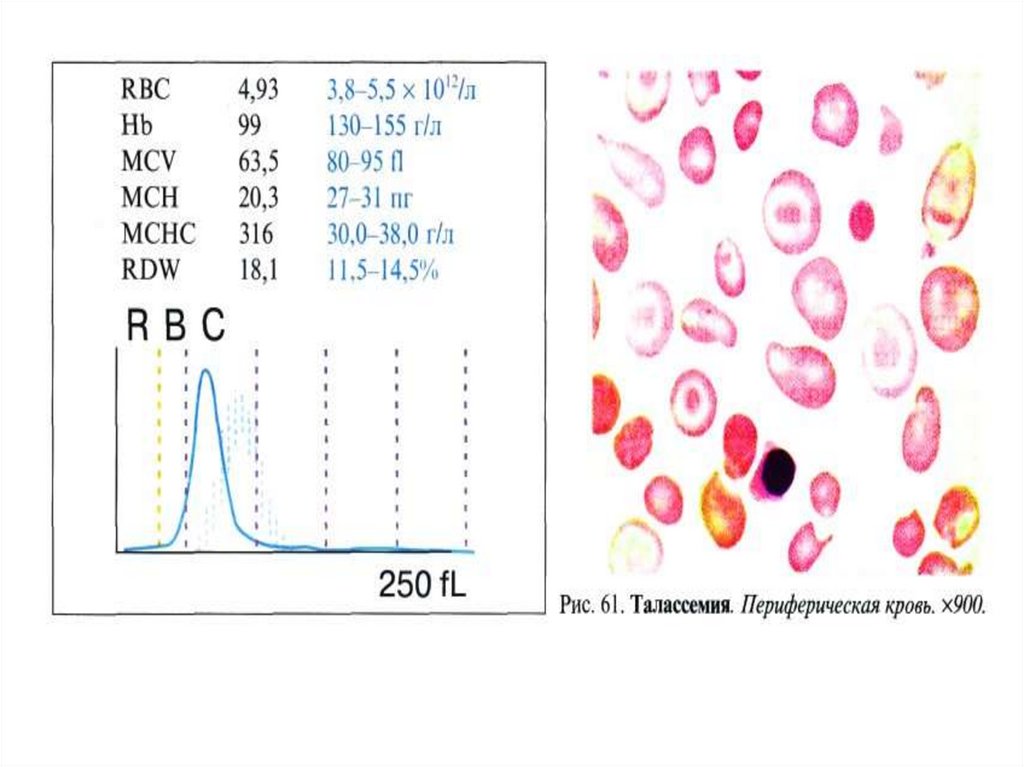
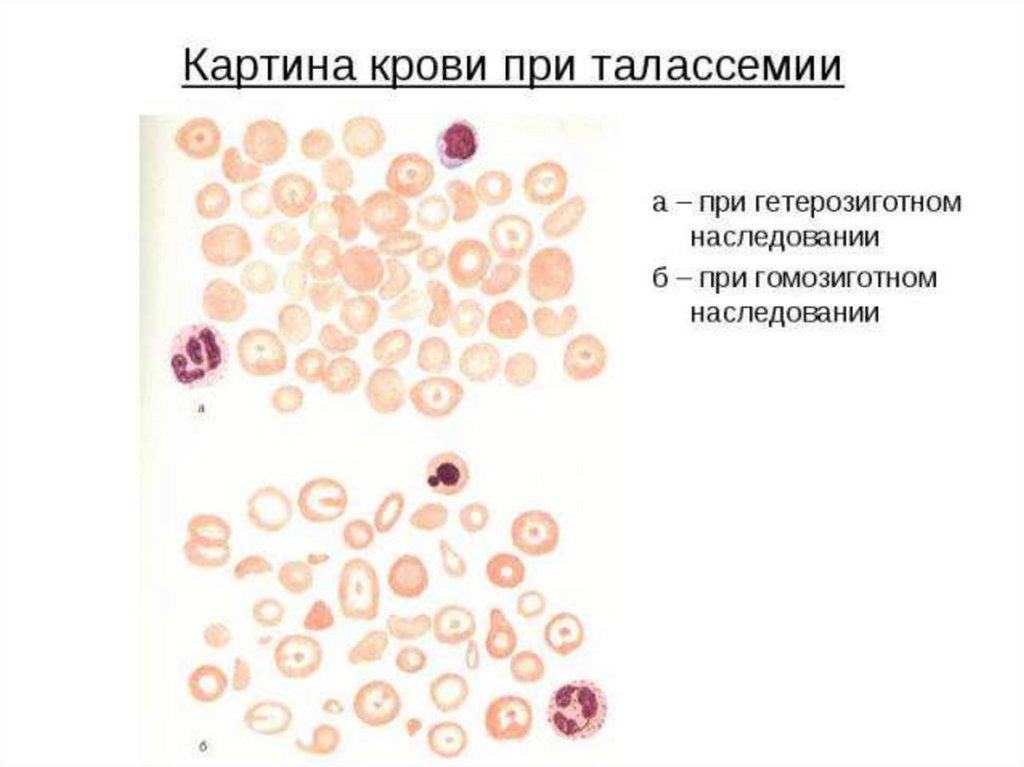
Талассемиинесбалансированное образование глобиновых цепей
образуются тетрамеры гемоглобина, состоящие из
одинаковых протомеров
нарушение основной функции гемоглобина - транспорт
кислорода к тканям
Нарушение эритропоэза и ускоренный гемолиз
эритроцитов и клеток-предшественников
анемии
84.
β-талассемии• не синтезируются β-цепи гемоглобина.
• образование нестабильных тетрамеров,
содержащих только α-цепи.
• в костном мозге из-за преципитации нестабильных
α-цепей усиливается разрушение эритробластов, а
ускорение разрушения эритроцитов в циркулирующей
крови приводит к внутрисосудистому гемолизу.
• у больных β-талассемией наблюдается снижение
концентрации HbА и увеличение HbF.
85.
86.
87.
88.
89.
90.
91.
92.
93.
94.
95.
α-талассемиянедостаток образования α-глобиновых цепей
нарушение образования HbF у плода
Избыточные γ-цепи образуют тетрамеры - гемоглобин Барта (γ4)при физиологических условиях имеет повышенное сродство к
кислороду и не проявляет кооперативных взаимодействий
между протомерами
гемоглобин Барта не обеспечивает развивающийся плод
необходимым количеством кислорода
тяжёлая гипоксия плода
высокий процент внутриутробной гибели плода
96.
α-талассемияВыжившие новорождённые
при переключении с γ- на β-ген синтезируют β-тетрамеры
или НbН(β4), который, подобно гемоглобину Барта, имеет
слишком высокое сродство к кислороду, менее стабилен,
чем НbА и быстро разрушается
тканевая гипоксия
смерть вскоре после рождения.

































































 chemistry
chemistry








