Similar presentations:
Повторение и обобщение темы «Электролитическая диссоциация»
1.
Повторение и обобщениетемы «Электролитическая
диссоциация»
Учитель МОУ «СОШ №14»
Наумова Е. Ю.
2.
Основные понятия по темеЭлектролиты и неэлектролиты
Электролитическая диссоциация
Сильные и слабые электролиты
Кислоты, основания и соли с позиции
электролитической диссоциации
Реакции ионного обмена и условия их протекания
Свойства кислот, оснований, солей с позиции
электролитической диссоциации
3.
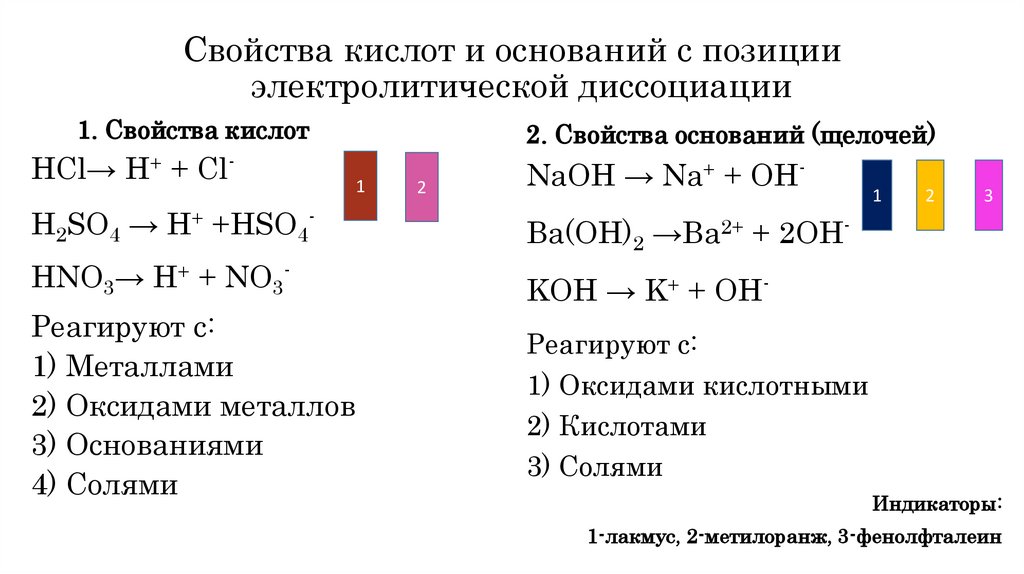
Свойства кислот и оснований с позицииэлектролитической диссоциации
1. Свойства кислот
HCl→ H+ + Cl-
2. Свойства оснований (щелочей)
1
2
NaOH → Na+ + OH-
H2SO4 → H+ +HSO4-
Ba(OH)2 →Ba2+ + 2OH-
HNO3→ H+ + NO3-
KOH → K+ + OH-
Реагируют с:
1) Металлами
2) Оксидами металлов
3) Основаниями
4) Солями
Реагируют с:
1) Оксидами кислотными
2) Кислотами
3) Солями
1
2
3
Индикаторы:
1-лакмус, 2-метилоранж, 3-фенолфталеин
4.
Свойства солей с позиции электролитическойдиссоциации
AlCl3 → Al3+ + 3ClNa3PO4 → 3Na+ + PO43MgSO4 → Mg2+ + SO42Каждая соль индивидуальна, её свойства
определяются ионами, находящимися в растворе.
Реагируют с:
1) Металлами
2) Кислотами
3) Основаниями (щелочами)
4) Солями
5.
Примеры уравнений реакций, отражающиххимические свойства кислот, оснований, солей.
1.
Взаимодействие кислот и оснований.
А) H2SO4 + 2NaOH → Na2SO4 + 2H2O
2H+ + SO42- + 2Na+ + 2OH- → 2Na+ + SO42- + 2H2O
2H+ + 2OH- → 2H2O
H+ + OH- → H2O
Б) H2SO4 + Mg(OH)2 → MgSO4 + 2H2O
2H+ + SO42- + Mg(OH)2 → Mg2+ + SO42- + 2H2O
2H+ + Mg(OH)2 → Mg2+ + 2H2O
6.
Примеры уравнений реакций, отражающиххимические свойства кислот, оснований, солей.
2. Взаимодействие кислот и солей.
Помните, что более сильная кислота вытесняет более
слабую кислоту!
2HCl + K2CO3 → 2KCl + H2O + CO2↑
2H+ + 2Cl- + 2K+ + CO32- → 2K+ + 2Cl- + H2O + CO2↑
2H+ + CO32- → H2O + CO2↑
7.
Примеры уравнений реакций, отражающиххимические свойства кислот, оснований, солей.
3. Взаимодействие щелочей и солей.
Помните, что соль должна быть растворимой в воде и
образована малоактивным или не активным металлом!
2KOH + MgSO4 → K2SO4 + Mg(OH)2↓
2K+ + 2OH- + Mg2+ + SO42- → 2K+ + SO42- + Mg(OH)2↓
2OH- + Mg2+ → Mg(OH)2↓
8.
Примеры уравнений реакций, отражающиххимические свойства кислот, оснований, солей.
4. Взаимодействие солей с солями.
Помните, что обе соли должны быть растворимыми в воде и
одна из новых солей выпадает в осадок!
А) CuCl2 + 2AgNO3 → Cu(NO3)2 + 2AgCl↓
Cu2+ + 2Cl- + 2Ag+ + 2NO3- → Cu2+ + 2NO3- + 2AgCl↓
2Cl- + 2Ag+ → 2AgCl↓
Cl- + Ag+ → AgCl↓
Б) MgSO4 + CuCl2 ↔ MgCl2 + CuSO4
Mg2+ + SO42- + Cu2+ +2Cl- ↔ Mg2+ + 2Cl- + Cu2+ + SO42-
Реакция не протекает до конца, так как все ионы находятся в растворе. Является
обратимой.
9.
Домашнее заданиеПрочитайте текст параграфа 11.
Выполните задания 2,4 (составьте уравнения реакций в
молекулярном и в ионном виде, о которых говорится в
заданиях).
Для составления используйте таблицу растворимости.
Выполняя домашнюю работу самостоятельно, вы успешно
подготовитесь к практической работе №1.








 chemistry
chemistry








