Similar presentations:
Электролитическая диссоциация. Реакции ионного обмена
1. Электролитическая диссоциация. Реакции ионного обмена
2.
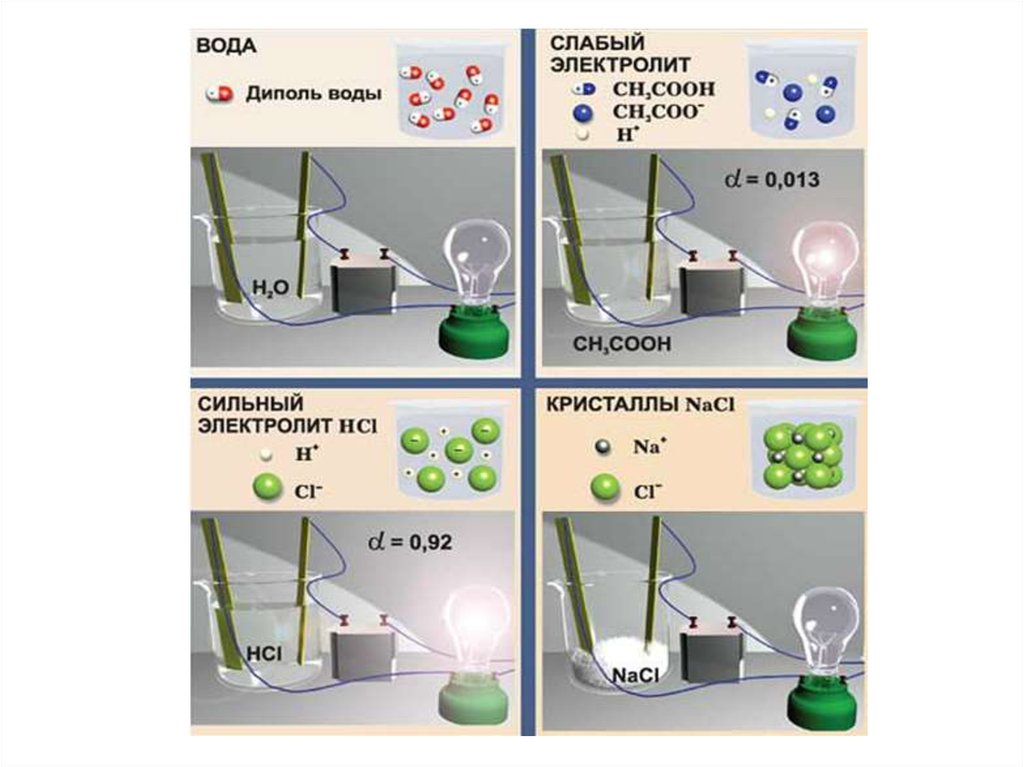
Электролиты – вещества, которые в растворе илирасплаве распадаются на заряженные частицы – ионы.
Процесс распада электролитов на ионы в водных
растворах и расплавах называется электролитической
диссоциацией.
Электролиты
3.
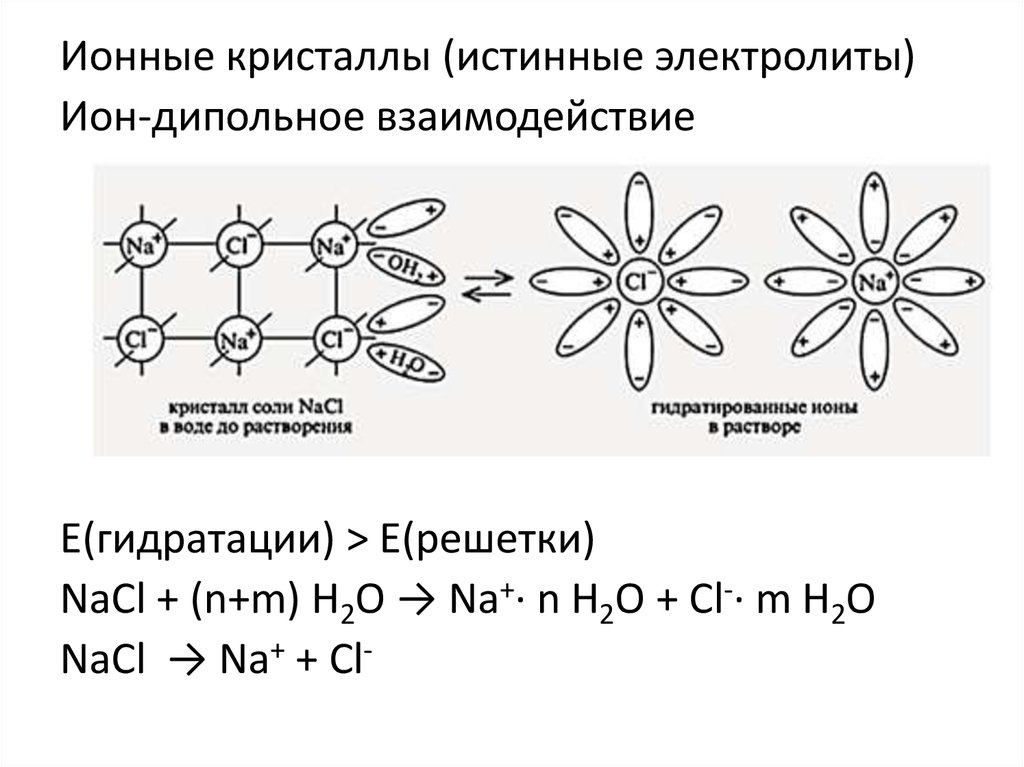
Ионные кристаллы (истинные электролиты)Ион-дипольное взаимодействие
Е(гидратации) > Е(решетки)
NaCl + (n+m) H2O → Na+· n H2O + Cl-· m H2O
NaCl → Na+ + Cl-
4.
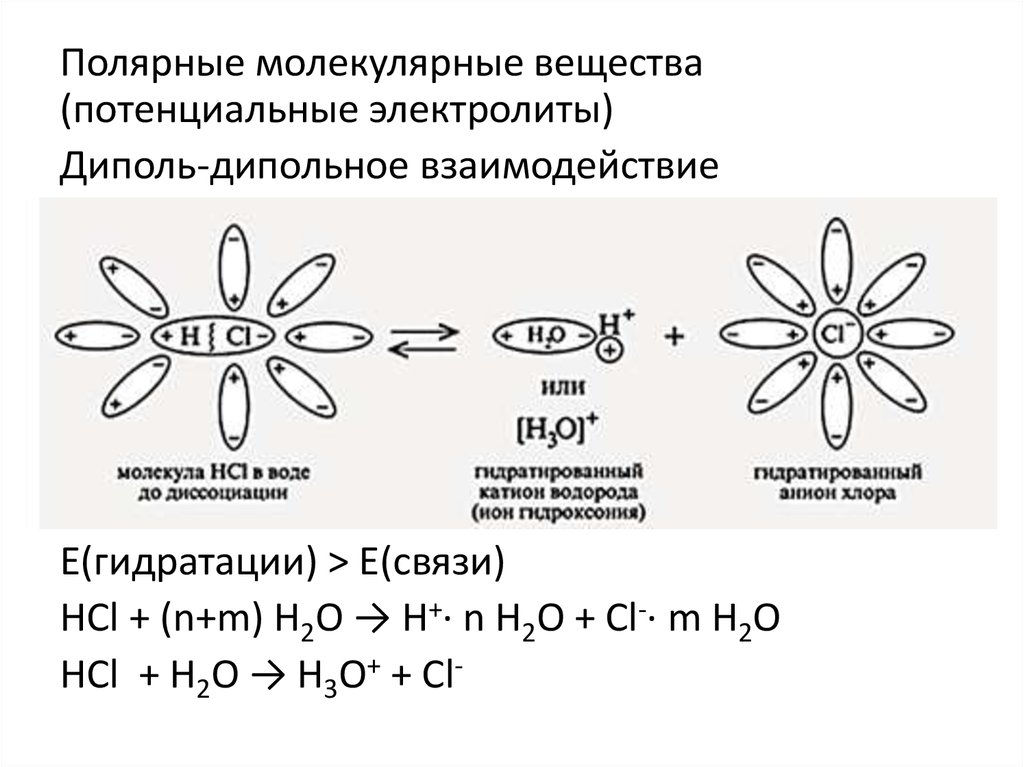
Полярные молекулярные вещества(потенциальные электролиты)
Диполь-дипольное взаимодействие
Е(гидратации) > Е(связи)
НCl + (n+m) H2O → Н+· n H2O + Cl-· m H2O
НCl + H2O → Н3О+ + Cl-
5.
Для молекулярных электролитовСтепень диссоциации (ионизации):
Сильные электролиты:
1) соли;
2) щелочи – LiOH, NaOH, KOH, RbOH,
CsOH, Ba(OH)2 , Ca(OH)2, Sr(OH)2;
3) кислоты (α = 1) – H2SO4, HCl, HNO3, HBr,
HI, HClO4, HМnO4;
6.
7.
Кислоты – электролиты, которые придиссоциации в качестве катионов образуют
только ионы Н+
HCl → H+ + Cl–
H2SO4 → H+ + HSO4− (I ступень)
HSO4− H+ + SO42- (II ступень)
8.
Основания – электролиты, которые придиссоциации в качестве анионов образуют
только OH−
NaOH → Na+ + OH−
NH3 + H2O NH4+ + OH−
Mg(OH)2
(MgOH)+
(MgOH)+ + OH− (I ступень)
Mg2+ + OH− (II ступень)
9.
Амфотерные гидроксиды (амфолиты) –электролиты, которые могут диссоциировать
как по кислотному, так и по основнóму типу
Be(OH)2 ↔ Be2+ + 2OH− (основный тип)
Be(OH)2 + 2H2O
2H+ + [Be(OH)4]2(кислотный тип)
10.
Ступенчато диссоциируют кислые, оснóвныеи комплексные соли:
КНСО3 → К+ + НСО3−
НСО3−
Н+ + СО32−
(CuOH)NO3 → Сu(OH)+ + NO3−
(CuOH)+
Cu2+ + OH−
Na2[Zn(OH)4] → 2 Na+ + [Zn(OH)4]2−
[Zn(OH)4]2−
Zn2+ + 4 OH−
11.
Средние, двойные и смешанные солидиссоциируют в одну стадию!
CaCl2 → Ca2+ + 2Cl−
Al2(SO4)3 → 2Al3+ +3SO42–
КFe(SO4)2 → К+ + Fe3+ + SO42-
12.
Диссоциация водыH2O ↔ H+ + OH−
[H+]·[OH−] = KW – константа автопротолиза
KW = 10-14 при 250С
следовательно, [H+]=[OH−] =10-7
Водородный показатель (рН) – десятичный
логарифм молярной концентрации ионов
водорода, взятый со знаком «минус»
рН = – lg[H+]
13.
При [H+]=[OH−] =10-7,рН = – lg10-7 =7 – нейтральная среда
при [H+] > 10-7, рН < 7 – среда кислая
при [H+] < 10-7, рН > 7 – среда
щелочная
14.
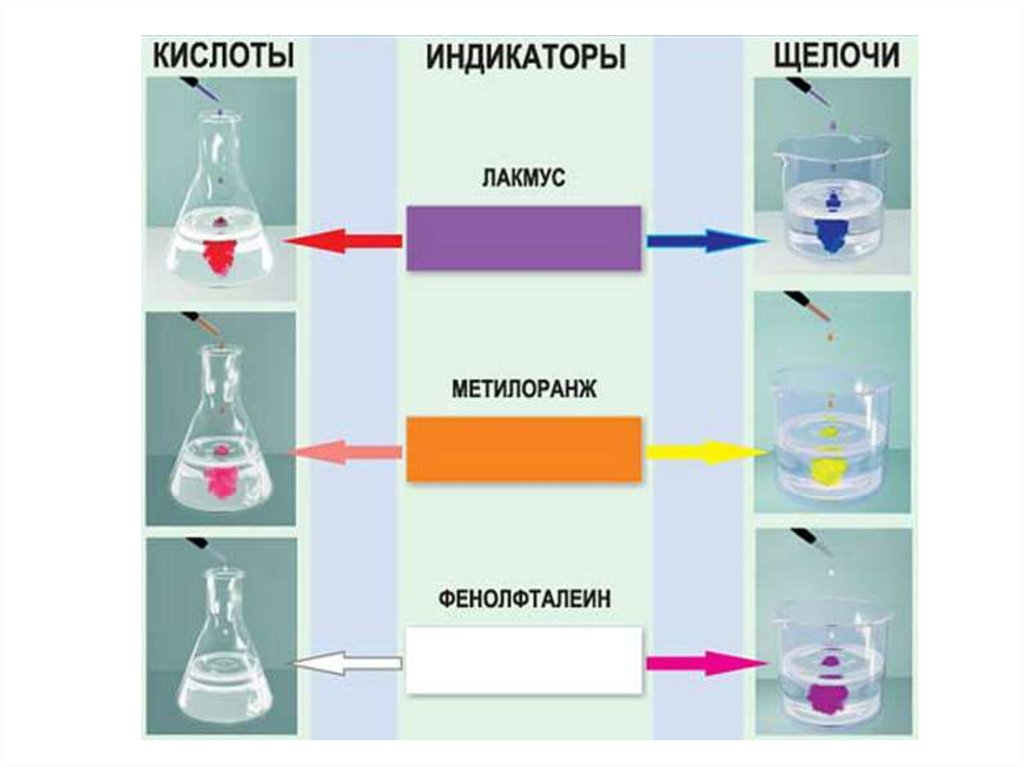
Окраска лакмуса:15.
Реакции ионного обменаВ виде ионов записываются только
сильные и растворимые в воде
электролиты
Реакции ионного обмена всегда
протекают в сторону связывания ионов.
Ионы связываются с образованием
газа; осадка; слабого электролита.
16.
Реакция нейтрализации1) Сильная кислота + щелочь с образованием
растворимых солей
Вa(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O
Ba2+ + 2ОН− + 2Н+ + 2NO3− = Ba2+ + 2NO3− + 2H2O
(полная ионная форма)
OH − + H + → H2O
17.
2) Сильная кислота + щелочь с образованиемнерастворимых солей
Вa(OH)2 + H2SO4 → BaSO4↓ + 2H2O
Вa2+ + 2 OH− + 2H+ + SO42- → BaSO4↓ + 2H2O
3) Реакции с участием слабого электролита
HNO3 + NH3 → NH4NO3
H+ + NH3 → NH4+
18.
H2S + 2KOH → K2S + 2 H2OH2S + 2OH− → S2− + 2 H2O
Al(OH)3 + KOH → K[Al(OH)4]
Al(OH)3 + OH− → [Al(OH)4] −
Реакции нейтрализации протекают
всегда, если хотя бы один исходный
электролит сильный
19.
4)Реакция нейтрализации между двумя слабыми
электролитами возможна, если продукт реакции
(соль) существует в присутствии воды
H2S + 2NH3 → (NH4)2S
H2S + 2NH3 → 2NH4+ + S2−
Mg(OH)2 + 2HF → MgF2↓ + 2 H2O
ионная форма отсутствует
Al(OH)3 + H2S ≠ – реакция не идет
20.
5) Неполная нейтрализацияв избытке кислоты:
H2SО4 + KOH → KНSО4 + H2O
2H+ + SО42− + OH- → НSО4− + H2O
в избытке основания:
Fe(OH)3 + 2HCl → Fe(OH)Cl2 + 2 H2O
Fe(OH)3 + 2H+ → Fe(OH)2+ + 2 H2O
21.
Гидролиз солейРеакция обмена между ионами
соли и молекулами воды
Не подвергаются гидролизу соли:
• Образованные только сильными
электролитами (NaCl, KNO3, RbBr, Cs2SO4,
KClO3 и др.);
• Нерастворимые;
22.
1) Соль, образованная сильным основаниеми слабой кислотой
- гидролиз ПО АНИОНУ
K3PO4 – соль, образованная слабой
кислотой и сильным основанием.
PO43- + НОН ⇄ НРО42- + ОНK3PO4 + Н2О ⇄ К2НРО4 + КОН
ОН- - среда щелочная; рН > 7
23.
2) Соль, образованная слабым основанием исильной кислотой
- гидролиз ПО КАТИОНУ
CuCl2 – соль, образованная слабым
основанием и сильной кислотой.
Cu+2 + НОН ⇄ CuOH+ +H+
CuCl2+H2O ⇄ (CuOH)Cl + HCl
H+ - среда кислая; рН < 7
24.
3) Соль, образованная слабым основанием ислабой кислотой
- гидролиз ПО КАТИОНУ И ПО АНИОНУ
Гидролизуются соли –
Al2S3,Cr2S3(необратимо)
Al2S3 + H2O Al(OH)3 + H2S
NH4F, CH3COONH4(обратимо)
NH4F + H2O ⇄ NH3 · H2O + HF
25.
Совместный гидролиз1) Соли металлов со степенью окисления +3 и соли
летучих кислот (карбонаты, сульфиды, сульфиты)
2AlCl3 + 3K2S + 6H2O → 2Al(OH)3 + 3H2S↑ + 6KCl
2NH4Cl + Na2SiO3 → 2NH3↑ + H2SiO3↓ + 2NaCl
26.
2) Соли металлов со степенью окисления +2(кроме кальция, стронция и бария) и
растворимые карбонаты - образуется осадок
ОСНÓВНОГО КАРБОНАТА металла:
2 CuCl2 + 2Na2CO3 + H2O → (CuOH)2CO3 +
+ CO2↑ + 4 NaCl
27.
Гидролиз - эндотермический процессKF + H2O ⇄ HF + KOH – Q
Какие факторы усиливают гидролиз?
• Нагревание
• Добавление воды
Как подавить (ослабить) процесс гидролиза?
• Раствор делают максимально
концентрированным;
• Для смещения равновесия влево добавляют
один из продуктов гидролиза – кислоту, если
идёт гидролиз по катиону или щёлочь, если
идёт гидролиз по аниону.
Пример:
Al+3 + HOH ⇄ AlOH +2 + H+























 chemistry
chemistry








