Similar presentations:
Термодинамика. Основные положения термодинамики
1.
ТермодинамикаЛекция № 6
2.
План лекции:1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
Основные положения термодинамики.
Внутренняя энергия как функция состояния.
Макроскопическая работа и теплообмен.
Первое начало термодинамики. Теплоемкость вещества.
Применение первого закона термодинамики к различным процессам.
Второе начало термодинамики. Обратимые и необратимые процессы.
Круговые процессы (циклы). Принцип действия тепловых двигателей.
Энтропия.
Атмосферное давление. Изменение атмосферного давления с высотой.
Испарение и конденсация. Зависимость температуры кипения от
давления. Влажность воздуха.
11. Поверхностное натяжение жидкостей. Сила поверхностного натяжения.
Смачивание. Капиллярные явления.
3.
1. Основные положениятермодинамики
• Часть физики, занимающаяся изучением
общих свойств вещества, связанных с
тепловым движением в условиях
равновесия, называется термодинамикой.
• Термодинамической системой называется
часть пространства с находящимися в ней
физическими объектами, изучаемая
методами термодинамики.
4.
1. Основные положениятермодинамики
В зависимости от возможных способов
изоляции системы от внешней среды
различают несколько видов систем:
• открытая возможен обмен веществом с
внешней средой;
• закрытая нет обмена веществом;
• изолированная нет обмена и веществом и
энергией;
• замкнутая изолированная в
механическом смысле (нет обмена
5.
1. Основные положениятермодинамики
• Состояние системы описывается с
помощью термодинамических
(макроскопических) параметров:
давления, температуры, объема и их
производных: плотности, концентрации и
др.
• Система находится в термодинамическом
равновесии, если макроскопические
параметры, определяющие ее состояние,
остаются постоянными.
6.
1. Основные положениятермодинамики
• Квазистатическими (квазиравновесными)
процессами называются такие, при которых
макроскопические параметры системы
заметно изменяются лишь за время,
большее времени релаксации.
7.
2. Внутренняя энергия какфункция состояния
• Внутренняя энергия тела (системы тел)
равна сумме кинетической энергии
хаотического движения его молекул и
потенциальной энергии их
взаимодействия.
• Внутренняя энергия U идеального газа
включает только кинетическую энергию
теплового движения молекул
, где
N число молекул газа,
средняя
кинетическая энергия одной молекулы.
8.
2. Внутренняя энергия какфункция состояния
• Число независимых координат,
необходимых для полного описания
движения тела называют числом степеней
свободы.
Полное число степеней свободы для:
• одноатомных молекул
;
• двухатомных молекул
;
• многоатомных молекул
.
9.
2. Внутренняя энергия какфункция состояния
• В соответствии с теоремой равномерного
распределения энергии по степеням свободы
средняя кинетическая энергия одной молекулы:
• Для одноатомных молекул:
• Внутренняя энергия газа, имеющего массу m:
10.
2. Внутренняя энергия какфункция состояния
• Так как
• то
• Внутренняя энергия одного моля газа:
• Внутренняя энергия идеального газа
определяется его температурой.
Внутренняя энергия есть функция
состояния.
11.
3. Макроскопическая работа итеплообмен
• Здесь S площадь поршня, р
давление газа, dV изменение
объема газа.
• Работа конечного процесса:
• Графически работа выражается
площадью криволинейной
трапеции.
12.
3. Макроскопическая работа итеплообмен
• Работа при изотермическом изменении
объема идеального газа:
• Работа изобарического изменения объема
газа:
13.
3. Макроскопическая работа итеплообмен
• Теплообменом называется процесс обмена
внутренними энергиями соприкасающихся
тел, не сопровождающийся совершением
работы.
• Теплообмен характеризуется количеством
теплоты Q количеством энергии,
передаваемым от одного тела к другому
посредством теплопередачи.
14.
3. Макроскопическая работа итеплообмен
• По способу передачи теплоты теплообмен
можно разделить на 3 вида:
теплопроводность, конвекция, тепловое
излучение.
• Теплопроводностью называют процесс
переноса внутренней энергии от более
нагретого тела (или его части) к менее
нагретому телу (или его части).
15.
3. Макроскопическая работа итеплообмен
• Коэффициент теплопроводности, или
удельная проводимость, численно равный
количеству теплоты, которая проходит
через образец толщиной 1 м, площадью
1 м2 за 1 секунду.
16.
3. Макроскопическая работа итеплообмен
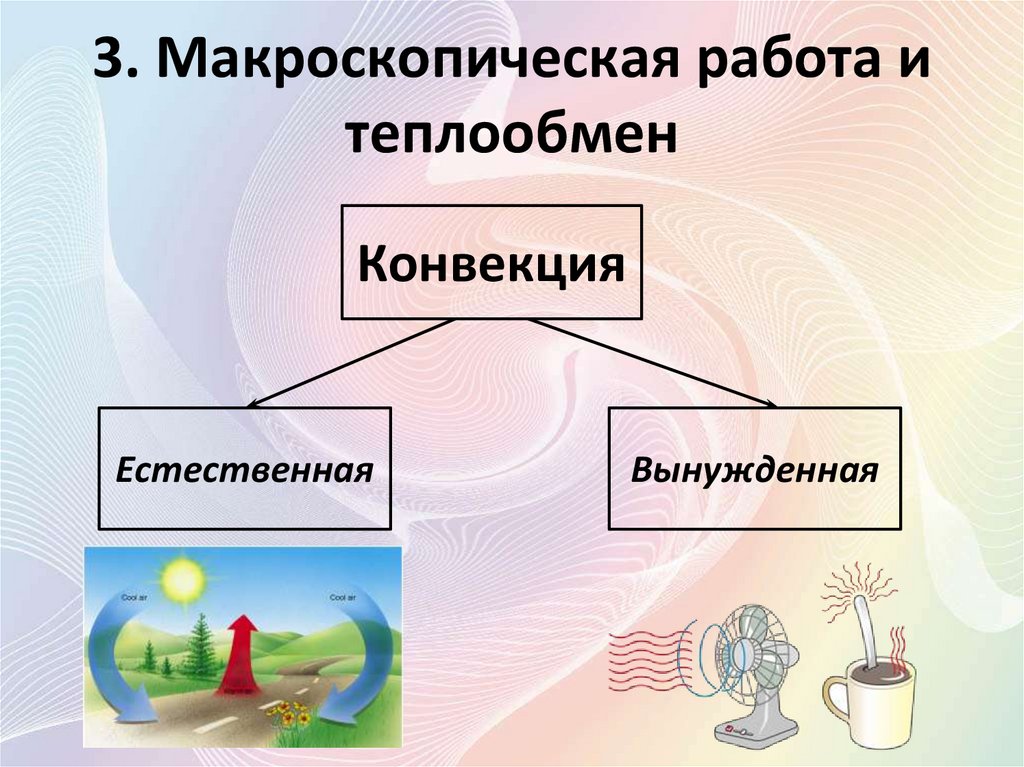
• Конве́кция (от лат. convectiō —
«перенесение») — вид теплообмена, при
котором внутренняя энергия передается
струями и потоками.
17.
3. Макроскопическая работа итеплообмен
Конвекция
Естественная
Вынужденная
18.
3. Макроскопическая работа итеплообмен
• Тепловое излучение − это
электромагнитное излучение,
возникающее за счет внутренней энергии
тела.
19.
4. Первое началотермодинамики. Теплоемкость
вещества
• Закон сохранения энергии:
Первое начало термодинамики:
• количество теплоты, полученное
системой, расходуется на изменение ее
внутренней энергии и на совершение
системой работы над внешними телами;
• невозможно построить машину,
совершающую работу больше получаемой
энергии (то есть невозможно построить
20.
4. Первое началотермодинамики. Теплоемкость
вещества
• Теплоемкостью тела называют отношение
количества теплоты, которое необходимо
сообщить телу для изменения его
температуры, к величине изменения
температуры:
21.
4. Первое началотермодинамики. Теплоемкость
вещества
• Удельная теплоемкость, численно равная
количеству теплоты, необходимому для
нагревания тела массой 1 кг на 1 К:
• Молярная теплоемкость, определяемая
количеством теплоты, необходимым для
нагревания 1 моля газа на 1 К:
22.
5. Применение первого законатермодинамики к различным процессам
• Изотермический процесс:
• поэтому
• Понятие теплоемкости тела для такого
процесса не применяется
23.
5. Применение первого законатермодинамики к различным процессам
• Изохорный процесс:
• Газ работы не совершает
• Молярная теплоемкость
24.
5. Применение первого законатермодинамики к различным процессам
• Изобарный процесс:
• Первое начало термодинамики:
• Молярная теплоемкость
25.
5. Применение первого законатермодинамики к различным процессам
• Из уравнения Менделеева Клапейрона
(для одного моля газа):
• С учетом
26.
5. Применение первого законатермодинамики к различным процессам
• Адиабатный процесс:
• Газ совершает работу
• Уравнение адиабатного процесса
• где
постоянная адиабаты.
27.
5. Применение первого законатермодинамики к различным процессам
28.
5. Применение первого законатермодинамики к различным процессам
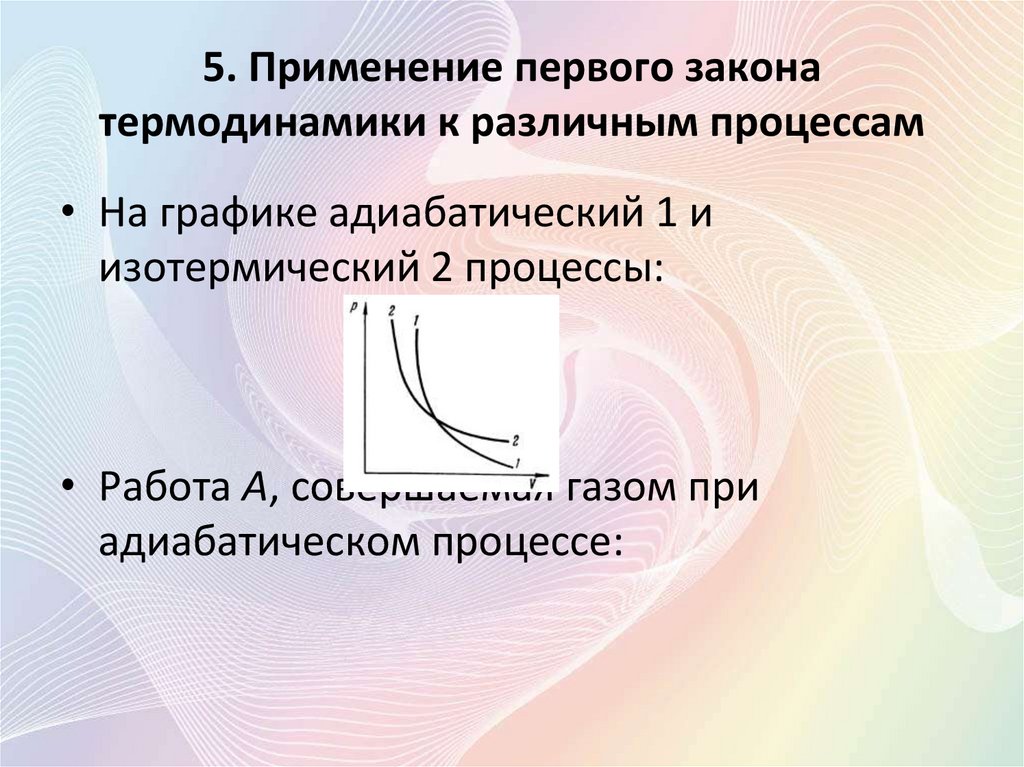
• На графике адиабатический 1 и
изотермический 2 процессы:
• Работа A, совершаемая газом при
адиабатическом процессе:
29.
6. Второе начало термодинамики.Обратимые и необратимые процессы
• Второе начало термодинамики:
1. Невозможен такой процесс,
единственным результатом которого была
бы передача теплоты от менее нагретого
тела более нагретому.
2. Невозможен такой процесс,
единственным результатом которого было
бы превращение теплоты в работу.
30.
6. Второе начало термодинамики.Обратимые и необратимые процессы
• Обратимым называется процесс, для
которого возможен переход из конечного
состояния в начальное через те же
состояния, что и в прямом процессе,
причем, если система возвращается в
исходное состояние, то в окружающих
телах и самой системе не происходит
никаких изменений.
• Процессы, не удовлетворяющие этим
условиям, называют необратимыми.
31.
7. Круговые процессы (циклы). Принципдействия тепловых двигателей
• Тепловой двигатель это устройство,
преобразующее внутреннюю энергию
топлива в механическую энергию
(двигатель внутреннего сгорания), или
устройство, в котором часть тепловой
энергии, полученной от нагревателя,
превращается в полезную работу.
• Процесс, при котором система, пройдя
через ряд состояний, возвращается в
исходное состояние называется круговым
32.
7. Круговые процессы (циклы). Принципдействия тепловых двигателей
• Работа цикла
• Отношение совершаемой
работы к количеству теплоты,
полученному от нагревателя,
называется коэффициентом
полезного действия (КПД)
тепловой машины :
33.
7. Круговые процессы (циклы). Принципдействия тепловых двигателей
• Карно показал, что максимально
возможный КПД идеальной
тепловой машины достигается при
использовании цикла из двух
изотерм и двух адиабат:
Никола
Леонард Сади
Карно
(1796 – 1832)
• где Т1, Т2 температуры нагревателя
и холодильника, соответственно.
34.
8. Энтропия• Идеальный цикл Карно является
обратимым:
• Теплота Q2, отдаваемая холодильнику,
является величиной отрицательной, тогда:
35.
8. Энтропия• Отношение передаваемой теплоты к температуре
называется приведенной теплотой.
• При бесконечном увеличении числа циклов и
уменьшении их размеров приведенная теплота
определяется как:
• где Q бесконечно малое количество
передаваемой теплоты.
36.
8. Энтропия• При этом за полный цикл приведенная
теплота также равна нулю:
• Функция S называется энтропией.
• Изменение энтропии:
37.
8. Энтропия• Энтропия замкнутой системы либо не
меняется (в случае обратимых процесса),
либо возрастает (в случае необратимых
процессов):
• Второе начало термодинамики: все
процессы в природе протекают в
направлении, приводящем к увеличению
энтропии.
38.
9. Атмосферное давление.Изменение атмосферного
давления с высотой
• Атмосфера это воздушная
оболочка Земли, простирающаяся
на высоту в несколько тысяч
километров.
Отто фон
Герике
(1602 –
1686)
39.
9. Атмосферное давление. Изменениеатмосферного давления с высотой
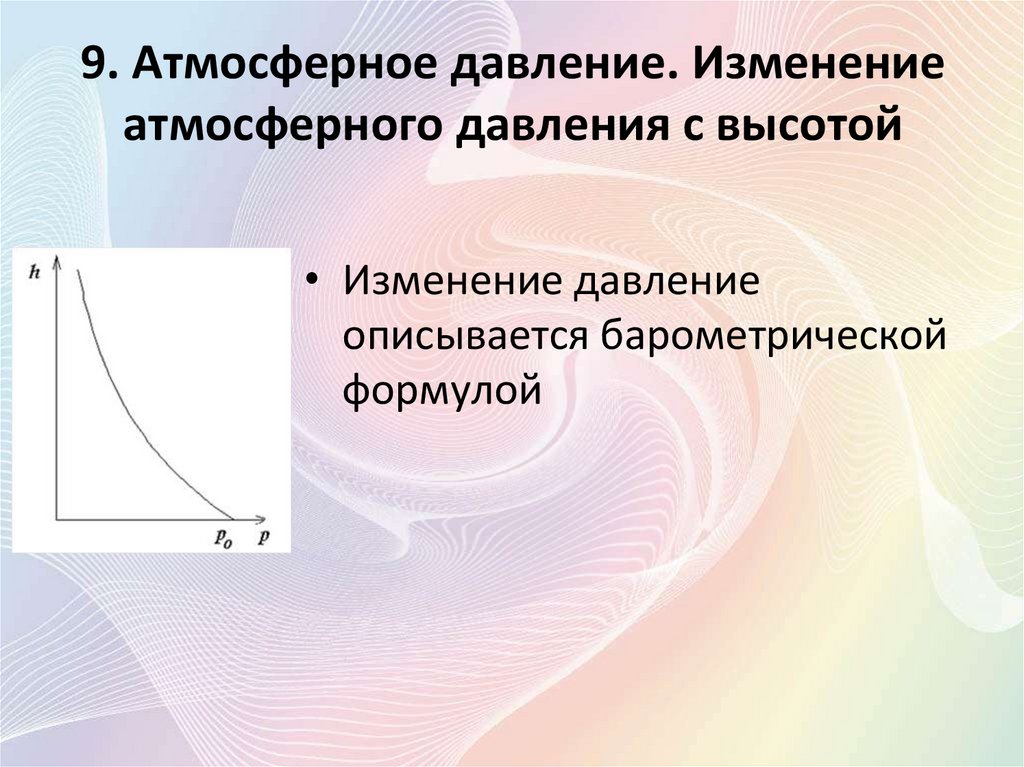
• Изменение давление
описывается барометрической
формулой
40.
10. Испарение и конденсация. Зависимостьтемпературы кипения от давления.
Влажность воздуха
• Испарением называется переход вещества
из жидкого состояния в газообразное
(парообразное).
• Количество теплоты, которое необходимо
передать жидкости массой 1 кг для ее
испарения при постоянной температуре,
называется удельной теплотой
испарения:
41.
10. Испарение и конденсация. Зависимостьтемпературы кипения от давления.
Влажность воздуха
• Одновременно с испарением происходит и
обратный процесс перехода вещества из
парообразного в жидкое состояние
конденсация.
• Пар, находящийся в динамическом
равновесии со своей жидкостью,
называется насыщенным.
• При определенной температуре начинается
процесс бурного испарения с поверхности
жидкости и внутрь пузырьков по всему
42.
10. Испарение и конденсация. Зависимостьтемпературы кипения от давления.
Влажность воздуха
• Относительной влажностью называют
отношение давления водяного пара в
воздухе р к давлению насыщенного пара
воды рн при температуре атмосферы:
• При температуре, называемой точкой
росы, пар становится насыщенным и
начинается конденсация возникает туман,
выпадает роса, твердые поверхности
запотевают.
43.
10. Испарение и конденсация. Зависимостьтемпературы кипения от давления.
Влажность воздуха
• Относительная влажность:
• Абсолютной влажностью называется
плотность водяного пара, находящегося в
воздухе (масса пара в 1 м3).
Гигрометр
Психрометр
44.
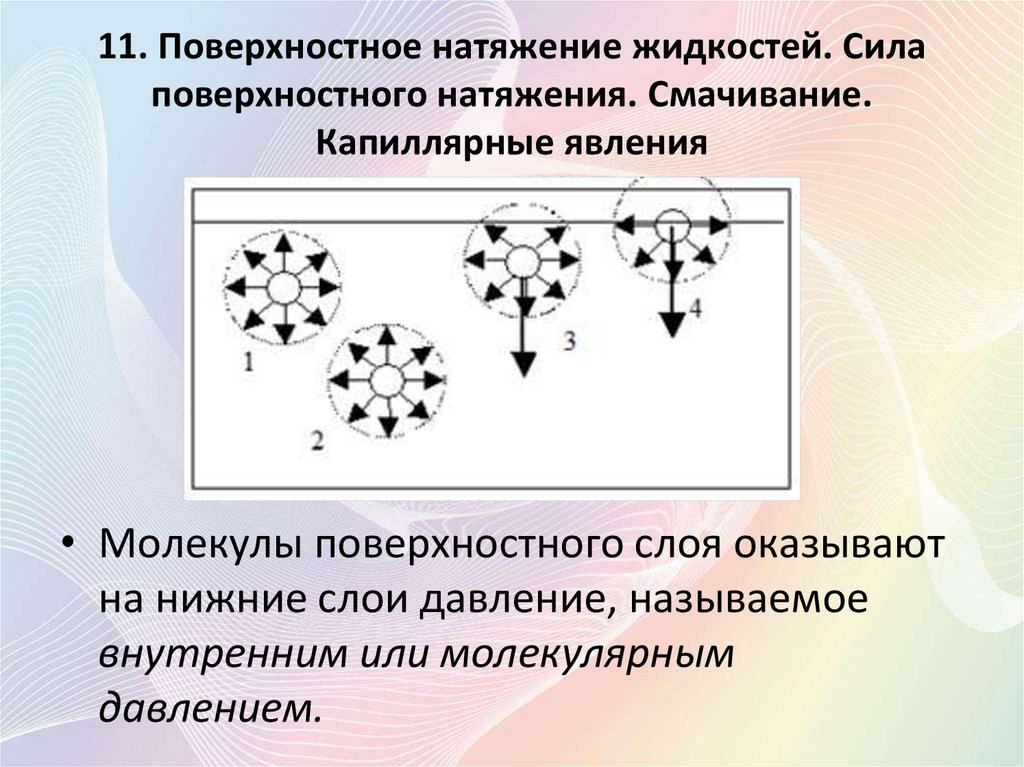
11. Поверхностное натяжение жидкостей. Силаповерхностного натяжения. Смачивание.
Капиллярные явления
• Молекулы поверхностного слоя оказывают
на нижние слои давление, называемое
внутренним или молекулярным
давлением.
45.
11. Поверхностное натяжение жидкостей. Силаповерхностного натяжения. Смачивание.
Капиллярные явления
• Сила, приходящаяся на
единицу длины контура,
называется
коэффициентом
поверхностного
натяжения:
46.
11. Поверхностное натяжение жидкостей. Силаповерхностного натяжения. Смачивание.
Капиллярные явления
• Мыльная пленка на проволочном каркасе
ограничена с двух сторон поверхностным
слоем, поэтому слой граничит с
перемычкой по контуру длины 2l и,
соответственно, действует на
перемычку с силой
• Работа при перемещении перемычки:
47.
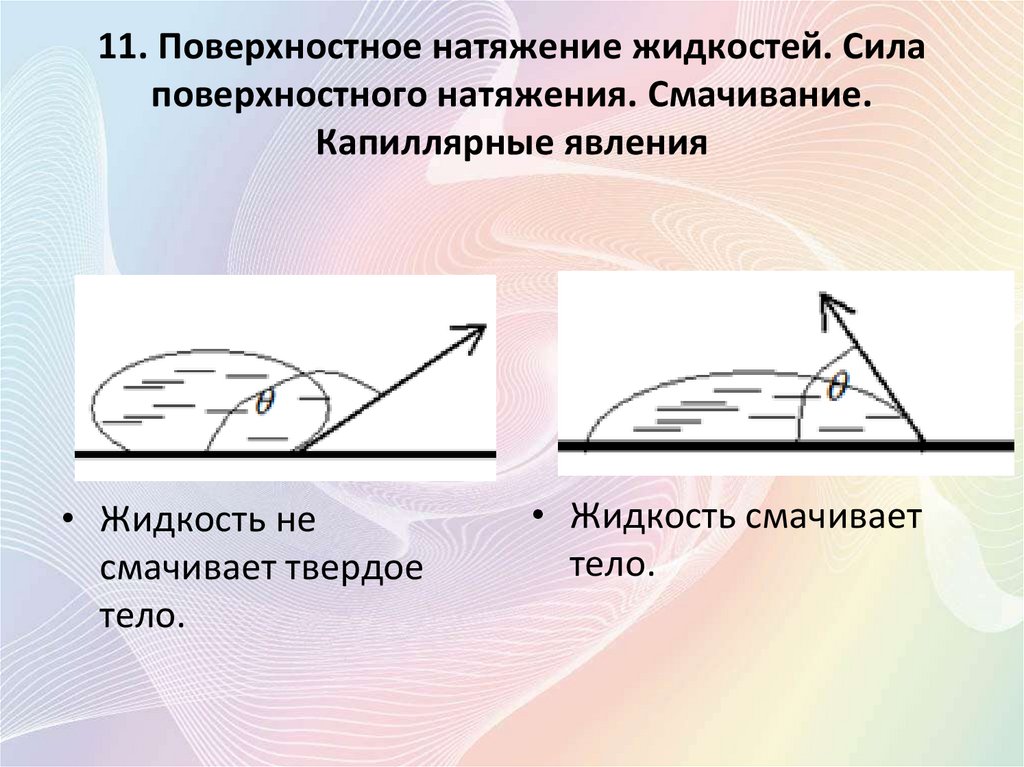
11. Поверхностное натяжение жидкостей. Силаповерхностного натяжения. Смачивание.
Капиллярные явления
• Коэффициент поверхностного натяжения:
• Угол, отсчитываемый внутри жидкости
между касательными к поверхностям
твердого тела и жидкости, называется
краевым.
48.
11. Поверхностное натяжение жидкостей. Силаповерхностного натяжения. Смачивание.
Капиллярные явления
• Жидкость не
смачивает твердое
тело.
• Жидкость смачивает
тело.
49.
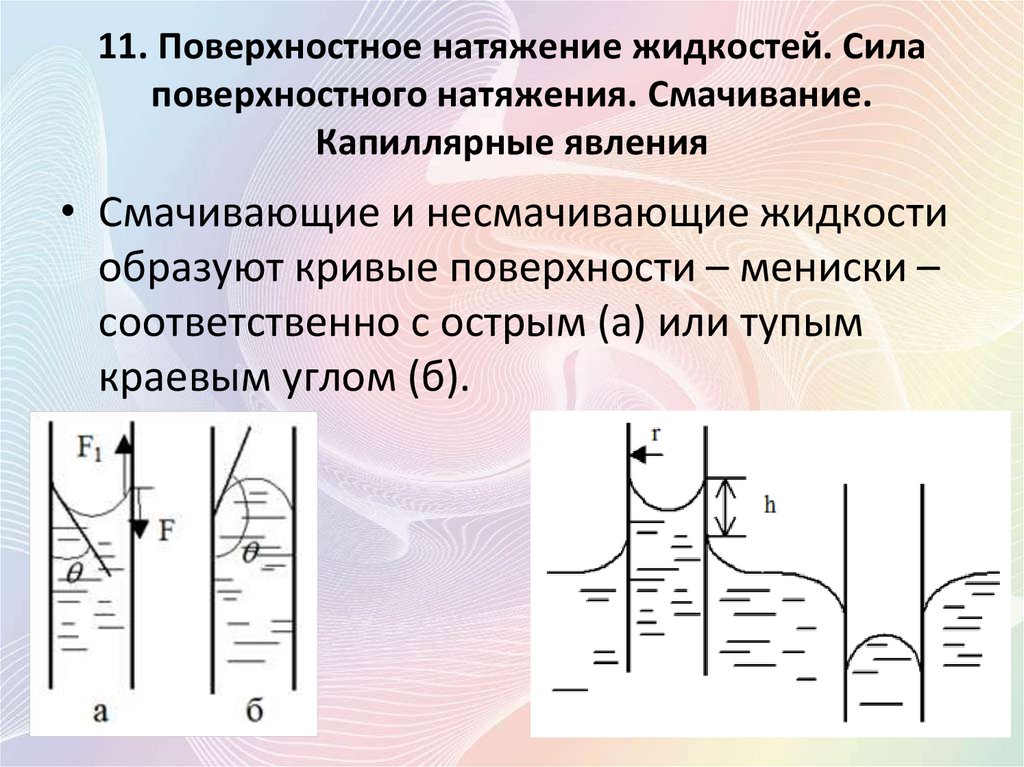
11. Поверхностное натяжение жидкостей. Силаповерхностного натяжения. Смачивание.
Капиллярные явления
• Смачивающие и несмачивающие жидкости
образуют кривые поверхности – мениски –
соответственно с острым (а) или тупым
краевым углом (б).










































 physics
physics








