Similar presentations:
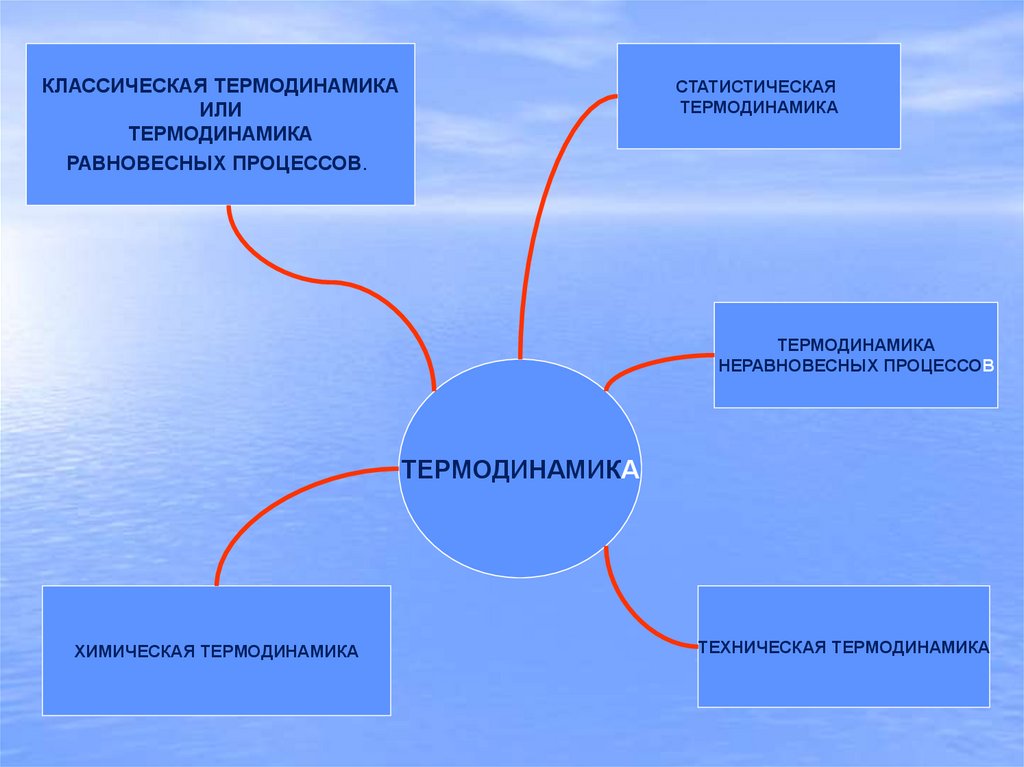
Классическая термодинамика или термодинамика равновесных процессов
1.
2.
КЛАССИЧЕСКАЯ ТЕРМОДИНАМИКАИЛИ
ТЕРМОДИНАМИКА
РАВНОВЕСНЫХ ПРОЦЕССОВ.
СТАТИСТИЧЕСКАЯ
ТЕРМОДИНАМИКА
ТЕРМОДИНАМИКА
НЕРАВНОВЕСНЫХ ПРОЦЕССОВ
ТЕРМОДИНАМИКА
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА
3. ОСНОВЫ ТЕРМОДИНАМИКИ.
• Это теория о наиболее общих свойствахмакроскопических тел.
• На первый план выступают тепловые
процессы и энергетические преобразования
•Ядром являются два начала (закона)
термодинамики
4. ИЗ ИСТОРИИ РАЗВИТИЯ ТЕРМОДИНАМИКИ
АВТОРСУТЬ ВВЕДЕННЫХ ПРЕДСТАВЛЕНИЙ
Д. Фаренгейт (1685-1736)
В 1710 – 1714 годах предложил шкалу и термометр:
0° - температура смеси воды, льда и поваренной соли,
32° - температура смеси воды и льда, 212° температура кипения воды, 96° - температура тела
человека.
А. Цельсий (1701 – 1744),
В 1742 году предложил стоградусную шкалу температур:
0° - температура таяния льда, 100° - температура
кипение воды
голливудский физик, мастерстеклодув
шведский физик и астроном.
Ж. Понселе (1788 – 1867),
французский физик и инженер.
В 1826 году ввел понятие работы и единицы её
измерения.
С. Карно (1796 – 1832),
французский физик и инженер.
Ввел представление об идеальной тепловой машине, а в
1824 году фактически дал формулировку второго начала
термодинамики, связал тепло с движение частиц тела.
Б. Клапейрон (1799 –
1864), французский физик и
В 1834 году вывел уравнение состояния идеального
газа, обобщенное в дальнейшем Д. И. Менделеевым.
инженер.
5. ИЗ ИСТОРИИ РАЗВИТИЯ ТЕРМОДИНАМИКИ
АВТОРСУТЬ ВВЕДЕННЫХ ПРЕДСТАВЛЕНИЙ
Р. Майер (1818 – 1878),
В 1842 году одним из первых сформулировал закон
сохранения и превращения энергии.
Дж. Джоуль (1818 – 1889),
В 1843 году первый вычислил механический
эквивалент теплоты и пришел к закону сохранения
энергии.
немецкий врач и
естествоиспытатель.
английский физик
Г. Гельмгольц (1821 – 1894), В 1847 году дополнив идеи Майера и опыты Джоуля,
немецкий физик и
естествоиспытатель
сформулировал и математически обосновал закон
сохранения и превращения энергии.
Р. Клаузиус (1822 – 1888),
немецкий физик-теоретик.
В 1850 году сформулировал второе начало
термодинамики, а в 1854 г. дал математическую
формулировку первого начала.
У. Томсон (Кельвин) (1824 – 1907),
В 1848 году ввел понятие абсолютной температуры,
в 1851 году сформулировал второе начало
термодинамики.
английский физик.
6. ЧТО ИЗУЧАЕТ ТЕРМОДИНАМИКА?
Возникла как наука тепловых процессов,рассматриваемых с точки зрения энергетических
преобразований.
Не рассматривает явления с точки зрения движения
молекул.
Изучает наиболее общие свойства макроскопических
систем, находящихся в равновесном состоянии, и
процессы их перехода из одного состояния в другое.
Термодинамический метод широко используется в
других разделах физики, химии, биологии.
Как и любая физическая теория или раздел физики,
имеет свои границы применимости.
7. ГРАНИЦЫ ПРИМЕНИМОСТИ ТЕРМОДИНАМИКИ
• Неприменима к системе из нескольких молекул.•Не может быть применима ко
всей Вселенной, слишком
сложной и неопределенной
физической системе.
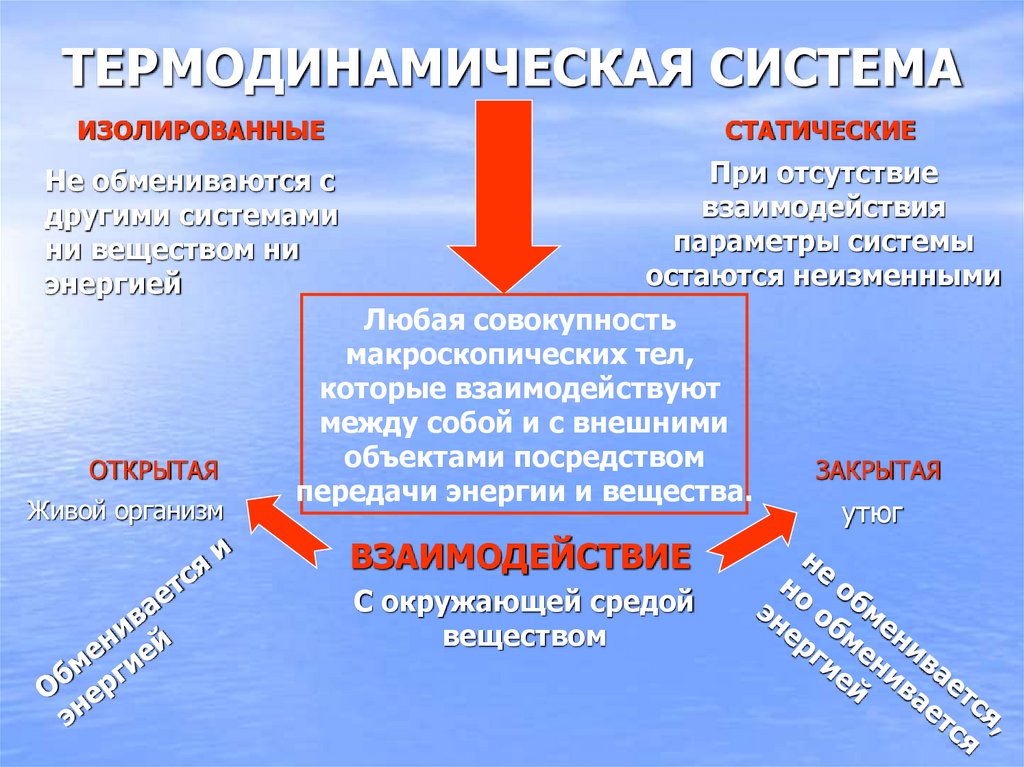
8. ТЕРМОДИНАМИЧЕСКАЯ СИСТЕМА
ИЗОЛИРОВАННЫЕСТАТИЧЕСКИЕ
Не обмениваются с
другими системами
ни веществом ни
энергией
При отсутствие
взаимодействия
параметры системы
остаются неизменными
ОТКРЫТАЯ
Живой организм
Любая совокупность
макроскопических тел,
которые взаимодействуют
между собой и с внешними
объектами посредством
передачи энергии и вещества.
ВЗАИМОДЕЙСТВИЕ
С окружающей средой
веществом
ЗАКРЫТАЯ
утюг
9.
ТЕРМОДИНАМИЧЕСКИЕПАРАМЕТРЫ
Совокупность физических величин, характеризующих
свойства термодинамической системы.
V - объём
Р - давление
T - температура
U - внутренняя энергия
10. Одноатомный газ -
газ , состоящий из отдельныхатомов, а не
молекул(идеальный газ).
Одноатомными являются
инертные газы- гелий, неон,
аргон и др.
11.
ВНУТРЕННЯЯЭНЕРГИЯ.
12.
1. Внутренняя энергия тела равна суммекинетической энергии движения молекул и
потенциальной энергии взаимодействия
молекул.
U Ek Е p
2. Внутренняя энергия зависит от температуры и
от количества частиц. Обозначается U,
измеряется в Дж.
3. Т.к. потенциальная энергия идеального газа равна
0, то
U E
k
Выведем формулу для расчета внутренней энергии
одноатомного идеального газа:
13.
m3
Ek E N ; N
N A ; E kT
M
2
3
m
3 m
3 m
E k kT
NA
kN A T
RT
U Ek
2
M
2M
2M
3 m
U
RT - внутренняя энергия
2M
одноатомного идеального газа.
5 m
U
RT - внутренняя энергия
2M
двуатомного идеального газа.
14.
Изменение внутренней энергии:3 m
U U 2 U 1
R T
2 M
3
или U
p V
2
Способы изменения внутренней энергии
Совершение работы
Теплопередача
Теплопроводность
Излучение
Конвекция
15. Теплообмен
теплопроводностьконвекция
излучение
16. Теплопроводность
- это такой тип теплообмена,когда тепло передаётся от
более нагретых участков тела
менее нагретым вследствие
теплового движения молекул.
• Все вещества имеют различную
теплопроводность. Лучшие
проводники тепла – кристаллы.
• Те вещества, в которых расстояния
между молекулами большие – плохие
проводники тепла. Это древесина,
кирпич и т.д.
17. Конвекция
- это такой типтеплообмена, при
котором энергия
переносится струями
жидкости или газа.
• Плотность горячего газа
или жидкости меньше,
чем холодных, поэтому
конвекционные потоки
поднимаются вверх.
18. Лучистый обмен или просто излучение
- это перенос энергии ввиде
электромагнитных
волн.
Любое нагретое тело является
источником излучения.
• Этот вид теплообмена
отличается от предыдущих
тем, что может происходить и
в вакууме.
19.
Количество теплоты, Q – это энергия, переданнаясистеме или полученная системой при теплообмене.
Процесс
Формула, удельные величины
Нагревание или
охлаждение
Q cm T
Кипение или
конденсация
Q=rm
r– удельная теплота парообразования,
Дж/кг
Плавление или
кристаллизация
Q=λm
λ – удельная теплота плавления, Дж/кг
Сгорание
топлива
Q=qm
q – удельная теплота сгорания, Дж/кг
c- удельная теплоемкость, Дж/(кг*К)
m – масса, кг;
- изменение температуры, К
Уравнение теплового
баланса:
Q Q
1
2
Qn const
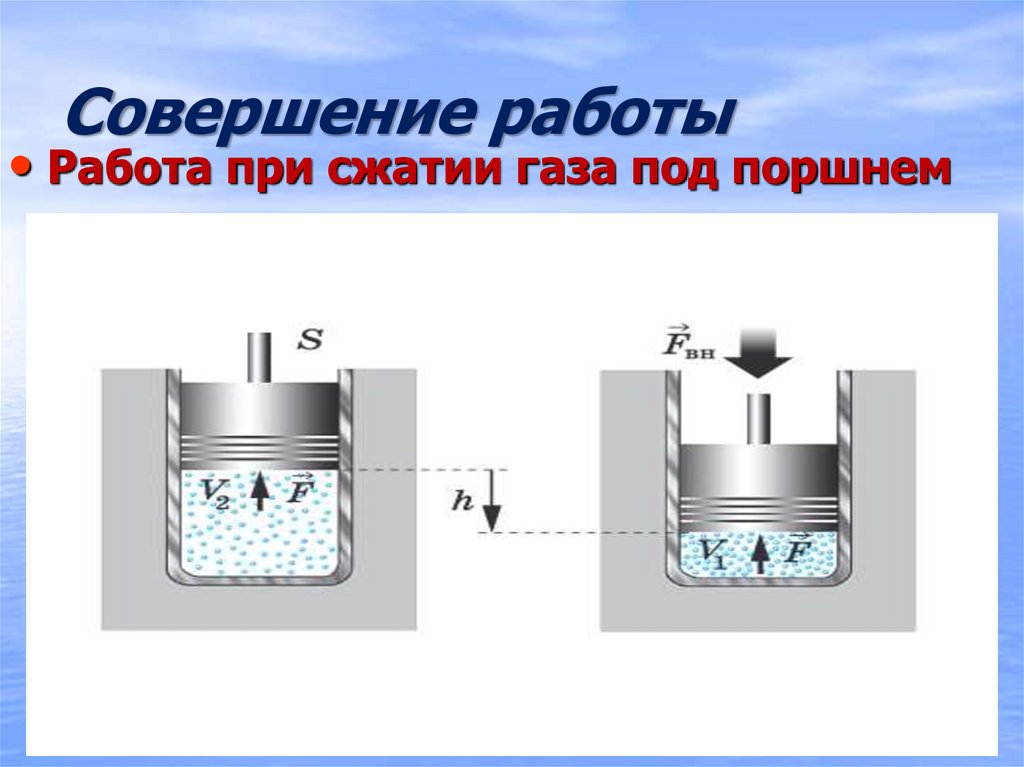
20. Совершение работы
• Работа при сжатии газа под поршнем21. Совершение работы
• Работа при расширении газа подпоршнем
22.
Работа в термодинамике – работа сил, приложенных квнешним телам со стороны системы при её деформации.
Работа газа численно равна площади фигуры под графиком
зависимости давления от объёма в координатах p, V
Расширение газа
p
p 1
A>0
2
p
2
Сжатие газа
A<0
1
V
V1
V
V
AГаза p (V2 V1 ) p V - работа газа
V1
V2
2
Aвн AГ p V - работа внешних сил
23.
Задача №1. В стальном баллоне находится гелий массой0,5 кг при температуре 10°С. Как изменится внутренняя
энергия гелия, если его температура повысится до 30°С?
Дано:
Решение:
m 0,5кг
3 m
U
R T
2M
t1 10 C
0
t 2 300 C
кг
моль
Дж
R 8,31
кг моль
U ?
T1 t1 273 283K ; T2 t2 273 303K ;
M 4 10 3
T T2 T1 20 K
3 0,5
3
U
8
,
31
20
31
,
2
10
Дж
3
2 4 10
Ответ. 31,2 кДж
24.
Задачи (самостоятельно):1. Определите изменение внутренней
O 2 ( ) массой
энергии кислорода
3 кг при изменении его температуры от
17ºС до 27ºС.
2. Газ, расширяясь изобарно, совершает
работу 0,2 кДж при давлении 200 кПа.
Определите первоначальный объём газа,
если конечный объём стал равен 2,5 л.
25. I ЗАКОН ТЕРМОДИНАМИКИ
(Закон сохранения и превращения энергии в применениик тепловым процессам)
Изменение внутренней энергии U системы
равно сумме работы A совершенной
внешними телами над системой, и
сообщенного ей количества теплоты Q.
U=A+Q
A*=-A
Q=A*+ U
Количество теплоты Q, переданное системе, расходуется на
увеличение её внутренней энергии U и совершение системой
работы A* над внешними телами.
26. ТЕРМОДИНАМИКА ИЗОПРОЦЕССОВ.
Процессы, происходящие при постоянномзначении одного из параметров состояния (T,V
или P) с данной массой газа называются
изопроцессами.
ИЗОТЕРМИЧЕСКИЙ
ИЗОХОРНЫЙ
ИЗОБАРНЫЙ
АДИАБАТНЫЙ
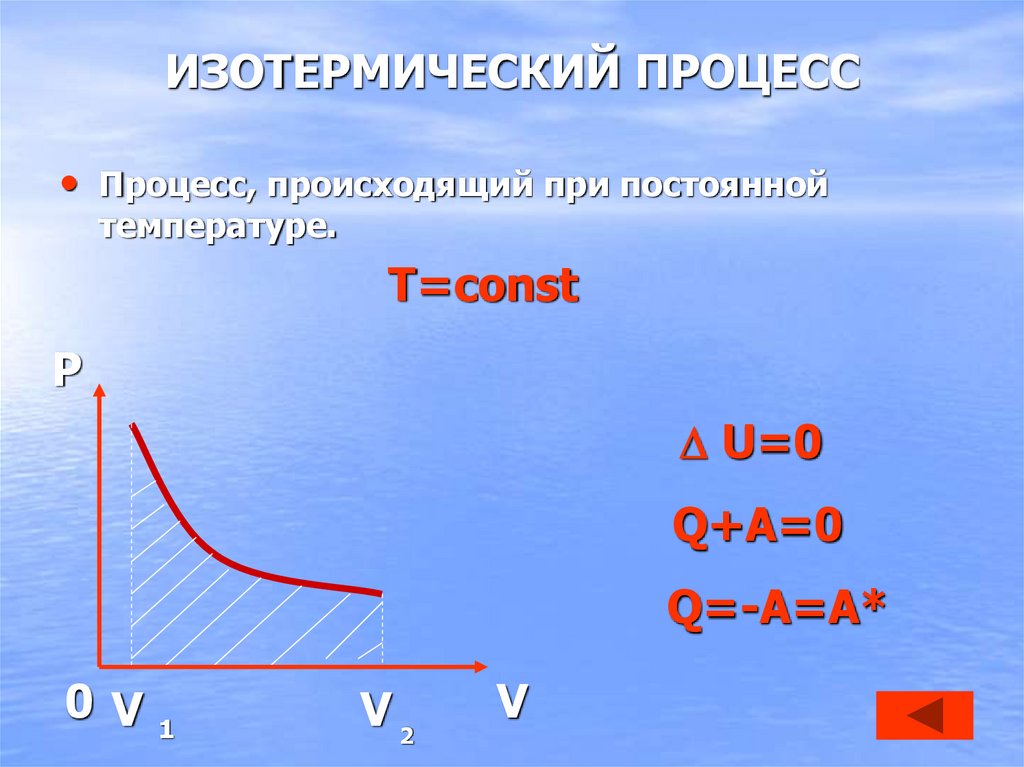
27. ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС
• Процесс, происходящий при постояннойтемпературе.
T=const
P
U=0
Q+A=0
Q=-A=A*
0 V1
V2
V
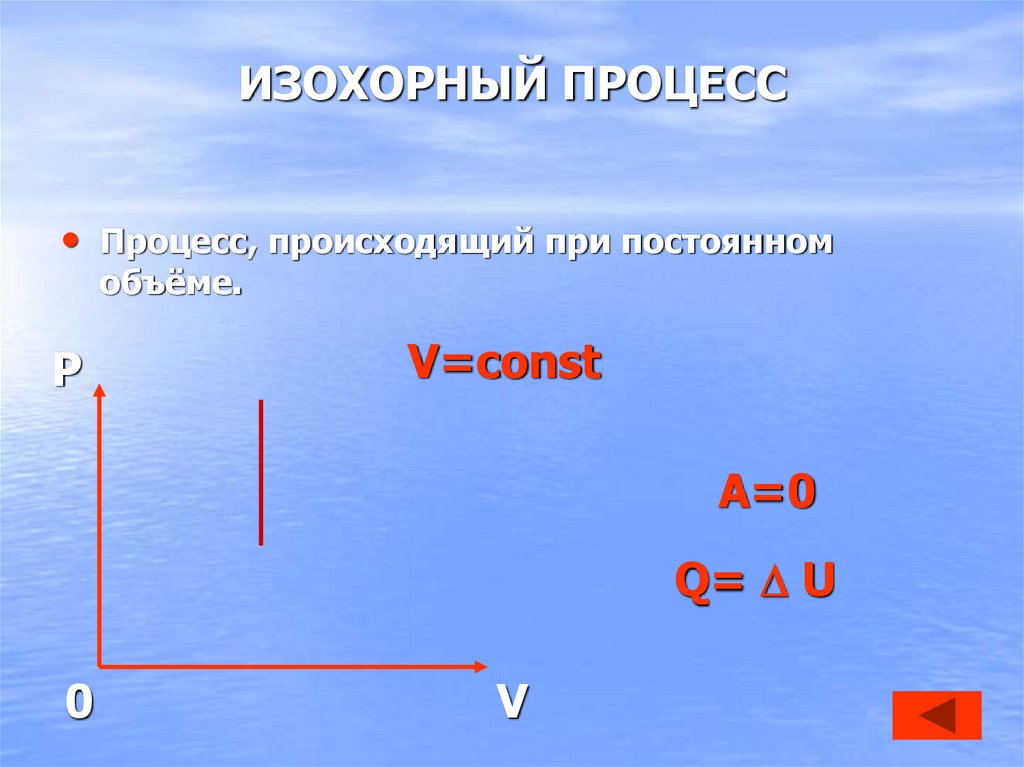
28. ИЗОХОРНЫЙ ПРОЦЕСС
• Процесс, происходящий при постоянномобъёме.
P
V=const
A=0
Q= U
0
V
29. ИЗОБАРНЫЙ ПРОЦЕСС
• Процесс, происходящий при постоянномдавлении.
A*=p (V 1 + V)
2
P
U=A+Q
Q=A*+ U
0V1
V2
V
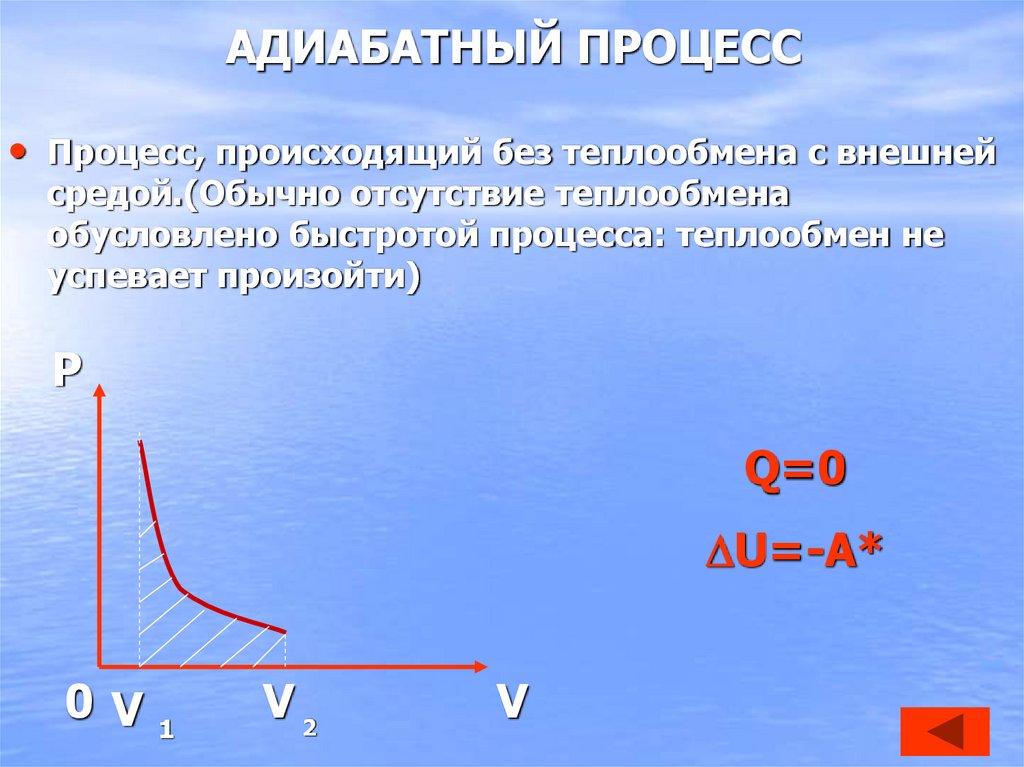
30. АДИАБАТНЫЙ ПРОЦЕСС
• Процесс, происходящий без теплообмена с внешнейсредой.(Обычно отсутствие теплообмена
обусловлено быстротой процесса: теплообмен не
успевает произойти)
P
Q=0
U=-A*
0 V1
V2
V
31. II ЗАКОН ТЕРМОДИНАМИКИ
Не возможно перевести теплоту от более холодной системык более горячей при отсутствии других одновременных
изменений в обеих системах или окружающих телах.
Не возможен круговой процесс, единственным
результатом которого было бы производство работы за
счет охлаждения теплового резервуара.
Не возможен круговой процесс, единственным
результатом которого является передача теплоты от
менее нагретого тела более нагретому.
Тепловые процессы необратимы.
32. ТЕПЛОВОЙ ДВИГАТЕЛЬ – ГЛАВНЫЙ ДВИГАТЕЛЬ СОВРЕМЕННОЙ ЭНЕРГЕТИКИ
• Периодически действующий двигатель, совершающийработу за счет полученной извне теплоты.
НАГРЕВАТЕЛЬ (Т1)
Q1
РАБОЧЕЕ ТЕЛА
Q2
ХОЛОДИЛЬНИК (Т2)
A*
A*=Q1 – Q2
Виды двигателей:
1. Паровая и газовая турбины
2. Карбюраторный двс
3. Дизель двс
4. Ракетный двигатель
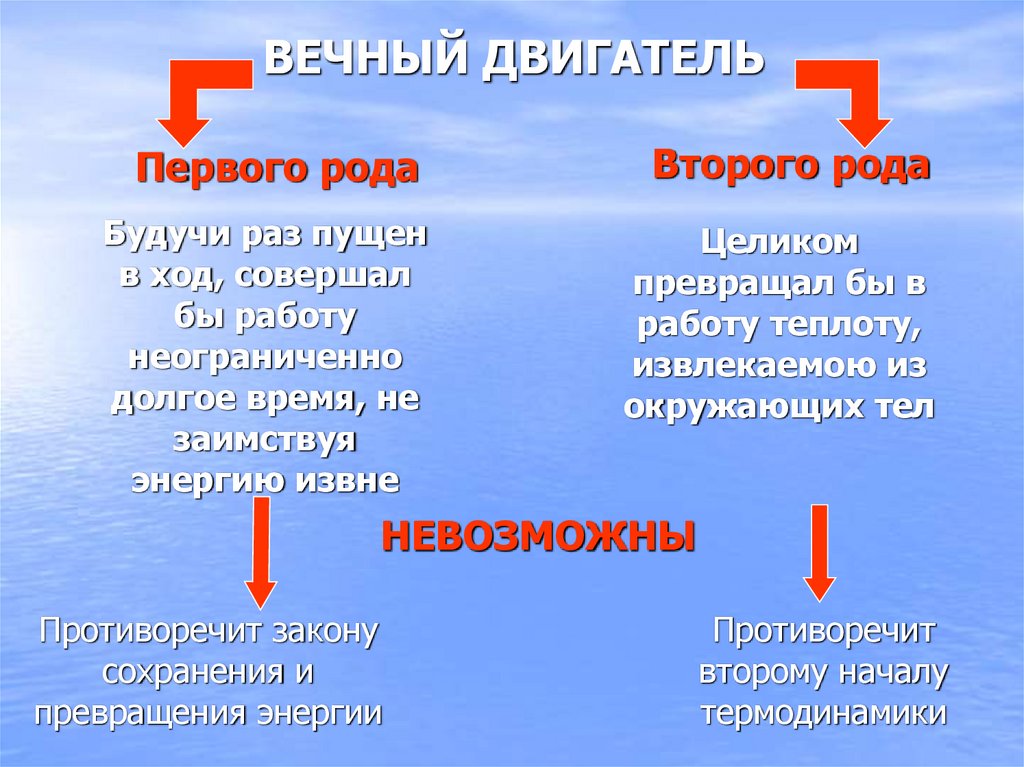
33. ВЕЧНЫЙ ДВИГАТЕЛЬ
Первого родаВторого рода
Будучи раз пущен
в ход, совершал
бы работу
неограниченно
долгое время, не
заимствуя
энергию извне
Целиком
превращал бы в
работу теплоту,
извлекаемою из
окружающих тел
НЕВОЗМОЖНЫ
Противоречит закону
сохранения и
превращения энергии
Противоречит
второму началу
термодинамики
34. ТЕРМОДИНАМИКА И ПРИРОДА
В окружающей нас природе термодинамическиобратимых процессов нет.
Энтропия в термодинамически не обратимых процессах,
протекающих в изолированной системе, возрастает.
По определению А. Эддингтона, возрастание энтропии,
определяющей необратимые процессы есть «стрела
времени»:чем выше энтропия системы, тем больше
временной промежуток прошла система в своей эволюции.
Возрастание энтропии вселенной должно привести к тому,
что температура всех тел сравняется т. е. наступит
тепловое равновесие и все процессы прекратятся, наступит
«тепловая смерть Вселенной». (Выводы второго закона
термодинамики не всегда имеют место в природе и его
нельзя применить ко всем существующим процессам).
35. Тест по ТЕРМОДИНАМИКЕ
1. На сколько отделов делится термодинамика как предмет?а) на три
б) на четыре
в) на пять
г) на шесть
2. Кем была предложена температурная шкала, которой мы
пользуемся в повседневной жизни?
а) Кельвином
б) Цельсием
в) Карно
г) Джоулем
3. Что изучает термодинамика?
а) тепловые процессы
б) движение молекул
в) звуковые явления
г) механические явления
4. Термодинамическая система, которая не взаимодействует с
другими системами называется:
а) закрытой
б) изолированной
в) статической
г) открытой
5. Процессы, происходящие при постоянной температуре
называются:
а) адиабатными
б) изотермическими
в) изобарными
г) изохорными
36. Тест по ТЕРМОДИНАМИКЕ (продолжение)
6. При каком изопроцессе работа не совершается?а) при изотермическом
б) изохорном
в) адиабатном
г) изобарном
а) обратимы
б) изолированы
в) необратимы
г) закрыты
а) паровая турбина
б) водяная турбина
в) ракетный двигатель
г) дизель
а) возрастает
б) уменьшатся
в) не изменяется
г) равна нулю
7. Согласно второму началу термодинамики тепловые
процессы:
8. Какой двигатель не является тепловым?
9. Энтропия в термодинамически необратимых процессах:
10. Тепловая смерть Вселенной наступит, если:
а) температура всех тел сравняется;
б) температура всех тел станет равной нулю;
в) температура всех тел будет повышаться;
г) температура всех тел будет понижаться.





























 physics
physics








