Similar presentations:
Биогенность химических элементов. Лекция №5
1.
ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-ЯсенецкогоКафедра биологической химии с курсами медицинской,
фармацевтической и токсикологической химии
БИОГЕННОСТЬ ХИМИЧЕСКИХ
ЭЛЕМЕНТОВ
Лекция №5 для студентов первого курса, обучающихся
по специальности 31-05-03 стоматология
Лектор: старший преподаватель Пащенко Светлана Ивановна
г.Красноярск, 2023
2.
ЦЕЛЬ ЛЕКЦИИПоказать влияние строения атомов биогенных
элементов на:
- образование химической связи
- природу разрыва химической связи
-Выяснить природу электронных эффектов
заместителей и их влияние на реакционные центры
молекул.
Выяснению характера реакционных центров:
нуклеофильных, электрофильных, кислотных и
основных.
Уделить внимание механизмам химических реакций:
АE,, SE, AR
3.
ПЛАН ЛЕКЦИИ1. Исторические предпосылки к созданию теории
строения органических соединений Бутлерова А.М.
2. Строение атома.
3. Основные положения теории химического строения
органических веществ Бутлерова А.М.
4. Гибридизация
.5. Химическая связь. Свойства ковалентной связи
6 Реакционные частицы в органических реакциях
7 Реакционные места в субстратах в органических
соединениях.
6. Выводы
4.
Элементы - органогеныБиогенными элементами (органогенами) называют элементы,
необходимые для построения и жизнедеятельности различных
клеток организмов.
5.
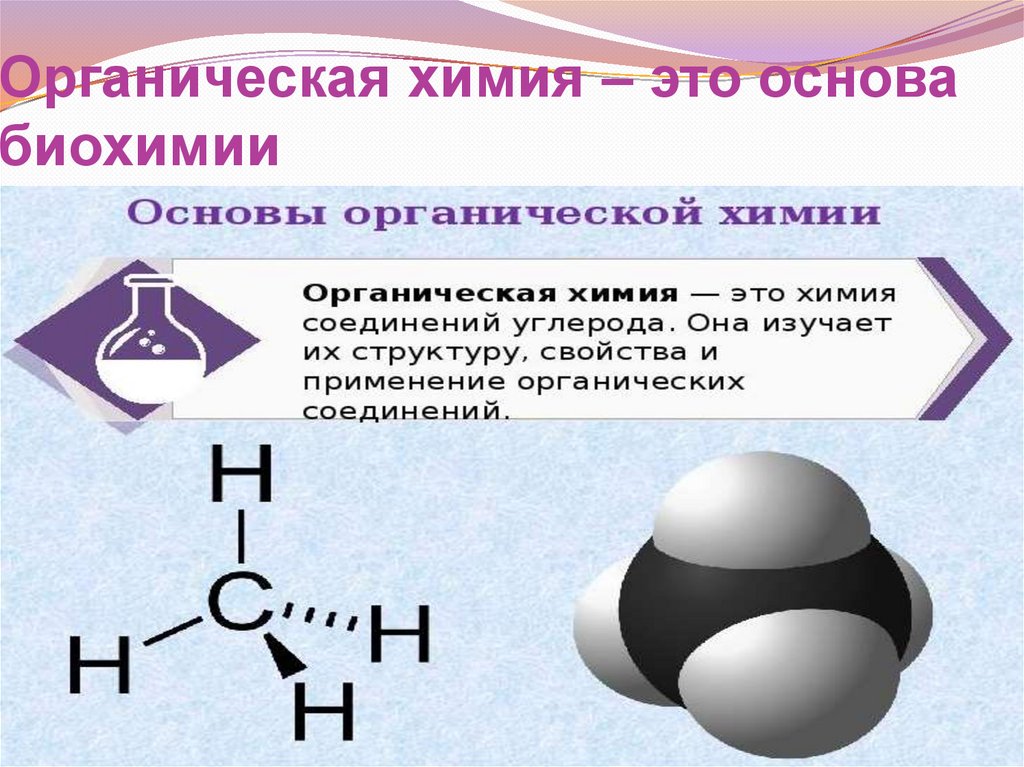
Органическая химия – это основабиохимии
6.
Органическая химия – это химияуглеводородов и их производных.
Углеводороды – это простейшие органические
соединения молекулы которых состоят только из
атомов углерода и водорода.
Производные углеводородов – это продукты замещения
атомов водорода на другие атомы или группы атомов
7.
Классификацияорганических соединений
8.
Строение атома9.
АТОМНАЯ ОРБИТАЛЬ10.
Квантовые числа, как характеристикасостояния электронов в атоме
11.
12.
Возможны значения квантовых чисел13.
Квантове числа – как характеристикисостояния электронов в атоме
14.
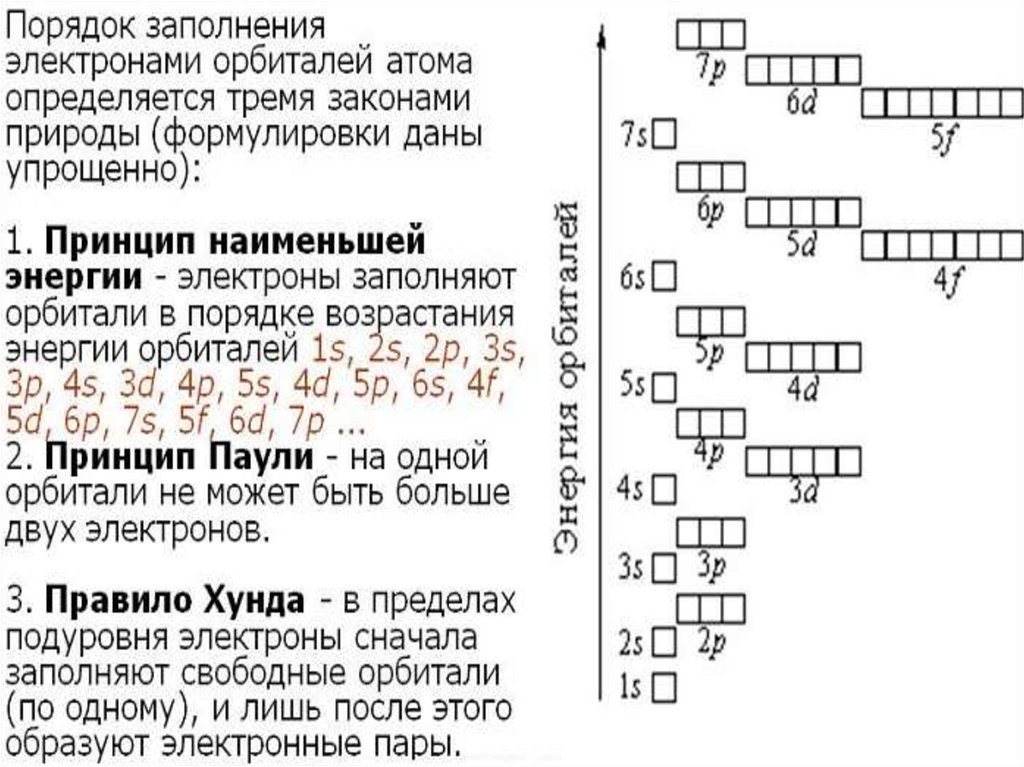
СТРОЕНИЕ ЭЛЕКТРОННЫХОБОЛОЧЕК
15.
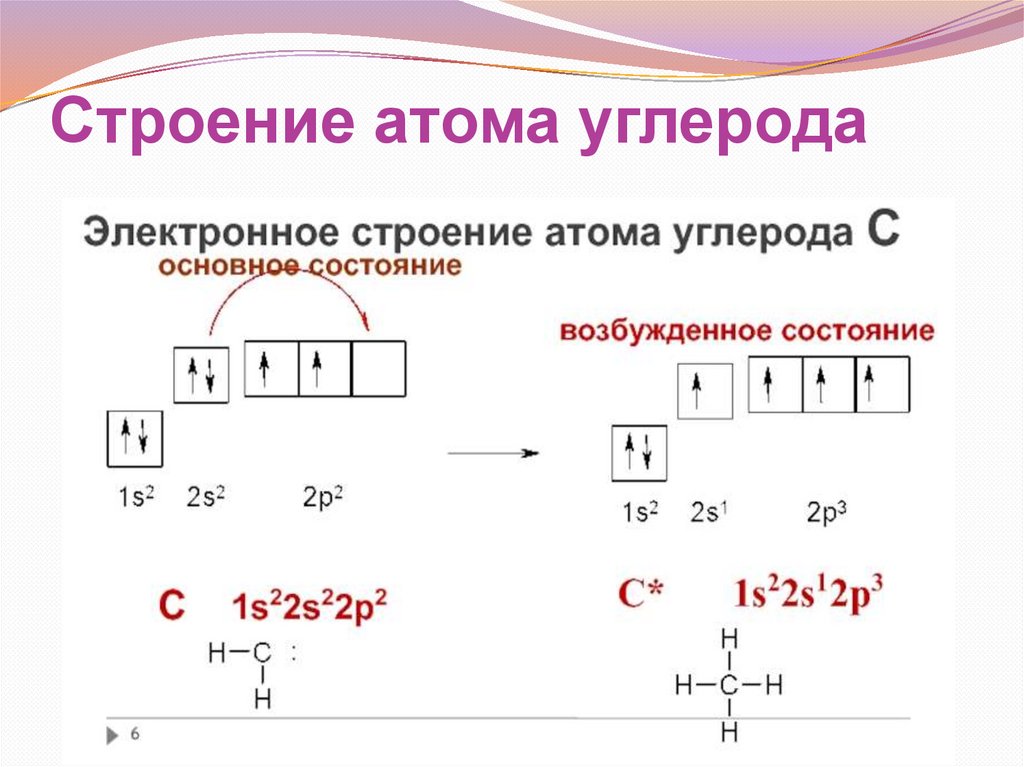
Строение атома углерода16.
ТЕОРИЯ СТРОЕНИЯ ОРГАНИЧЕСКИХСОЕДИНЕНИЙ А.М.БУТЛЕРОВА
17.
ТЕОРИЯ СТРОЕНИЯ ОРГАНИЧЕСКИХСОЕДИНЕНИЙ А.М. Бутлерова
Первое положение
Атомы в молекулах соединены не беспорядочно,
а строго в определённой последовательности,
согласно их валентности.
18.
Строение органическихсоединений
Цепи бывают линейные, разветвлённые и замкнутые
19.
ТЕОРИЯ СТРОЕНИЯ ОРГАНИЧЕСКИХСОЕДИНЕНИЙ А.М. Бутлерова
Второе положение теории
Свойства веществ зависят не только от того, какие атомы и в
каких количества входят в состав молекулы , но и от того , в
каком порядке они соединены между собой.
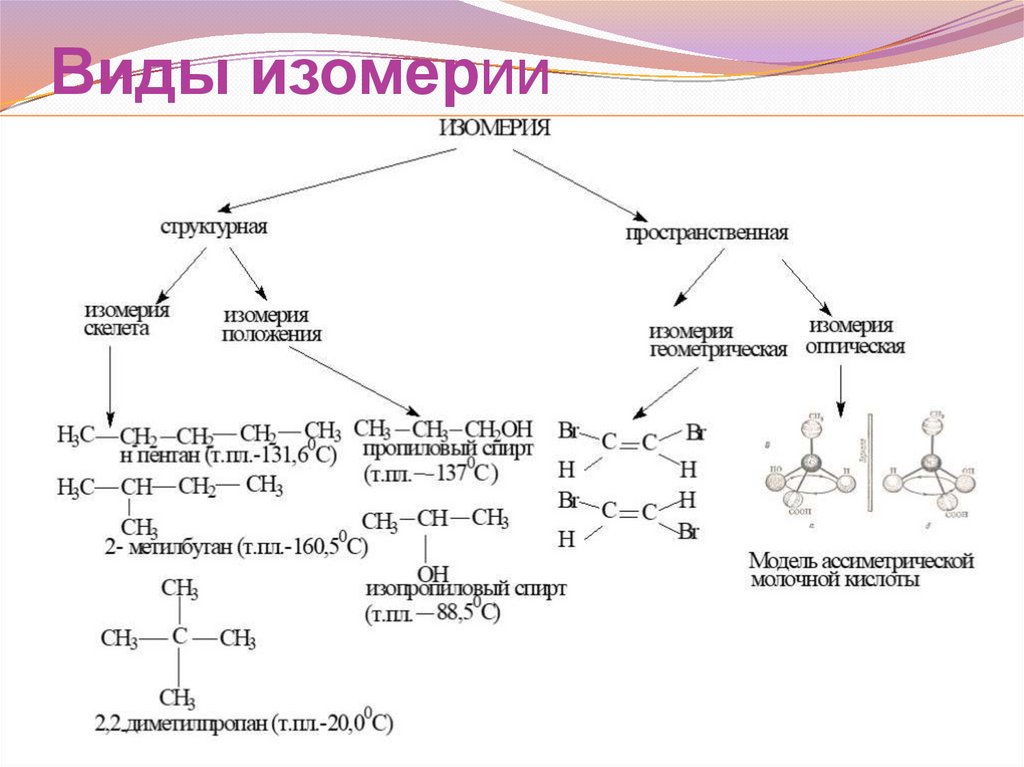
Изомеры – это вещества, имеющие одинаковый качественный
и количественный состав молекул, но разное строения, а
от сюда и разные свойства.
20.
Виды изомерии21.
ТЕОРИЯ СТРОЕНИЯОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
А.М. Бутлерова
Третье положение теории
Атомы и группы атомов , входящие в состав молекулы, взаимно
влияют друг друга, от чего зависят химическая активность и
реакционная способность молекул
Взаимное влияние проявляется в поляризуемости связи, т.е. в
смещении электронов связи под влиянием электроотрицательности
атомов в молекуле .
22.
Электронные эффектыИндуктивный эффект – это смещение электронной плотности вдоль G- связи от
одного атома к другому вследствие их разности электроотрицательности
Шкала Полинга
Мезомерный эффект - это передача электронного
влияния заместителей по сопряжённой системе
( смещение по П-связи)
23.
Некоторые электронные эффекты24.
Значение теории строенияорганических соединений
25.
ГИБРИДИЗАЦИЯЭЛЕКТРОННЫХ ОБЛАКОВ
Гибридизация атомных орбиталей — выравнивание
электронной плотности атомных орбиталей неодинакового
типа,что сопровождается формированием новых,
молекулярных орбиталей с одинаковыми формой и энергией.
Гибридные орбитали из-за большего перекрывания образуют более прочные
связи по сравнению с негибридизованными орбиталями
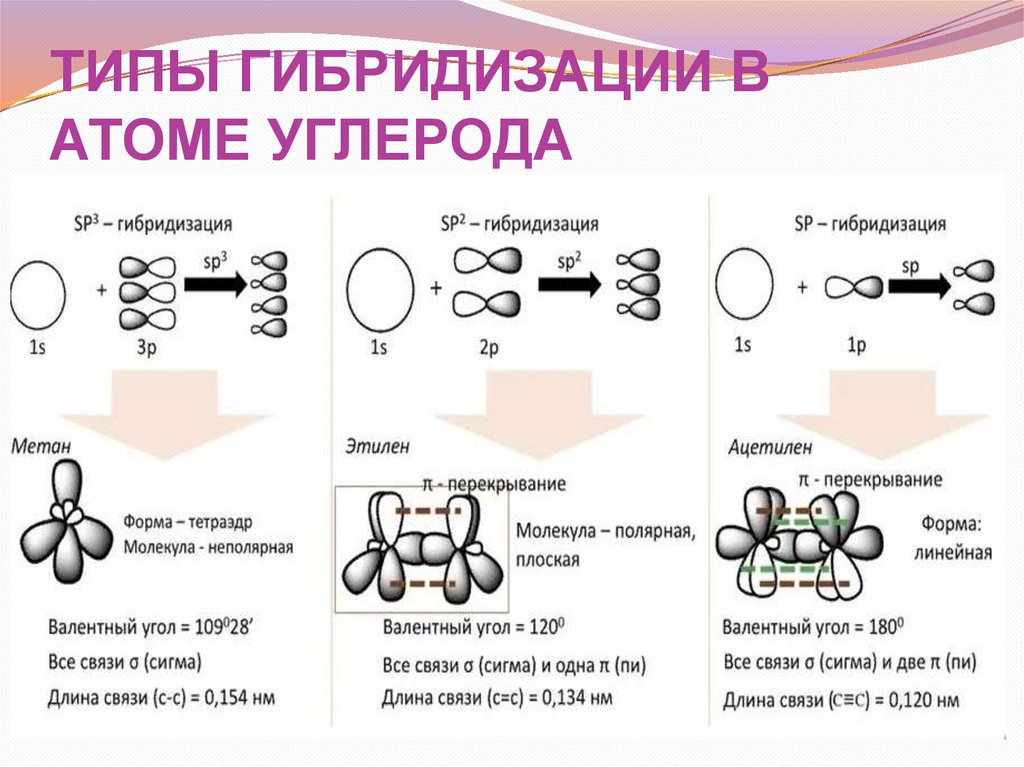
26.
ТИПЫ ГИБРИДИЗАЦИИ ВАТОМЕ УГЛЕРОДА
27.
Определения типа гибридизации28.
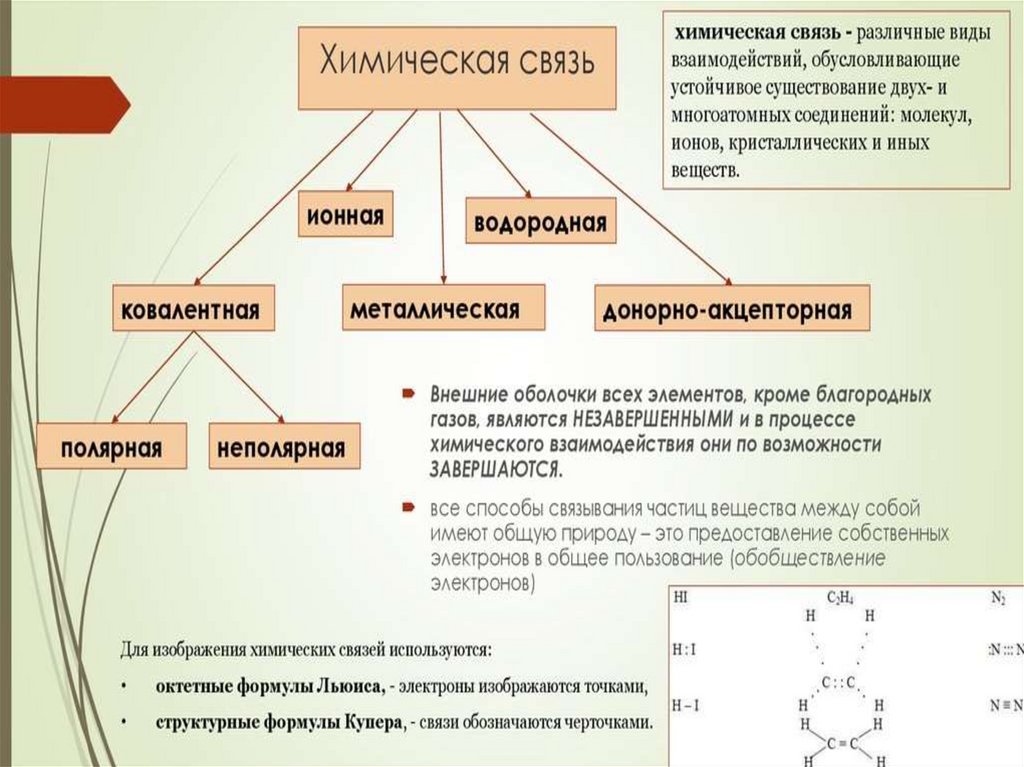
ХИМИЧЕСКАЯ СВЯЗЬХИМИЧЕСКАЯ СВЯЗЬ - это электростатическое взаимодействие
между атомами с участием валентных электронов, сопровождаемое
выделением энергии от 20 до 1000 кДж/моль.
29.
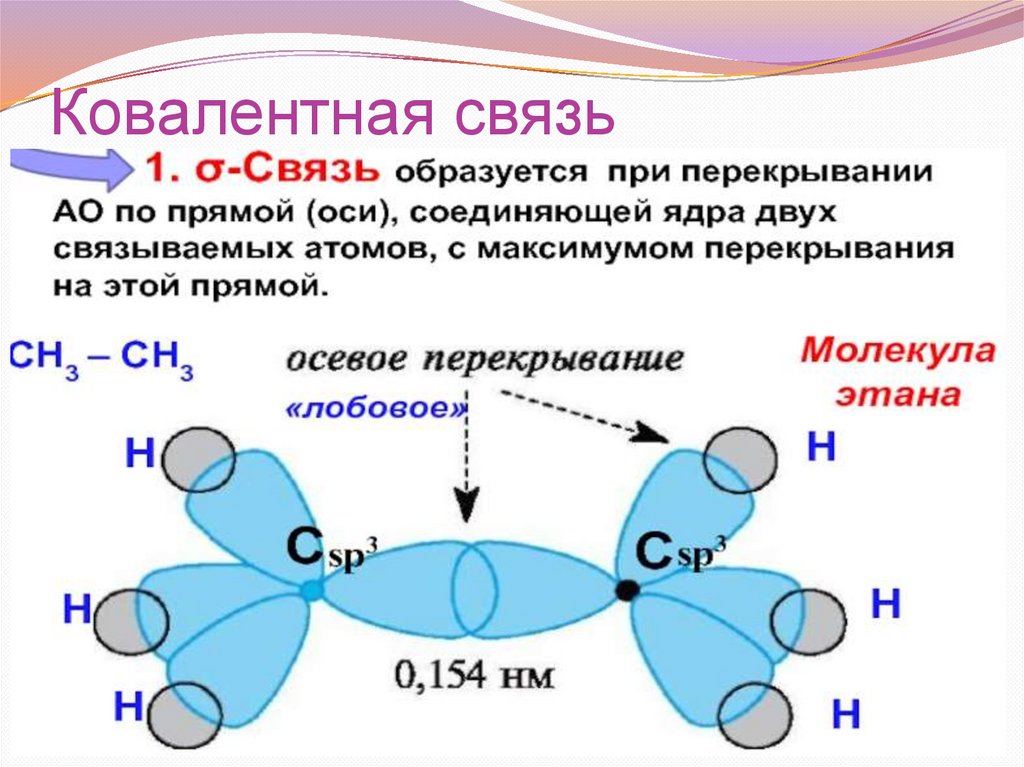
Ковалентная связь30.
КОВАЛЕНТНАЯ СВЯЗЬ31.
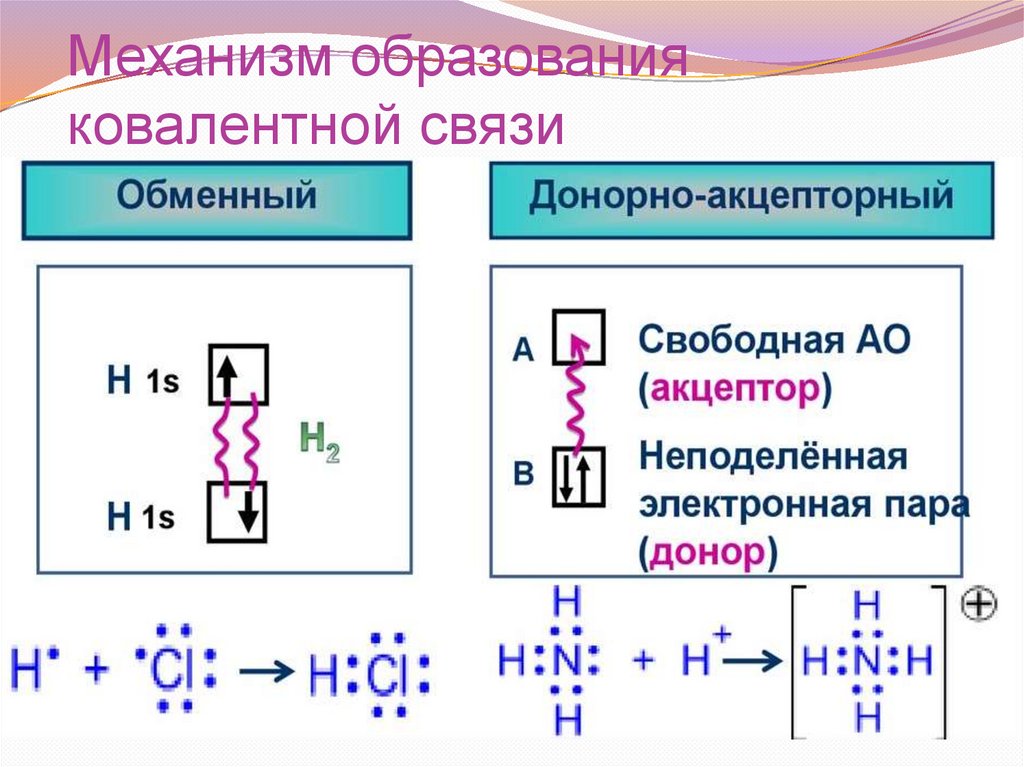
Механизм образованияковалентной связи
32.
Способы разрыва ковалентной связи33.
Характеристики ковалентной связи34.
35.
36.
Полиненасыщенные соединения с двойнойсвязью
37.
СОПРЯЖЕНИЕ38.
СОПРЯЖЕНИЕ39.
40.
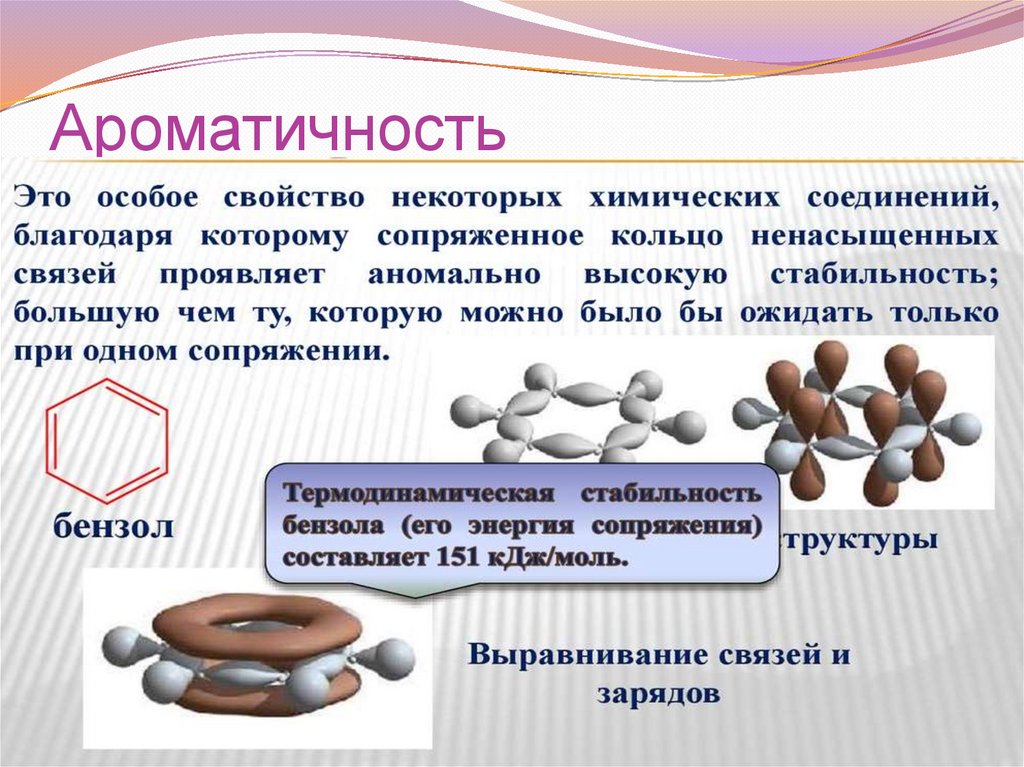
ЭНЕРГИЯ СОПРЯЖЕНИЯДля бензола Е сопряжения - 150,6 кДж/моль
Для бутадиена Е сопряжения – 15 кДж/моль
41.
Ароматичность42.
Условия ароматичности43.
Вещества, обладающиеароматичностью
44.
45.
Особенности реакций в органической химии46.
Пример реакции в органической химии47.
Статический и динамическийфактор- составляющие
48.
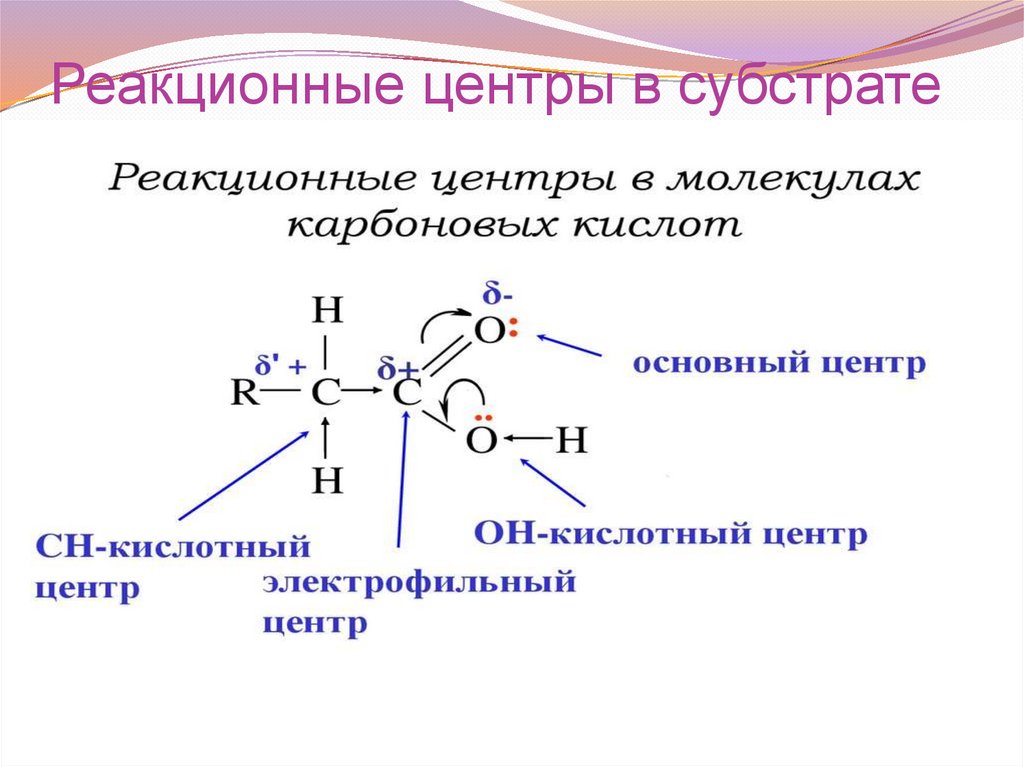
Реакционные центры в субстрате49.
Динамический фактор50.
Промежуточные частицы в органическихреакциях
51.
Реакционные частицы в органической химии52.
Электрофилы и нуклеофилы ворганической химии
53.
выводИзученные вами определения понятия
помогут вам усвоить механизмы
химических реакций в органической
химии, понять поведение биологических
молекул в организме человека.












































 chemistry
chemistry








