Similar presentations:
Понятие химического равновесия. ЗДМ
1.
Понятие химического равновесия. ЗДМ.1
2.
Протекание самопроизвольного процесса в термодинамическойсистеме сопровождается уменьшением свободной энергии системы
(dG < 0, dА < 0).
Условием термодинамического равновесия в закрытой системе является
минимальное значение соответствующего термодинамического
потенциала:
Изобарно-изотермические (P = const, T = const):
ΔG = 0
dG = 0, d2G > 0
Изохорно-изотермические (V = const, T = const):
ΔА = 0
dА = 0, d2F > 0
Термодинамическим равновесием называется такое
термодинамическое состояние системы, которое при постоянстве
внешних условий не изменяется во времени, причем эта
неизменяемость не обусловлена каким-либо внешним процессом.
Состояние системы, при котором скорости прямой и обратной реакции
равны, называется химическим равновесием.
2
3.
Истинноехимическое
равновесие
характеризуется
тремя
признаками:
-
в системе не происходит видимых во времени изменений при
отсутствии внешних воздействий;
-
равновесие достигается как при прямой, так и при обратной
реакции;
-
самое малое внешнее воздействие легко смещает равновесие в ту
или другую сторону.
Метастабильным (кажущимся) равновесием является такое состояние
системы, при котором из-за некоторых “тормозящих” факторов
химическая реакция не доходит до состояния истинного равновесия.
3
4.
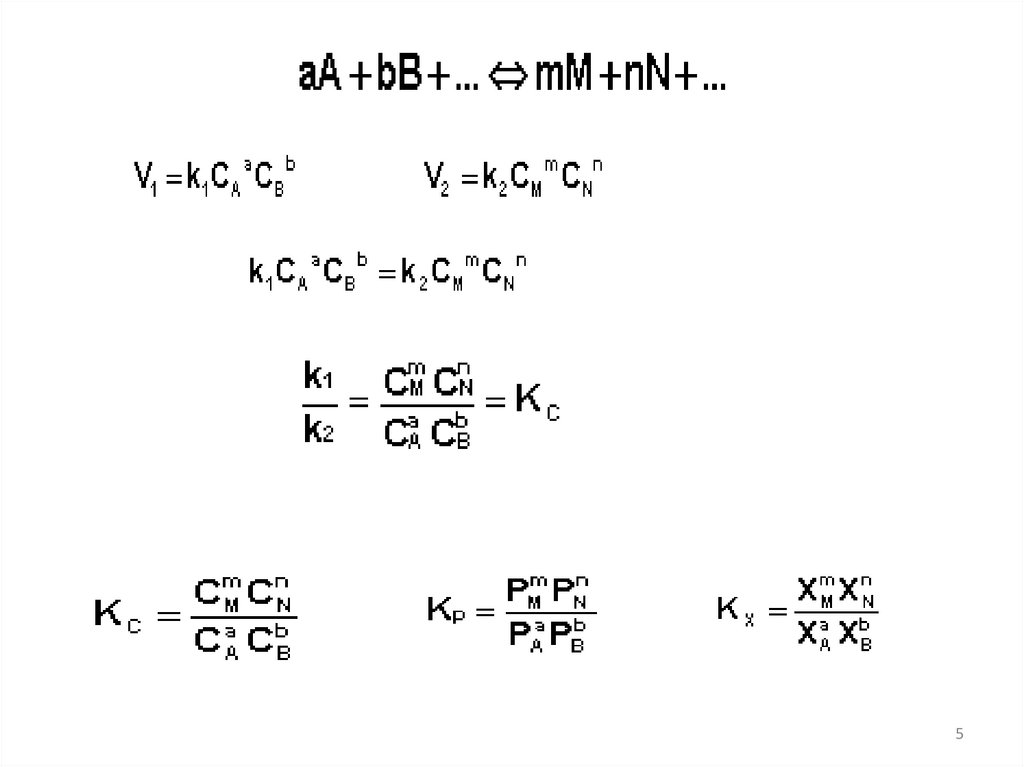
Закон действующих масс"Химическое равновесие устанавливается тогда,
когда произведение концентраций продуктов
реакции, возведенных в степени, равные
стехиометрическим коэффициентам, деленное
на произведение концентраций реагентов,
возведенных в соответствующие степени,
становится постоянной величиной при
определенных условиях"
4
5.
56.
67.
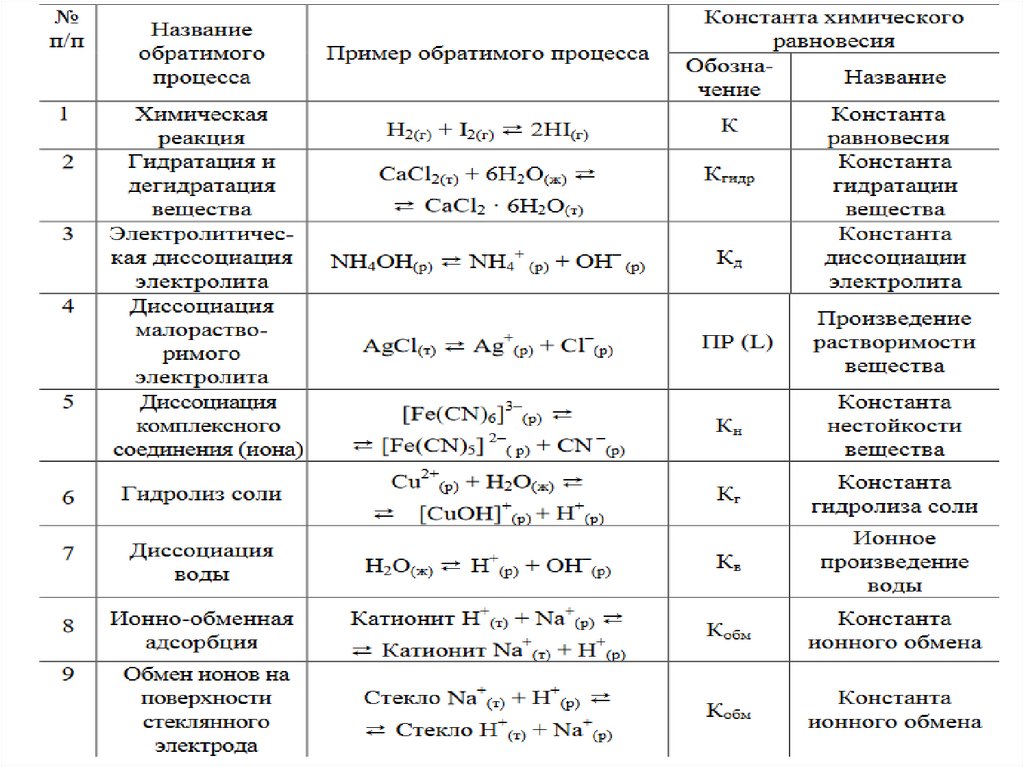
Равновесие в гетерогенных системахДля следующей гетерогенной равновесной системы:
FeO(тв)+H2(г)↔Fe(т)+H2O(г)
выражение константы равновесия не будет содержать ни оксида железа,
ни железа:
К=[H2O(г)]/[H2(г)].
А для системы:
CO3(тв)↔CaO(тв)+CO2(г)
в выражение константы равновесия входит только СО2:
К = [СО2]
7





 chemistry
chemistry








