Similar presentations:
Молекулярная физика и термодинамика (лекция 12)
1.
Молекулярная физикаи термодинамика
Парфентьева Наталия Андреевна
2.
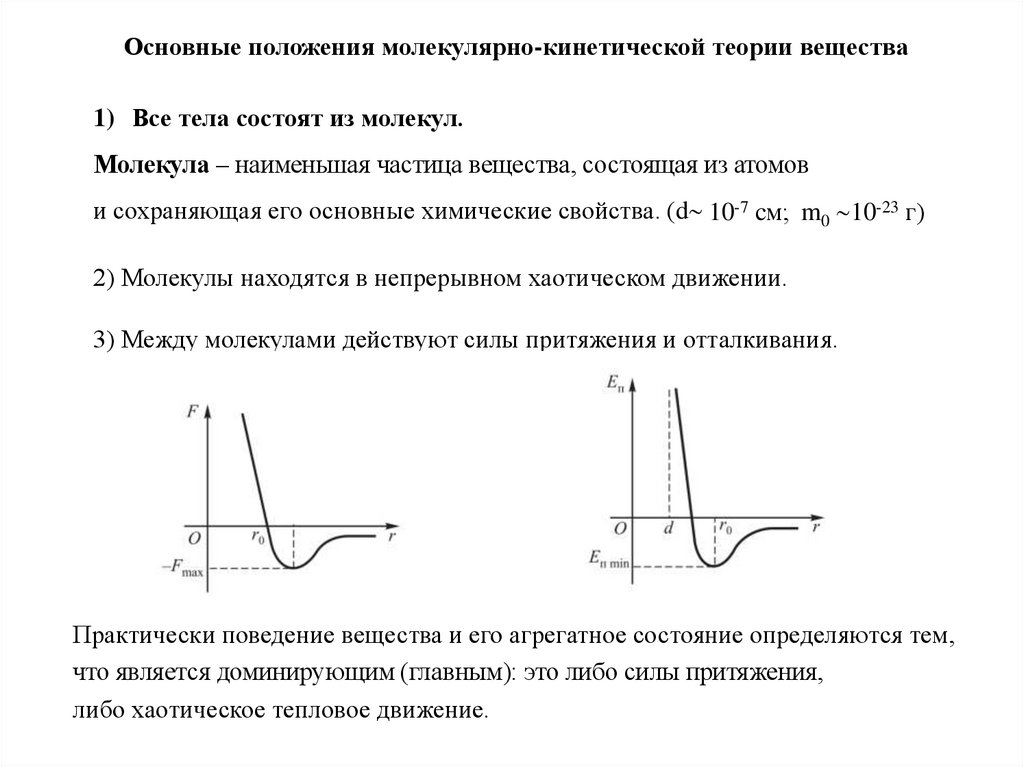
Основные положения молекулярно-кинетической теории вещества1) Все тела состоят из молекул.
Молекула – наименьшая частица вещества, состоящая из атомов
и сохраняющая его основные химические свойства. (d 10-7 cм; m0 10-23 г)
2) Молекулы находятся в непрерывном хаотическом движении.
3) Между молекулами действуют силы притяжения и отталкивания.
Практически поведение вещества и его агрегатное состояние определяются тем,
что является доминирующим (главным): это либо силы притяжения,
либо хаотическое тепловое движение.
3.
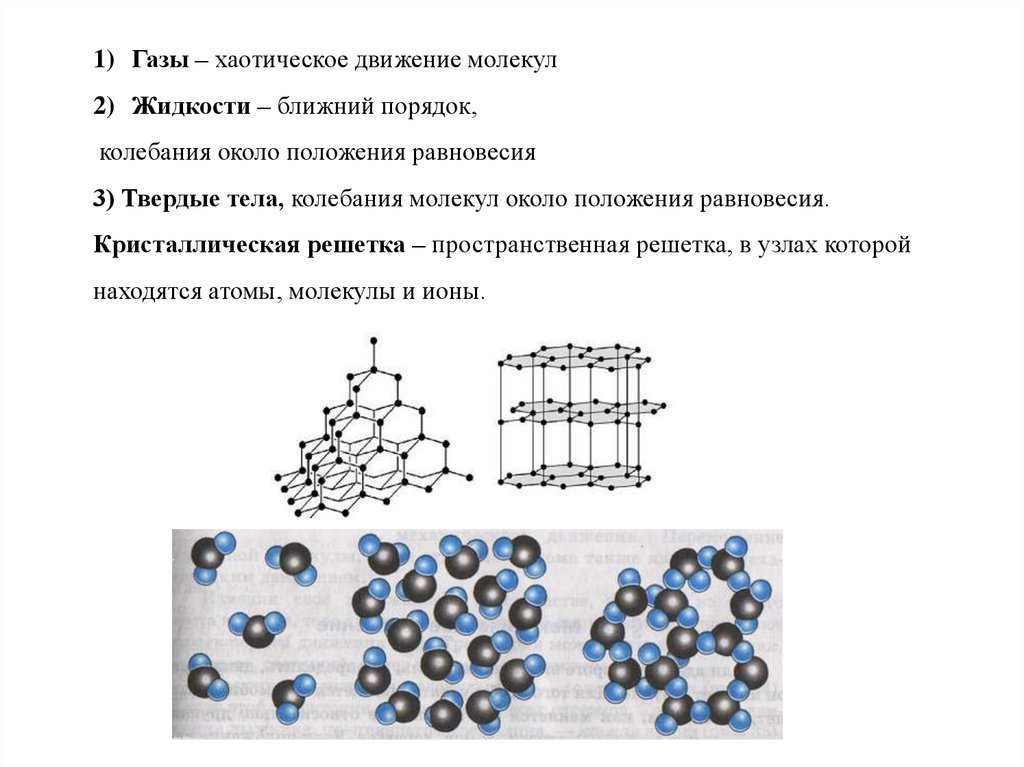
1) Газы – хаотическое движение молекул2) Жидкости – ближний порядок,
колебания около положения равновесия
3) Твердые тела, колебания молекул около положения равновесия.
Кристаллическая решетка – пространственная решетка, в узлах которой
находятся атомы, молекулы и ионы.
4.
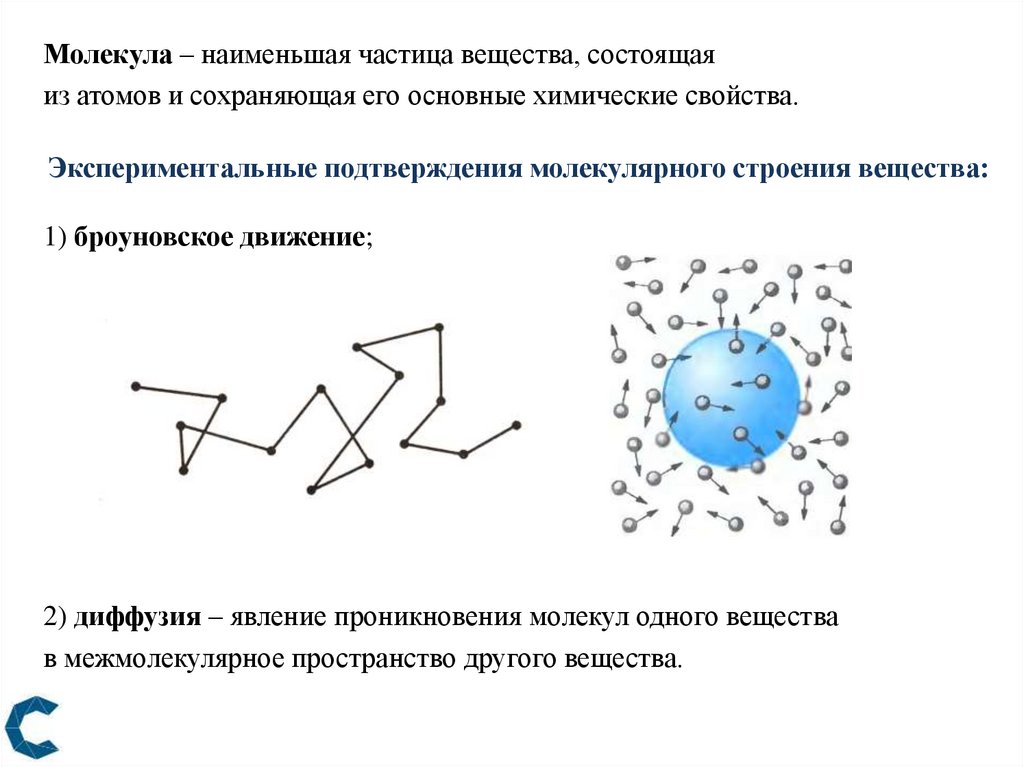
Молекула – наименьшая частица вещества, состоящаяиз атомов и сохраняющая его основные химические свойства.
Экспериментальные подтверждения молекулярного строения вещества:
1) броуновское движение;
2) диффузия – явление проникновения молекул одного вещества
в межмолекулярное пространство другого вещества.
5.
Относительная молекулярная масса – отношение массы молекулы(атома) к 1/12массы атома углерода.
Количество вещества (моль)
Моль равен количеству вещества, содержащему столько же молекул, сколько их
содержится в 0,012 кг углерода (С12).
Один моль любого вещества содержит число молекул, равное числу Авогадро NA =
6,022 1023 моль–1.
Молярная масса M равна произведению массы одной молекулы m0 на число
Авогадро NA: M = m0 NA.
Количество вещества равно:
m
M
Число молекул вещества массой m
N
m
NA
M
6.
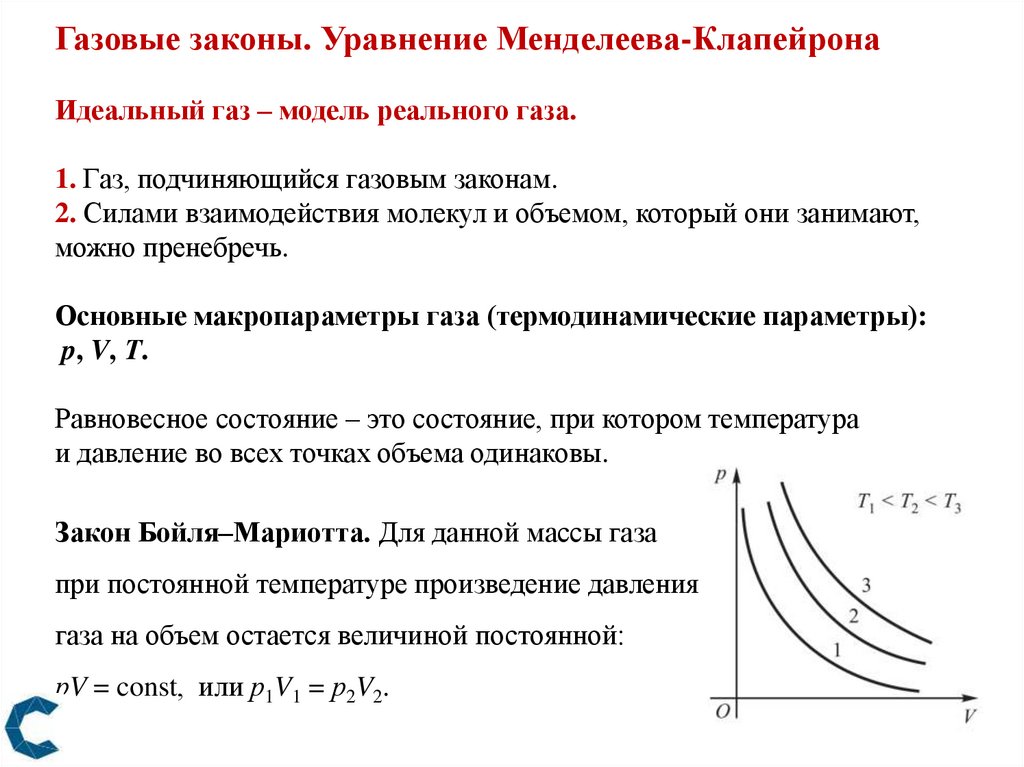
Газовые законы. Уравнение Менделеева-КлапейронаИдеальный газ – модель реального газа.
1. Газ, подчиняющийся газовым законам.
2. Силами взаимодействия молекул и объемом, который они занимают,
можно пренебречь.
Основные макропараметры газа (термодинамические параметры):
p, V, Т.
Равновесное состояние – это состояние, при котором температура
и давление во всех точках объема одинаковы.
Закон Бойля–Мариотта. Для данной массы газа
при постоянной температуре произведение давления
газа на объем остается величиной постоянной:
рV = const, или р1V1 = р2V2.
7.
Закон Гей-Люссака. Для данной массы газапри постоянном давлении объем изменяется
при увеличении температуры по линейному закону:
V = V0(1 + t ), где = 1/273 .
V/T = const
Закон Шарля. Для данной массы газа
при постоянном объеме давление изменяется
при увеличении температуры по линейному закону:
p = p0(1 + t C). p/T = const
8.
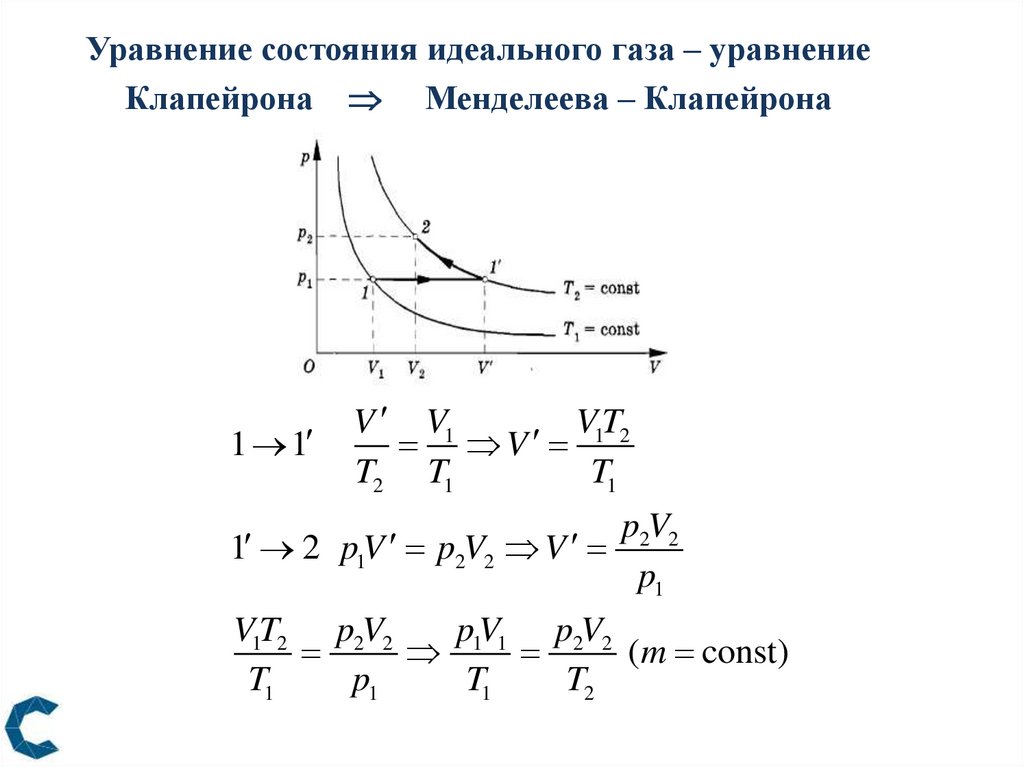
Уравнение состояния идеального газа – уравнениеКлапейрона Менделеева – Клапейрона
1 1
V V1
V1T2
V
T2 T1
T1
1 2 p1V p2V2 V
p2V2
p1
V1T2 p2V2
p1V1 p2V2
(m const)
T1
p1
T1
T2
9.
Из опыта известно, что 1 моль любого газа при нормальных условиях(р0 = 1 атм = 1,013 105 Па и t0 = 0 С, т. е. T0 = 273 К) занимает объем
V0 = 22,4 л = 22,4 10–3м3.
pV p0V0
R
T
T0
R
1атм 22,4л
1моль 273К
pV RT
pV RT
R = kNA
0,082
атм л
моль К
8,31
Дж
моль К
10.
Различные формы записи уравненияm
RT
M
m
pV
N AkT NkT
M
N
n
p nkT
V
pV
Закон Дальтона
Если в сосуде объемом V находится смесь газов, то давление смеси
газов равно сумме парциальных давлений: р = р1 + р2 + …
RT n mi
р pi
V i Mi
i
Эффективная молярная масса – это молярная масса такого
воображаемого газа, который при тех же температуре и объеме, что и
смесь газов, оказывает на стенки сосуда то же давление.
11.
Основное уравнение молекулярно-кинетической теории газов(МКТ) – связь макро- и микропараметров газа
Макропараметры
Микропараметры
Давление, p Па, мм.рт.ст.
Масса молекулы, m, кг, а.е.м
Объем, V, м3, л
Концентрация молекул,n, 1/м3
Температура, t, Т С , К
Скорость молекул, v, м/с
12.
Вывод основного уравнениямолекулярно-кинетической теории газов
Вспомогательные предположения.
1) Газ идеальный.
2) Молекулы можно разделить на группы.
N1 молекул имеют скорость v1, N2 – скорость v2, …, Nj – скорость vj.
Концентрация молекул первой группы n1 = N1/V, второй – n2 = N2/V, …,
nj = Nj/V, где V – объем сосуда.
Очевидно, что N1 + N2 + … + Nj = N, где N – общее число молекул,
n1 + n2 + … + nj = n, где n – концентрация молекул в сосуде.
3) Направления движения молекул равновероятны.
Молекулы движутся по трем взаимно-перпендикулярным направлениям.
В среднем в каждом направлении движется N/6 частиц.
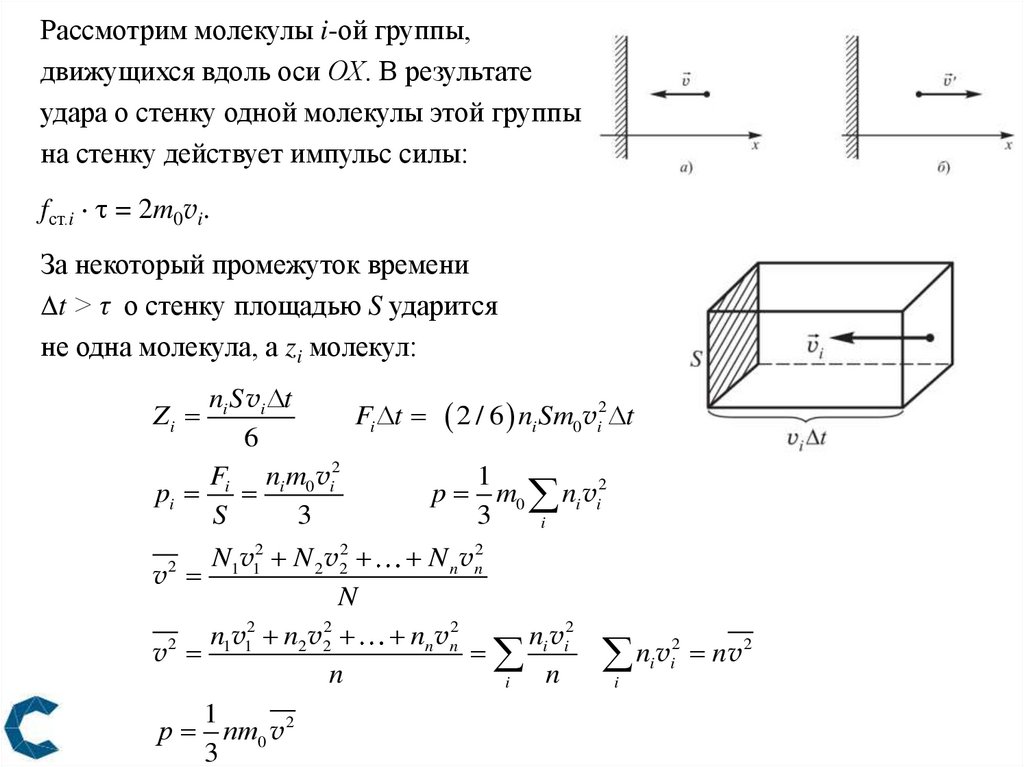
13.
Рассмотрим молекулы i-ой группы,движущихся вдоль оси ОХ. В результате
удара о стенку одной молекулы этой группы
на стенку действует импульс силы:
fст.i = 2m0vi.
За некоторый промежуток времени
t ˃ τ о стенку площадью S ударится
не одна молекула, а zi молекул:
ni S vi t
Fi t 2 / 6 ni Sm0 vi2 t
6
Fi ni m0 vi2
1
pi
p m0 ni vi2
S
3
3
i
Zi
N1v12 N 2 v22 N n vn2
v
N
n1v12 n2 v22 nn vn2
ni vi2
2
v
n
n
i
1
р nm0 v 2
3
2
2
2
n
v
n
v
ii
i
14.
Средняя кинетическая энергия молекулы равна:mv2
E
2
v2 2E / m
2
p nE
3
3
E kT
2
р nkT
Абсолютная температура – мера кинетической
энергии поступательного движения молекул.
3kT
vср.кв v
m0
2
15.
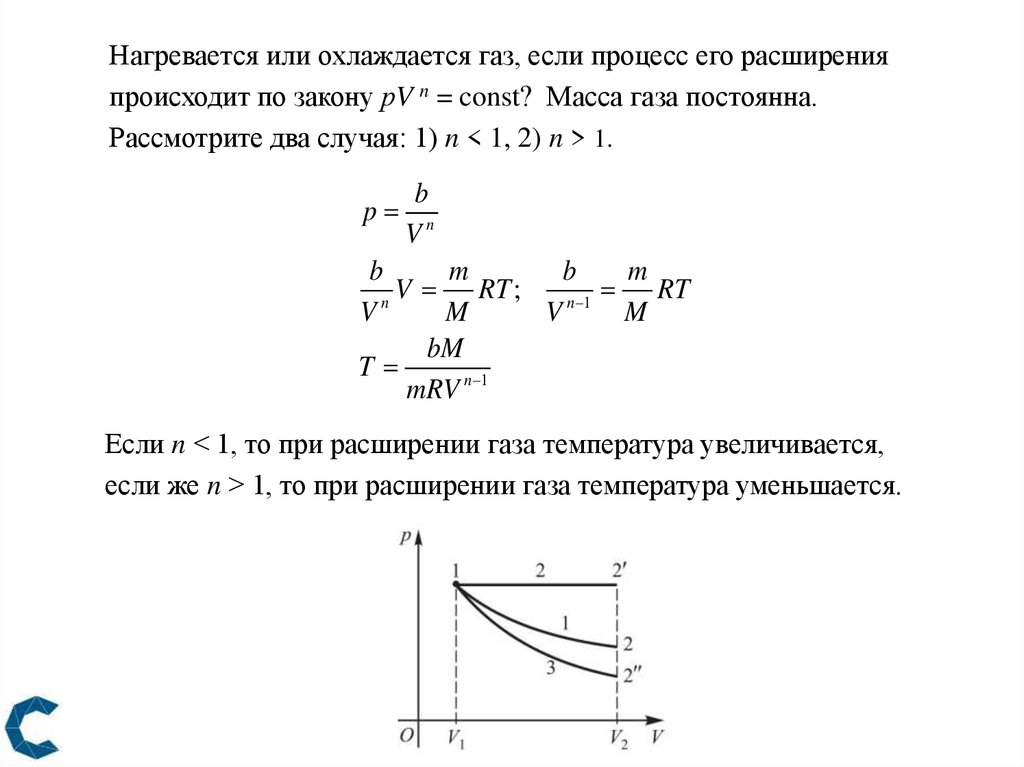
Нагревается или охлаждается газ, если процесс его расширенияпроисходит по закону рV n = const? Масса газа постоянна.
Рассмотрите два случая: 1) n < 1, 2) n > 1.
p
b
Vn
b
m
b
m
V
RT
;
RT
n
n 1
V
M
V
M
bM
T
mRV n 1
Если n < 1, то при расширении газа температура увеличивается,
если же n > 1, то при расширении газа температура уменьшается.
16.
Сосуд разделен пополам тонкой полунепроницаемой перегородкой,пропускающей водород и не пропускающей кислород. В левую
половину сосуда впускают m1 = 36 г кислорода и m2 = 4 г водорода.
Общий объем сосуда V = 20 л, температура 27 С. Определите давление
в левой и правой половинах сосуда, когда установится равновесие.
р рн р0
рн
m2 RT
M2 V
m1 2 RT
p0
M1 V
RT m2 2m1
5
p1
4,96
·10
Па
V M 2 M1
р2 рн
m2 RT
M2 V
2, 48 ·105 Па
17.
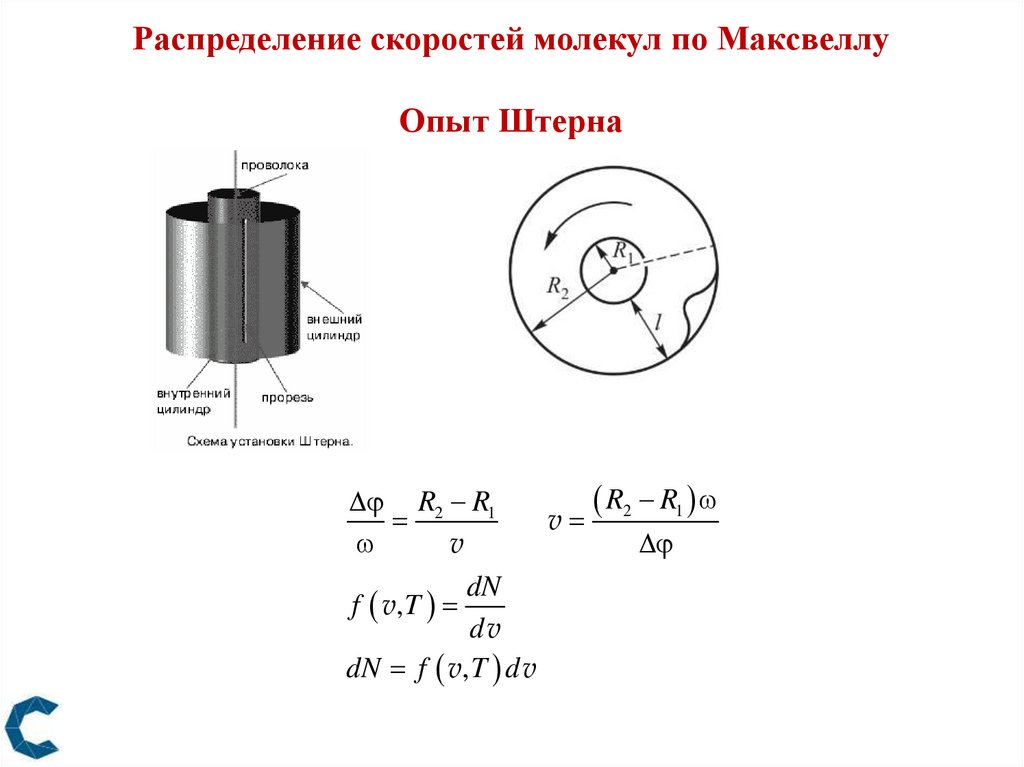
Распределение скоростей молекул по МаксвеллуОпыт Штерна
R2 R1
R R
v 2 1
v
dN
f v, T
dv
dN f v, T d v
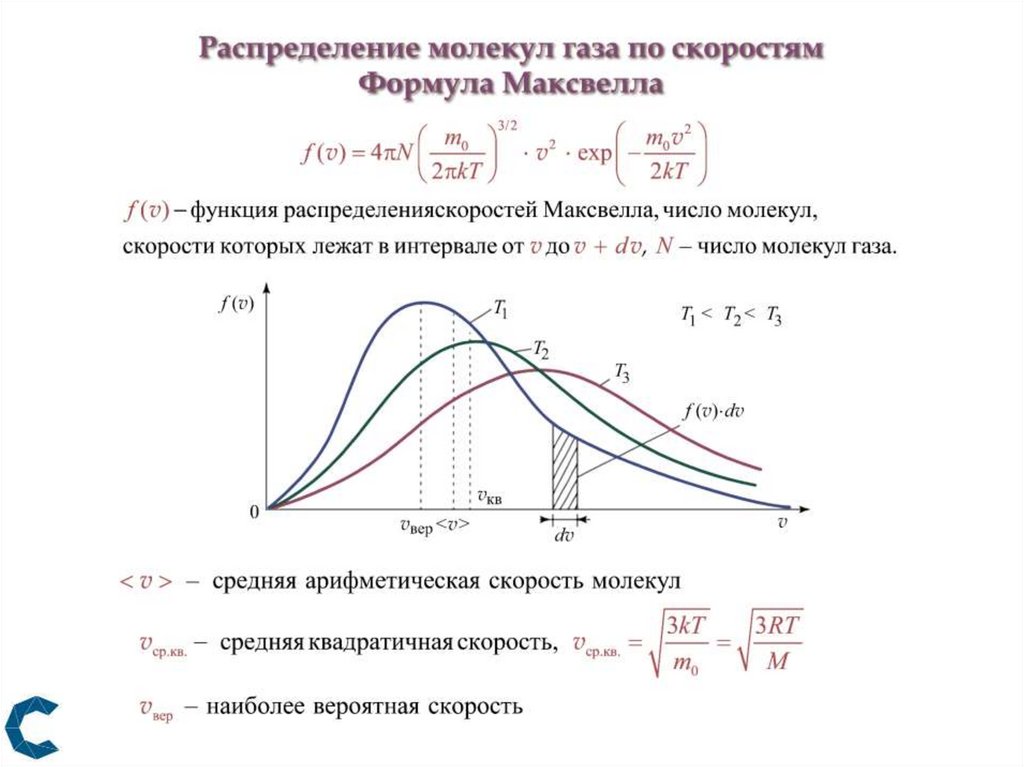
18.
19.
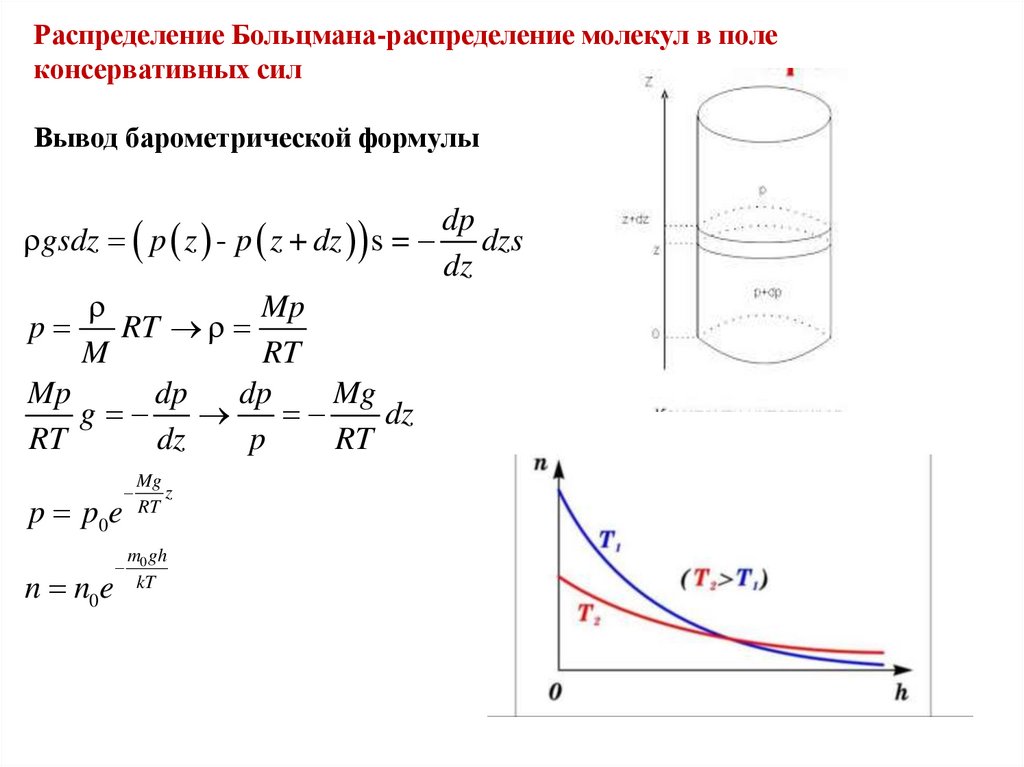
Распределение Больцмана-распределение молекул в полеконсервативных сил
Вывод барометрической формулы
dp
gsdz p z - p z + dz s = dzs
dz
Mp
p
RT
M
RT
Mp
dp
dp
Mg
g
dz
RT
dz
p
RT
p p0e
n n0e
Mg
z
RT
m0 gh
kT









 physics
physics