Similar presentations:
Молекулярная физика и термодинамики
1.
Молекулярнаяфизика и термодинамики
16.12.2023
1
2. Основные положения МКТ. Параметры МКТ. Основные термодинамические параметры. Функция состояния. Процесс. Изопроцесс.
16.12.20232
3. Основные положения МКТ:
все тела состоят из молекулвсе молекулы находятся в непрерывном
беспорядочном тепловом движении, при котором
они обмениваются импульсами и энергией
молекулы взаимодействуют между собой по
определенным законам
16.12.2023
3
4.
Основные термодинамическиепараметры:
1.
давление P;
2.
температура T;
3.
объём V
16.12.2023
4
5. Уравнение состояния
f(P,V,T) = 0P = f(V,T)
16.12.2023
5
6.
Удельный объем:Плотность ( ) :
16.12.2023
1
m
V
6
7. Количества вещества
m16.12.2023
7
8.
Законы идеальных газов16.12.2023
8
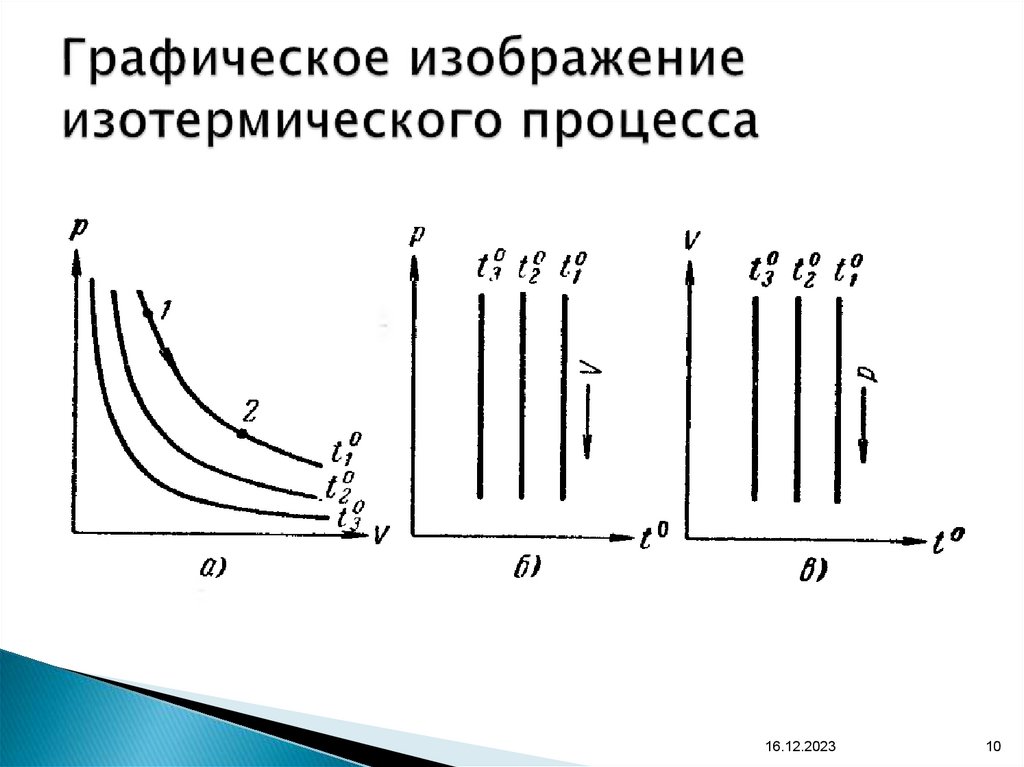
9. Закон Бойля-Мариотта:
Для данной массы газа, при постоянной температуре,произведение давления газа на объем остается
величиной постоянной. Процесс изотермический
(Т=const):
P V = const
P1 V1 = P2 V2
16.12.2023
9
10. Графическое изображение изотермического процесса
16.12.202310
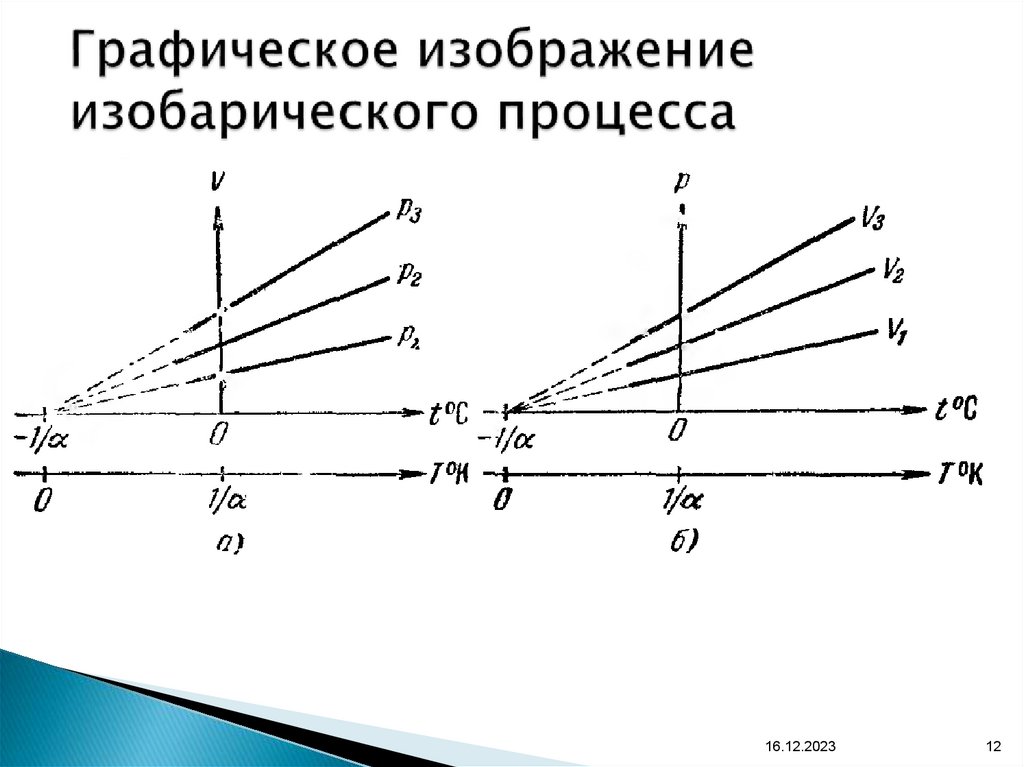
11. Закон Гей – Люссака (изобарический процесс)
Для данной массы газа, при постоянном давлении,объем линейно возрастает с увеличением
температуры (р = const и m = const )
V = V0(1 + t),
V
const .
T
V1 T1
V2 T2
16.12.2023
11
12. Графическое изображение изобарического процесса
16.12.202312
13. Закон Шарля (изохорический процесс)
Для данной массы газа, при постоянном объеме,давление линейно возрастает с увеличением
температуры, то есть при V = const и m = const:
P = P0(1 + t)
P
const .
T
P1 T1
P2 T2
16.12.2023
13
14. Закон Авогадро:
При одинаковых давлениях и одинаковыхтемпературах в равных объемах различных идеальных
газов содержится одинаковое число молекул
N A 6,022 10 моль
23
-1
Следствие: моли любых газов, при одинаковых температуре и
давлении, занимают одинаковые объемы.
16.12.2023
14
15.
1 моль равен количеству вещества системы,содержащей столько же структурных элементов,
сколько содержится атомов в углероде массой 0,012
кг.
3
V 22,41 10 м / моль
16.12.2023
3
15
16.
Число молекул идеального газа, содержащихся в1 м3 при нормальных условиях, называется
числом Лошмидта:
N L P0 / kT0 2,68 10
25
м
3
Нормальные условия: P0 = 105 Па; Т0 = 273 К;
16.12.2023
16
17. Уравнение Менделеева-Клапейрона
р1 V1 p V2/
р
/
T1
.
р2 T2
р1 V1 р2 V2
.
T1
T2
16.12.2023
17
18.
р VB М
T
р V
В const R
Т
В
R
индивидуальная газовая постоянная
16.12.2023
18
19. Уравнение Менделеева-Клапейрона
р Vm
R T ,
р R T
16.12.2023
19
20. Вывод основного уравнения МКТ. Закон Дальтона
16.12.202320
21.
Вывод основного уравнения МКТm
N
количество вещества
NA
N N A
16.12.2023
21
22.
Вывод основного уравнения МКТN
р V
R T
NA
pV N k T
k R
NA
1,38 10 23 Дж/К - постоянная Больцмана
16.12.2023
22
23.
Основное уравнение молекулярно кинетической теории идеальногогаза
p nk T
16.12.2023
23
24. Закон Дальтона
Для смеси газов, заполняющих объём V притемпературе Т, парциальные давления:
m1 RT
P1
1V
m2 RT
P2
2V
mn RT
Pn
nV
16.12.2023
24
25. Давление смеси идеальных газов равно сумме парциальных давлений Р, входящих в неё газов
Pсм P1 P2 ... Pnm1RT m2 RT RT m1 m2
Pñì
.
μ1V
μ 2V
V μ1 μ 2
16.12.2023
25
26. Термодинамический смысл давления
Давление газа – есть следствие столкновениягазовых молекул со стенками сосуда (XVIII в. Даниил
Бернулли)
F dF
р lim
.
S 0 S
dS
16.12.2023
26
27. Среднеквадратичная скорость:
υ2
2
2
2
υ x υ y υ z .
2
2
2
υx υ y υz
16.12.2023
27
28.
Термодинамический смысл давленияm
υ
1
2
0
2
P m0 n υ n
,
3
3
2
2
2
P n Ek
3
16.12.2023
28
29. Единицы измерения давления. 1 Н/м2 = 1 Па; 1 атм. = 9,8 Н/см2 = 98066 Па 105 Па 1 мм рт.ст. = 1 тор = 1/760 атм. = 133,3 Па 1
FP ,
S
Н
м 2 .
16.12.2023
29
30. Термодинамический смысл температуры
16.12.202330
31.
Эмпирическая температура (t) – мераотклонения тел от состояния
теплового равновесия с тающим
льдом, находящимся под давлением в
одну физическую атмосферу. [ С]
16.12.2023
31
32.
Термодинамическая температураT = t + 273,16
[К]
2 m0 υ
T
3k
2
2
k 1,38 10
23
Дж К
-1
постоянная Больцмана
16.12.2023
32
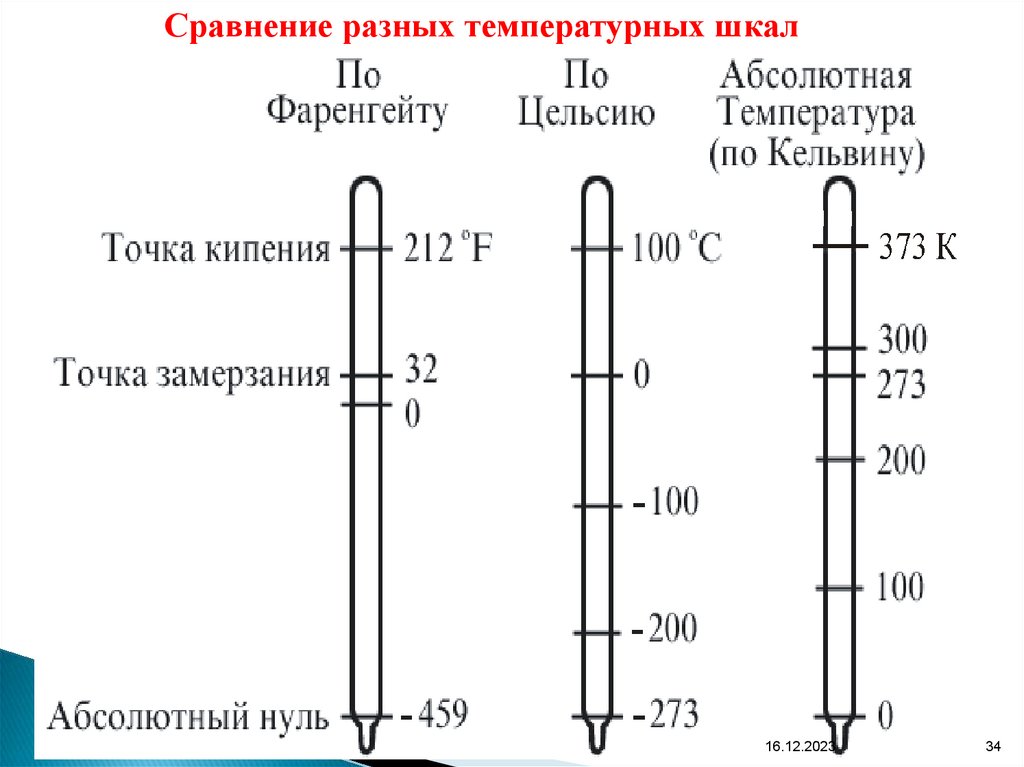
33. В физике и технике за абсолютную шкалу температур принята шкала Кельвина. Другие температурные шкалы: – шкала Фаренгейта
16.12.202333
34.
Сравнение разных температурных шкал16.12.2023
34































 physics
physics








