Similar presentations:
Молекулярная физика и термодинамика. Физические основы молекулярно-кинетической теории (МКТ) газов
1. Молекулярная физика и термодинамика Физические основы молекулярно-кинетической теории (МКТ) газов
1.2.
3.
4.
5.
6.
7.
8.
Основные положения МКТ и их опытное
обоснование
Масса и размеры молекул. Постоянная Авогадро
Состояние системы. Внутренняя энергия
системы
Основное уравнение МКТ идеального газа
Понятие температуры
Закон Авогадро. Закон Дальтона
Уравнение состояния идеального газа
Средняя квадратичная скорость движения
молекул
2.
1. Основные положения МКТ1. Вещество имеет дискретную
структуру, состоит из частиц,
которые разделены промежутками.
2. Частицы находятся в
непрерывном хаотическом
движении.
3. Частицы взаимодействуют друг с
другом. На дальних расстояниях
преобладают силы притяжения, на
близких – силы отталкивания.
3.
2. Масса и размеры молекулОтносительной молекулярной массой
( r) называется отношение массы m0
молекулы данного вещества к 1/12
части массы m0с атома изотопа
углерода 6С12 .
r
m0
1
m0 c
12
Моли различных веществ содержат одно и то же
количество частиц, равное постоянной Авогадро NA =
6,02*1023 моль-1 .
Масса моля вещества носит название
молярной массы ( ).
m
[ ] 1
кг
моль
4.
Оценим массу молекулы воды (m0)m0
H O 2 10
2
3
NA
кг
кг
кг
3
3
16 10
18 10
моль
моль
моль
кг
18 10
моль 3 10 26 кг
m0
N A 6,02 10 23 1
моль
3
5.
3. Состояние системы. Внутренняя энергия системы.Равновесным состоянием системы называется такое
состояние, при котором все параметры системы остаются при
неизменных внешних условиях постоянными сколь угодно
долго.
Если в различных точках системы параметр имеет различное
значение – тогда состояние системы называется
неравновесным.
Процесс, состоящий из непрерывной последовательности
равновесных состояний, называется равновесным.
Внутренняя энергия тела состоит из:
1) кинетической энергии хаотического движения молекул
2) потенциальной энергии взаимодействия между
молекулами
3) внутримолекулярной энергии
Внутренняя энергия является функцией состояния системы.
6.
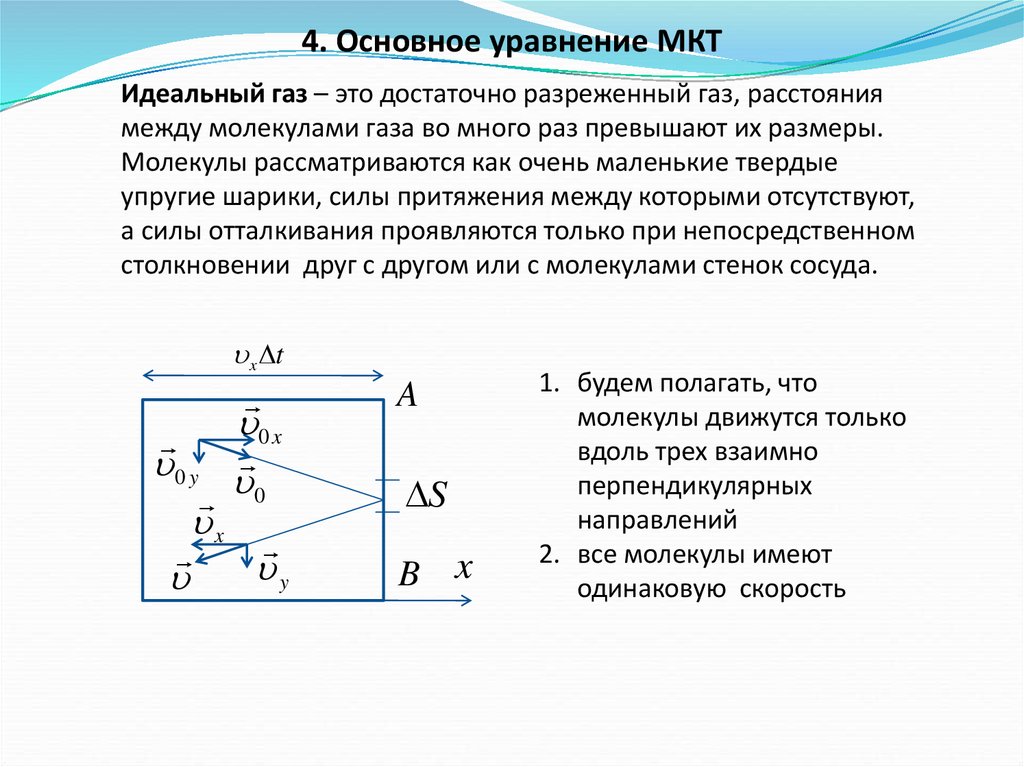
4. Основное уравнение МКТИдеальный газ – это достаточно разреженный газ, расстояния
между молекулами газа во много раз превышают их размеры.
Молекулы рассматриваются как очень маленькие твердые
упругие шарики, силы притяжения между которыми отсутствуют,
а силы отталкивания проявляются только при непосредственном
столкновении друг с другом или с молекулами стенок сосуда.
x t
0 x
0 y
0
x
y
A
S
B x
1. будем полагать, что
молекулы движутся только
вдоль трех взаимно
перпендикулярных
направлений
2. все молекулы имеют
одинаковую скорость
7.
Число молекул, достигающих площадки ∆S:N
1
1
nV n x t S
6
6
Молекула при соударении со стенкой сообщает ей импульс:
F t 2m0 x
Поскольку ударяется N молекул, то полный импульс будет равен:
F t 2m0 x N
1
F t 2m0 x n x t S
6
1
P nm0 x2
3
F
P
S
- Основное уравнение МКТ
Средняя кинетическая энергия поступательного движения молекулы:
E
m0 2
2
тогда
2
P nE
3
8.
5. ТемператураТемпература – мера термодинамического
равновесия тел.
Температурная шкала Цельсия: t 0 V0 t 100 V
Температура – мера средней кинетической
энергии хаотического движения молекул.
PV
T
R
- Универсальная газовая постоянная
R 8,31
PV RT
Дж
моль К
- Уравнение Клайперона
9.
Из сравнения основного уравнения МКТ и уравненияКлайперона:
2
RT
nE
3
V
3RT
E
2V n
k
3 R
E
T
2 NA
R
Дж
1,38 10 23
NA
К
3
E kT
2
- Постоянная Больцмана
- кинетическая энергия
10.
6. Закон Авогадро. Закон Дальтона2
3
P nE
E kT
3
2
P nkT
Закон Авогадро: при одинаковых давлениях и
температурах концентрация молекул у всех газов
одна и та же.
Если имеется смесь нескольких газов:
N
P
P Pi i
i 1
- давление, которое было бы в сосуде,
если бы в нем находились только
молекулы i-го газа – парциальное
давление.
Закон Дальтона: давление смеси идеальных газов
равно сумме парциальных давлений газов,
образующих смесь.
11.
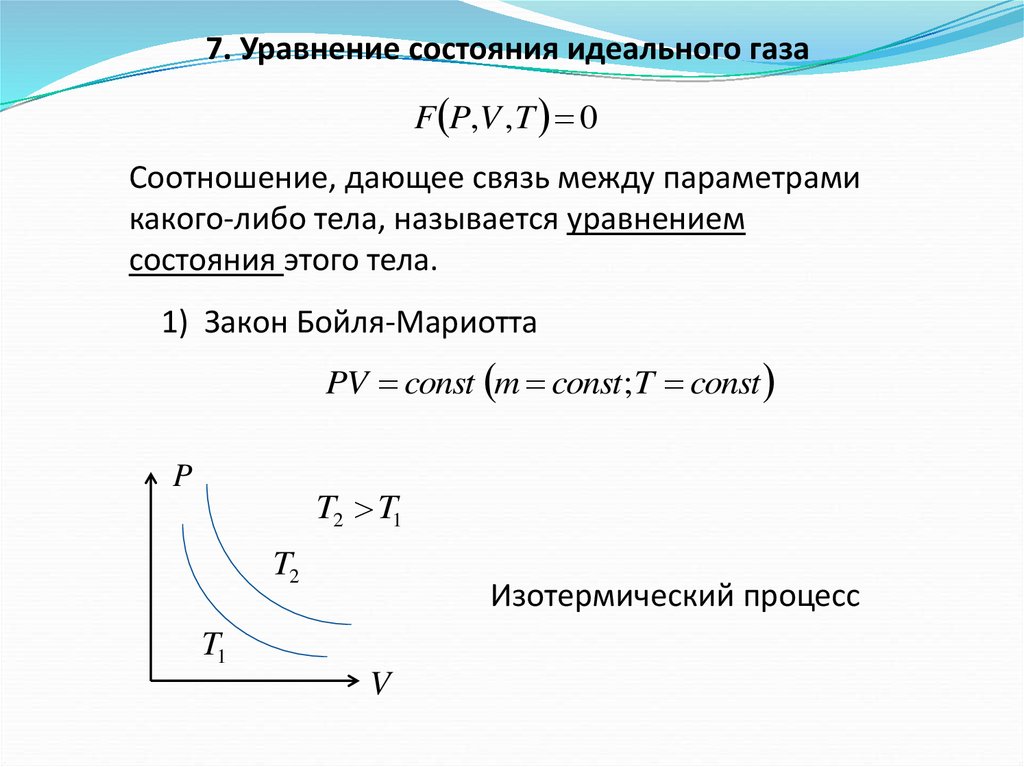
7. Уравнение состояния идеального газаF P,V , T 0
Соотношение, дающее связь между параметрами
какого-либо тела, называется уравнением
состояния этого тела.
1) Закон Бойля-Мариотта
PV const m const ; T const
P
T2 T1
T2
Изотермический процесс
T1
V
12.
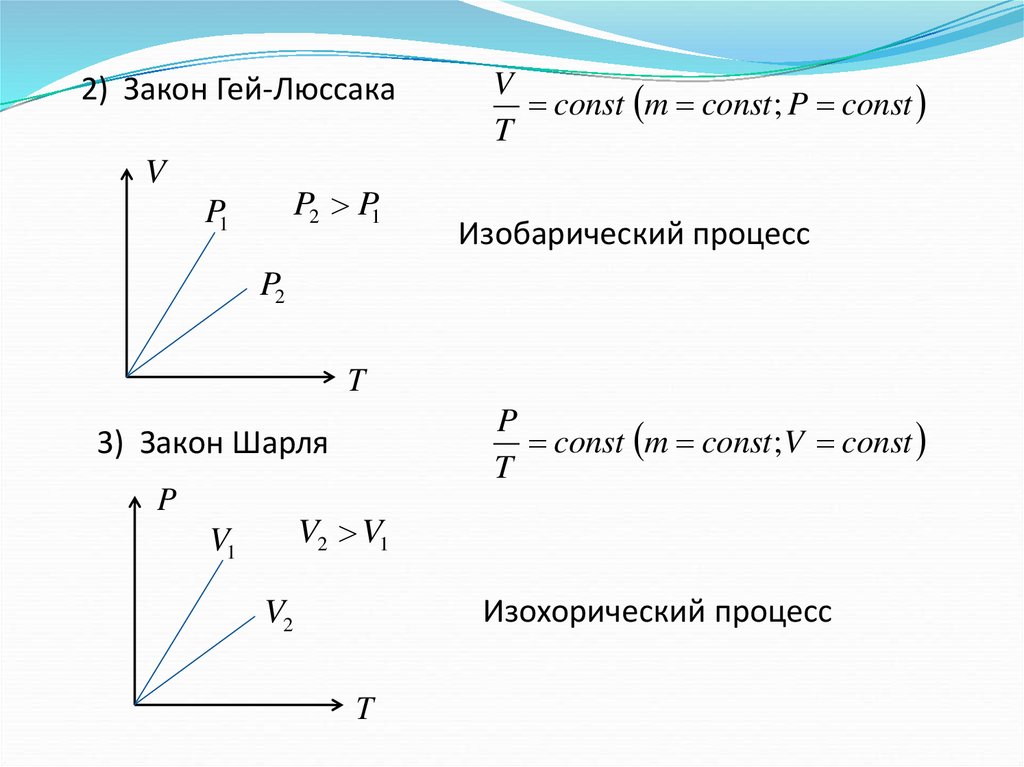
2) Закон Гей-ЛюссакаV
P2 P1
P1
V
const m const ; P const
T
Изобарический процесс
P2
T
P
const m const ;V const
T
3) Закон Шарля
P
V2 V1
V1
Изохорический процесс
V2
T
13.
Уравнение состояния идеального газа дляслучая, когда все три параметра изменяются.
1 1': P1V1 P1 'V2
P
P1
1 PV T
1 1 1
1' P1 ' V2 T1
P1 '
P2 V2 T2
2
V
P2
PV
m
RT
P1 ' P2
1' 2 :
T1 T2
P1V1 P2V2
T1
T2
- Объединенный
газовый закон
- Уравнение состояния
идеального газа – уравнение
Клайперона-Менделеева
14.
8. Средняя квадратичная скорость движения молекул3
E kT
2
3
m 2
kT
2
2
3kT
m
2
m 2
E
2
3kT
m
2
-средняя квадратичная скорость
движения молекул
m – масса одной молекулы
R
k
NA
2
3RT 3RT
mN A
2
3RT
15.
1. Распределение молекул по2.
3.
4.
5.
6.
скоростям
Экспериментальная проверка
распределения Максвелла
Барометрическая формула
Распределение Больцмана
Опыты Перрена
Средняя длина свободного
пробега. Число столкновений
16.
1. Распределение молекул по скоростямЗакон Максвелла описывается некоторой функцией f(υ),
называемой функцией
распределения молекул по
скоростям.
dN ( )
,
Функция f(υ) определяет относительное
N
число молекул
скорости которых лежат в интервале от υ до υ+dυ, т.е.
dN ( )
f ( )d
N
f
dN ( )
f ( )
Nd
-Закон
распределен
m0
4
e
(1) ия молекул
идеального
2 kT
газа по
скоростям
где m0 – масса молекулы, k – постоянная
Больцмана
(распределен
3
2
m0 2
2
2 kT
17.
fdS
в
Относительное число
молекул
кв
d
dN
,
N
dN
N
скорости которых лежат в интервале
от υ до υ+dυ, находится
как площадь
заштрихованной на
рис. полоски
18.
Найдем значение наиболее вероятнойскорости υв , продифференцировав выражение
(1) по аргументу υ и приравняв
результат нулю.
df
m0
4
d
2 kT
2kT
в
m0
3
2
2 e
Т.к.
m0 2
2 kT
k
m0 2
d
e
2kT
R
NA
2
m0 2
2 kT
в
d 0
2 RT
19.
fT1
T2 T1
T2
в1 в 2
m0
m
f ( ) ~
~
~
T
T
T
где m0 – масса одной молекулы, m – масса газа,
– молярная масса
При повышении температуры площадь, ограниченная кривой,
остаётся неизменной.
При прочих равных параметрах
m1 , m01, 1 m2 , m02 , 2
20.
Cреднее значение скоростиКаждому интервалу
i
соответствует количество молекул
Ni f ( ) N i
N
i
i
- сумма значений скоростей всех N молекул.
N
i
N
f ( )d
0
i
f ( ) N
f ( )
N
i
i
i
8kT
m0
i
Средняя
арифметическая
скорость
Ni
21.
Скорости, характеризующие состояние газа:Наиболее вероятная скорость
Средняя
арифметическая
скорость
Средняя
квадратичная
скорость
2kT
в
m0
8kT
m0
3kT
m0
2
в
2 RT
8 RT
2
3RT
22.
2. Экспериментальная проверкараспределения Максвелла
Немецкий физик Штерн в
1920 г. экспериментально
определил скорости
молекул.
S R
t
S R t
Считая r <<R, можно положить
t
R
тогда
R
S
2
или
R 2
S
Измерив ΔS и ω, можно определить υ
23.
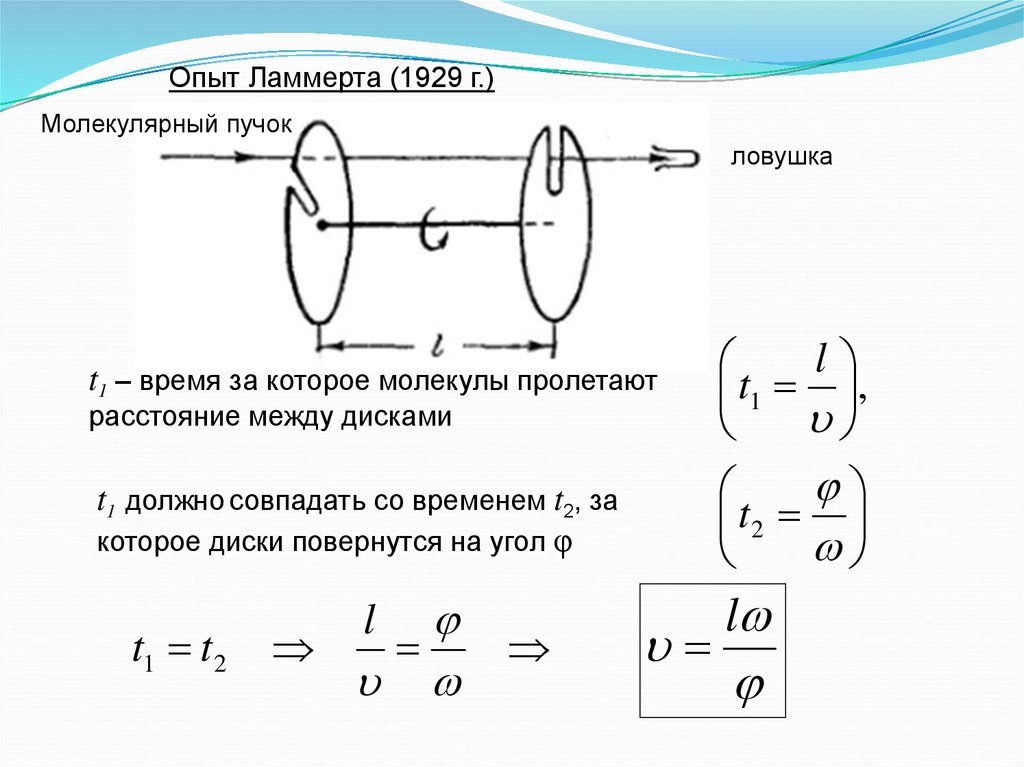
Опыт Ламмерта (1929 г.)Молекулярный пучок
ловушка
t1 – время за которое молекулы пролетают
l
t1 ,
t1 должно совпадать со временем t2, за
которое диски повернутся на угол φ
t2
расстояние между дисками
t1 t 2
l
l
24.
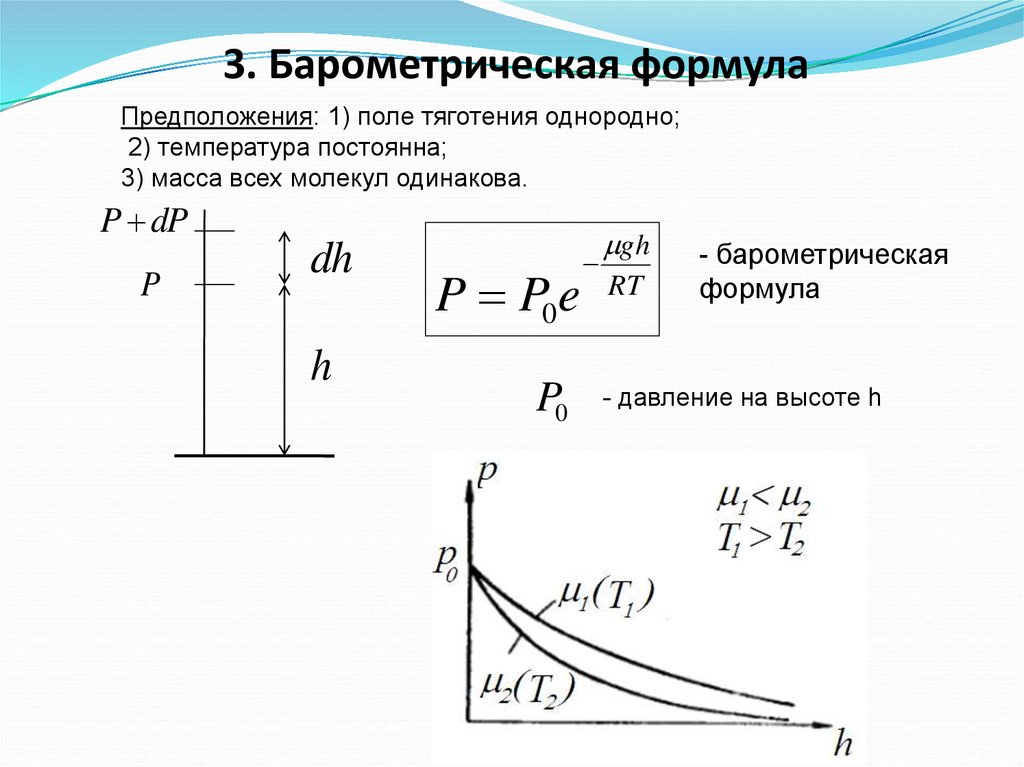
3. Барометрическая формулаПредположения: 1) поле тяготения однородно;
2) температура постоянна;
3) масса всех молекул одинакова.
P dP
P
dh
h
P P0 e
P0
gh
RT
- барометрическая
формула
- давление на высоте h
25.
4. Распределение БольцманаЗаменив в барометрической формуле
P nkT
получим закон изменения числа молекул в единице объема с высотой
n n0e
gh
RT
E p m0 gh
R
k
; m0
NA
NA
n n0e
Ep
kT
n n0 e
m0 gh
kT
Распределение
Больцмана
Две тенденции распределения молекул по высоте: 1)
притяжение молекул к Земле (чем больше m и меньше T);
2) тепловое движение стремится разбросать молекулы по
высоте.
26.
5. Опыты ПерренаПеррен (1909 г.) – опыты по определению числа Авогадро.
Рассмотрим слой, находящийся над дном кюветы на
высоте h.
Δh – толщина слоя.
Число частиц, попадающих в поле зрения микроскопа:
N n(h) S h
Распределение молекул по высоте
m0 g p
- вес броуновской частицы
N1 n0 e
N 2 n0 e
ph1
kT
S h
ph2
kT
S h
ln
n n0 e
n n0e
m0 gh
kT
ph
kT
N1
p ( h2 h1 )
N 2
kT
p(h2 h1 )
k
N1
T ln
N 2
R
N A
k
27.
6. Средняя длина свободного пробегаМежду двумя последовательными столкновениями
молекулы проходят некоторый путь l, который
называется длиной свободного пробега.
Минимальное расстояние, на которое сближаются при
столкновении центры двух молекул, называется
эффективным диаметром молекул d.
l
z
- средняя скорость
- среднее число соударений за 1 с
z 2n d
2
1
l
2 d 2 n
1
l
2 n
d 2
Эффективное
сечение молекул
28.
Явления переноса в термодинамическинеравновесных системах
•Диффузия
•Теплопроводность
•Вязкость
К явлениям переноса относятся
теплопроводность (обусловлена переносом
энергии), диффузия (обусловлена переносом
массы) и внутреннее трение (обусловлено
переносом импульса).
29.
1. Диффузия. Явление диффузии заключается в том, чтопроисходит
самопроизвольное
проникновение
и
перемешивание частиц двух соприкасающихся газов,
жидкостей и даже твердых тел; диффузия продолжается,
пока существует градиент плотности.
С макроскопической точки зрения перенос массы
вещества подчиняется закону Фика: масса вещества M,
переносимая за время t через площадку
S, прямо
пропорциональна градиенту плотности / x
M D
S t
x
[D]=м2/с
D — коэффициент диффузии.
Знак минус показывает, что перенос массы происходит в
направлении убывания плотности .
30.
Согласно кинетической теории газов:1
D l
3
l
- средняя длина свободного пробега
-средняя скорость движения молекул,
d – эффективный диаметр
n0 – концентрация молекул.
31.
2. Теплопроводность.Перенос энергии в форме теплоты
подчиняется закону Фурье:
Количество теплоты q, которое переносится в единицу
времени через площадку S в направлении нормали к
площадке, прямо пропорционально dT/dz — градиенту
температуры.
dT
— коэффициент
q
S теплопроводности
dz
Дж
м с град
[q]= Дж/с
Знак минус показывает, что при теплопроводности энергия
переносится в направлении убывания температуры
- плотность газа, сV – удельная
1
l cV теплоемкость газа при постоянном
3
объеме
32.
3. Внутреннее трение (вязкость). Механизм возникновениявнутреннего трения между параллельными слоями газа
(жидкости), движущимися с различными скоростями,
заключается в том, что из-за хаотического теплового движения
происходит обмен молекулами между слоями, в результате
чего импульс слоя, движущегося быстрее, уменьшается, а
движущегося медленнее — увеличивается, что приводит к
торможению слоя, движущегося быстрее, и ускорению слоя,
движущегося медленнее.
du
f
S
dz
Сила внутреннего трения между двумя
слоями газа (жидкости) подчиняется закону
Ньютона:
где — коэффициент вязкости, du/dz — градиент скорости,
показывающий быстроту изменения скорости в направлении z,
перпендикулярном направлению движения слоев, S — площадь, на
которую действует сила f.
Коэффициент вязкости вычисляется по формуле:
1
l
3
33.
Физические основы термодинамики1. Первое начало термодинамики.
2. Работа газа при изменении его объема.
3. Число степеней свободы молекулы. Закон
равномерного распределения энергии по
степеням свободы.
4. Теплоемкость идеального газа.
5. Адиабатический и политропический
процессы.
6. Работа, совершаемая идеальным газом при
различных процессах.
34.
1. Первое начало термодинамикиВнутренняя энергия может изменяться за счет двух
различных процессов:
1) Совершения над телом работы А’
2) Сообщения телу количества теплоты Q путем
теплопередачи
U U 2 U1
Q U A
Изменение внутренней энергии
Первое начало термодинамики
Теплота, передаваемая системе, расходуется на
увеличение ее внутренней энергии и на
совершение системой работы против внешних сил.
35.
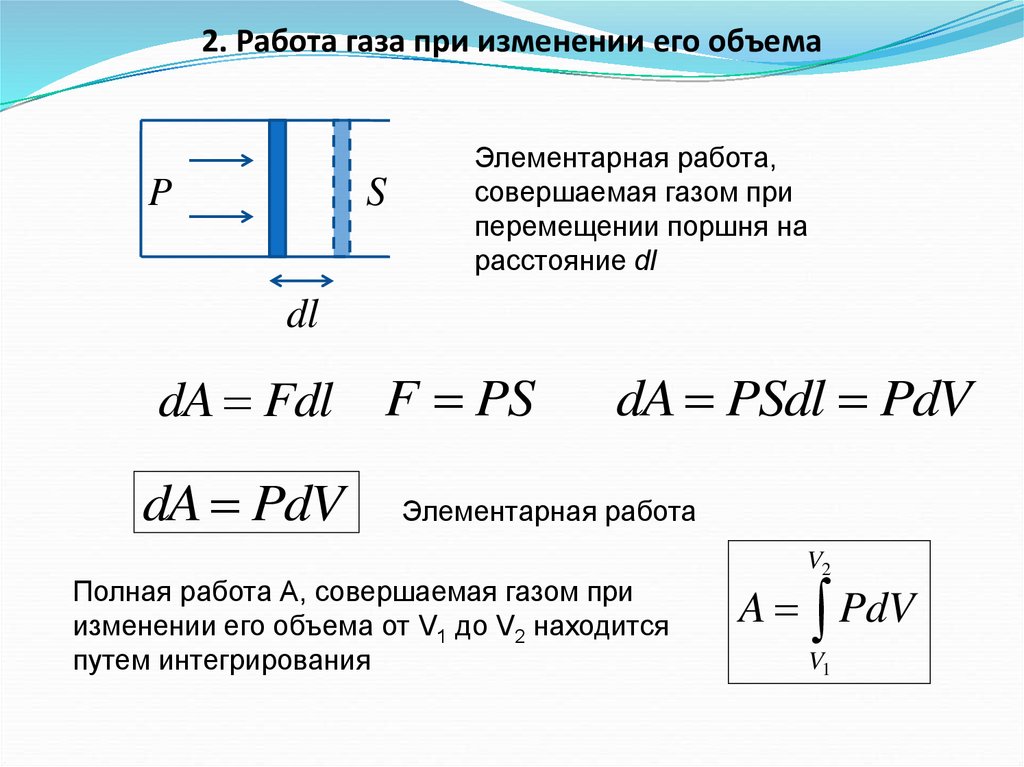
2. Работа газа при изменении его объемаS
P
Элементарная работа,
совершаемая газом при
перемещении поршня на
расстояние dl
dl
dA Fdl
dA PdV
F PS
dA PSdl PdV
Элементарная работа
Полная работа А, совершаемая газом при
изменении его объема от V1 до V2 находится
путем интегрирования
V2
A PdV
V1
36.
3. Число степеней свободы молекулы3
E kT
2
Средняя энергия поступательного движения
молекулы:
Числом степеней свободы механической системы называется
количество независимых величин, с помощью которых может быть
задано положение системы.
Средняя кинетическая энергия молекулы:
i
E kT
2
i iпост iвращ 2iколеб
i
i
U N A E N A kT RT
2
2
Внутренняя энергия 1 моля
идеального газа:
Внутренняя энергия произвольной массы газа:
U
m
U
mi
U
RT
2
37.
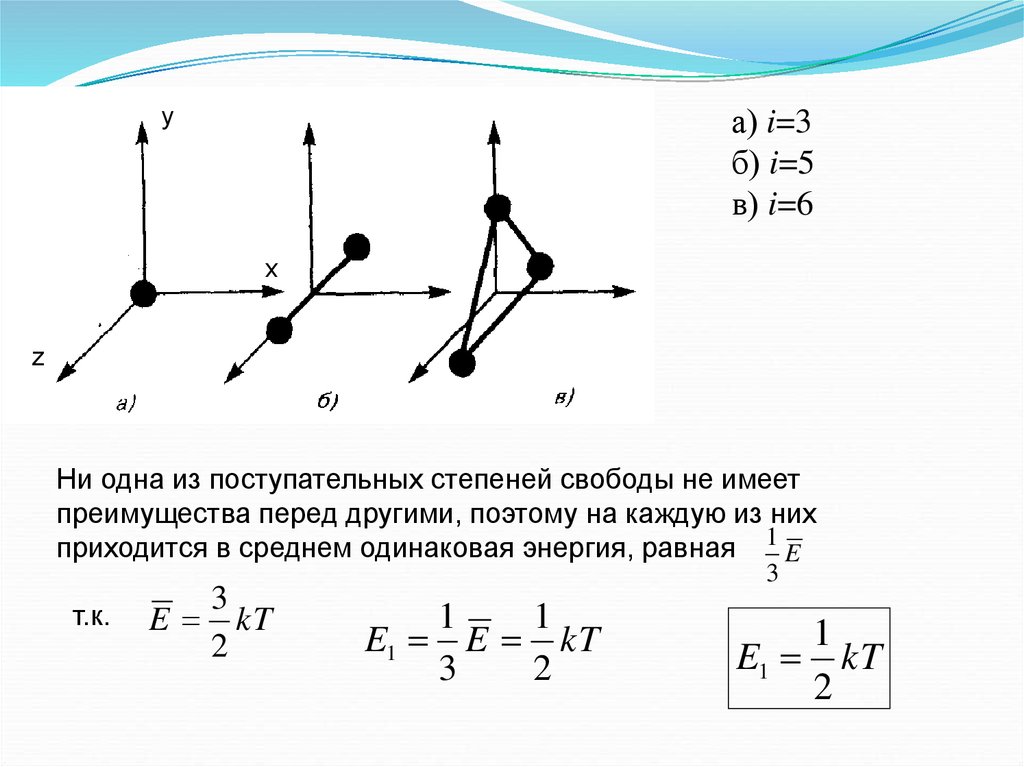
а) i=3б) i=5
в) i=6
y
x
z
Ни одна из поступательных степеней свободы не имеет
преимущества перед другими, поэтому на каждую из них
приходится в среднем одинаковая энергия, равная 1 E
т.к.
3
E kT
2
3
1
1
E1 E kT
3
2
1
E1 kT
2
38.
4.Теплоемкость идеального газаТеплоемкостью тела называется величина,
равная количеству тепла, которое нужно
сообщить телу, чтобы повысить его
температуру на один градус.
dQ
C
dT
Дж
C
К
Удельной теплоемкостью вещества
называется величина, равная количеству
теплоты, необходимому для нагревания 1
кг вещества на 1 градус.
dQ
c
mdT
Дж
c
кг К
C c
V const
молярная теплоемкость вещества (теплоемкость одного моля)
dV 0
i
U RT
2
A 0
dQV dU
i
CV R
2
dQV dU
CV
dT
dT
молярная теплоемкость при
постоянном объеме
39.
При нагревании газа при постоянном давлении его объем изменяется,сообщаемое газу количество теплоты идет не только на увеличение его
внутренней энергии, но и на совершение работы.
P const
dQP dU PdV
dV
dQP dU
Cp
P
dT
dT
dT P
dV
PV RT
C p CV P
dT P
C p CV R
i
CV R
2
dU
dT
CV
PdV RdT
P
dV
dT
R
Уравнение Майера
i
CP R R
2
i 2
CP
R
2
CP i 2
CV
i
молярная
теплоемкость при
постоянном
давлении
показатель адиабаты
40.
5. Адиабатический процессАдиабатическим называется процесс, протекающий
без теплообмена с внешней средой.
dQ dU PdV
m
PV
m
RT
dU
dQ 0
CV dT
CV dT PdV 0
(1)
m
dT
PdV VdP
PdV VdP
CV
PdV 0
m
R
m
1
m
C CV
VdP
P
PdV
CV
RdT
PdV VdP
m
R
Подставляем
в (1)
PdV VdP
R
PdV
CV
VdP
PdV
CP CV R
dP
dV
P
V
41.
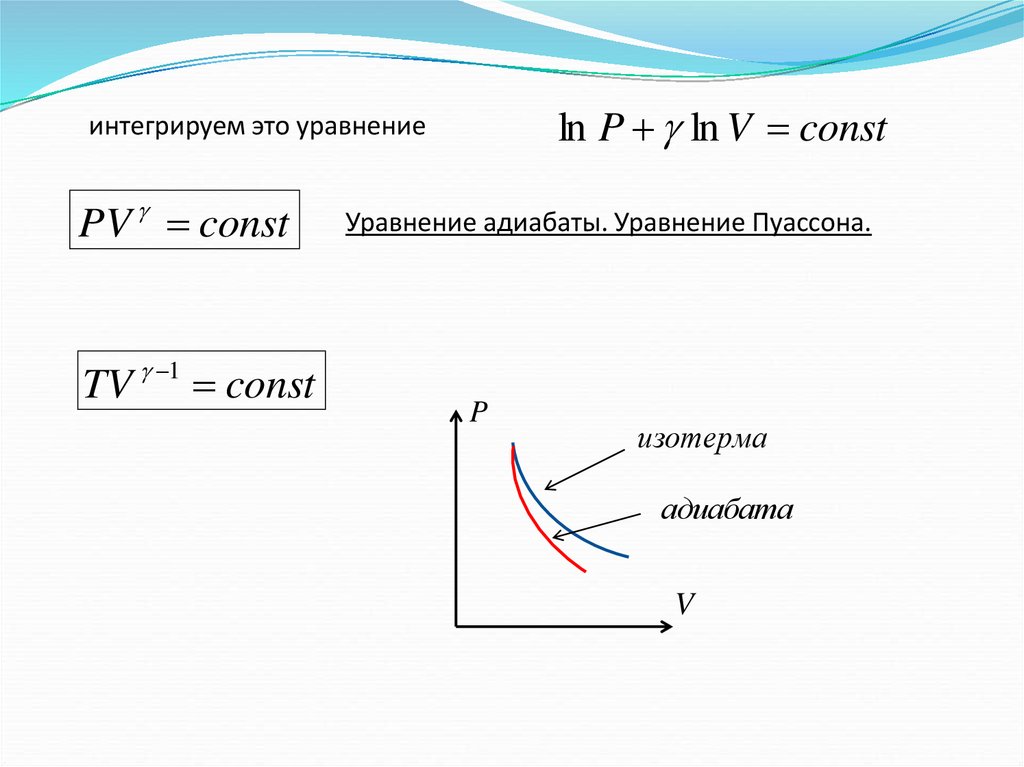
ln P ln V constинтегрируем это уравнение
PV const
TV 1 const
Уравнение адиабаты. Уравнение Пуассона.
P
изотерма
адиабата
V
42.
Политропическим называется такой процесс, прикотором давление и объем идеального газа связаны
соотношением:
PV const
n
TV
n 1
const
n может принимать любые значения
n 0
n 1
n
n
Изобарический процесс
Изотермический процесс
Адиабатический процесс
Изохорический процесс
43.
6. Работа, совершаемая идеальным газом при различныхпроцессах
V2
A12 PdV
P1V1n
P n
V
PV n P1V1n
V1
V2
dV
A12 PV n
V
V1
n
1 1
Рассмотрим случай
dV
1 1
1
V V n n 1 V1n 1 V2n 1
1
V2
P1V1 V1
A12
1
n 1 V2
n 1
n 1
P1V1n 1
1
A12
n 1
n 1
n 1 V1
V2
n 1
m RT1 V1
A12
1
n 1 V2
Работа, совершаемая идеальным газом при любом политропическом
процессе, кроме изотермического (n=1)
44.
nДля адиабатического
процесса:
1
m RT1 V1
A12
1
1 V2
Для изотермического процесса: n=1
V2
A12 PdV
V1
m RT
P
V
m
V2
A12 RT ln
V1
При изобарическом
процессе:
При изохорическом
процессе:
m
V2
dV
A12 RT
V
V1
Работа, совершаемая газом при
изотермическом процессе
A12 p(V2 V1 )
A12 0
45.
Реальные газы1. Отклонение газов от идеальности
2. Уравнение Ван-дер-Ваальса
3. Экспериментальные изотермы
46.
1. Отклонение газов от идеальностиПоведение идеальных газов
описывается уравнением:
pV
m
RT
Fо- сила отталкивания; Fп – сила
притяжения; F – результирующая сила
При рассмотрении реальных газов
необходимо учитывать:
1. Взаимодействие молекул
2. Объем молекул
dA dEп
47.
Критерием различных агрегатных состояний веществаявляется соотношение величин En.min и kT
En.min - наименьшая потенциальная энергия взаимодействия
молекул – определяет работу против сил притяжения,
необходимую для того, чтобы разъединить молекулы,
находящиеся в равновесии (r=r0);
kT – определяет порядок средней кинетической энергии
хаотического теплового движения молекул.
1.
2.
3.
Если En.min << kT , то вещество находится в газообразном
состоянии
Если En.min >> kT , то вещество находится в твердом
состоянии
Если En.min ≈ kT , то вещество находится в жидком
состоянии
48.
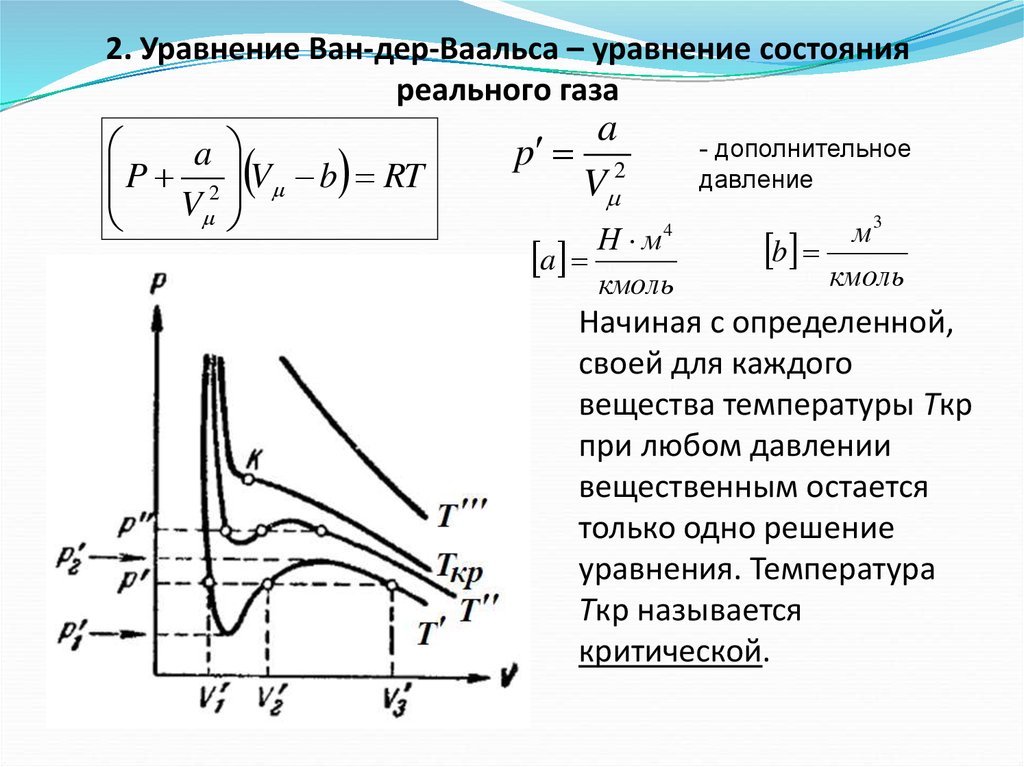
2. Уравнение Ван-дер-Ваальса – уравнение состоянияреального газа
a
P
V b RT
2
V
a
p 2
V
a Н м
- дополнительное
давление
4
кмоль
м3
b
кмоль
Начиная с определенной,
своей для каждого
вещества температуры Ткр
при любом давлении
вещественным остается
только одно решение
уравнения. Температура
Ткр называется
критической.
49.
3. Экспериментальные изотермыМанометр
Газ (или пар), находящийся в равновесии со своей жидкостью,
называется насыщенным паром. Давление, при котором может
существовать равновесие при данной температуре, называется
давлением (или упругостью) насыщенного пара.
50.
Экспериментальные изотермы для нескольких значенийтемпературы
газ
жидкость
51.
1.Внутренняя энергия реального газа2.Эффект Джоуля-Томсона
3.Ожижение газов
52.
1. Внутренняя энергия реального газаВнутренняя энергия реального газа
Ek
U Ek E p
- кинетическая энергия движения молекул;
- взаимная потенциальная энергия молекул
Ep
Кинетическая энергия молекул, содержащихся в моле газа равна:
dA pi dV
pi
Ek cV T
Работа против внутренних сил идет на
увеличение потенциальной энергии
системы
- внутреннее давление
a
dE p pi dV 2 dV
V
a
U cV T
V
Интегрируем:
a
Ep
V
- Внутренняя энергия реального газа
53.
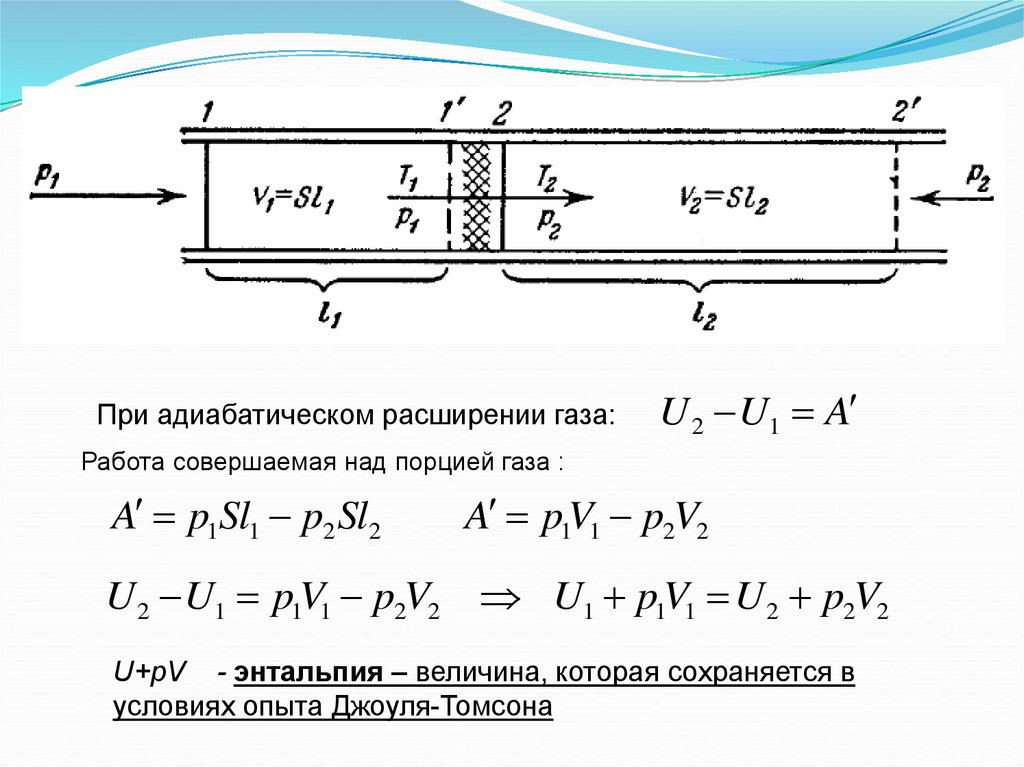
2. Эффект Джоуля-ТомсонаПропуская газ по теплоизолированной трубке с
пористой перегородкой, Джоуль и Томсон
обнаружили, что при расширении, которым
сопровождается
прохождение
газа
через
перегородку, температура
его несколько
изменяется. В зависимости от начальных
давления
и
температуры
изменение
температуры ΔТ имеет тот или иной знак и, в
частности, может оказаться равным нулю. Это
явление получило название эффекта ДжоуляТомсона.
54.
При адиабатическом расширении газа:U 2 U1 A
Работа совершаемая над порцией газа :
A p1Sl1 p2 Sl2
A p1V1 p2V2
U 2 U1 p1V1 p2V2 U1 p1V1 U 2 p2V2
U+pV - энтальпия – величина, которая сохраняется в
условиях опыта Джоуля-Томсона
55.
После расширения газ можно считать идеальным.Расчет для моля газа
p2V2 RT2
U 2 cV T2
Из уравнения Ван дер Ваальса для газа до расширения:
a
p1 2 (V1 b) RT1
V1
RT1
a
p1
2
V1 b V1
a
RT1
p1 2
V1 V1 b
RT1
a
p1V1
2 V1
V1 b V1
Внутренняя энергия до расширения:
a
U1 cV T1
V1
Подставив в (*) , получим:
a RT1
a
cV T1
2 V1 cV T2 RT2
V1 V1 b V1
56.
a RT1V1 acV T1
cV T2 RT2
V1 V1 b V1
Преобразуем третье слагаемое:
RT1V1 RT1 (V1 b b) RT1 (V1 b) RT1b
RT1b
RT1
V1 b
V1 b
V1 b
V1 b
подставим
a
RT1b a
cV T1 RT1
cV T2 RT2
V1
V1 b V1
Преобразуем:
(cV R)T1
RT1b 2a
(cV R)T2
V1 b V1
RT1b 2a
(cV R)(T2 T1 )
V1 b V1
RT1b 2a
1
T
(cV R) V1 b V1
Знак ΔТ определяется знаком выражения в скобках
57.
ΔТ=0 приRT1b 2a
0
V1 b V1
RT1b 2a
V1 b V1
2a(V1 b) V1RT1b
2a(V1 b) 2a b
1
T1
V1Rb
Rb V1
При
При
V1 b T1 0
2a
V1 T1
Rb
2a
T1
При
- эффект всегда отрицательный
bR
2a
При
- эффект положительный только при большом
T1
bR начальном объеме
58.
После расширения газ можносчитать идеальным.
RT1b 2a
1
T
(cV R) V1 b V1
Знак ΔТ определяется
знаком выражения в
скобках
ΔТ=0 при
RT1b 2a
0
V1 b V1
При
При
2a
T1
bR
2a
T1
bR
2a b
1
T1
Rb V1
- эффект всегда отрицательный
- эффект положительный только при большом
начальном объеме
59.
1.Обратимые и необратимыепроцессы. Коэффициент
полезного действия тепловой
машины.
2.Второе начало
термодинамики.
3.Цикл Карно. Коэффициент
полезного действия цикла
Карно для идеального газа.
60.
1. Обратимые и необратимые процессы. Коэффициентполезного действия тепловой машины
Обратимым процессом называется такой процесс, который может
быть проведен в обратном направлении таким образом, что система
будет проходить через те же состояния, что и при прямом ходе, но в
обратной последовательности.
Только равновесный процесс может быть обратимым.
Круговым процессом (или циклом) называется такой процесс, при
котором система после ряда изменений возвращается в исходное
состояние.
P
1
a
b
Работа, совершаемая при круговом процессе ,
численно равна площади, охватываемой
кривой.
2
V
V1
V2
61.
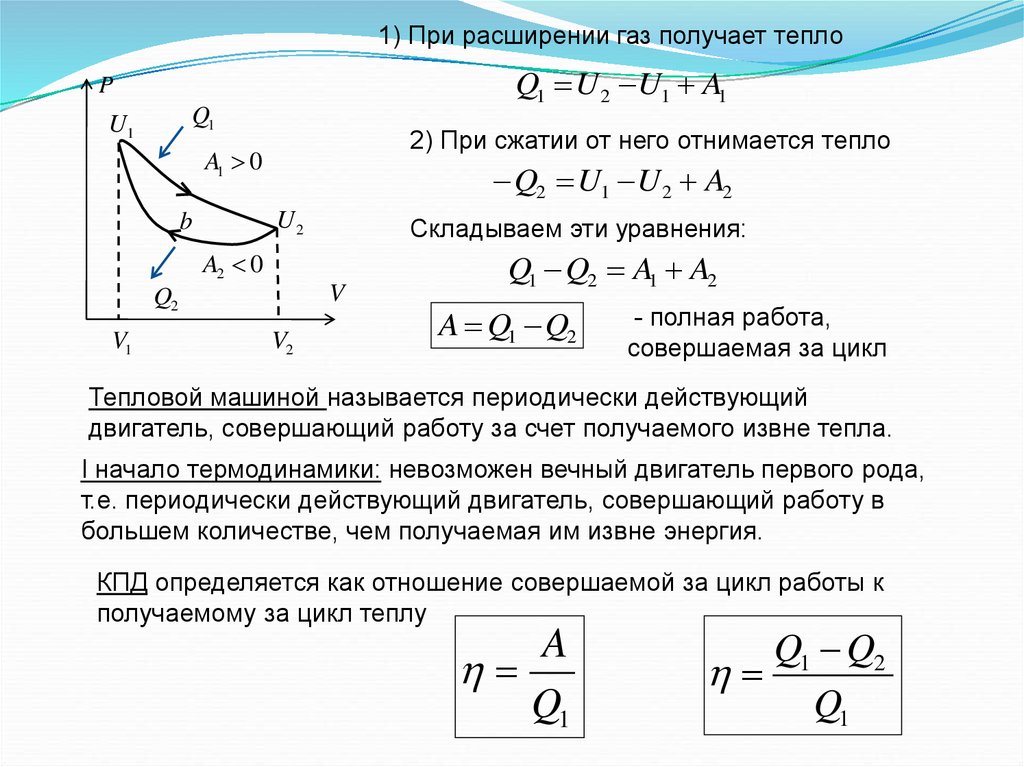
1) При расширении газ получает теплоQ1 U 2 U1 A1
P
Q1
U1
2) При сжатии от него отнимается тепло
A1 0
Q2 U1 U 2 A2
U2
b
Складываем эти уравнения:
A2 0
V
Q2
V1
V2
Q1 Q2 A1 A2
A Q1 Q2
- полная работа,
совершаемая за цикл
Тепловой машиной называется периодически действующий
двигатель, совершающий работу за счет получаемого извне тепла.
I начало термодинамики: невозможен вечный двигатель первого рода,
т.е. периодически действующий двигатель, совершающий работу в
большем количестве, чем получаемая им извне энергия.
КПД определяется как отношение совершаемой за цикл работы к
получаемому за цикл теплу
A
Q1
Q1 Q2
Q1


















































 physics
physics








