Similar presentations:
Альдегиды. Карбоновые кислоты. Жиры
1.
12.
Цели:1.
2.
Познакомиться с классом альдегидов, его
свойствами. Выяснить области применения
альдегидов.
Познакомиться с карбоновыми кислотами и
их производными. Узнать свойства
карбоновых кислот и их производных,
определить области применения.
2
3.
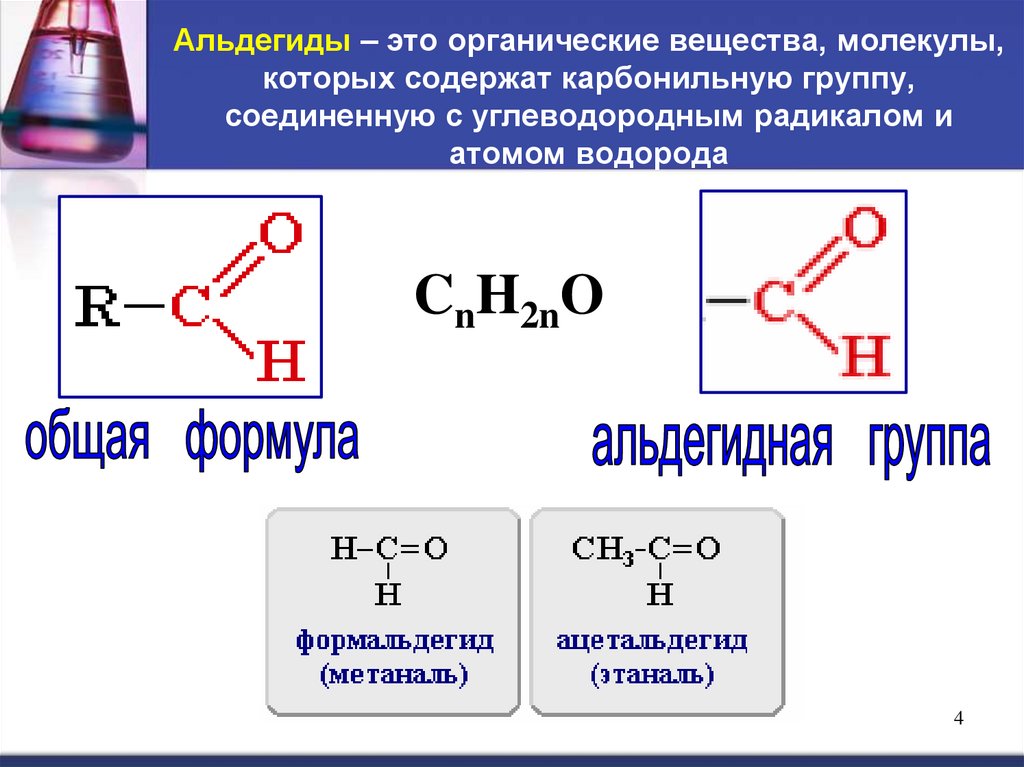
34. Альдегиды – это органические вещества, молекулы, которых содержат карбонильную группу, соединенную с углеводородным радикалом и
атомом водородаCnH2nO
4
5.
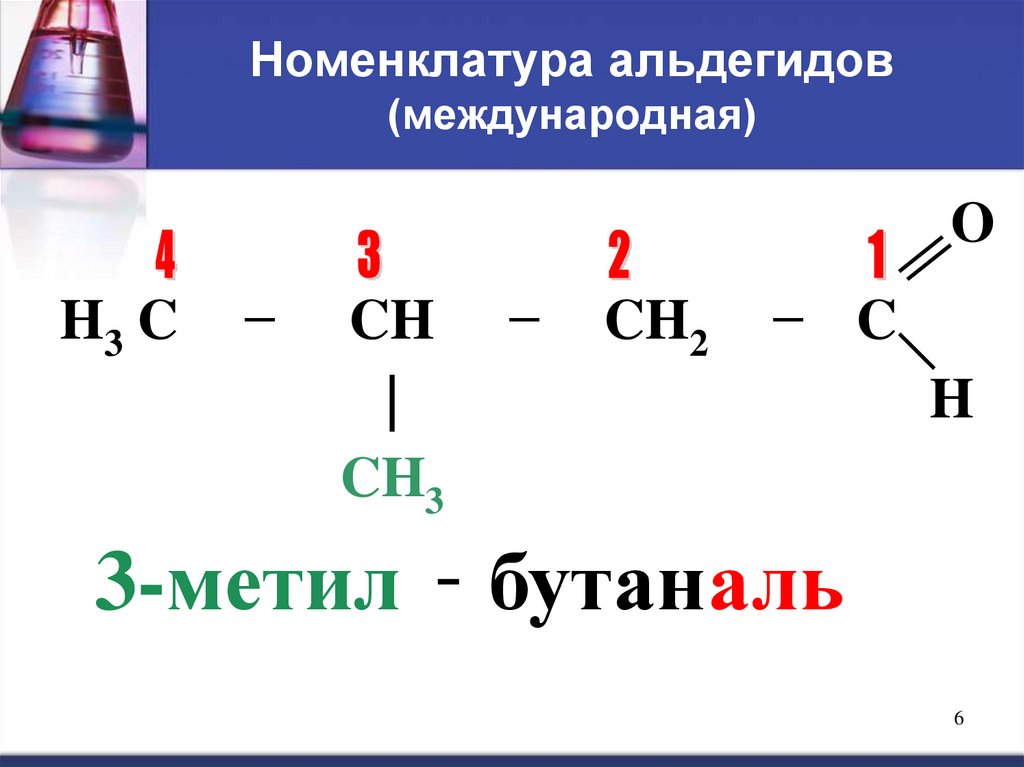
56. Номенклатура альдегидов (международная)
OH3 C
−
CH
|
CH3
−
CH2
− C
H
3-метил - бутаналь
6
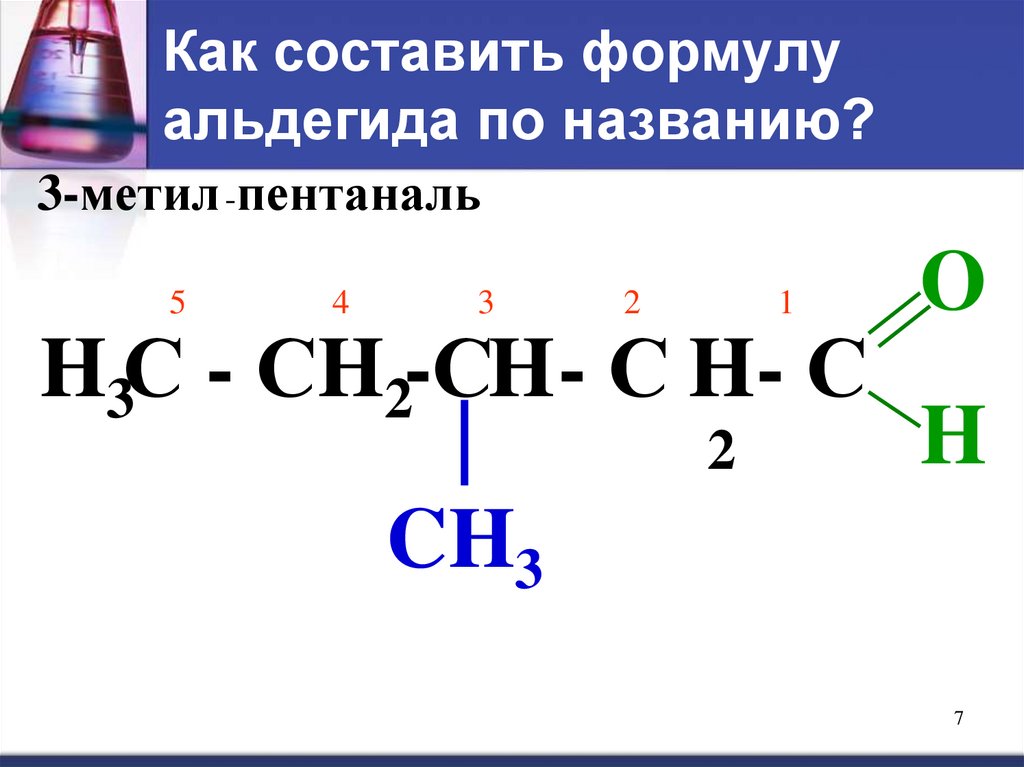
7. Как составить формулу альдегида по названию?
3-метил -пентаналь5
4
3
2
1
O
H3С - СH2-СH - С H- С
H
|
2
CH3
7
8. Изомерия
Вид изомерииФормулы изомеров
По углеродному
скелету
начиная с С4
межклассовая с
кетонами,
начиная с С3
непредельными
спиртами и
простыми
эфирами (с С3)
8
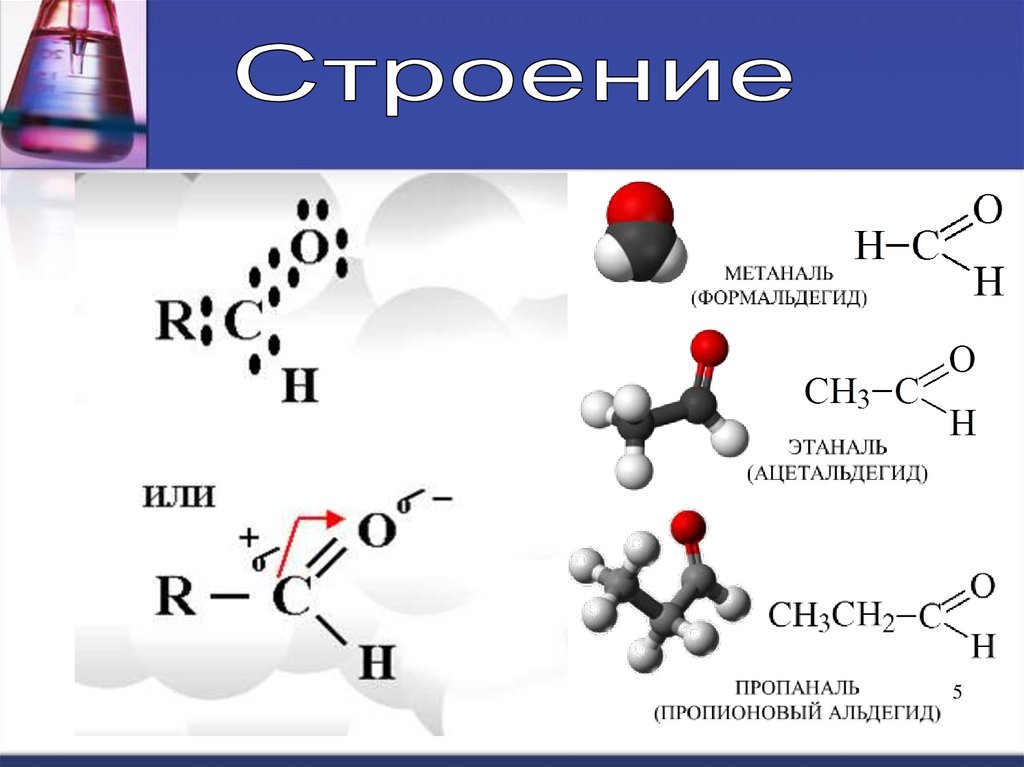
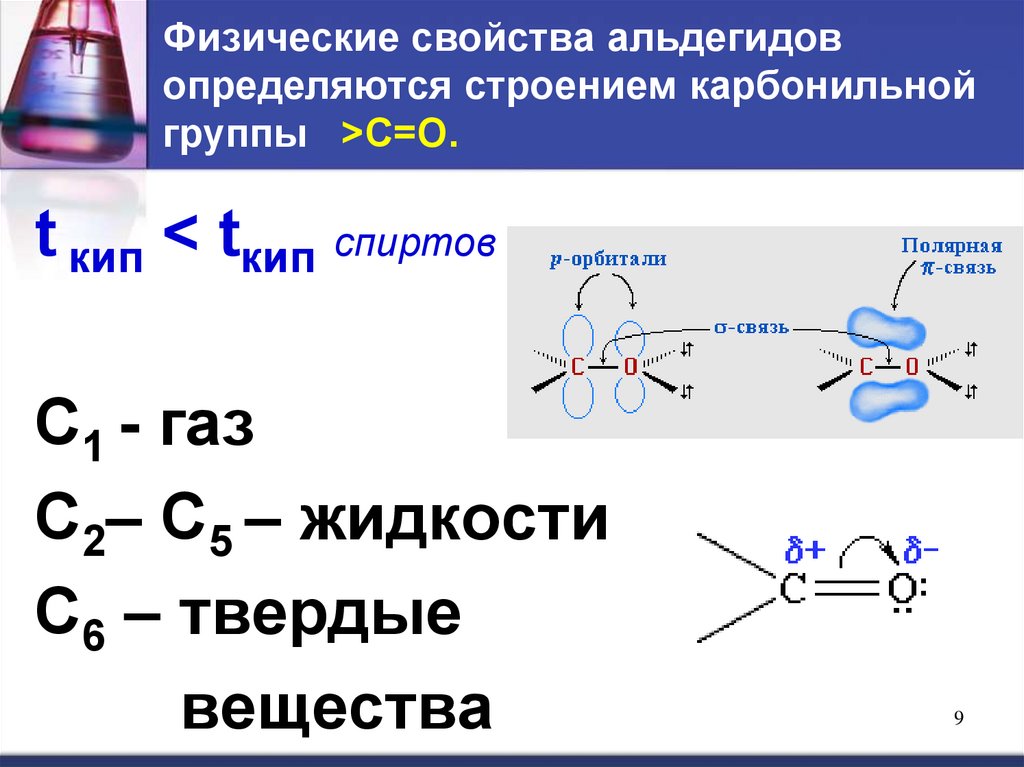
9. Физические свойства альдегидов определяются строением карбонильной группы >C=O.
Физические свойства альдегидовопределяются строением карбонильной
группы >C=O.
t кип < tкип спиртов
С1 - газ
С2– С5 – жидкости
С6 – твердые
вещества
9
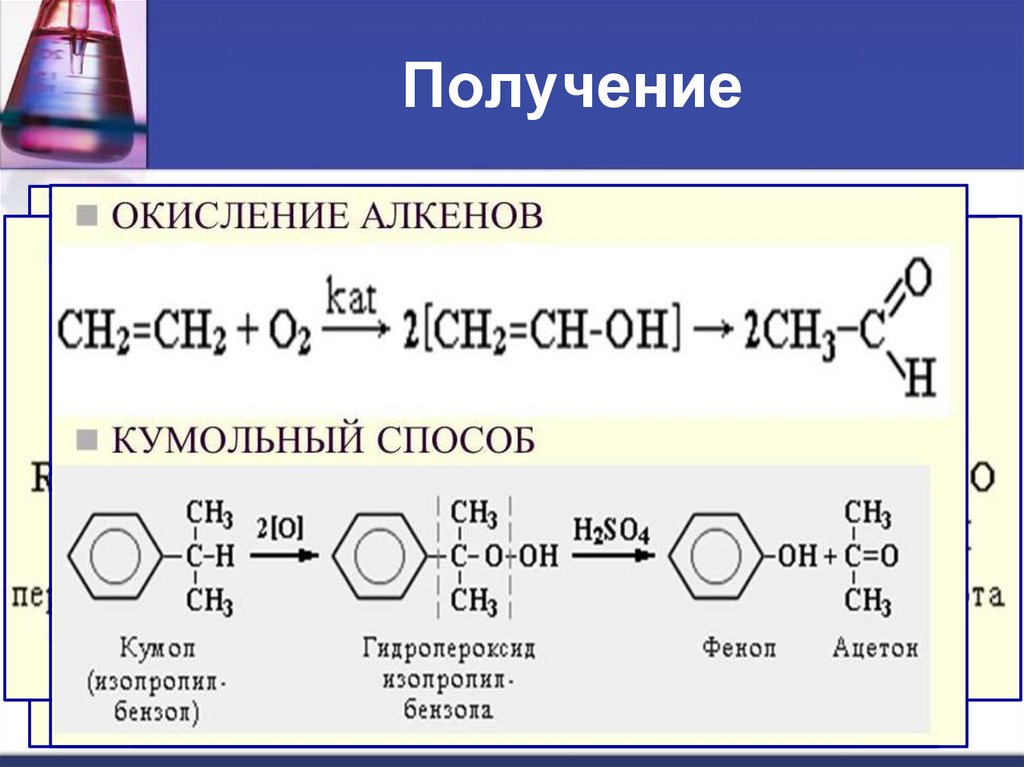
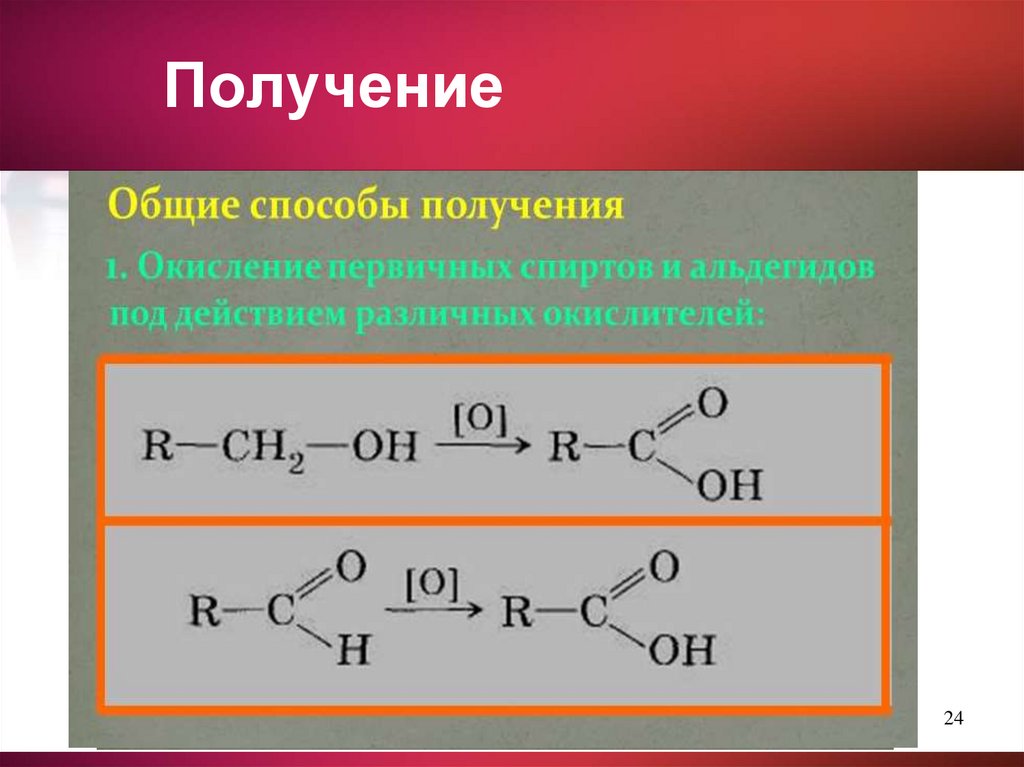
10. Получение
1011.
Химические реакциивосстановления
полимеризации
присоединения
окисления
11
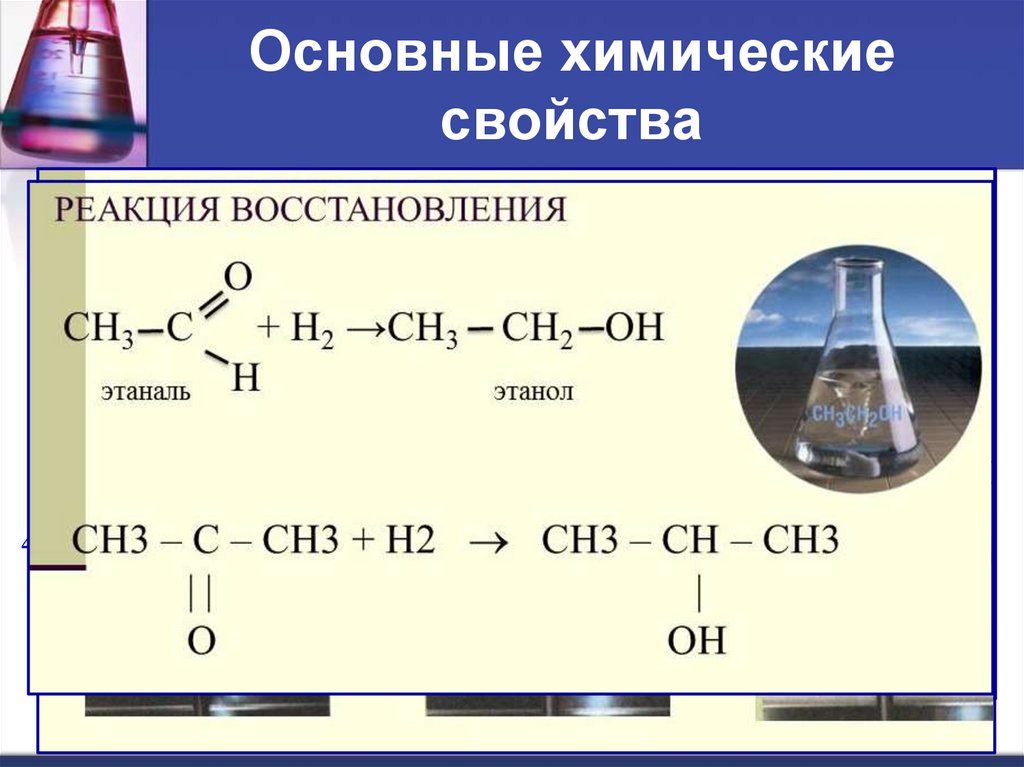
12. Основные химические свойства
4.СH2O
+
реакция полимеризации
СH2
+ H2O
12
13. Применение альдегидов
14. Применение альдегидов
1415. Применение альдегидов
1516.
1617. Карл Вильгельм Шееле
1718.
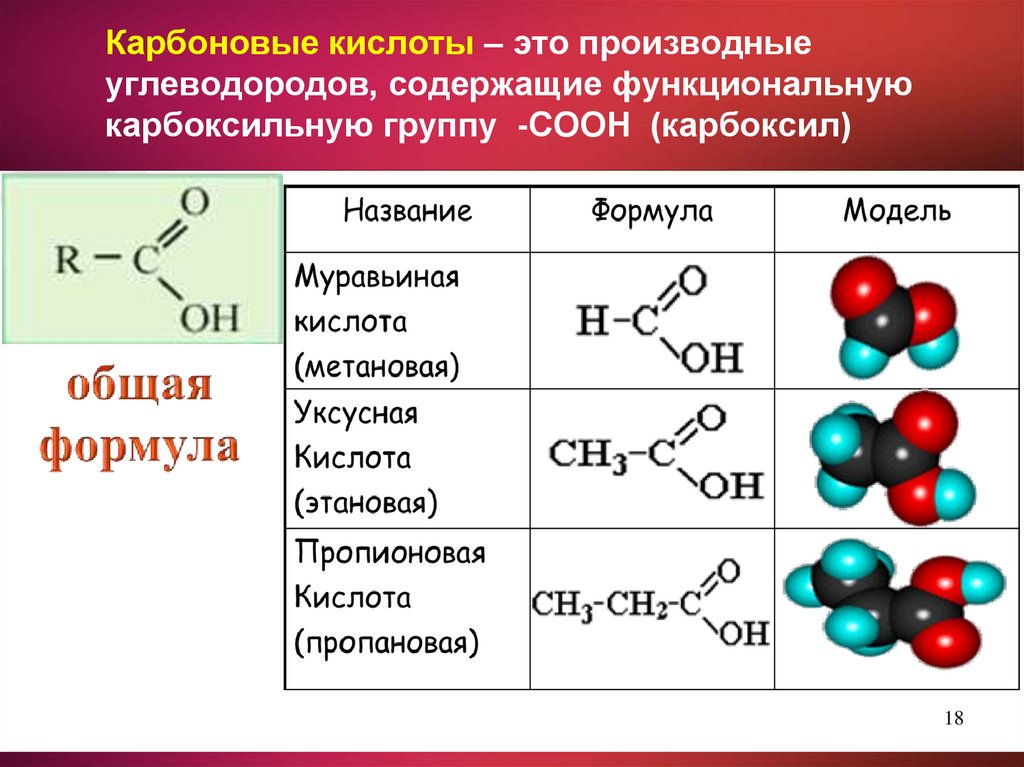
Карбоновые кислоты – это производныеуглеводородов, содержащие функциональную
карбоксильную группу -СООН (карбоксил)
18
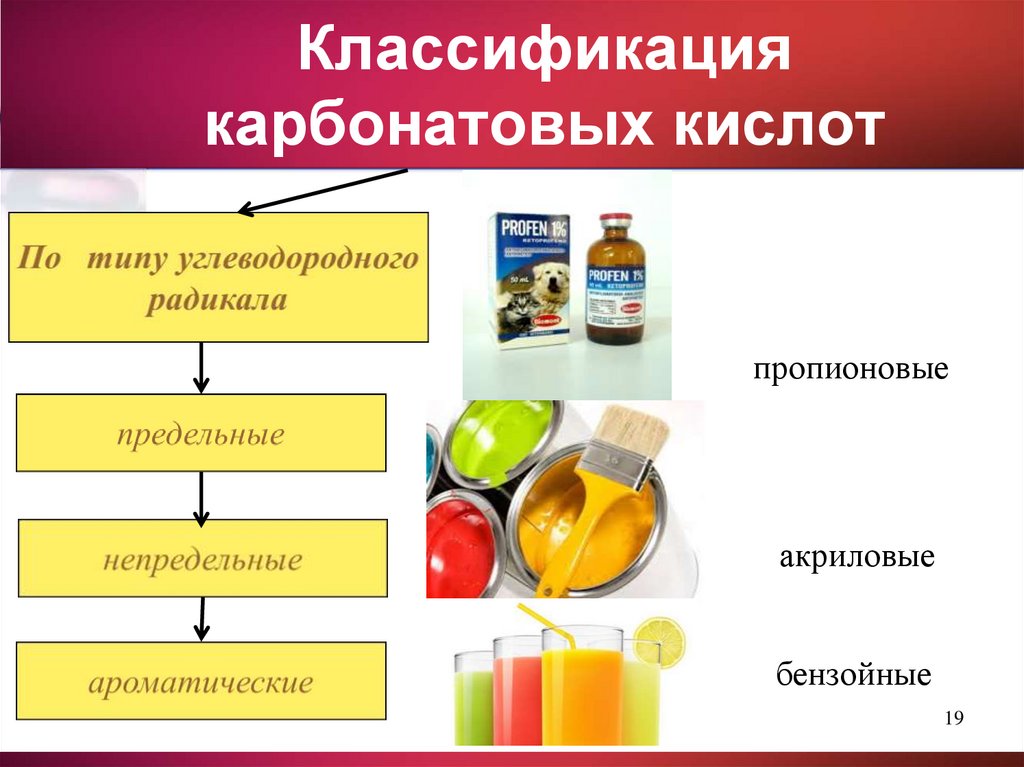
19. Классификация карбонатовых кислот
пропионовыеакриловые
бензойные
19
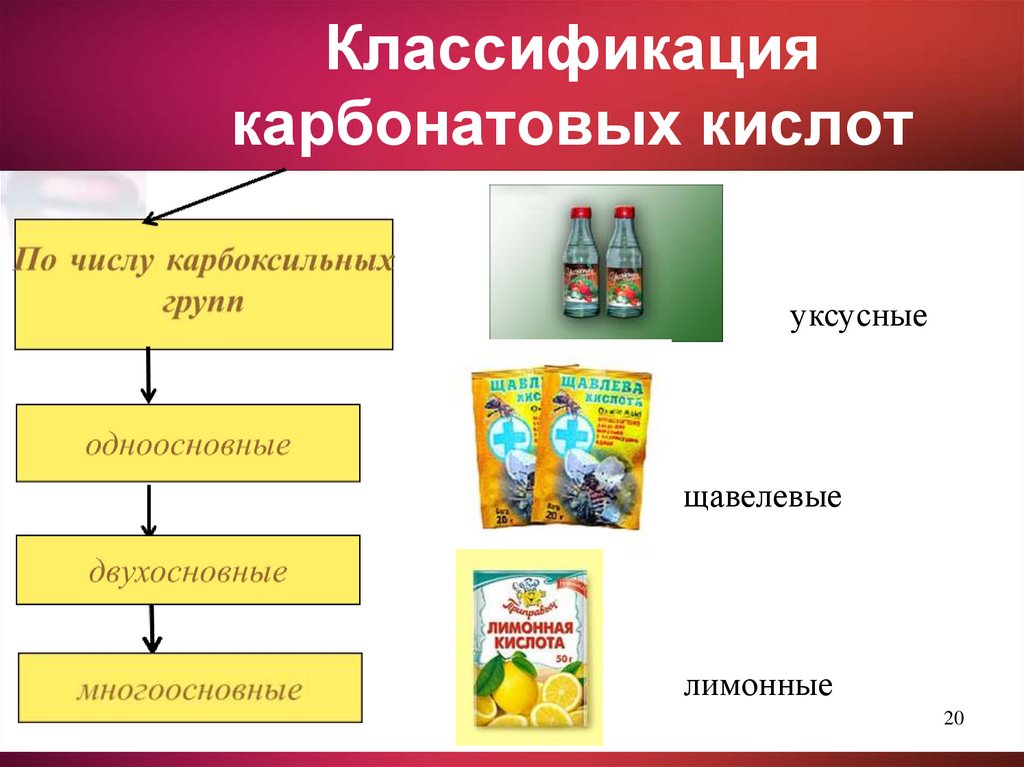
20. Классификация карбонатовых кислот
уксусныещавелевые
лимонные
20
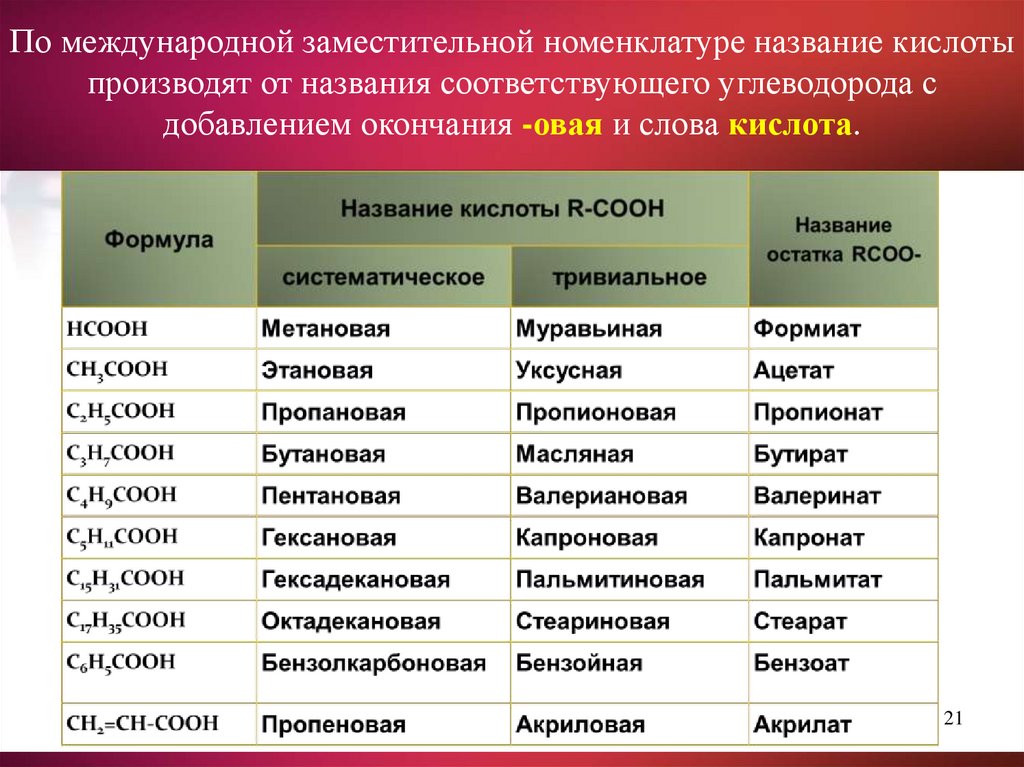
21.
По международной заместительной номенклатуре название кислотыпроизводят от названия соответствующего углеводорода с
добавлением окончания -овая и слова кислота.
21
22. Номенклатура и изомерия
Нумерацию цепи всегданачинают с атома
углерода карбоксильной
группы, поэтому в
названиях положение
группы -СООН не
указывают.
Например:
5
4
3
2
1
О
СН3-СН2-СН-СН2-С
СН3
ОН
3-метилпентановая кислота
Внутри класса
возможна только
изомерия
углеродной цепи.
Первые три члена
гомологического
ряда изомеров не
имеют.
22
23. Физические свойства
2324. Получение
2425. Химические свойства
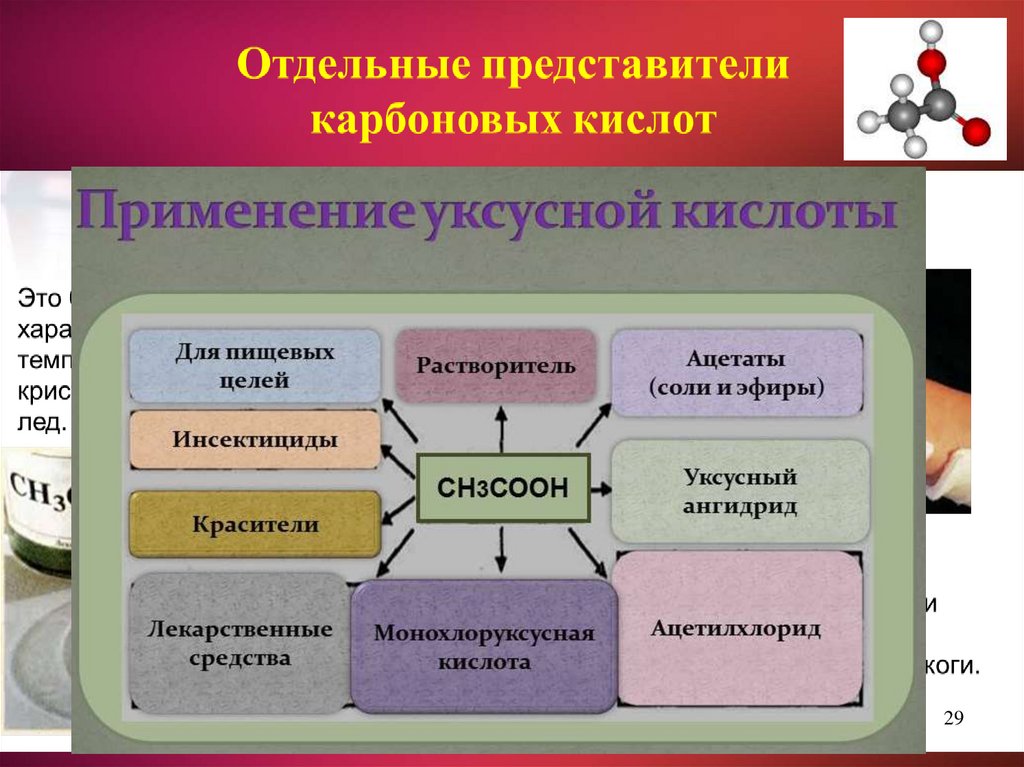
2526. Применение карбоновых кислот
Искусственныеволокна
26
27.
Карбоновые кислоты широкораспространены в природе
!
27
28.
2829.
2930.
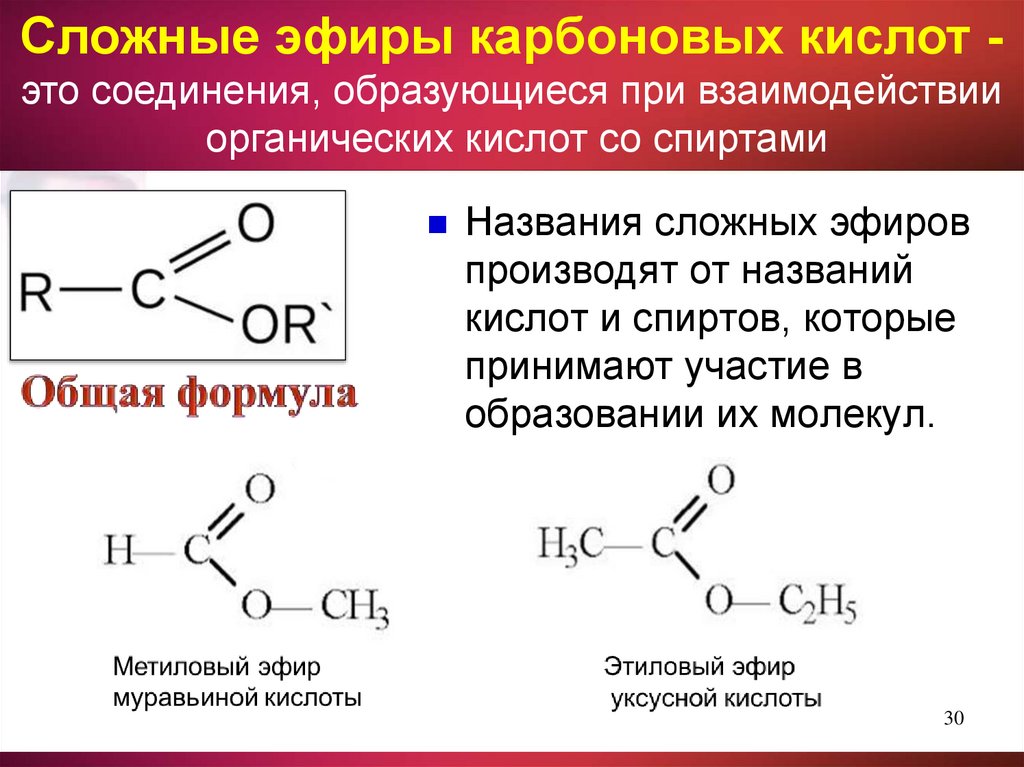
Сложные эфиры карбоновых кислот это соединения, образующиеся при взаимодействииорганических кислот со спиртами
Названия сложных эфиров
производят от названий
кислот и спиртов, которые
принимают участие в
образовании их молекул.
30
31.
Физические и химическисвойства
31
32.
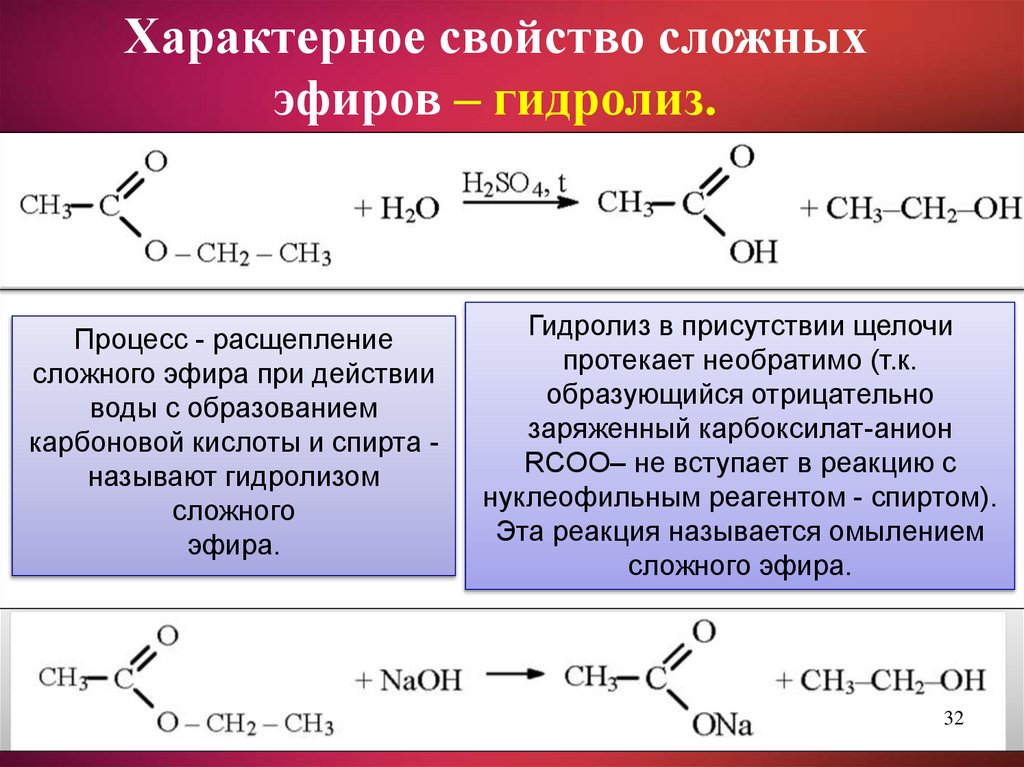
Характерное свойство сложныхэфиров – гидролиз.
Процесс - расщепление
сложного эфира при действии
воды с образованием
карбоновой кислоты и спирта называют гидролизом
сложного
эфира.
Гидролиз в присутствии щелочи
протекает необратимо (т.к.
образующийся отрицательно
заряженный карбоксилат-анион
RCOO– не вступает в реакцию с
нуклеофильным реагентом - спиртом).
Эта реакция называется омылением
сложного эфира.
32
33.
Нахождение в природе33
34.
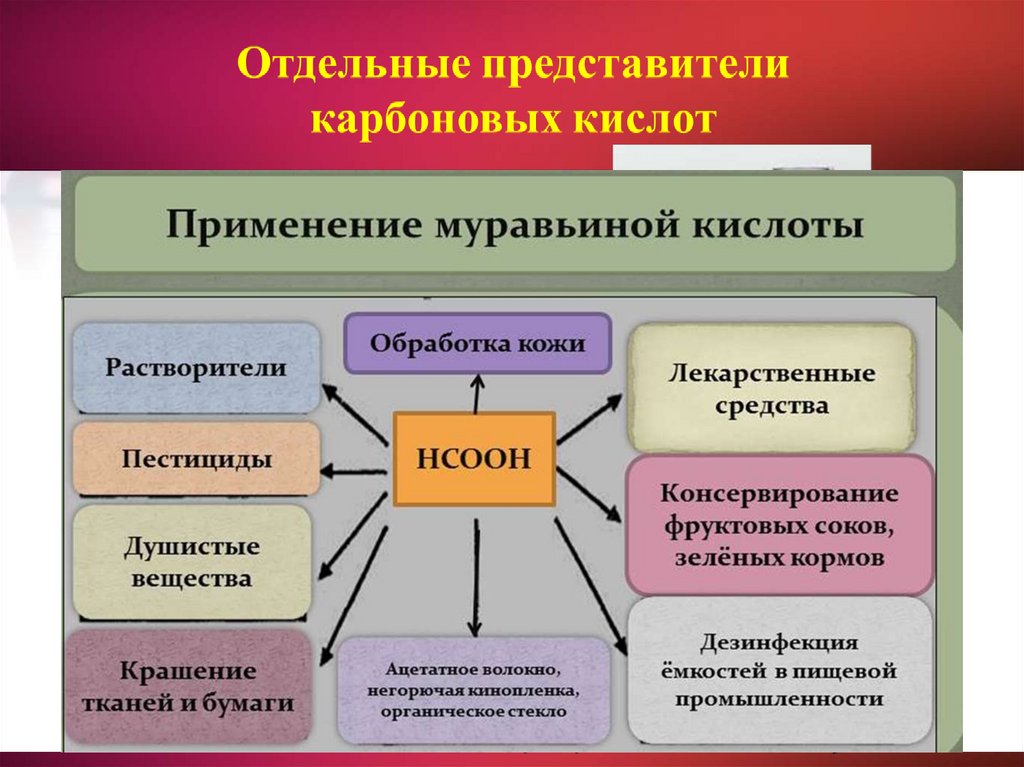
Применение34
35.
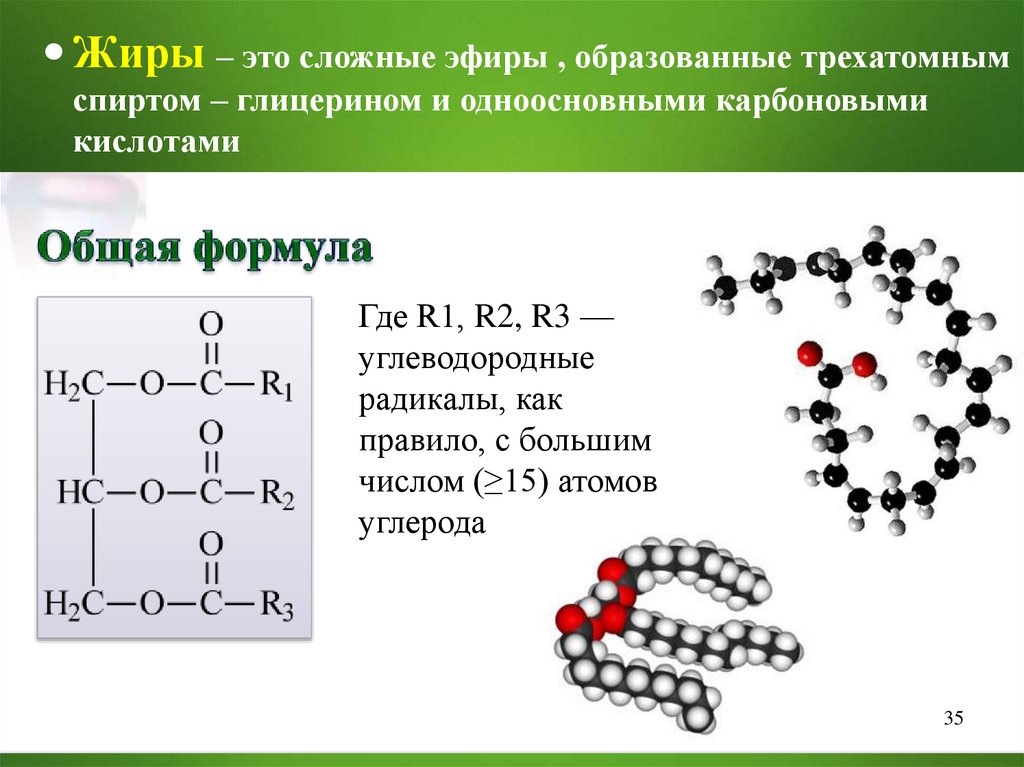
Жиры – это сложные эфиры , образованные трехатомнымспиртом – глицерином и одноосновными карбоновыми
кислотами
Где R1, R2, R3 —
углеводородные
радикалы, как
правило, с большим
числом (≥15) атомов
углерода
35
36.
История изучения жировК.Шееле в 1779 г. установил что в состав жиров
входит глицерин.
М.Шеврель в 1823 году установил, что, жиры
разлагаются на глицерин и карбоновые кислоты
М.Бертло в 1854 году осуществил синтез жира как
сложного эфира.
36
37.
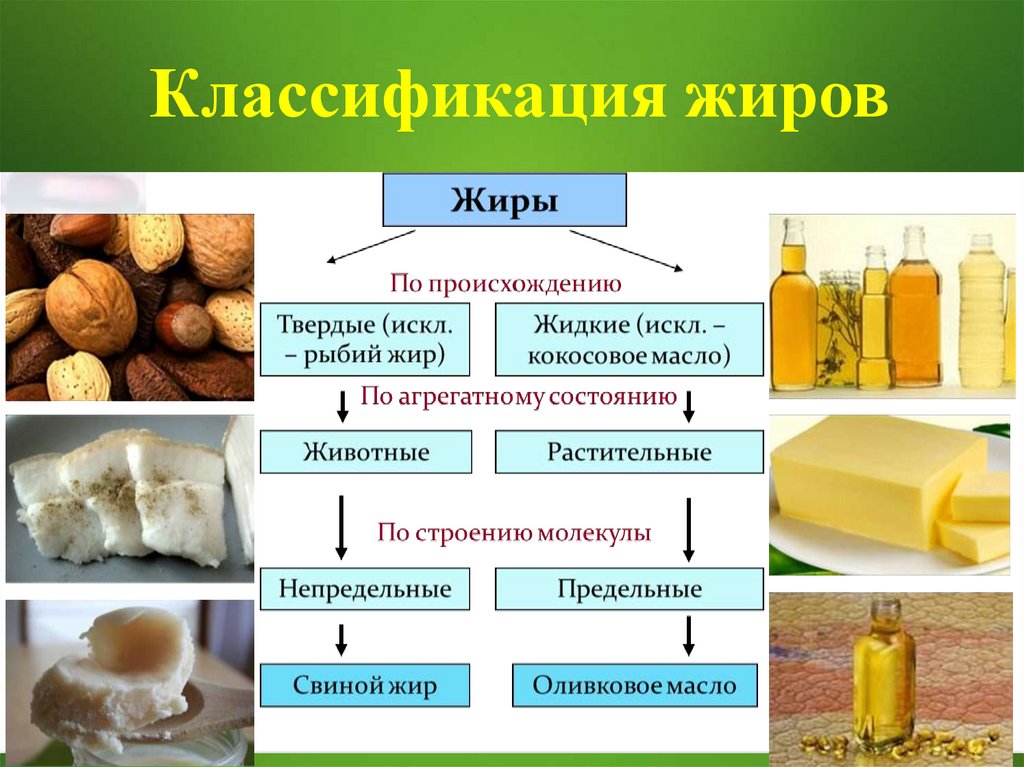
Классификация жиров37
38. Физические свойства
1.2.
3.
1. Жиры не растворимы в воде
2. Жиры не растворимы в спирте
3. Жиры растворимы в бензине
4. Плотность их меньше плотности воды
5. Если при комнатной температуре они имеют
твердое агрегатное состояние, то их называют
жирами, а если жидкое, то – маслами.
6. У жиров низкие температуры кипения и
плавления
7. Высокая вязкость
8. Слабо проводят тепло и электричество
38
39. Химические свойства
Этот процесс используют в технике для получения глицерина, карбоновыхкислот и мыла. Для получения глицерина и карбоновых кислот жир нагревают
с водой (при 170˚С и при повышенном давлении) в автоклавах:
При длительном хранении в обычных условиях жиры, например, сливочное
масло, подвергаются частичному гидролизу. Образовавшаяся масляная
кислота придает сливочному маслу неприятный вкус и запах. Этот процесс
называют прогорканием.
39
40.
Щелочной гидролиз (омыление)При проведении гидролиза в щелочной среде (в растворе щелочи или
карбоната натрия) выделяются натриевые соли карбоновых кислот, которые
являются мылами. Поэтому щелочной гидролиз жиров называют омылением:
40
41.
4142.
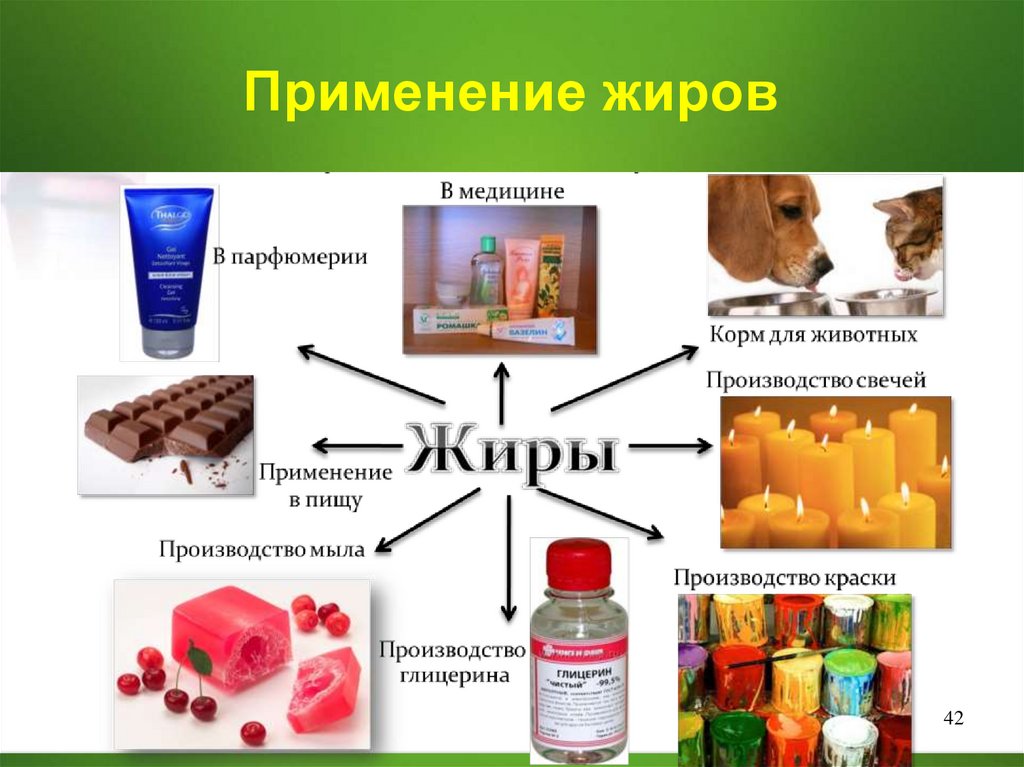
Применение жиров42
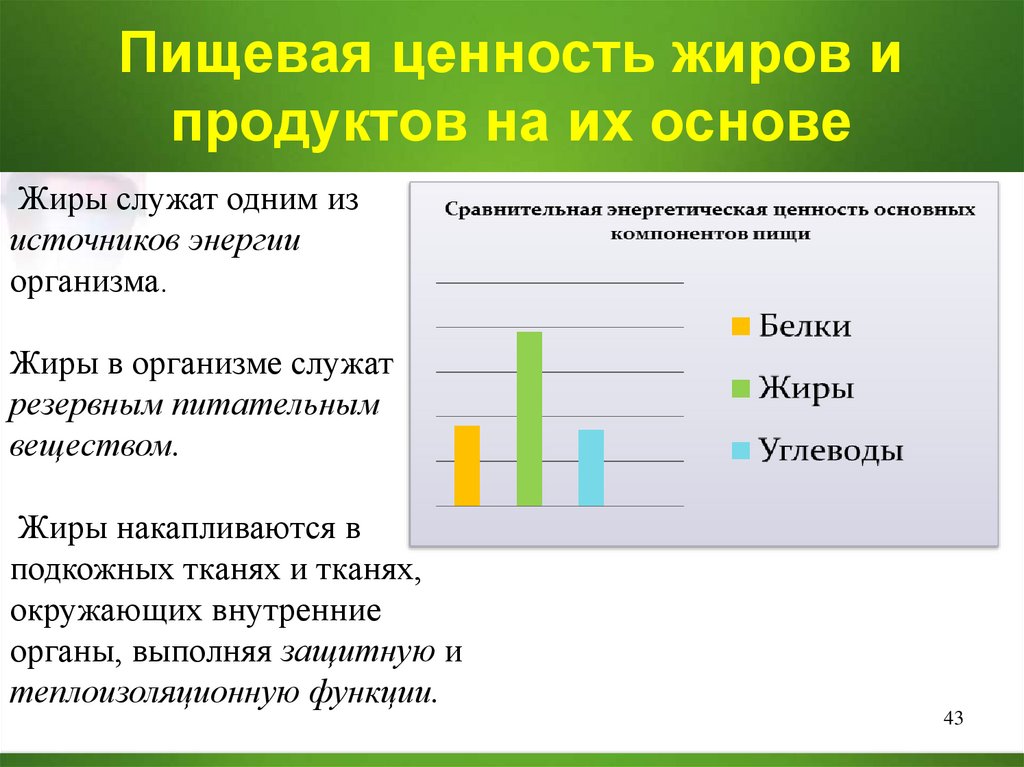
43. Пищевая ценность жиров и продуктов на их основе
Жиры служат одним изисточников энергии
организма.
Жиры в организме служат
резервным питательным
веществом.
Жиры накапливаются в
подкожных тканях и тканях,
окружающих внутренние
органы, выполняя защитную и
теплоизоляционную функции.
43
44.
Маргарин – этотонкодисперсная
эмульсия, в состав
которой входят твердый
жир, растительное
масло, молоко,
ароматизаторы,
витамины, сахар, соль,
пищевые красители. Его
используют в
хлебопекарной,
кондитерской
промышленности, в сети
общественного питания.
Майонез – это также
тонкодисперсная
эмульсия растительного
масла с водой, яичным
порошком, сухим
молоком, сахаром,
уксусом и специями. Его
применяют в качестве
приправы к
разнообразным
кулинарным блюдам для
повышения их
питательности и
44
облагораживания вкуса.
45.
Мыла и синтетическиемоющие средства
Мыла – это натриевые или калиевые соли
высших предельных одноосновных
карбоновых кислот
Калиевые соли – это жидкие мыла,
натриевые соли – твердые мыла.
Калиевые мыла лучше растворимы в воде,
содержатся в шампунях и кремах для бритья.
Натриевые мыла ограниченно растворимы,
Используются для получения хозяйственного
и туалетного мыла.
При получении туалетного мыла добавляют
душистые и красящие вещества –
антисептики.
45
46. Получение мыла
В настоящее время мыло получаютнейтрализацией синтетических кислот:
С15 H 31COOH KOH
C15 H 31COOK H 2O
пальмитат калия
(жидкое мыло)
С15 H 31COOH NaOH
C15 H 31COONa H 2O
пальмитат натрия
(твердое мыло)
Кислоты, необходимые для
производства мыла, преимущественно
получают каталитическим окислением
парафинов нефти:
., t
2С32 H 66 5O2 кат
4C15 H 31COOH 2 H 2O
пальмитиновая кислота
46
47. Недостатки мыла
4748. Синтетические моющие средства
Одну из групп синтетическихмоющих средств составляют соли
сложных эфиров высших спиртов и
серной кислоты. В отличие от
обычного мыла СМС не
подвергаются гидролизу, поэтому их
растворы нейтральны. Они
сохраняют моющее действие в
жесткой и даже морской воде, так как
образующиеся при этом кальциевые и
магниевые соли растворимы. СМС
входят в состав разнообразных
стиральных порошков.
48
49.
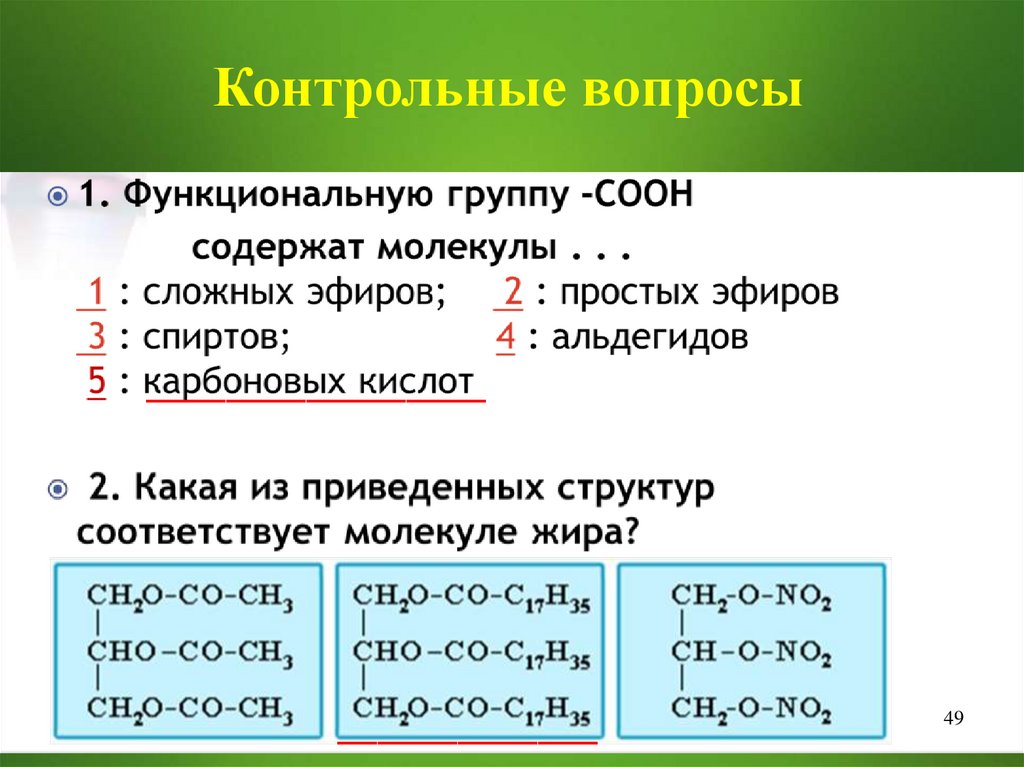
Контрольные вопросы_________________
_____________
49
50.
Домашнее заданиеСоставьте структурные
Выучить тривиальные
формулы следующих
названия низших
карбоновых кислот:
карбоновых кислот.
1. 3-этилоктановая кислота Напишите уравнения
2. метилпропановая кислота реакций следующих
3. 3,5,5 – триметилгесановая превращений:
кислота
Этан – хлорэтан –
4. 2-метил-3-этилгептановая - этанол – этаналь –
кислота
-уксусная кислота
5. 2,4-диметилпентановая
кислота
50
51. Источники
► Учебник по химиии 11 класс Новошинский,Новошинская.
► http://chemistrychemists.com/N6_2011/U1/ChemistryAndChemists_6_2011
-U1-6.html
► http://ppt4web.ru/khimija/karbonovye-kisloty2.html
► http://www.chemistry.ssu.samara.ru/vrml/link19.htm
► http://mscience.ru/edu_articles/ochemistry_articles/171klassifikaciya-i-nomenklatura-karbonovyhkislot.html(таблицы)
► www.alhimic.ucoz.ru/load/26-1-0-39
► www.alleng.ru/edu/chem1.htm
► www.uchportal.ru/load/60-1-0-9056
51
52.
Проект по химиипо разделу:
«Функциональные
производные
Подготовили ученики
углеводородов» на тему:
11 «А» кл. МБОУ СОШ№65:
«Альдегиды. Карбоновые
кислоты и их производные» Сенная Наталья
Альшанова Кристина
Ермакова Анна
Витязева Елизавета
52
Скибин Максим






























 chemistry
chemistry








