Similar presentations:
Положение железа в периодической системе химических элементов Д.И. Менделеева
1.
Презентация по химии для 9 классов:«Метапредметный урок химии»
Учитель химии, биологии
Школы№277
Кировского района
Комалетдинова Фарида Мансуровна
Санкт-Петербург 2024
1
2.
Метапредметный урокМетапредметный урок — это урок, целью которого
является ориентация на тесную связь обучения с
непосредственными жизненными потребностями,
интересами и социокультурным опытом учащихся,
умение учиться, т. е. способность ученика к
саморазвитию и самосовершенствованию, создание
условий для активизации мыслительных процессов
ребёнка.
2
3.
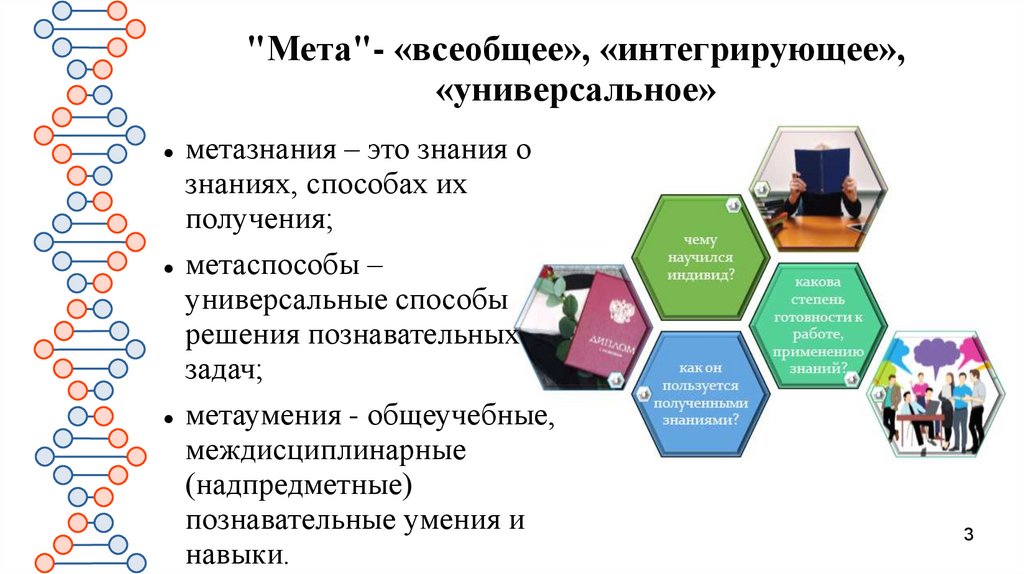
"Мета"- «всеобщее», «интегрирующее»,«универсальное»
метазнания – это знания о
знаниях, способах их
получения;
метаспособы –
универсальные способы
решения познавательных
задач;
метаумения - общеучебные,
междисциплинарные
(надпредметные)
познавательные умения и
навыки.
3
4.
УДД регулятивные, познавательные,коммуникативные
регулятивные - обеспечивают возможность управления познавательной и
учебной деятельностью посредством постановки целей, планирования,
контроля, коррекции своих действий, оценки успешности усвоения;
познавательные - включают действия исследования, поиска, отбора и
структурирования необходимой информации, моделирование изучаемого
содержания;
коммуникативные - обеспечивают возможности сотрудничества: умение
слышать, слушать и понимать партнера, планировать и согласованно
выполнять совместную деятельность, распределять роли, взаимно
контролировать действия друг друга, уметь договариваться, вести дискуссию,
правильно выражать свои мысли, оказывать поддержку друг другу и
эффективно сотрудничать как с учителем, так и со сверстниками.
4
5.
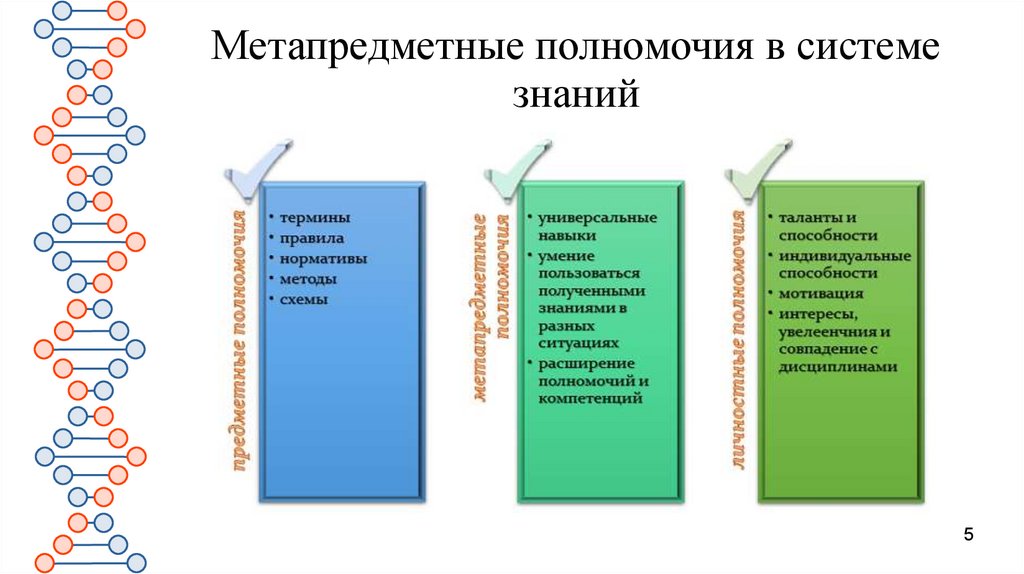
Метапредметные полномочия в системезнаний
5
6.
Железо в космосе.Мотивация: тема урока создаёт проблемную ситуацию
Проблемная ситуация:
Что будет если все месторождения железа иccякнут?
Железо чаще всего встречается в газообразной форме в звездах
(например, на Солнце), и в более конденсированной форме на скалистых
планетах, составляя ядро (Меркурий ядро -83%).
Наличие гематита — соединения из оксида железа— было впервые
зафиксировано на Марсе в 2010 году в кратере у подножия горы Шарп.
Ученые Технологического университета Суинберна предложили способ
добычи железа на Марсе, в котором используется солнечный свет, реголит
и атмосферный углекислый газ (Acta Astronautica).
6
7.
Цели и задачи урокаЦели: ознакомить с положением железа в периодической системе химических
элементов Д. И. Менделеева, строением атома, природными месторождениями,
соединениями; с современными методами получения, применения, выявить связь
химических свойств и биологических функций в железа в организме;
Задачи: способствовать формированию научного мировоззрения, развитию
логического мышления детей и воспитанию интереса к предмету, истории
развития науки.
Тип урока: «открытие» новых знаний.
7
8.
Логика построения урокаМотивация → актуализация опорных знаний →
восприятие, осмысление →
→ проверка усвоения → закрепление → анализ,
самоанализ.
Рис.1 Железо на поверхности Марса
8
9.
Планируемые результатыПланируемые результаты:
личностные: проявление учебно-познавательного интереса к теме урока; развитие навыков
общения, умения находить выходы из спорных ситуаций; развитие мотивов учебной деятельности
и формирование личностного смысла учения;
метапредметные:
регулятивные УУД: определять и формулировать тему и цели урока, ставить учебнопознавательную задачу и сохранять ее до конца учебных действий; планировать свои действия;
оценивать результаты своей деятельности и умение находить свои ошибки;
познавательные УУД: понимать учебную информацию, классифицировать ее и находить
необходимую информацию из учебника и другой литературы;
коммуникативные УУД: уметь грамотно строить устную и письменную речь, анализировать и
обосновывать свою точку зрения;
предметные: применять полученные знания о железе и его соединениях, знать физические и
химические свойства, уметь проводить качественные реакции на ионы железа двух- и
трехвалентного и распознавать опытным путем ионы железа, экспериментально доказывать
амфотерность соединений железа, знать биологическую роль железа в организме.
10.
«Месторождения железа»Первое железо, используемое человеком было
космического происхождения. Железные
метеориты содержат 91 % железа, 8,4 % —
никеля, кобальта — 0,6 %.
Железо входит в состав большинства горных
пород. Для получения железа используют
железные руды с содержанием железа 30–70 % и
более.
Крупные промышленные месторождения
минерала магнетит в России располагаются в
Курской Магнитной Аномалии, в Мурманской
области (месторожднние Ковдор), на Урале
(Магнитогорск).
(Ученик показывает и называет месторождения
соединений железа на рис. 3)
Рис.2 Метеоритное железо
Рис.3 Месторождения соединений
железа.
10
11.
Железо в рудемагнетит Fe3O4 — содержит 72 % железа;
гематит Fe2O3 — содержит до 65 % железа;
Криворожский район (Украина);
лимонит Fe2O3 nH2O — содержит 60 % железа;
месторождения в Крыму;
пирит FeS2 — содержит примерно 47 % железа;
месторождения пирита Урал.
11
12.
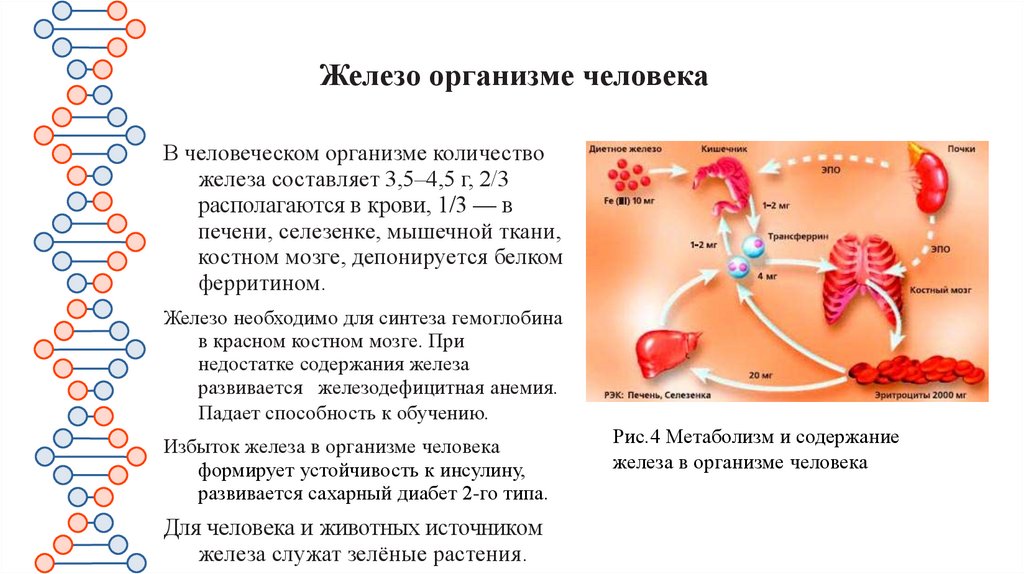
Железо организме человекаВ человеческом организме количество
железа составляет 3,5–4,5 г, 2/3
располагаются в крови, 1/3 — в
печени, селезенке, мышечной ткани,
костном мозге, депонируется белком
ферритином.
Железо необходимо для синтеза гемоглобина
в красном костном мозге. При
недостатке содержания железа
развивается железодефицитная анемия.
Падает способность к обучению.
Избыток железа в организме человека
формирует устойчивость к инсулину,
развивается сахарный диабет 2-го типа.
Для человека и животных источником
железа служат зелёные растения.
Рис.4 Метаболизм и содержание
железа в организме человека
13.
Дефицит железа снижает способность к обучениюВ условиях дефицита железа, количество
или чувствительность Д2-рецепторов
снижается, следовательно и допамина.
Допамин является ингибитором
опиатов. (Youdim с соавторами,
1989).Эндогенные опиатные пептиды
вовлечены в процессы памяти и
обучения, так как введение таких
пептидов вызывает амнезию и
забывчивость (Pablo, 1983 и 1985).
Влияние Д2-рецепторов на процесс
обучения: Yehuda с соавторами (1988)
показал, что у крыс с недостатком
железа наблюдается увеличение
опиатных пептидов и снижено
обучение.
Таким образом дефицит железа снижает
количество Д2-рецепторов и допамина,
Рис. 5 Дефицит железа и способность к
обучению
14.
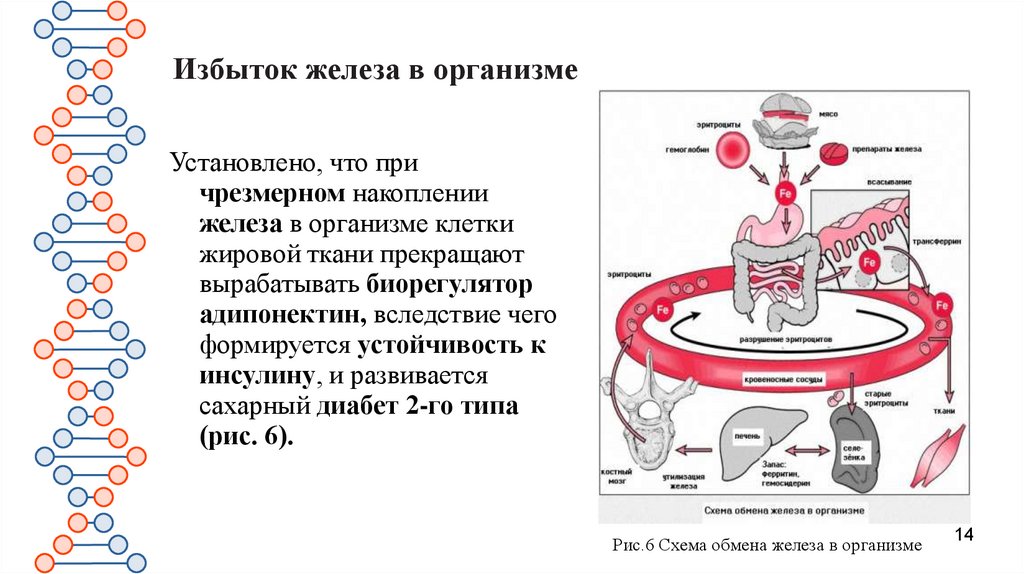
Избыток железа в организмеУстановлено, что при
чрезмерном накоплении
железа в организме клетки
жировой ткани прекращают
вырабатывать биорегулятор
адипонектин, вследствие чего
формируется устойчивость к
инсулину, и развивается
сахарный диабет 2-го типа
(рис. 6).
Рис.6 Схема обмена железа в организме
14
15.
Аллотропные модификацииЗадание 7. Вспомните, что
называют аллотропией и
аллотропными модификациями.
Железо может существовать в двух
аллотропных модификациях,
различающихся кристаллическими
решетками.
При низкой температуре устойчиво
альфа-Fе с объемноцентрированной кубической (ОЦК)
решеткой.
При температуре выше 910
градусов — гамма-Fе с
гранецентрированной кубической
Рис.7 Аллотропные модификации:
альфа-Fе, гамма-Fе.
16.
Визитная карточка железа.Задание 1. Определить положение
железа в периодической системе
химических элементов
Д. И. Менделеева.
Составить по плану визитную
карточку железа:
период, группа;
подгруппа;
порядковый номер;
атомная масса;
число электронов;
число протонов и нейтронов.
Визитная карточка железа.
Железо расположено в 4-м периоде
(большом), четном ряду,
8 группе, Б подгруппе (побочной),
порядковый номер — 26;
атомная масса Ar Fe=56;
состав атома: 26 протонов;
30 нейтронов;
26 электронов.
16
17.
Схема строения атомаЗадание 2. Напишите схему строения
атома железа, его электронную
формулу и распределение электронов
по энергетическим уровням,
проверьте правильность, устраните
ошибки, воспользуйтесь учебником.
Схема строения атома:
+26 ) ) ) )
2e 8e 14e 2e
Электронная формула:
Рис.8 Распределение электронов по
энергетическим уровням железа.
1s22s22 p63s23 p63d64s2.
17
18.
Распределение электронов по энергетическим уровням:Задание 3. Проанализируйте
схему распределения электронов
по энергетическим уровням.
Где расположены валентные
электроны на последнем или
предпоследнем слоях?
Подготовьте ответ и обоснуйте его.
Валентные электроны
расположены на последнем и
предпоследних слоях, т. к. это
элемент побочной подгруппы.
Железо относят к d-элементам,
оно входит в состав триады
металлов: Fе,Со, Ni
18
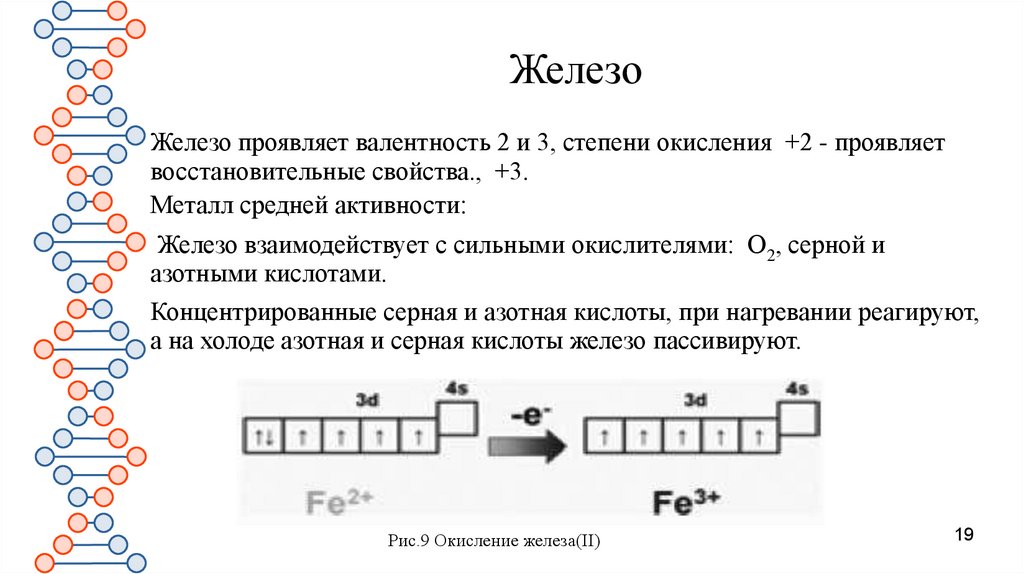
19.
ЖелезоЖелезо проявляет валентность 2 и 3, степени окисления +2 - проявляет
восстановительные свойства., +3.
Металл средней активности:
Железо взаимодействует с сильными окислителями: O2, серной и
азотными кислотами.
Концентрированные серная и азотная кислоты, при нагревании реагируют,
а на холоде азотная и серная кислоты железо пассивируют.
Рис.9 Окисление железа(II)
19
20.
Физические свойства железаПластичный серебристо-серый
металл, обладающий
магнитными свойствами.
Железо относится к тяжёлым
тугоплавким металлам.
Плотность - 7,874 г/см³
Температура плавления — 1539
°C.
В ряду активности железо
располагается до водорода,
относится к металлам
средней активности.
Рис. 10 Магнитные свойства железа.
21.
Общие характеристики оксидов и гидроксидов железаОксид железа (II) (FeO) — чёрное
кристаллическое вещество,
нерастворимое в воде, проявляет
свойства основания. Легко окисляется на
воздухе и превращается в более
Оксиду и гидроксиду железа (III) характерны
устойчивый оксид железа (III).
слабые амфотерные свойства.
Оксид железа (III) (Fe2O3) — красноСоединения двухвалентного железа –
коричневый нерастворимый в воде
восстановители, т. е. в реакциях они
порошок, обладает амфотерными
отдают электроны элементам. Они
свойствами. Реагирует с кислотами с
просто окисляются на воздухе.
образованием солей железа (III), при
Соединения трехвалентного железа –
сплавлении — со щелочами, образуя
окислители. Они длительное время
ферриты.
могут находиться в растворе.
Оксид и гидроксид железа (2)
взаимодействуют с растворами кислот,
но не реагируют со щелочами. Т. е. они
обладают основными свойствами.
Оксид железа (II, III) (железная окалина) —
двойной оксид с формулой Fe3O4 или
FeO⋅Fe2O3, образуется при нагревании 21
железа на воздухе.
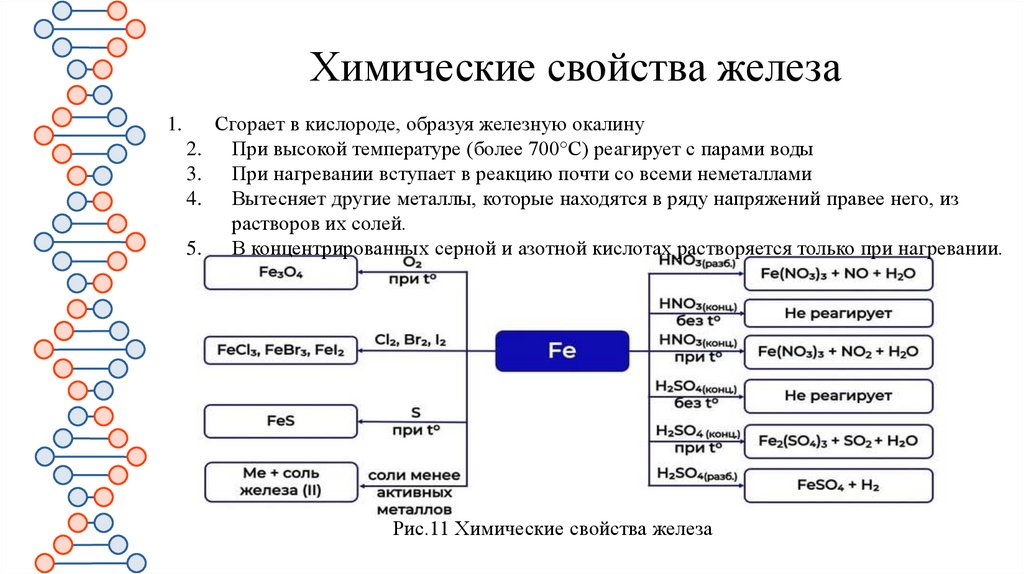
22.
Химические свойства железа1.
Сгорает в кислороде, образуя железную окалину
2. При высокой температуре (более 700°C) реагирует с парами воды
3. При нагревании вступает в реакцию почти со всеми неметаллами
4. Вытесняет другие металлы, которые находятся в ряду напряжений правее него, из
растворов их солей.
5. В концентрированных серной и азотной кислотах растворяется только при нагревании.
Рис.11 Химические свойства железа
23.
Амфотерность железаОксиду и гидроксиду железа (III) характерны слабые амфотерные свойства.
Fe2O3 - оксид железа (III) красно-коричневый нерастворимый в воде порошок, может
существовать в трех формах – α, β, γ.
С кислотами Fe2O3 + 6 HCl = 2 FeCl3 + 3 H2O образуется хлорид железа
С твердыми щелочами при нагревании Fe2O3 + NaOH = 2 NaFeO2 + H2O феррат натрия
С карбонатами щелочных металлов при нагревании Fe2O3 + Na2CO3 = 2 NaFeO2 + CO2
Fe(OH)3 - гидроксид железа (III) бурое рыхлое вещество, обладает амфотерными
свойствами.
С разбавленными кислотами Fe(OH)3 + 3 HCl = FeCl3 + 3 H2O
С концентрированными растворами щелочей при нагревании
Fe(OH)3 + 3 NaOH = Na3[Fe(OH)6 ]
24.
Качественные реакции на ионы железаFe2+ и Fe3+
Для определения катиона железа (II) используется гексацианоферрат (III)
калия K3[Fe(CN)6] красная кровяная соль.
2К3[Fe(CN)6] + 3FeSO4 = Fe3[Fe(CN)6]2↓ + 3K2SO4
При этом выпадает тёмно-синий осадок турнбулевой сини.
Реактивом на катион железа III является гексацианоферрат(II) калия K4[Fe(CN)6] желтая
кровяная соль, при этом образуется темно-синий осадок берлинской лазури:
3К4[Fe(CN)6] + 4FeCl3 = Fe4[Fe(CN)6]3↓ + 12KCl
Также качественной реакцией на железо(III) могут служить растворы роданидов аммония
NH4SCN или калия KSCN, образуется малодиссоциирующее вещество роданид
железа кроваво красного цвета:
3KSCN + FeCl3 = Fe(SCN)3 + 3KCl
25.
Качественная реакция на ионы железа +2Качественная реакция на ионы железа (II)
Взаимодействие
ГЕКСАЦИАНОФЕРРАТА КАЛИЯ и
СУЛЬФАТА ЖЕЛЕЗА. При этом
образуется синий осадок «турбуленова
синь» Опыты по химии. Эксперименты.
Турбуленова синь.
Опыт №1 Реакция ГЕКСАЦИАНОФЕРРАТА
КАЛИЯ с раствором СУЛЬФАТА
ЖЕЛЕЗА. Опыты по химии.
https://youtu.be/x2xgyXHaJ
Турбуленова_синь
26.
Взаимодействие с желтой кровяной солью ионы железа +3Качественная реакция на ионы железа (III)
Взаимодействие с желтой кровяной солью
K4[Fe(CN)6] ионы железа +3. При этом
образуется синий осадок «берлинская лазурь»
Опыт №2 Взаимодействия раствора хлорида железа
(III) с раствором гексацианоферрата (II) калия
- https://youtu.be/phLXaltOG8E Берлинская
лазурь
В последнее время получены данные, которые
свидетельствуют, что молекулы берлинской
лазури идентичны по строению молекулам
турнбулевой сини. Состав молекул обоих этих
веществ можно выразить
формулой Fe4[Fe2(CN)6]3
Берлинская лазурь
27.
Качественная реакция на ион Fe3 Реактив — роданид калия KSCN.Опыт № 3. Качественная реакция на
ион Fe3 Реактив — роданид калия
KSCN.
К раствору хлорида железа(III)
добавить одну каплю раствора
роданида калия (KSCN).
В результате образовался интенсивнокрасный цвет: FeCl3 3KSCN
Fe SCN 3 3KCl
Результат опыта — образование темнокрасного цвета роданида железа
трехвалентного
https://youtu.be/LDEwrk6Akrc
https://youtu.be/LDEwrk6Akrc
Роданид_железа
28.
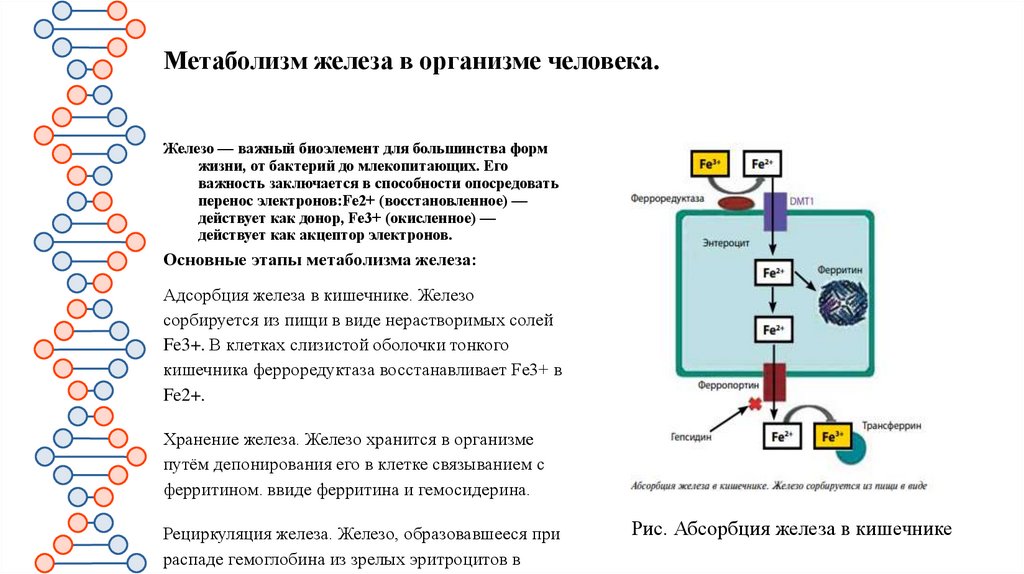
Метаболизм железа в организме человека.Железо — важный биоэлемент для большинства форм
жизни, от бактерий до млекопитающих. Его
важность заключается в способности опосредовать
перенос электронов:Fe2+ (восстановленное) —
действует как донор, Fe3+ (окисленное) —
действует как акцептор электронов.
Основные этапы метаболизма железа:
Адсорбция железа в кишечнике. Железо
сорбируется из пищи в виде нерастворимых солей
Fe3+. В клетках слизистой оболочки тонкого
кишечника ферроредуктаза восстанавливает Fe3+ в
Fe2+.
Хранение железа. Железо хранится в организме
путём депонирования его в клетке связыванием с
ферритином. ввиде ферритина и гемосидерина.
Рециркуляция железа. Железо, образовавшееся при
распаде гемоглобина из зрелых эритроцитов в
Рис. Абсорбция железа в кишечнике
29.
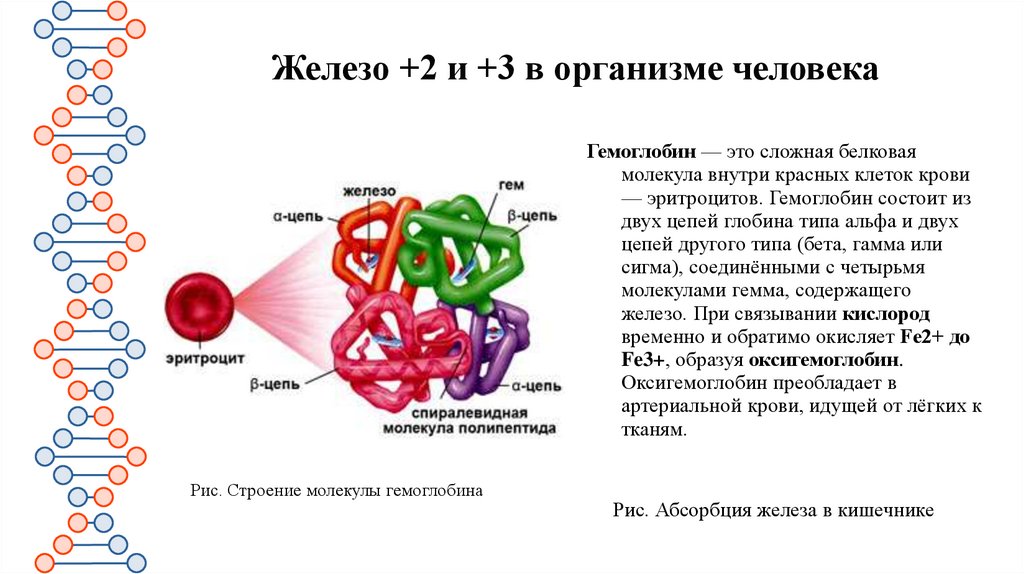
Железо +2 и +3 в организме человекаГемоглобин — это сложная белковая
молекула внутри красных клеток крови
— эритроцитов. Гемоглобин состоит из
двух цепей глобина типа альфа и двух
цепей другого типа (бета, гамма или
сигма), соединёнными с четырьмя
молекулами гемма, содержащего
железо. При связывании кислород
временно и обратимо окисляет Fe2+ до
Fe3+, образуя оксигемоглобин.
Оксигемоглобин преобладает в
артериальной крови, идущей от лёгких к
тканям.
Рис. Строение молекулы гемоглобина
Рис. Абсорбция железа в кишечнике
30.
ПолучениеСпособ получения железа при воздействии алюминия на оксид железа(ІІІ)
называется алюминотермией:
Fe2O3 + 2Al = Al2O3 + 2Fe
Пирометаллургия — восстановление металлов из руды при повышенной
температуре с помощью восстановителей.
Вопрос. Какие восстановитель железа вы знаете?
Ответ. Восстановителями являются СО и H2 :
Fe2O3 + 3CO = 2Fe + 3CO2
Fe2O3 + 3H2 = 2Fe + 3H2O
Окислитель — ион железа со С.О.+3
30
31.
Выполнить задание с кратким ответом.Семь металлов в древности соотносили с семью известными
планетами. Установите соответствие между металлом и планетой. Ответ дайте в
виде цифр, соответствующих буквам по алфавиту.
Планета
Металл
1) Меркурий
а) Золото
2) Солнце
б) Серебро
3) Луна
в) Ртуть
4) Марс
г) Медь
5) Венера
д) Железо
31
32.
Выполнить задание с кратким ответом.Установите соответствие между металлом и прилагательным
2. Установите соответствие между металлом и прилагательным,
подходящим для описания его свойств. Ответ дайте в виде
последовательности цифр, соответствующих буквам по алфавиту.
Металл
Свойство
а) Золото
1) Ядовитый
б) Серебро
2) Тугоплавкий
в) Ртуть
3) Серебристый
г) Железо
4) Желтый
32
33.
Выполните заданияВ состав
гемоглобина крови
человека входит:
Химическое
соединение Fe O3 4
называется:
Химическое
соединение FeS2
называется:
а) железо; б) медь;
в) золото.
а) магнетит; б)
лимонит; в) пирит
а) магнетит; б)
гематит; в) пирит.
33
34.
Ключевая особенность метапредметногорезультата
Ключевая особенность метапредметного
результата - нацеленость на развитие
способностей, в то время как результат
традиционного обучения – это знания,
умения и навыки.
34
35.
Домашнее заданиеПрочитайте § 36 страницы 183-189
Ответьте на вопрос: 2(устно), 3(письменно),
Решить задачу 6 на странице189,
Повторите п.34-35,выполните задания для
повторения п. 39 задания 1-4 (письменно) с.207.
36.
ЛитератураЖурин А.А., Заграничная Н.А. Химия: метапредметные результаты обучения. 8-11 классы. – М.: ВАКО, 2014. – 208 с. –
(Мастерская учителя химии).
Железная руда на Марсе https://scientificrussia.ru/articles/na-marse-est-zheleznaya-ruda#
https://ug.ru/nauchite-menya-kak/ - Учительская газета, №33 от 18 августа 2020 Научите меня – как. Автор: Светлана
ЩЕРБАКОВА
https://vbudushee.ru/library/kompetentsii-4k-formirovanie-i-otsenka-na-uroke-prakticheskie-rekomendatsii/ Компетенции
«4К»: формирование и оценка на уроке. Практические рекомендации
DissHelp https://disshelp.ru/blog/razbiraemsya-v-osnovnyh-parametrah-programm-po-fos-lichnostnye-metapredmetnye-ipredmetnye-rezultaty-obucheniya/ - РАЗБИРАЕМСЯ В ОСНОВНЫХ ПАРАМЕТРАХ ПРОГРАММ ПО ФОС:
ЛИЧНОСТНЫЕ, МЕТАПРЕДМЕТНЫЕ И ПРЕДМЕТНЫЕ РЕЗУЛЬТАТЫ ОБУЧЕНИЯ
Источник: https://disshelp.ru/blog/razbiraemsya-v-osnovnyh-parametrah-programm-po-fos-lichnostnye-metapredmetnye-ipredmetnye-rezultaty-obucheniya/
© DissHelp.ru - Своевременная помощь студентам и аспирантам
36
37.
Литератураhttps://chem.ru/tiocianat-zheleza-ii.html -chem.ru
https://chemege.ru/iron/
https://dzen.ru/a/Ye0CIoAJ2WcnRsnC - турбуленова синь
https://www.scientific.ru/journal/news/2012/1012/n281012.html Новости науки 28.10.12. Почему избыток
железа в организме вызывает сахарный диабет?
https://youtu.be/MqVPfotr7ek - На сколько легкая форма анемия действительно легкая?
https://medi.ru/info/4965/ -Medi.ru
ВартанянА. А Метаболизм железа, ферроптоз, рак А. А. РОССИЙСКИЙ БИОТЕРАПЕВТИЧЕСКИЙ
ЖУРНАЛ Russian journal of biotherapy 3'2017 ТОм 16 vol. 16 https://new-science.ru/3-raznyh-tipa-
magnitov-i-ih-primenenie/- New-Science.ru 3 разных типа магнитов и их применение
23.08.2019
38.
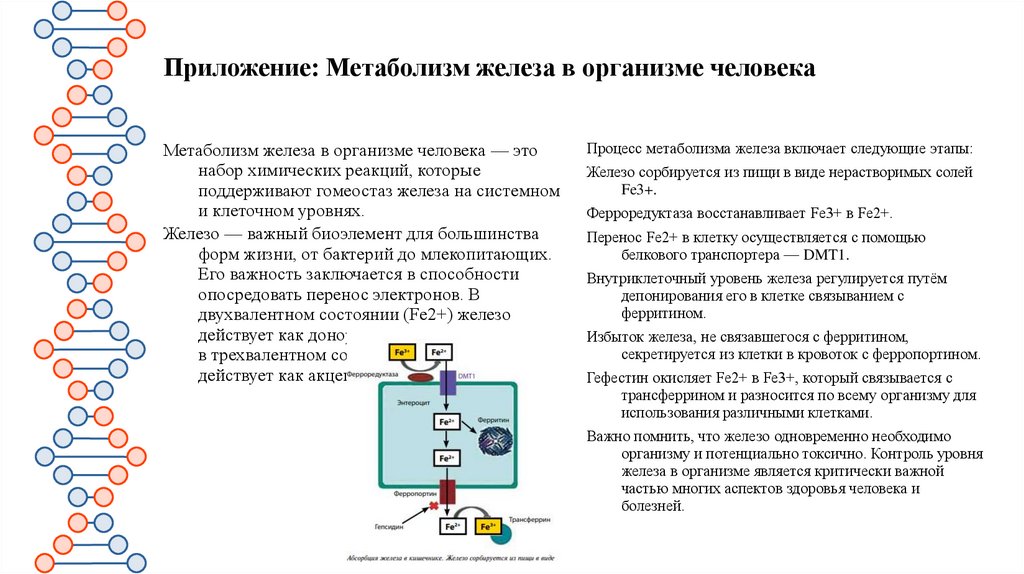
Приложение: Метаболизм железа в организме человекаМетаболизм железа в организме человека — это
набор химических реакций, которые
поддерживают гомеостаз железа на системном
и клеточном уровнях.
Железо — важный биоэлемент для большинства
форм жизни, от бактерий до млекопитающих.
Его важность заключается в способности
опосредовать перенос электронов. В
двухвалентном состоянии (Fe2+) железо
действует как донор электронов, в то время как
в трехвалентном состоянии (Fe3+) оно
действует как акцептор.
Процесс метаболизма железа включает следующие этапы:
Железо сорбируется из пищи в виде нерастворимых солей
Fe3+.
Ферроредуктаза восстанавливает Fe3+ в Fe2+.
Перенос Fe2+ в клетку осуществляется с помощью
белкового транспортера — DMT1.
Внутриклеточный уровень железа регулируется путём
депонирования его в клетке связыванием с
ферритином.
Избыток железа, не связавшегося с ферритином,
секретируется из клетки в кровоток с ферропортином.
Гефестин окисляет Fe2+ в Fe3+, который связывается с
трансферрином и разносится по всему организму для
использования различными клетками.
Важно помнить, что железо одновременно необходимо
организму и потенциально токсично. Контроль уровня
железа в организме является критически важной
частью многих аспектов здоровья человека и
болезней.
39.
Дефицит железа снижает способность к обучениюДопаминовые рецепторы. В условиях
дефицита железа, количество или
чувствительность Д2-рецепторов
снижается. (Youdim с соавторами,
1989).Области мозга, в которых, как
известно, концентрация железа наиболее
высокая, также имеют самую густую
сеть нейронов, специфически
реагирующих на опиатные пептиды
(энкефалины, эндорфины и т.д.). За
последние несколько лет стало
очевидным, что эндогенные опиатные
пептиды вовлечены в процессы памяти и
обучения, так как введение таких
пептидов вызывает амнезию и
забывчивость (Pablo, 1983 и 1985).
Влияние Д2-рецепторов на процесс
Рис. 1-5 Дефицит железа и способность к
обучению
40.
Метаболизм железа в организме человекаМетаболизм железа в организме человека — это
набор химических реакций, которые
поддерживают гомеостаз железа на системном
и клеточном уровнях.
Железо — важный биоэлемент для большинства
форм жизни, от бактерий до млекопитающих.
Его важность заключается в способности
опосредовать перенос электронов. В
двухвалентном состоянии (Fe2+) железо
действует как донор электронов, в то время как
в трехвалентном состоянии (Fe3+) оно
действует как акцептор.
У млекопитающих железо сорбируется из пищи в
виде нерастворимых солей в проксимальной
части тонкого кишечника. При нейтральных
рН Fe3+, поступающий из пищи, имеет очень
низкую растворимость,
и восстановление железа до Fe2+ существенно для
его абсорбции. Восстанавливает Fe3+ в Fe2+
ферроредуктаза (реакция Haber–Weiss): Fe3+
→ ферроредуктаза → Fe2+.
Процесс метаболизма железа включает следующие этапы:
Железо сорбируется из пищи в виде нерастворимых солей
Fe3+.
Ферроредуктаза восстанавливает Fe3+ в Fe2+.
Перенос Fe2+ в клетку осуществляется с помощью
белкового транспортера — DMT1.
Внутриклеточный уровень железа регулируется путём
депонирования его в клетке связыванием с
ферритином.
Избыток железа, не связавшегося с ферритином,
секретируется из клетки в кровоток с ферропортином.
Гефестин окисляет Fe2+ в Fe3+, который связывается с
трансферрином и разносится по всему организму для
использования различными клетками.
Важно помнить, что железо одновременно необходимо
организму и потенциально токсично. Контроль уровня
железа в организме является критически важной
частью многих аспектов здоровья человека и
болезней.
41.
Метаболизм железа в организме человекаМетаболизм железа в организме человека — это
набор химических реакций, которые
поддерживают гомеостаз железа на системном
и клеточном уровнях.
Железо — важный биоэлемент для большинства
форм жизни, от бактерий до млекопитающих.
Его важность заключается в способности
опосредовать перенос электронов. В
двухвалентном состоянии (Fe2+) железо
действует как донор электронов, в то время как
в трехвалентном состоянии (Fe3+) оно
действует как акцептор.
Процесс метаболизма железа включает следующие этапы:
Железо сорбируется из пищи в виде нерастворимых солей
Fe3+.
Ферроредуктаза восстанавливает Fe3+ в Fe2+.
Перенос Fe2+ в клетку осуществляется с помощью
белкового транспортера — DMT1.
Внутриклеточный уровень железа регулируется путём
депонирования его в клетке связыванием с
ферритином.
Избыток железа, не связавшегося с ферритином,
секретируется из клетки в кровоток с ферропортином.
Гефестин окисляет Fe2+ в Fe3+, который связывается с
трансферрином и разносится по всему организму для
использования различными клетками.
Важно помнить, что железо одновременно необходимо
организму и потенциально токсично. Контроль уровня
железа в организме является критически важной
частью многих аспектов здоровья человека и
болезней.
































 chemistry
chemistry








