Similar presentations:
Моноядерні арени
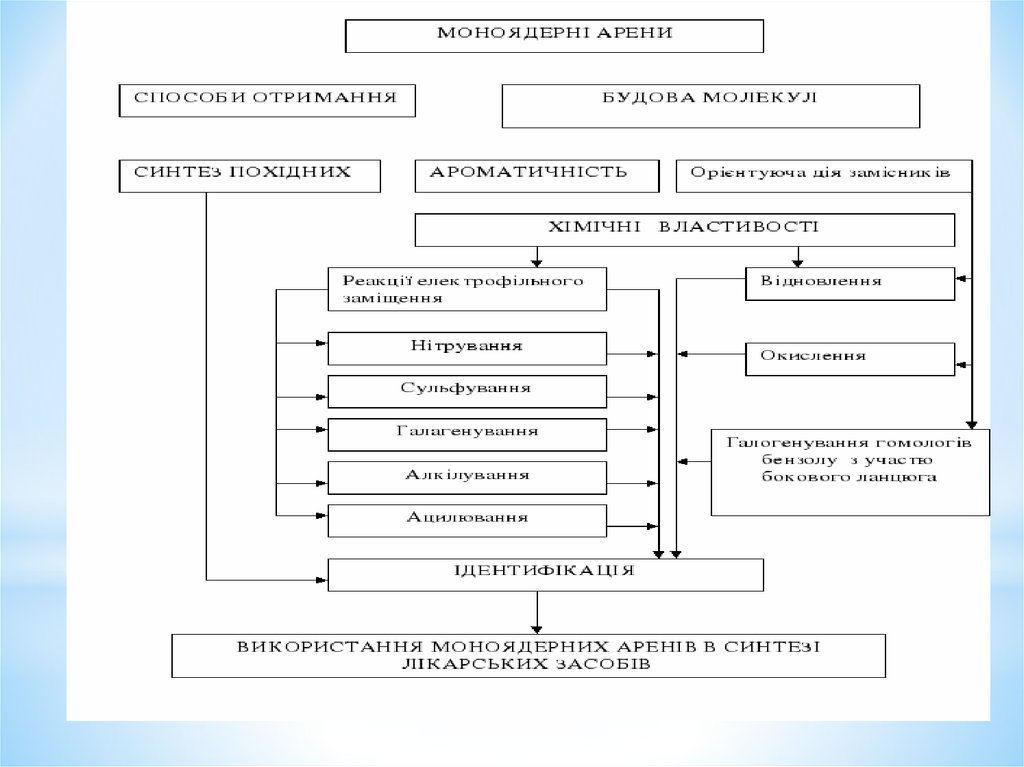
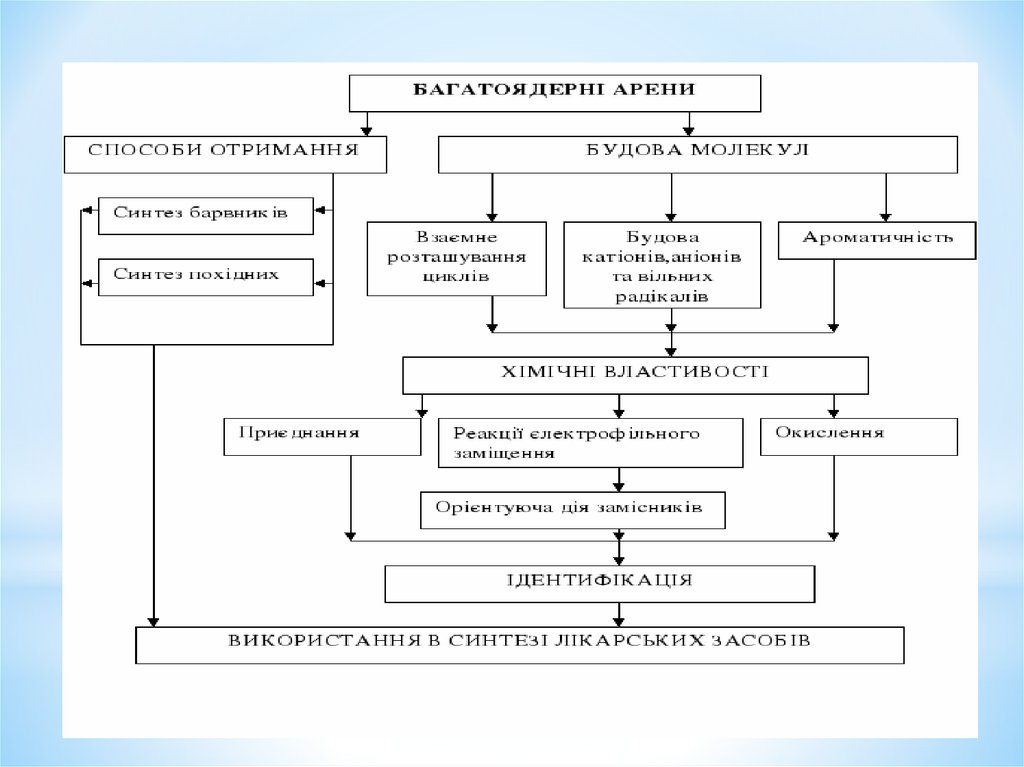
1. Моноядерні арени
*Моноядерні арени1
2.
План лекції1. Електронна будова бензолу. Ароматичні властивості.
Загальні критерії ароматичності.
2. Номенклатура та ізомерія моноядерних аренів.
3. Способи отримання моноядерних аренів:
4. Фізичні й хімічні властивості:
- реакції електрофільного заміщення (SE). Механізми
нітрування, сульфування
- галогенування, алкілування, ацилювання. Роль
каталізатора;
- реакції приєднання та окислення ;
- галогенування гомологів бензолу за участю бокового
ланцюга.
4. Вплив замісників у бензольному кільці на напрям та
швидкість реакцій електрофільного заміщення.
5. Узгоджена та неузгоджена орієнтація в дизаміщених
бензолу.
3.
4.
5.
Вуглеводні: ароматичніНазва класу
вуглеводню
Арени
Загальна Тип гібридизації
формула атома Карбону
СnН2n-6
Особливості
будови, закінчення
в назві
Основний
тип реакції
6 атомів С
SE ;
sp2, площинна, замкнуті в цикл, приєднання
6 -ароматична
жорстке
1200
система;
- ен
окислення
К ароматическим углеводородам относят соединения,
молекулы которых содержат одно или несколько
бензольных колец.
Совокупность специфических свойств бензола, а
именно высокая стабильность, инертность в реакциях
присоединения и склонность к реакциям замещения,
получила общее название «ароматичность»,
или «ароматические свойства».
6.
Вуглеводні: номенклатура та ізомеріяCH
CH3
CH2
CH3
CH3
стирен
(вінілбензен
толуен
(метилбензен)
о-ксилен
По
заместительной
номенклатуре
IUPAC (1,2-диметилбензен)
одноядерные арены рассматривают как продукты
замещения бензола
CH
CH2
феніл
бензил
бензиліден
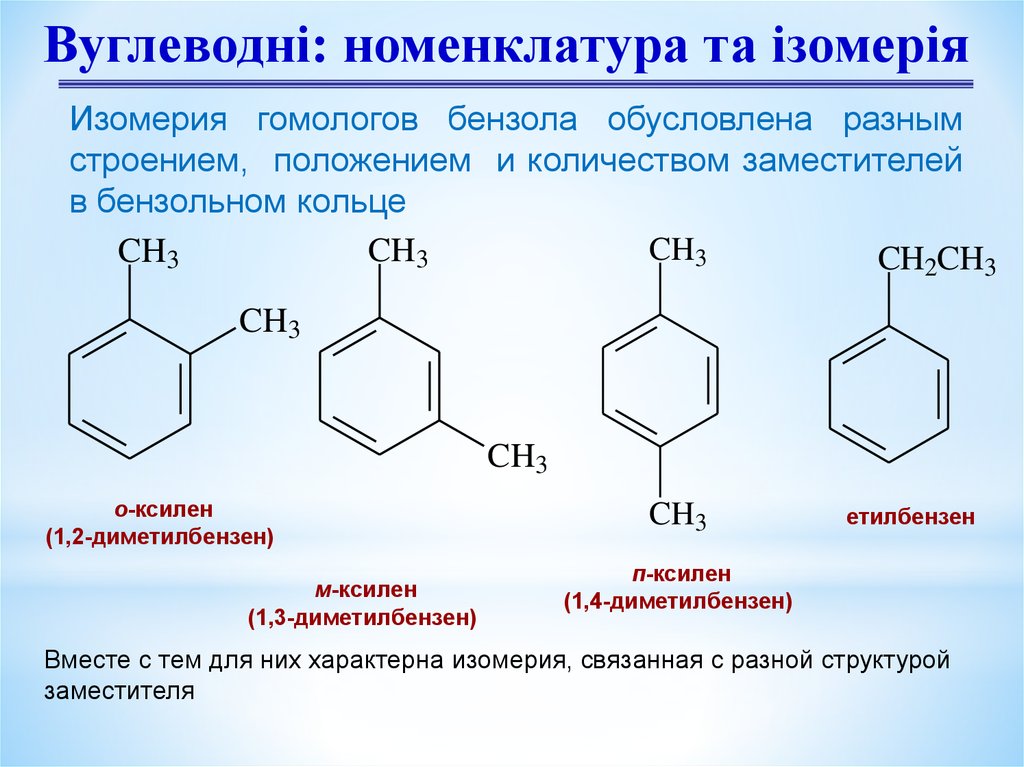
7.
Вуглеводні: номенклатура та ізомеріяИзомерия гомологов бензола обусловлена разным
строением, положением и количеством заместителей
в бензольном кольце
CH3
CH3
CH3
CH2CH3
CH3
CH3
о-ксилен
(1,2-диметилбензен)
м-ксилен
(1,3-диметилбензен)
CH3
етилбензен
п-ксилен
(1,4-диметилбензен)
Вместе с тем для них характерна изомерия, связанная с разной структурой
заместителя
8.
Вуглеводні: будова молекулАрени
H
H
C
H
C
C
C
C
H
H
C
H
H
H
H
C
C
C
C
C
H
C
H
H
6 електронів в
делокалізованому
зв язку
9.
Хімічні властивості: арениСогласно правилу Хюккеля критерием ароматичности
органического соединения является наличие в его
структуре плоского цикла, содержащего замкнутую
сопряженную систему, включающую (4n + 2)
π-электронов, где n = 0,1,2,3 и т. д.
Єлектрофільне заміщення:
Галогенування
Cl
+ Cl2
FeCl3, 25°C
+ HCl
хлорбензол
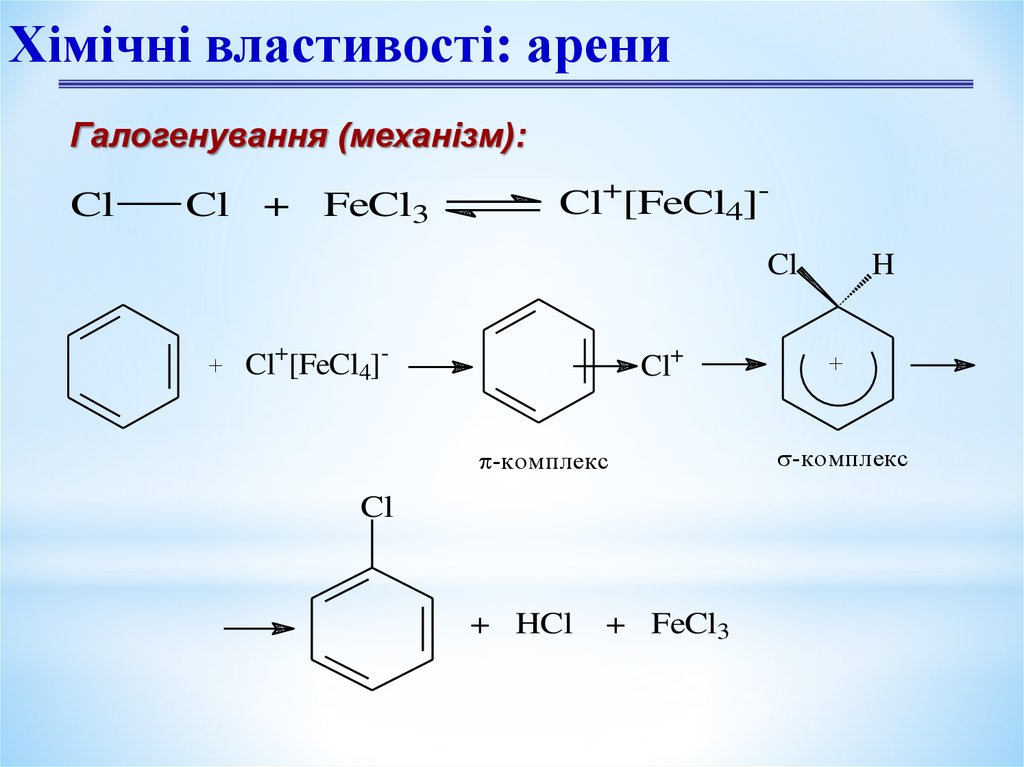
10.
Хімічні властивості: арениГалогенування (механізм):
Cl
Cl + FeCl3
Cl+[FeCl4]Cl
+
Cl+[FeCl4]-
Cl+
-комплекс
Cl
+ HCl
+ FeCl3
H
+
-комплекс
11.
Хімічні властивості: арениНітрування
Нитрованием называют процесс введения в молекулу
органического соединения нитрогруппы —NO2.
+ HNO3
NO2
H2SO4 (конц.)
+
H2O
нитробензол
HNO3 + 2H2SO4
+
NO2 + H3O+ + 2HSO4O2N
+
NO2+
NO2+
-комплекс
H
+
-комплекс
NO2
+ H+
12.
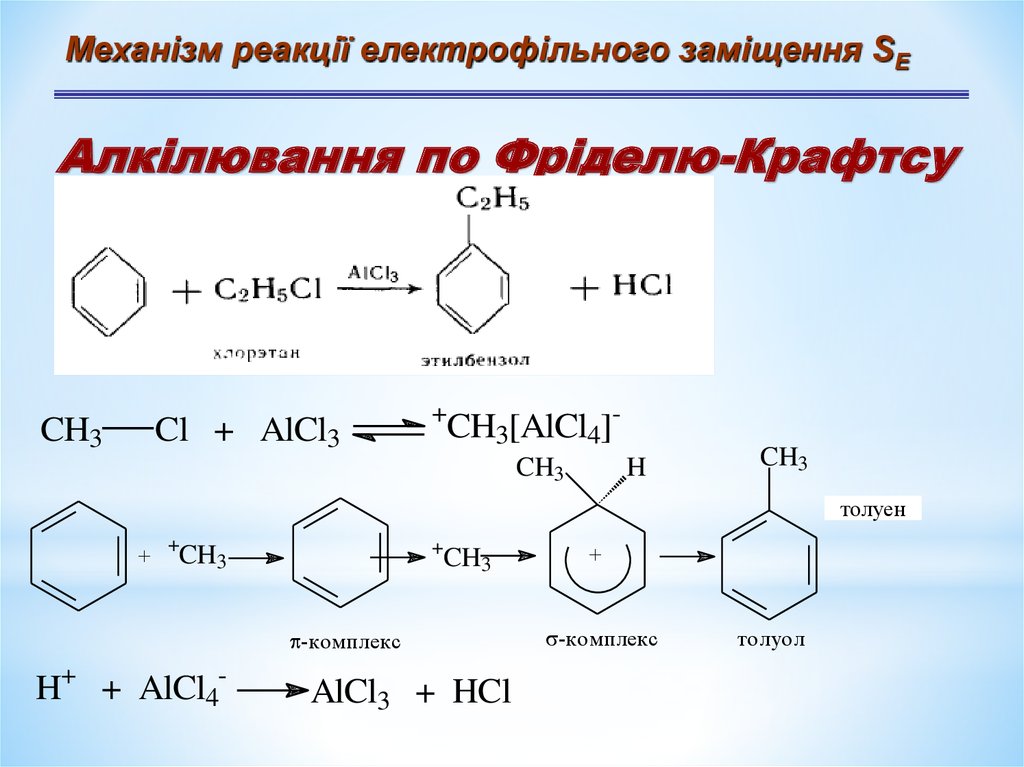
Механізм реакції електрофільного заміщення SЕАлкілювання по Фріделю-Крафтсу
CH3
Cl + AlCl3
+
CH3[AlCl4]CH3
H
CH3
толуен
+
+
+
CH3
CH3
-комплекс
H+ + AlCl4-
AlCl3 + HCl
+
-комплекс
толуол
13.
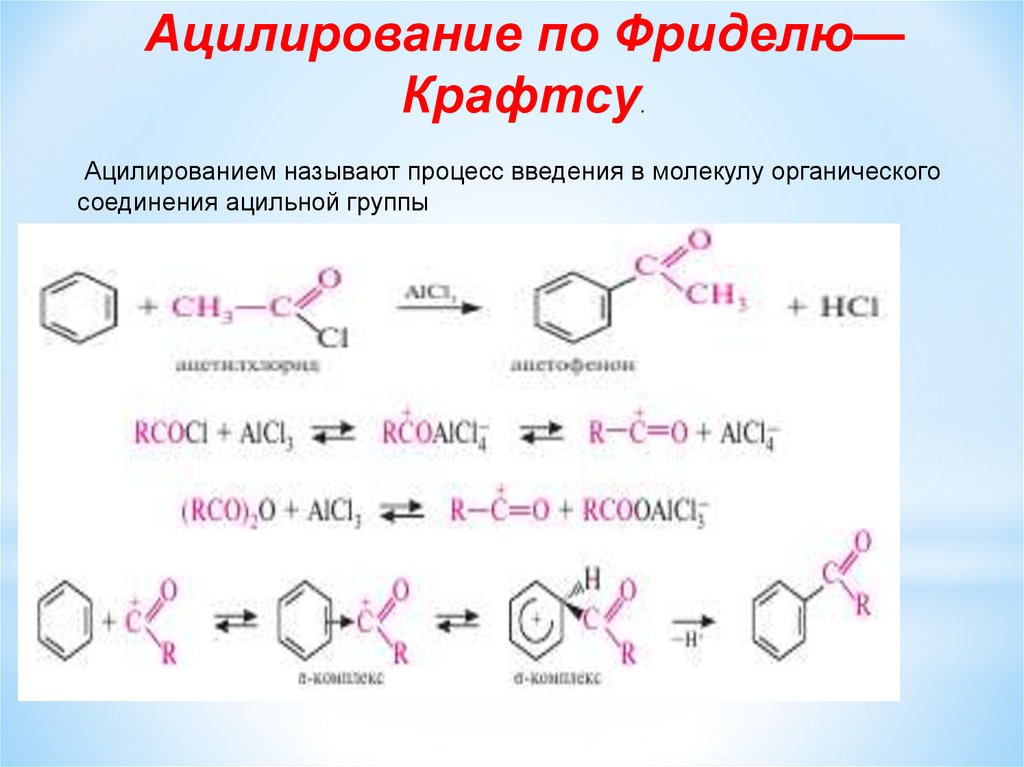
Ацилирование по Фриделю—Крафтсу.
Ацилированием называют процесс введения в молекулу органического
соединения ацильной группы
14. Механізм реакції електрофільного заміщення SЕ
*Механізм реакції електрофільного заміщення SЕ
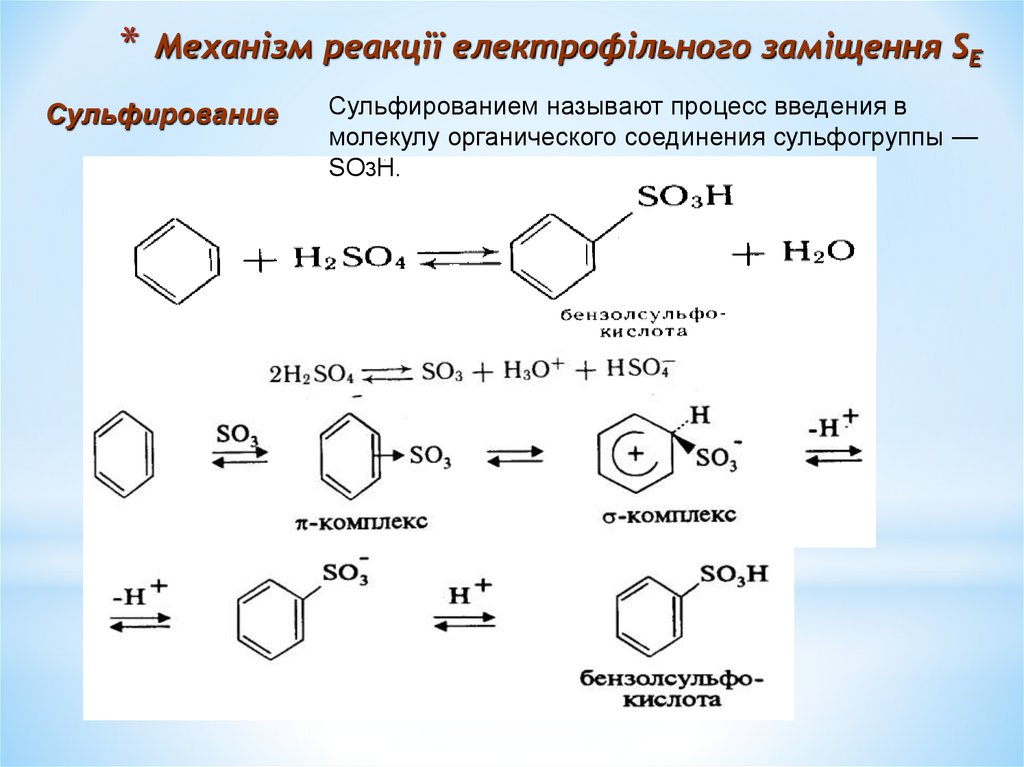
Сульфирование
Сульфированием называют процесс введения в
молекулу органического соединения сульфогруппы —
SO3H.
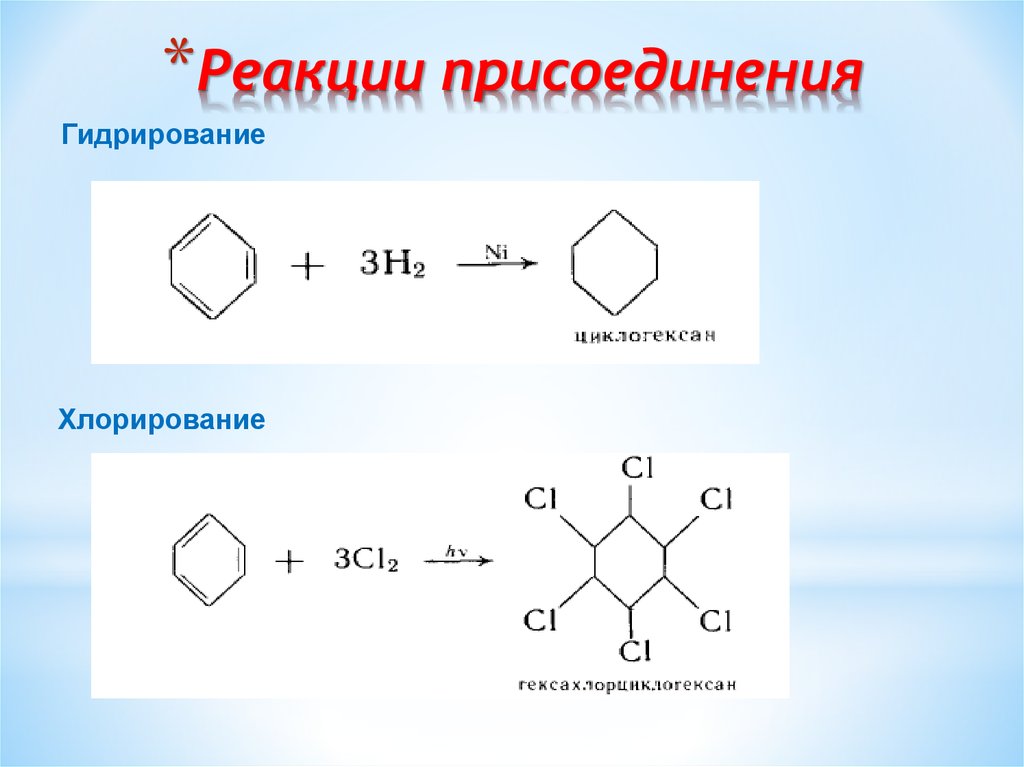
15. Реакции присоединения
*Реакции присоединенияГидрирование
Хлорирование
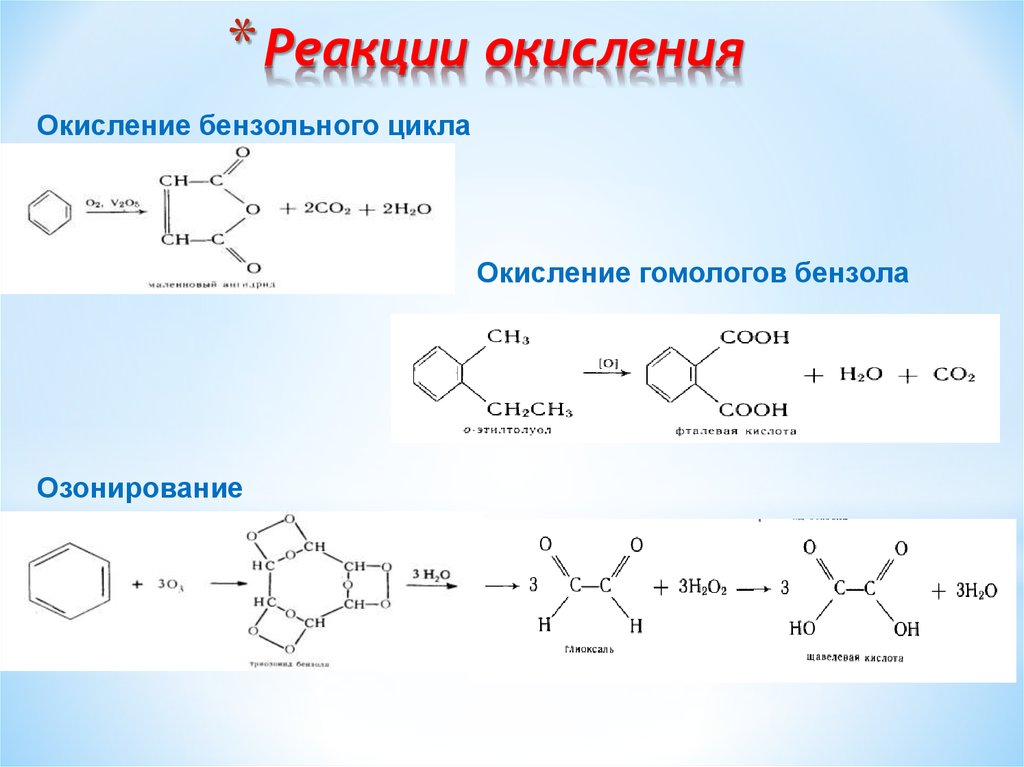
16. Реакции окисления
* Реакции окисленияОкисление бензольного цикла
Окисление гомологов бензола
Озонирование
17.
Правила орієнтації – замісники І родуЗамісники (орієнтанти) І роду – орто- і параположення:
Активуючі,
електронодонорні
властивості
–
пришвидшують реакцію SE:
А) —ОН, —OR, —OCOR, —SH, —NH2, —NHR
В) СН3, СН2СН3, СН2СН2СН3 та інші алкільні
радикали;
Дезактивуючі, електроноакцепторні властивості –
сповільнюють реакцію SE:
С) Hal ( F, Cl, Br, I)
18.
Правила орієнтації – замісники ІІ родуЗамісники (орієнтанти) ІІ роду – замісники
мета-положення:
—CN, —СООН, —SO3H, —СНО, —COR,
—COOR, —NO2 , —ССl3.
Заместители II рода уменьшают электронную плотность
в бензольном кольце и снижают скорость реакции
электрофильного
замещения
по
сравнению
с
незамещенным бензолом.
19.
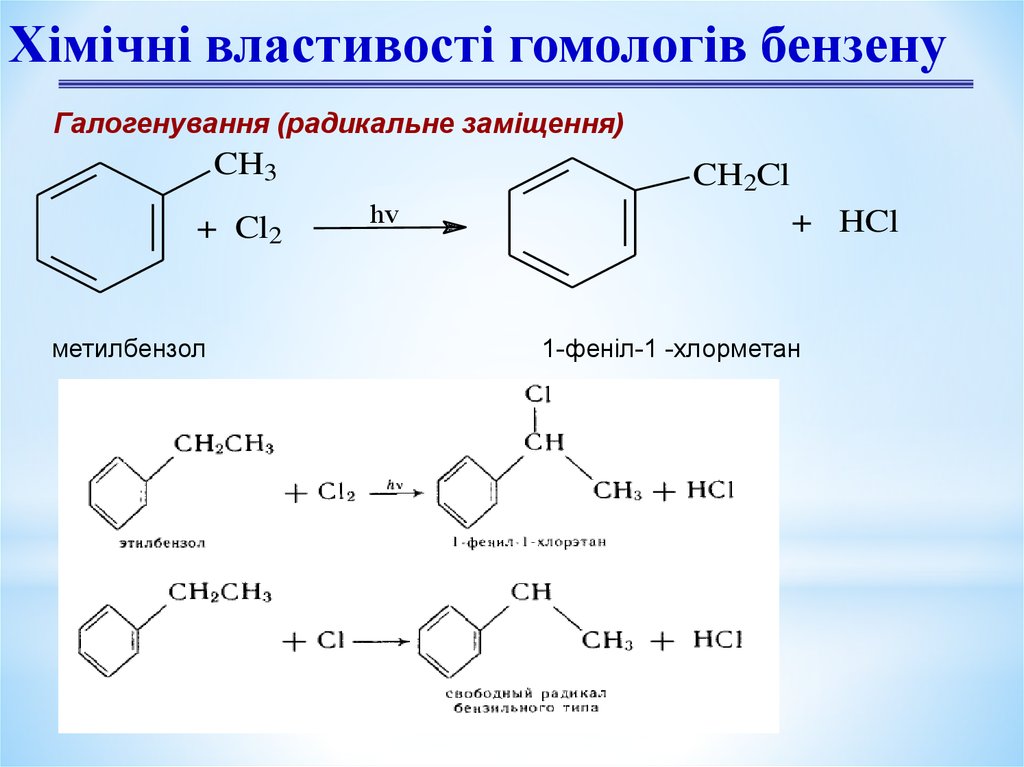
Хімічні властивості гомологів бензенуНітрування (радикальний механізм)
Реакція Коновалова
CH2NO2
CH3
HNO3
-H2O
метилбензол
1- фенил-1-нитрометан
20.
Хімічні властивості гомологів бензенуГалогенування (радикальне заміщення)
CH3
+ Cl2
метилбензол
CH2Cl
hv
+ HCl
1-феніл-1 -хлорметан
21.
Узгоджена та неузгодженаорієнтація
При согласованной ориентации оба имеющихся заместителя направляют
новую группу в одни и те же положения бензольного кольца.
Согласованная ориентация характерна для дизамещенных бензола, в
которых:
заместители находятся в мета-положении относительно друг друга и
принадлежат к ориентантам одного и того же рода (предпочтительные
места вхождения нового заместителя указаны стрелками)
заместители находятся в орто- или пара-положении по отношению друг
к другу, но один из них является заместителем I рода, а второй —
заместителем II рода.
COOH
Узгоджена
орієнтація
E+
Cl
22.
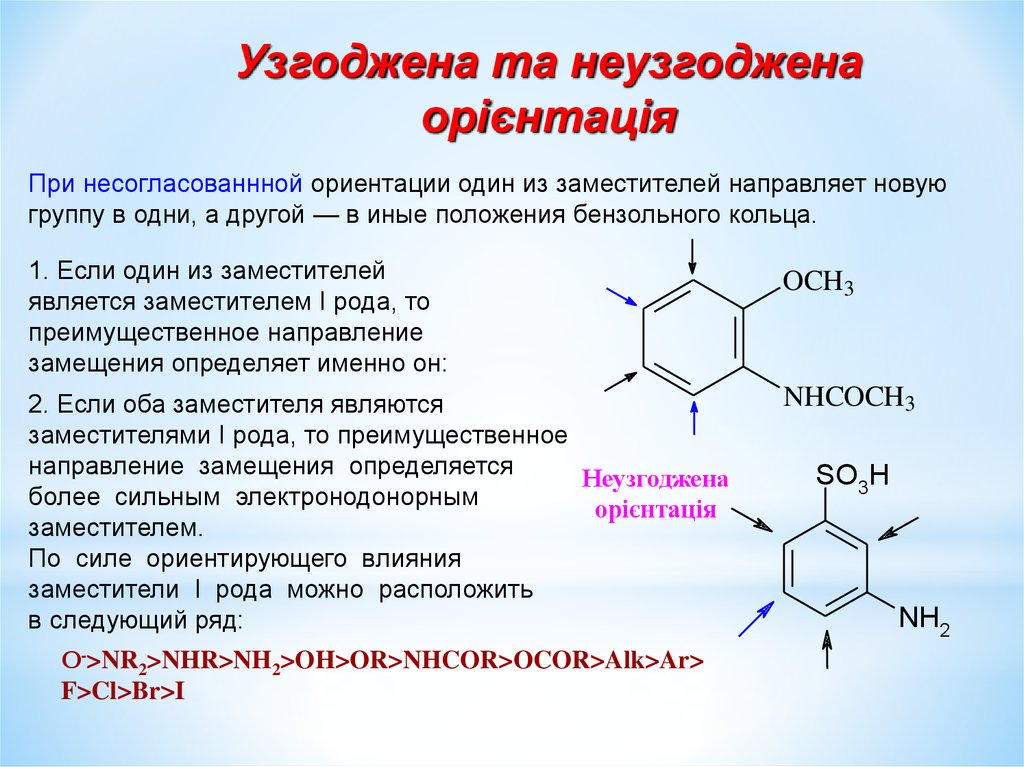
Узгоджена та неузгодженаорієнтація
При несогласованнной ориентации один из заместителей направляет новую
группу в одни, а другой — в иные положения бензольного кольца.
1. Если один из заместителей
является заместителем I рода, то
преимущественное направление
замещения определяет именно он:
2. Если оба заместителя являются
заместителями I рода, то преимущественное
направление замещения определяется
Неузгоджена
более сильным электронодонорным
орієнтація
заместителем.
По силе ориентирующего влияния
заместители I рода можно расположить
в следующий ряд:
О->NR2>NHR>NH2>OH>OR>NHCOR>OCOR>Alk>Ar>
F>Cl>Br>I
OCH3
NHCOCH3
SO3H
NH2
23.
Узгоджена та неузгоджена орієнтація3. Если оба заместителя являются
заместителями II рода,
электрофильное замещение
осуществляется с большим трудом, а
преимущественное место вхождения
третьего заместителя определяется
более сильным ориентантом.
По силе ориентирующего влияния в
реакциях SE заместители II рода можно
расположить в следующий ряд:
—COOH > —SO3H > —CN > —NO2
NO2
CN
Неузгоджена
орієнтація
24.
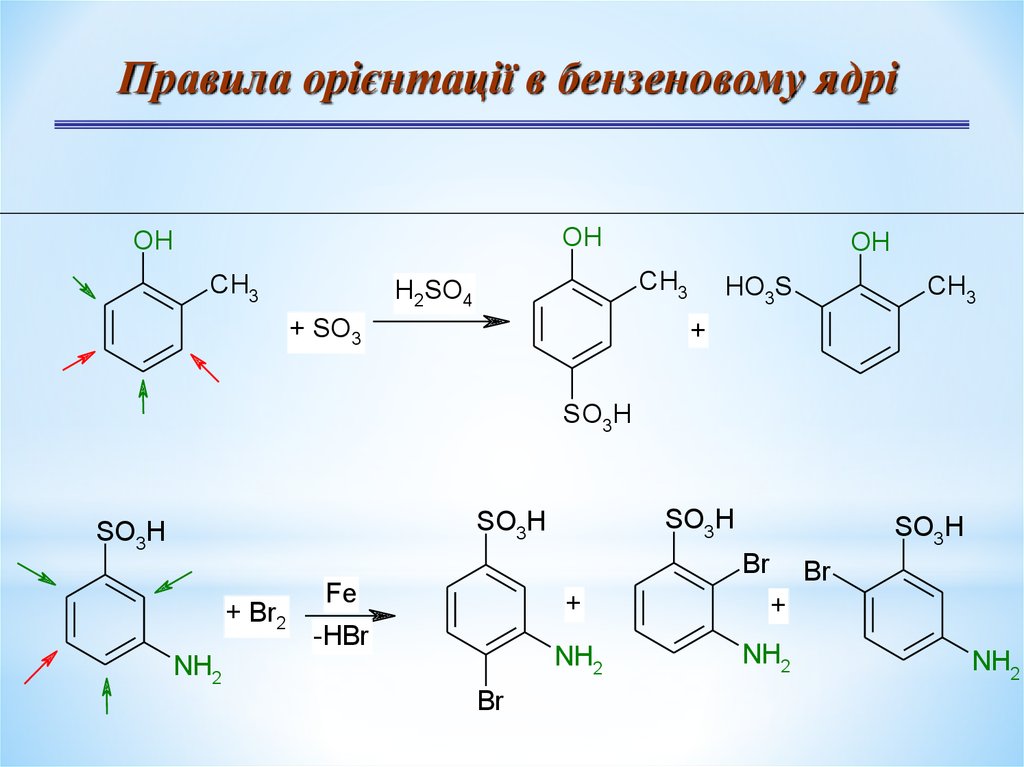
Правила орієнтації в бензеновому ядріOH
OH
CH3
OH
CH3
H2SO4
+ SO3
CH3
HO3S
+
SO3H
SO3H
SO3H
SO3H
SO3H
Br
+ Br2
Fe
+
-HBr
NH2
NH2
Br
Br
+
NH2
NH2
25.
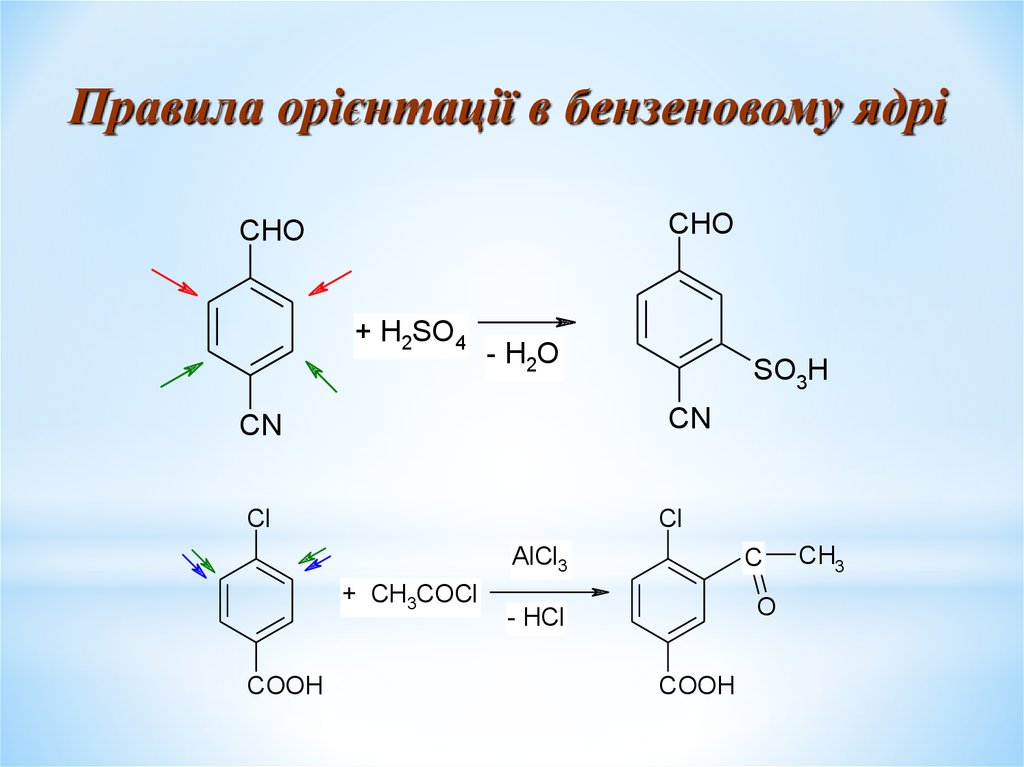
Правила орієнтації в бензеновому ядріCHO
CHO
+ H2SO4
- H2O
SO3H
CN
CN
Cl
Cl
AlCl3
+ CH3COCl
COOH
C
O
- HCl
COOH
CH3
26.
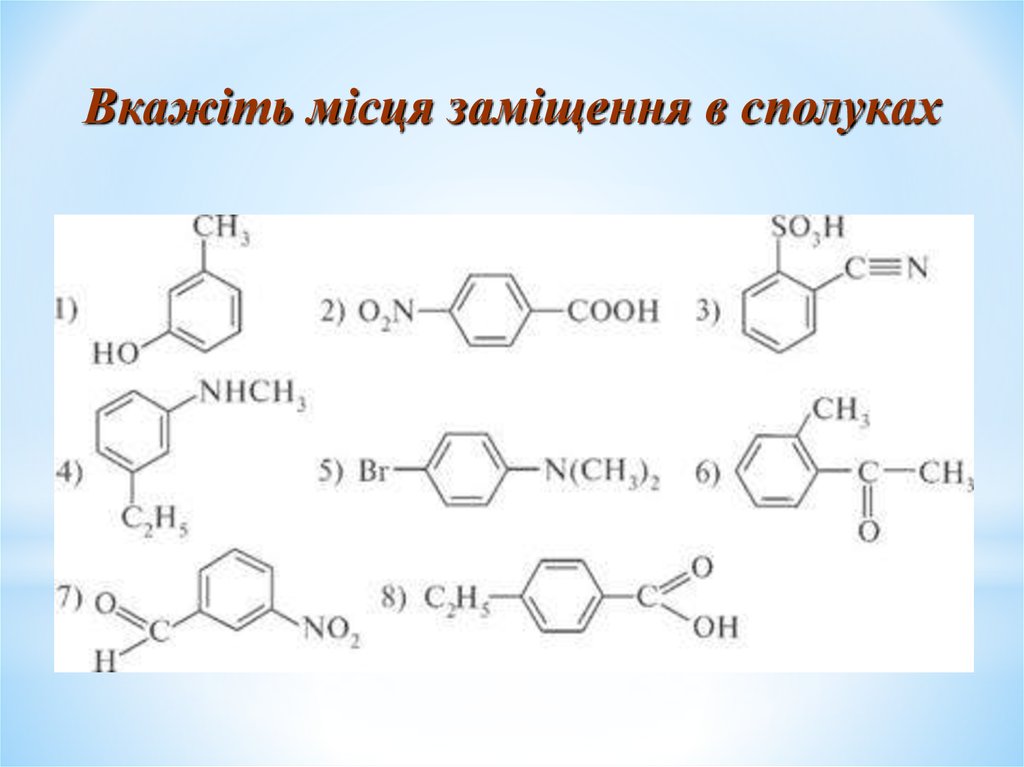
Вкажіть місця заміщення в сполуках27.
28. Дякую за увагу!
*Дякую за увагу!29.
Фізико-хімічні методи ідентифікаціїПМР-спектр нітробензену
УФ-спектр бензену
30.
Фізико-хімічні методи ідентифікаціїІЧ-спектр етилбензену
31.
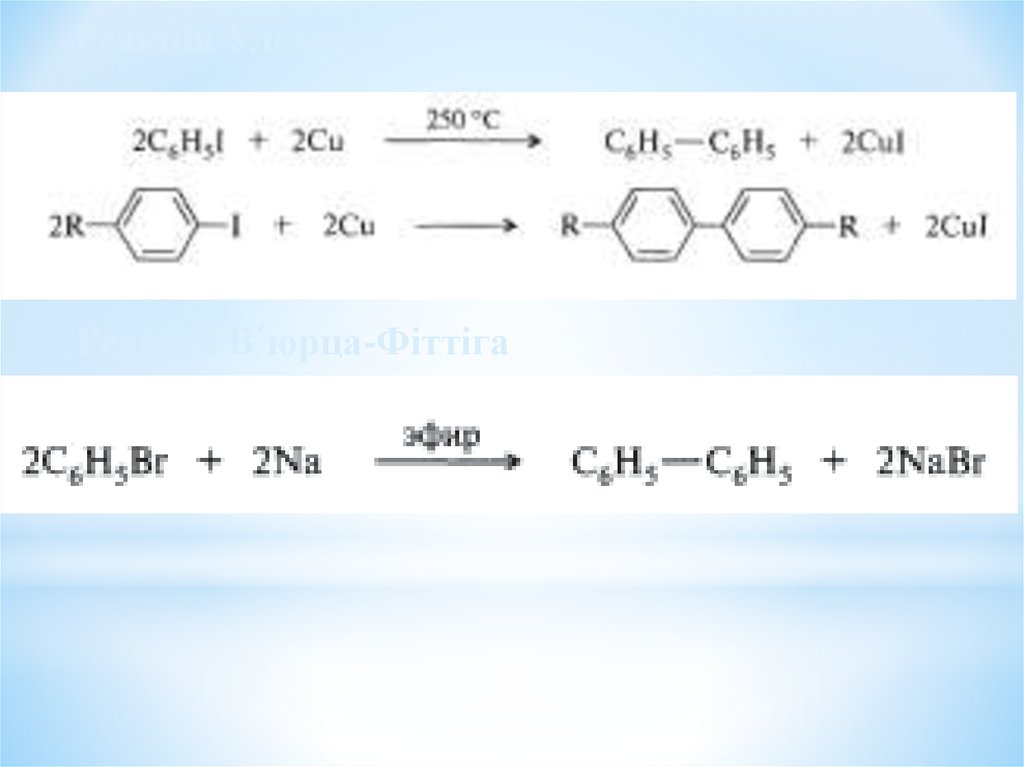
Реакція УльманаРеакція В´юрца-Фіттіга
32.
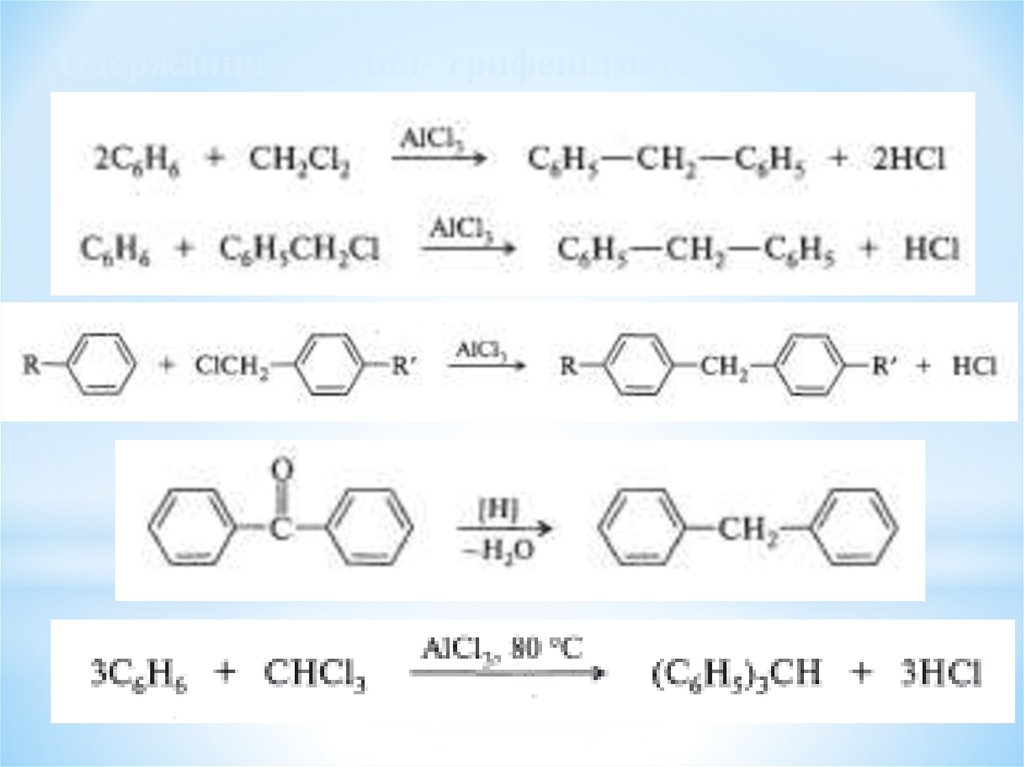
Одержання дифеніл- трифенілметану33.
Барвники трифенілметанового ряду.+ N(C H )
2 5 2
(C2H5)2N
COOH
C
COO
Брилья нтовий зелений
(хіноїдна структура)
34.
N,N-діетиланілін(C2H5)2N
N(C2H5)2
H
(C2H5)2N
N(C2H5)2
H
O
C
H
CH
бензальдегід
-H2O
лейкооснова
брилья нтового зеленого
35.
(C2H5)2N[O]
N(C2H5)2
C
OH
HOOC - COOH
оксалатна кислота
-H2O
PbO2
карбінольна основа
брилья нтового зеленого
4,4/ - біс – (діетиламіно)трифенілкарбінол
36.
хіноїднагрупа
..
..
(C2H5)2N
N(C2H5)2
+
N(C2H5)2
(C2H5)2N
+
C
COOH
або
COO
Брилья нтовий зелений
C
COOH
COO
37.
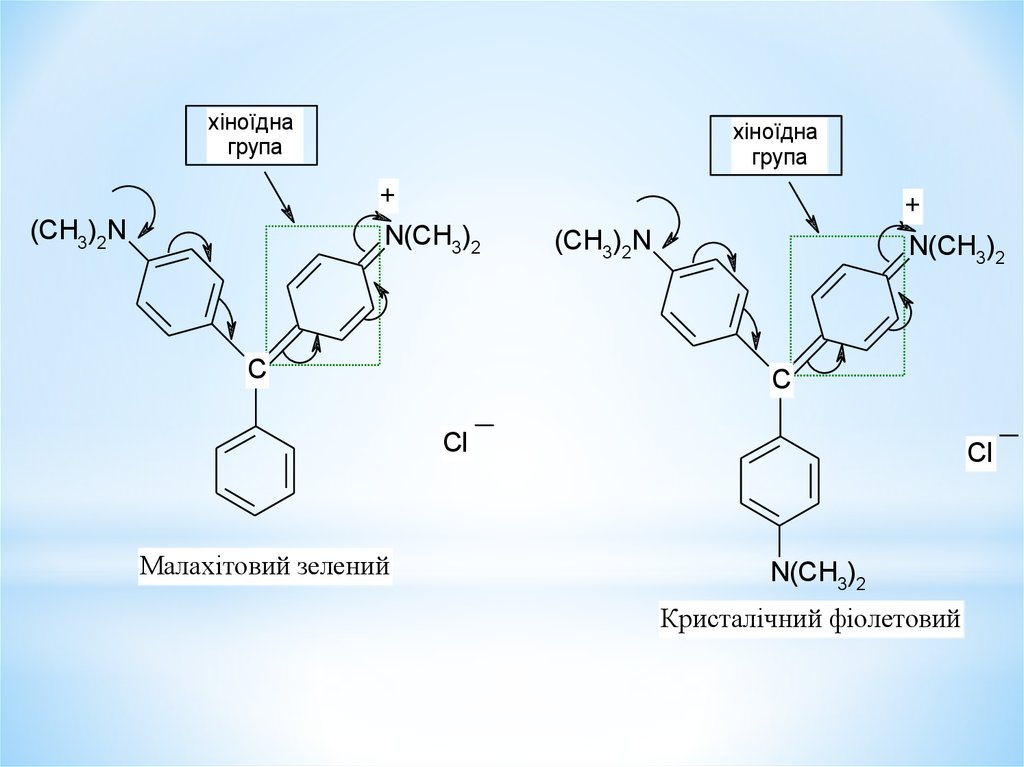
хіноїднагрупа
хіноїдна
група
+
N(CH3)2
(CH3)2N
C
+
N(CH3)2
(CH3)2N
C
Cl
Малахітовий зелений
Cl
N(CH3)2
Кристалічний фіолетовий
38.
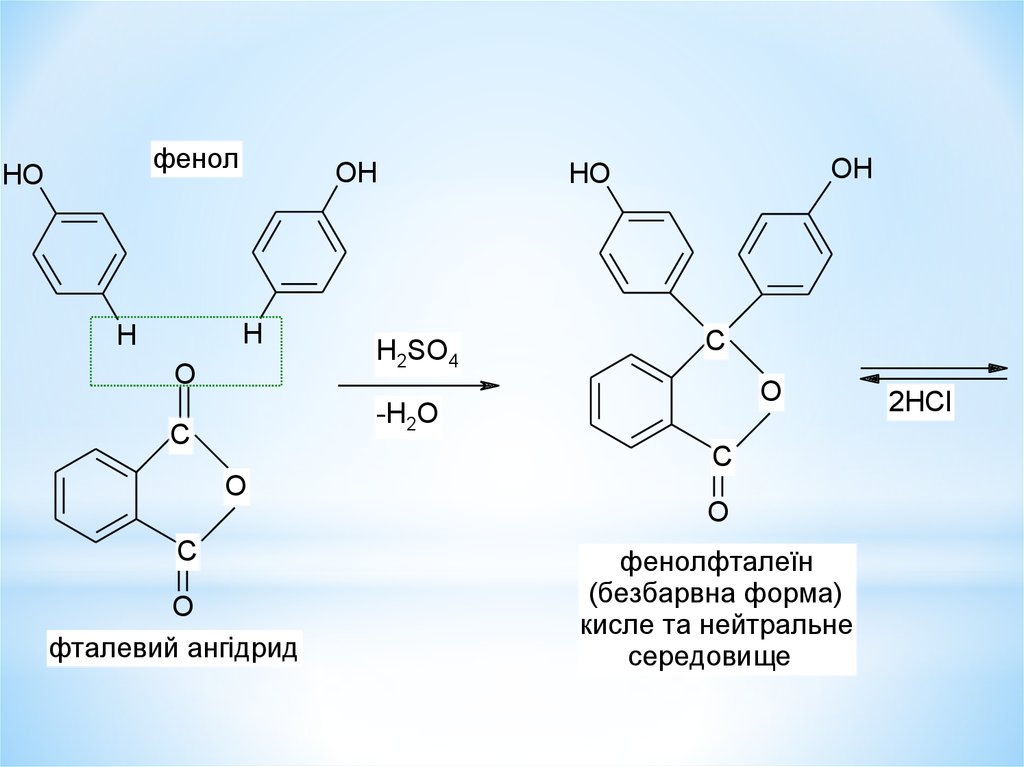
фенолHO
OH
H
H
O
H2SO4
OH
HO
C
O
-H2O
C
C
O
O
C
O
фталевий ангідрид
фенолфталеїн
(безбарвна форма)
кисле та нейтральне
середовище
2HCl
39.
+NaO
+
ONa
+
NaO
NaOH
C
O
HCl
C
ONa
C
O
фенолфталеїн
(форма з малиново-червоним забарвленням)
лужне середовище (рН =8,2 - 10,0)
OH
ONa
+
C
O
безбарвна форма
рН > 12
40.
Вкажіть катіон, аніон та радикал трифенілметанового ряду. Пояснітьпричину їх високої стійкості. Назвіть сполуки і вкажіть, як
впливають замісники на їх стабільність























 chemistry
chemistry








