Similar presentations:
Гидролиз солей. Полные и сокращенные ионные уравнения реакций гидролиза солей
1.
Гидролиз солей2.
Цель: сформировать представления огидролизе солей, о его сущности
Задачи
Научиться
составлять
полные
и
сокращенные ионные уравнения реакций
гидролиза солей.
Научиться
записывать
уравнения
обратимого, необратимого, ступенчатого
гидролиза
и
предсказывать
среду
растворов различных солей.
Усвоить практическое значение гидролиза
веществ.
3.
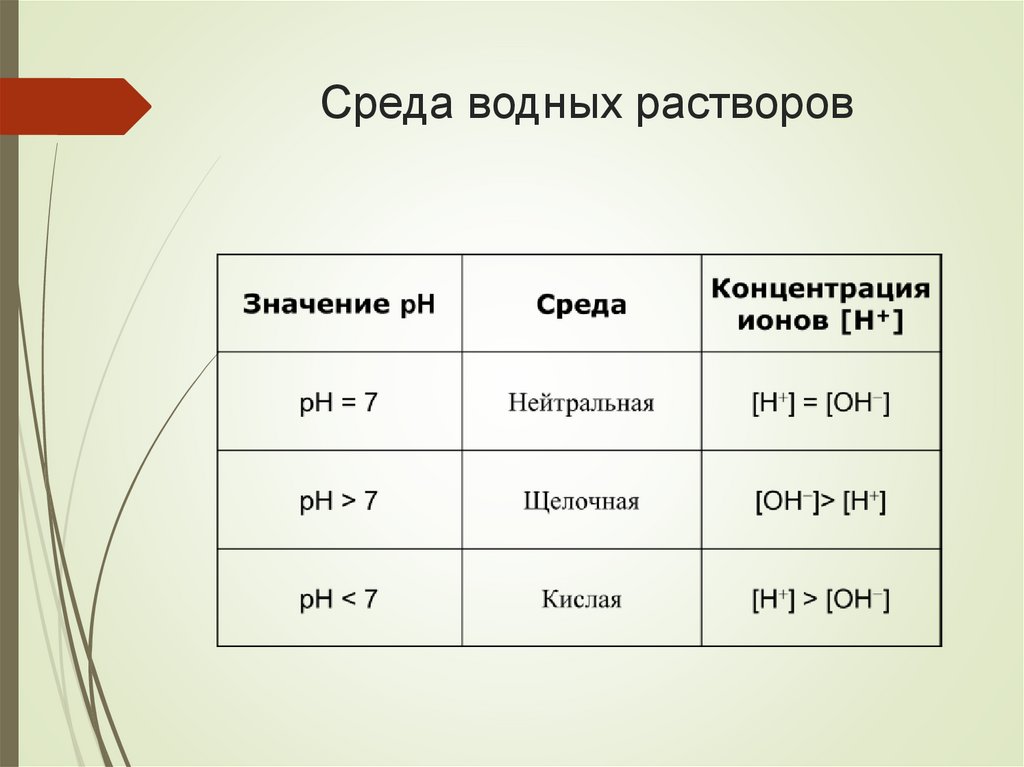
Что представляет собой вода сточки зрения ТЭД?
Н2О ⇄ Н+ + ОН−, [H+] = [OH −].
Для определения среды водных растворов пользуются
водородным показателем.
Водородный показатель (рН) – это
отрицательный десятичный логарифм
концентрации ионов водорода.
рН = −lg[H+].
Реакция чистой воды нейтральная, рН = 7.
4.
Среда водных растворов5.
План1. Понятие «гидролиз солей». Алгоритм составления
уравнения гидролиза солей. Типы солей.
а) Соли сильного основания и сильной кислоты.
б) Соли сильного основания и слабой кислоты.
в) Соли слабого основания и сильной кислоты.
г) Соли слабого основания и слабой кислоты.
Необратимый гидролиз.
2. Условия усиления и ослабления гидролиза.
3. Практическое значение гидролиза.
6.
Понятие «гидролиз солей»ГИДРОЛИЗ – от греческих слов
гидро – вода, лизис – разложение.
Гидролиз – это реакция обмена между солями
и водой, приводящая к образованию слабого
электролита.
Если кислота слабая, то образуется кислая
соль, если
основание – основная соль,
и
происходит изменение среды раствора.
7.
8.
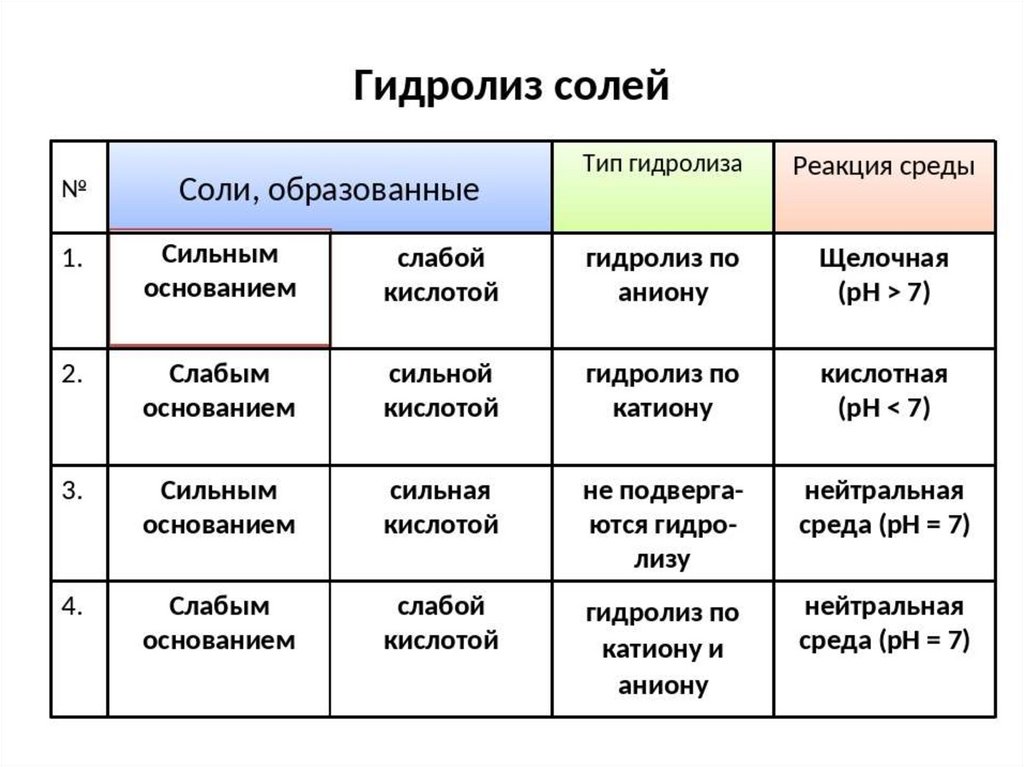
Типы солейТипы
Соли, образованные
сильной кислотой и
сильным основанием
Примеры
Na2SO4, CsCl, CaBr2, KNO3
Соли, образованные
Na2CO3, Na2SiO3, K2SO3
слабой кислотой и сильным
основанием
Соли, образованные
ZnCl2, CuSO4, AlCl3,
сильной кислотой и слабым NH4ClO4
основанием
Соли, образованные
слабой кислотой и слабым
основанием
NH4CN, (NH4)2S, Al2S3
9.
Соли, образованные сильнымоснованием и сильной кислотой
KOH←K2SO4→H2SO4
K2SO4; NaNO3.
Такие соли гидролизу
подвергаются.
[H+] = [OH−].
Нейтральная среда, рН = 7.
не
10.
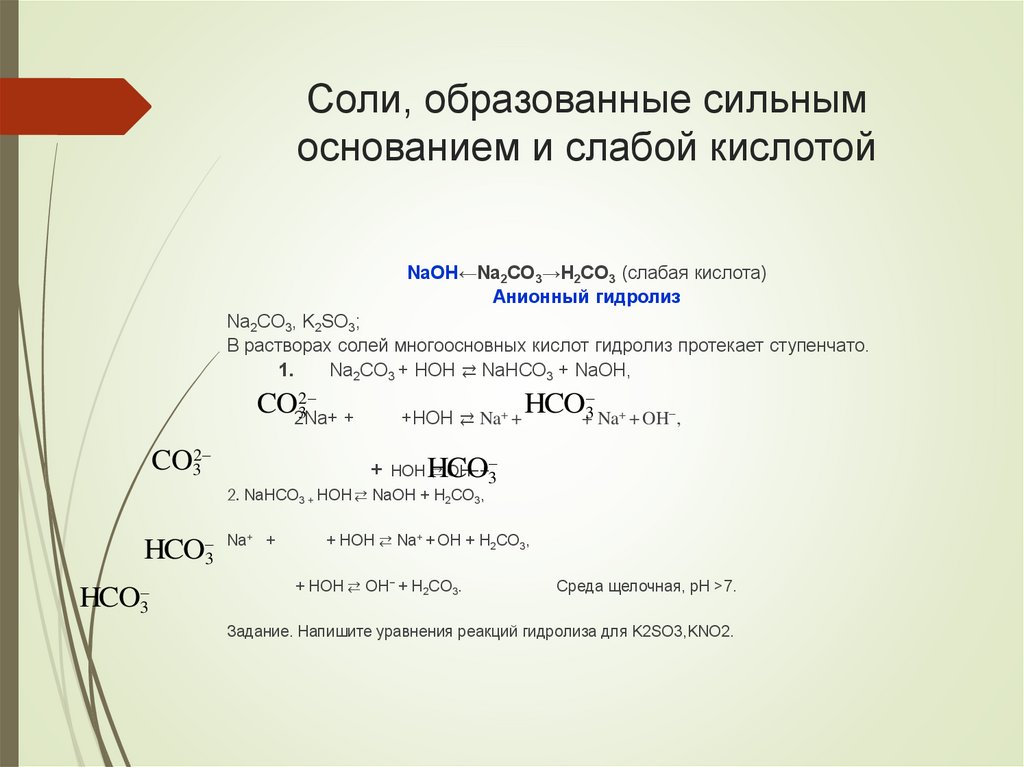
Соли, образованные сильнымоснованием и слабой кислотой
NaOH←Na2CO3→H2CO3 (слабая кислота)
Анионный гидролиз
Na2CO3, K2SO3;
В растворах солей многоосновных кислот гидролиз протекает ступенчато.
1.
Na2CO3 + HOH ⇄ NaHCO3 + NaOH,
2
CO2Na+
3
+
CO32
+HOH ⇄ Na+ +
+
HCO+3 Na+ + OH−,
HOH ⇄ OH−+3
HCO
2. NaHCO3 + HOH ⇄ NaOH + H2CO3,
HCO3
HCO3
Na+ +
+ HOH ⇄ Na+ + OH + H2CO3,
+ HOH ⇄ OH− + H2CO3.
Среда щелочная, pH >7.
Задание. Напишите уравнения реакций гидролиза для K2SO3,KNO2.
11.
Соли, образованные cлабымоснованием и сильной кислотой
HCl←FeCl2→Fe(OH)2 (слабое основание)
Катионный гидролиз
FeCl2, CuBr2, ZnSO4.
При растворении солей многокислотных оснований гидролиз протекает
ступенчато.
1. FeCl2 + HOH ⇄ FeOHCl + HCl
Fe2+ + 2Cl− + HOH ⇄ FeOH+ + 2Cl− + H+,
Fe2+ + HOH ⇄ FeOH+ + H+.
2. FeОНCl + HOH ⇄ FeOHCl + HCl,
FeOH+ + Cl− + HOH ⇄ Fe(OH)2 + Cl− + H+,
Fe2+ + HOH ⇄ FeOH+ + H+.
Кислая среда, pH< 7.
Задание. Напишите уравнение реакции гидролиза для CuBr2.
12.
Соли, образованные cлабымоснованием и слабой кислотой
(слабое основание) NH4OH←NH4CN→HCN (слабая кислота)
NH4CN, (NH4)2S.
Гидролиз идет и по катиону, и по аниону:
NH4CN + HOH ⇄ NH3∙H2O + HCN.
Характер среды определяется константой
диссоциации кислот и оснований. Если Кдис
одинакова – среда нейтральная.
Задание. Напишите уравнения реакций гидролиза для
Al2S3, CaH2 .
13.
ЗаданиеКакую реакцию среды имеют растворы солей CuSO4,
NaNO2, K2SO4? Какие из этих солей подвергаются
гидролизу?
14.
ВыводыГидролизу подвергаются только растворимые соли, в
состав которых входит либо катион, либо анион слабого
электролита.
В зависимости от состава соли определяют реакцию
среды.
Гидролиз – процесс обратимый.
Если в составу соли есть и катион, и анион слабых
электролитов (а соль в водной среде разлагается), идет
необратимый гидролиз.
15.
Условияусиления и ослабления
гидролиза
Гидролиз соли можно усилить, если:
добавить воду (уменьшить концентрацию);
нагреть раствор.
Гидролиз соли можно подавить, если:
охладить раствор;
добавить в раствор кислоту, если среда
кислая;
добавить в раствор щелочь, если среда
щелочная
16.
Роль гидролизав повседневной жизни человека
Стирка
Мытье посуды
Умывание с мылом
Процессы пищеварения
17.
Тест. Гидролиз солей1. Гидролизу не подвергается:
а) ZnCl2; б) Al2(SO4)3; в) KCl; г) Na2SO3.
2. Гидролизу подвергается:
а) Na2SO4; б) NaNO3; в) NaCl; г) Na2CO3.
3. Избыток катионов водорода Н+ образуется при гидролизе :
а) Na2SiO3; б) ZnCl2; в) K2CO3; г) NaNO3.
18.
Тест. Гидролиз солей4. Кислую среду имеет водный раствор:
а) хлорида натрия;
б)
хлорида
алюминия;
в) нитрата калия;
г)
хлорида
кальция.
5. Нейтральную среду имеет водный
раствор:
а) карбоната натрия; б) нитрата калия;
в) сульфата цинка;
г)
нитрата
свинца.
6. Щелочную среду имеет водный
раствор:
19.
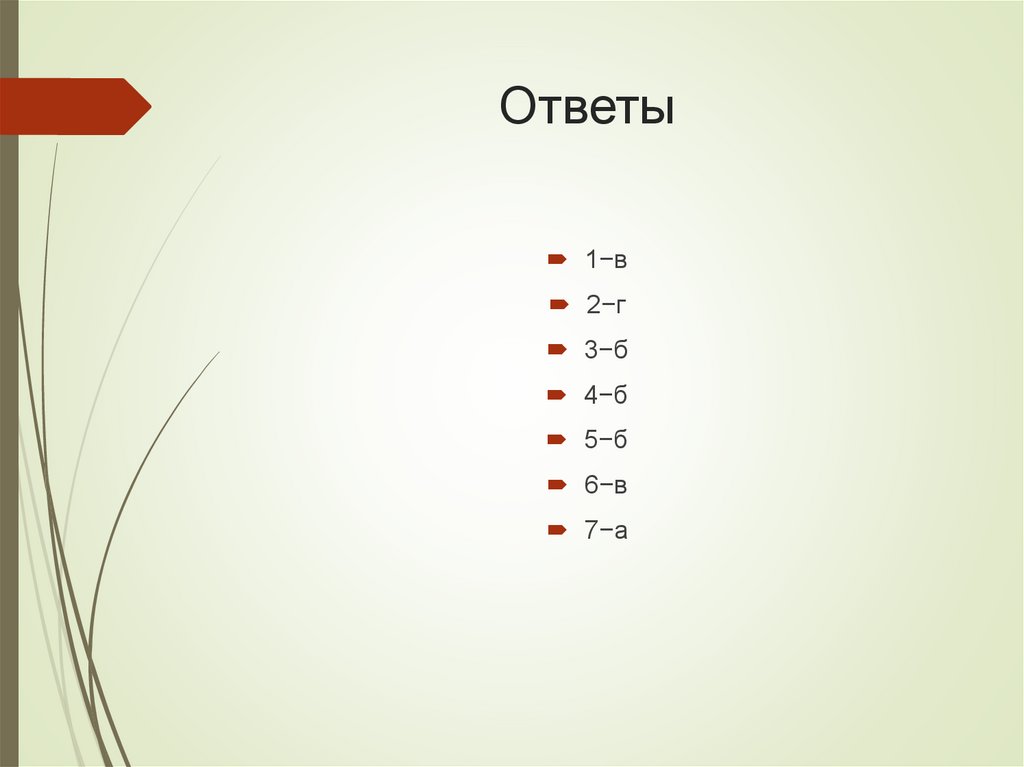
Ответы1−в
2−г
3−б
4−б
5−б
6−в
7−а
20.
Домашнее заданиеСоставите уравнения гидролиза для следующих солей:
K3PO4, AlCl3, Cr2S3;
определите типы солей и среду их водных растворов.
















 chemistry
chemistry








