Similar presentations:
Реакции гидролиза. Составление реакций ионного обмена путем составления их полных и сокращенных ионных уравнений
1.
Лабораторная(практическая)работа 5
Реакции гидролиза
Составление реакций ионного
обмена путем составления их
полных и сокращенных ионных
уравнений
Раздел 1. Общая и неорганическая химия
Тема 1.6. Химические реакции
2.
Цель: Экспериментальное проведение химических опытовразличных типов химических реакций, реакций ионного
обмена, реакций гидролиза, с соблюдением правил техники
безопасности.
Задача: Закрепление знаний по теме «Гидролиз».
Реактивы и оборудование:
3.
С техникой безопасности ознакомлен ______________роспись
4.
Основные теоретические сведения5.
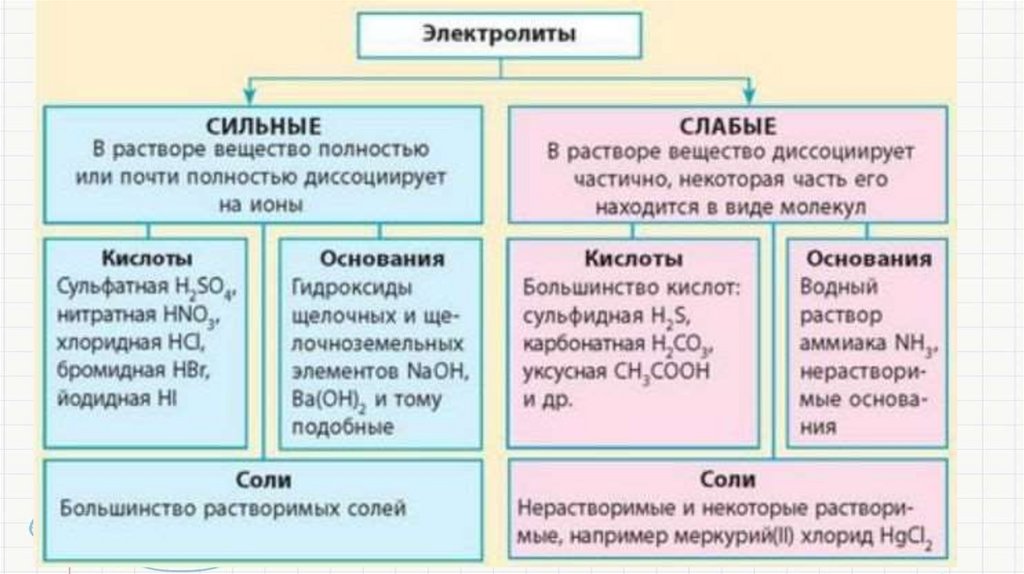
• Реакции ионного обмена — это реакции междусложными веществами (электролитами) в растворах, в
результате которых реагирующие вещества
обмениваются своими составными частями.
• Так как в этих реакциях происходит обмен ионами — они
называются ионными.
• Частным случаем реакций ионного обмена является
гидролиз солей
6.
7.
8.
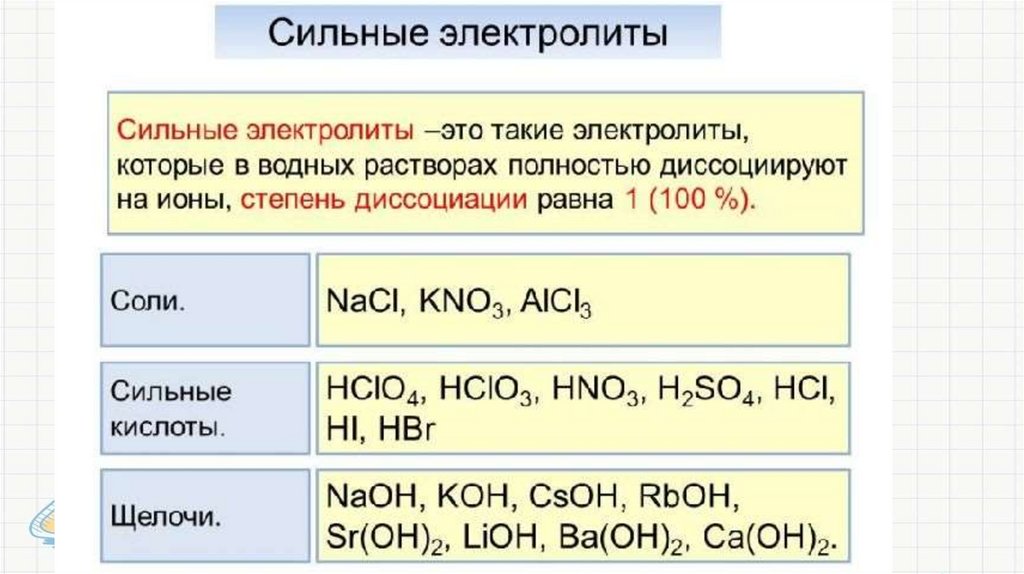
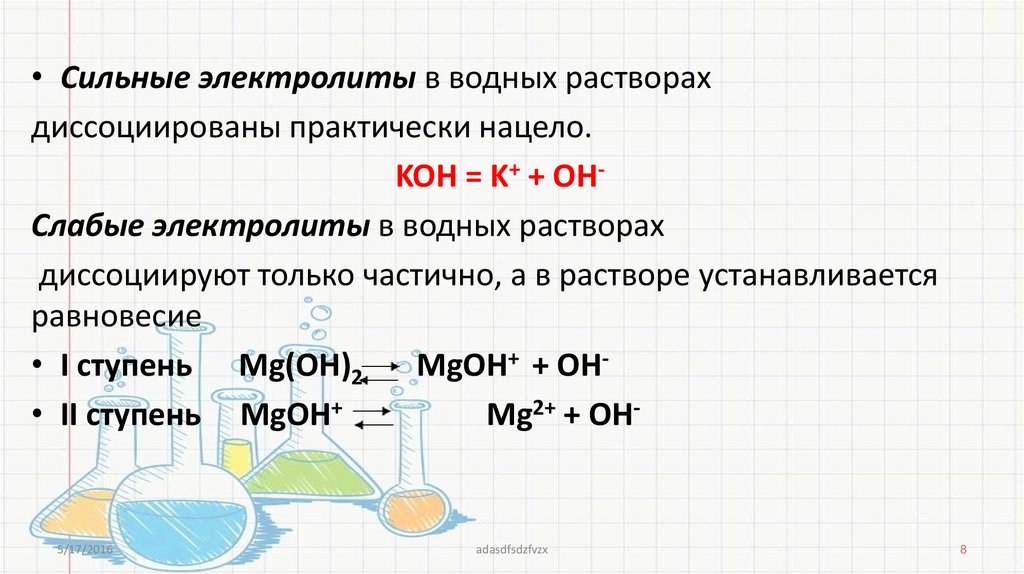
• Сильные электролиты в водных растворахдиссоциированы практически нацело.
KOH = K+ + OHСлабые электролиты в водных растворах
диссоциируют только частично, а в растворе устанавливается
равновесие
• I ступень Mg(OH)2
MgOH+ + OH• II ступень MgOH+
Mg2+ + OH-
5/17/2016
adasdfsdzfvzx
8
9.
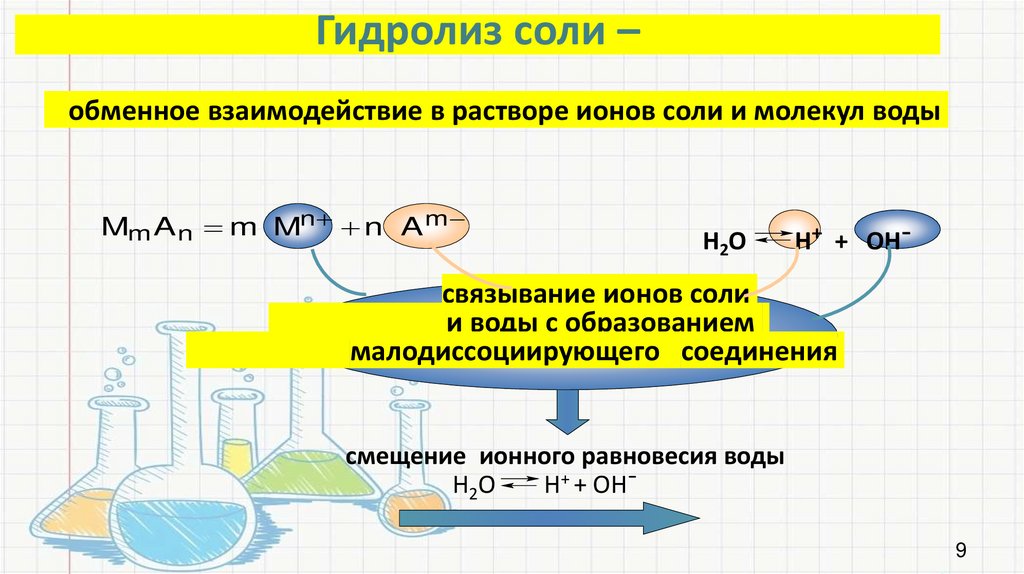
Гидролиз соли –обменное взаимодействие в растворе ионов соли и молекул воды
Mm A n m Mn n A m
Н2О
Н+ + ОН¯
связывание ионов соли
и воды с образованием
малодиссоциирующего соединения
смещение ионного равновесия воды
Н2О
Н+ + ОН¯
9
10.
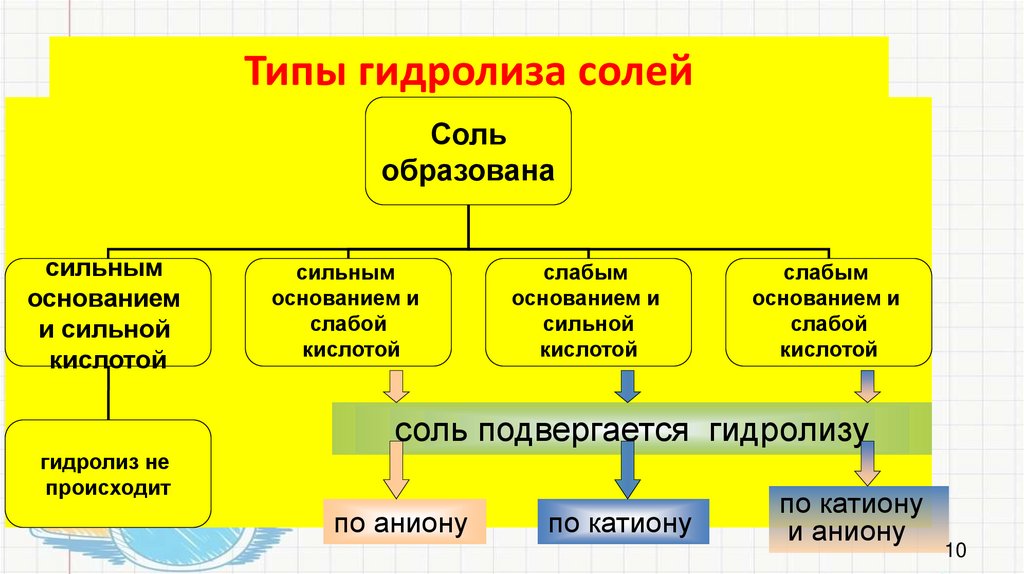
Типы гидролиза солейСоль
образована
сильным
основанием
и сильной
кислотой
сильным
основанием и
слабой
кислотой
слабым
основанием и
сильной
кислотой
слабым
основанием и
слабой
кислотой
соль подвергается гидролизу
гидролиз не
происходит
по аниону
по катиону
по катиону
и аниону
10
11.
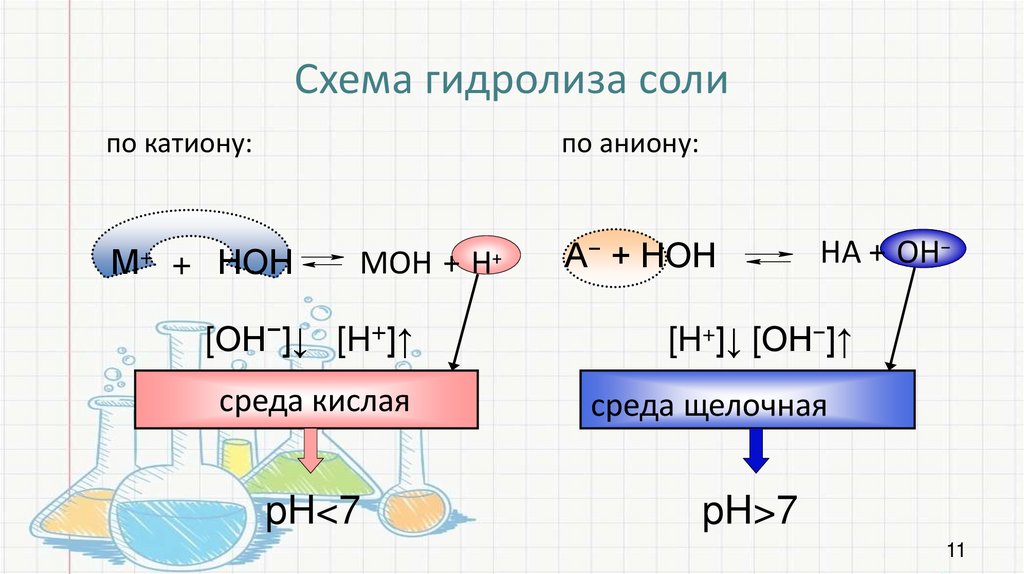
Схема гидролиза солипо катиону:
М+
по аниону:
+ НОН
MOH + H
[ОН−]↓ [H+]↑
среда кислая
pH<7
+
А− + НОН
HА + OH−
[H+]↓ [ОН−]↑
cреда щелочная
pH>7
11
12.
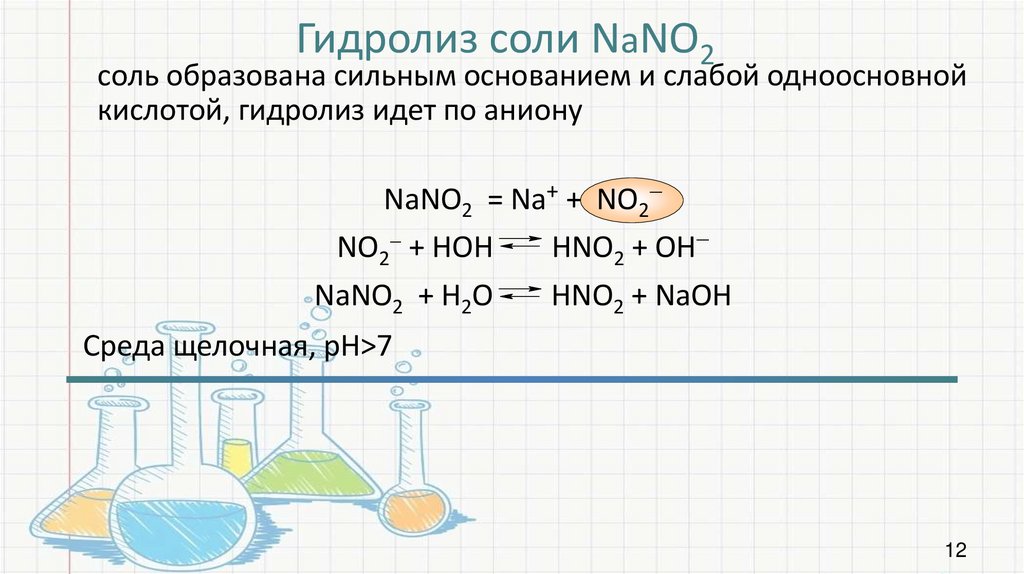
Гидролиз соли NаNO2соль образована сильным основанием и слабой одноосновной
кислотой, гидролиз идет по аниону
NaNO2 = Na+ + NO2
NO2 + HOH
HNO2 + OH
NaNO2 + H2O
HNO2 + NaOH
Среда щелочная, рН>7
12
13.
Составление реакций ионного обменапутем составления их полных и сокращенных ионных уравнений
Три условия необратимости химических реакций:
- выпадает осадок,
- образуется газообразное вещество
- образуется малодиссоциирующее вещество (вода, слабая кислота,
слабое
основание)
- Образование осадка
Молекулярное уравнение:
NaCl + AgNO3 = AgCl↓ + NaNO3
Полное ионное уравнение:
Na+ + Cl- + Ag+ + NO3- = AgCl↓ + Na+ + NO3−
Сокращенное ионное уравнение
Ag+ + Cl- = AgCl↓
14.
Образование газообразного веществаМолекулярное уравнение:
(NH4)2S + 2HCl = 2NH4Cl + H2S↑
Полное ионное уравнение:
2NH4+ + S2- + 2H+ + 2Cl- = 2NH4+ + 2Cl- + H2S↑
Сокращенное ионное уравнение
2H+ + S2- = H2S↑
- Образование малодиссоциирующего вещества
кислота, слабое основание)
Молекулярное уравнение:
H2SO4 + 2KOH = K2SO4 + 2H2O
Полное ионное уравнение:
2H+ + SO42- + 2K+ + 2OH- = 2K+ + SO42- + 2H2O
Сокращенное ионное уравнение
2H+ + 2OH- = 2H2O
(вода,
слабая
15.
• Реакции ионного обмена не протекают до конца, т.е.являются обратимыми, если образуются два сильных
электролита:
• KNO3 + NaCl= NaNO3 + KCl
• K+ + NO3- + Na+ + Cl-= Na+ + NO3- + K+ + Cl-
16.
Запомни!• В ионном виде записываются:
• - Формулы сильных электролитов
• В молекулярном виде записываются
• Формулы слабых и средних электролитов
• Формулы нерастворимых и малорастворимых веществ
• Формулы газов, оксидов
17.
Выполнение практической работы18.
Опыт№ 1. Реакции ионного обмена• В пробирку налить 1мл. раствора соли BaCl2
• затем добавить 1мл Na2SO4
• Наблюдения:
• Химическая реакция (в молекулярном и ионном виде):
5/17/2016
adasdfsdzfvzx
18
19.
Опыт№ 2. Реакции ионного обмена• В пробирку налить 1мл. раствора соли CuSO4
• затем добавить 1мл NaOH
• Наблюдения:
• Химическая реакция (в молекулярном и ионном виде):
5/17/2016
adasdfsdzfvzx
19
20.
21.
Опыт№ 3. Гидролиз соли, образованной сильным основаниеми слабой кислотой
• В две пробирки налить раствор соли Na2CO3
• В 1ую пробирку добавить 1-2 капли фенолфталеина
• Во 2ую пробрку добавить 1-2 капли лакмуса
• Наблюдения:
• Химическая реакция гидролиза соли (в молекулярном и
ионном виде):
• Укажите среда раствора соли:
5/17/2016
adasdfsdzfvzx
21
22.
Опыт№ 4. Гидролиз соли, образована слабым основанием исильной кислотой
В две пробирки налить раствор соли NH4Cl или (AlCl3
• В 1ую пробирку добавить 1-2 капли метилоранж
• Во 2ую пробрку добавить 1-2 капли лакмуса
• Наблюдения:
• Химическая реакция гидролиза соли(в молекулярном и
ионном виде):
• Укажите среда раствора соли:
5/17/2016
adasdfsdzfvzx
22
23.
• Опыт№ 5. Гидролиз соли, образована сильным основанием исильной кислотой
• В пробирку налить раствор NaCl и внести 1-3 капли лакмуса
• Наблюдения:
• Химическая реакция гидролиза соли (молекулярное ионное
уравнение реакции)
• Укажите среда раствора соли:
5/17/2016
adasdfsdzfvzx
23
24.
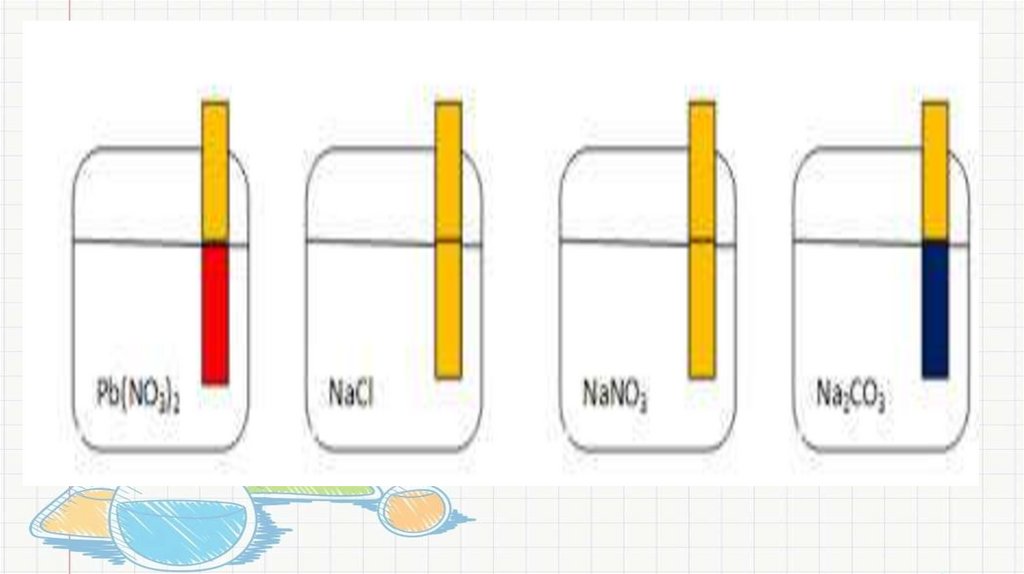
Опыт№ 6. Совместный Гидролиз солиВ пробирку налить 1мл раствора соли FeCl3
• Затем добавить 1мл Na2CO3
• Наблюдения:
• Химическая реакция гидролиза (в молекулярном и ионном
виде):
5/17/2016
adasdfsdzfvzx
24
25.
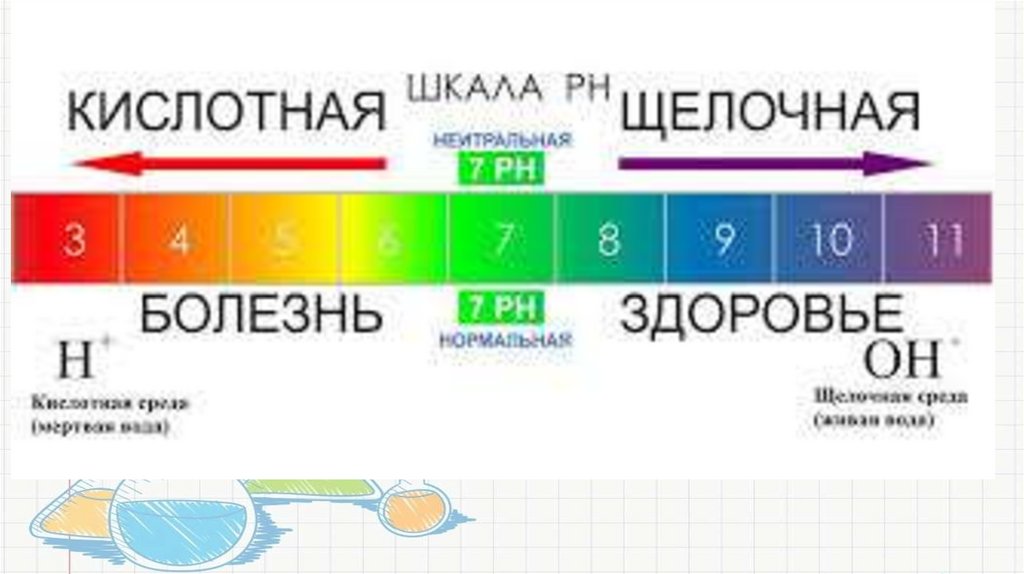
• Водородным показателем рН называют десятичный логарифмконцентрации водородных ионов, взятый с обратным знаком:
• рН = –lg[H+] или [Н+] = 10-рН,
• где [Н+] – концентрация ионов водорода, моль/л.
26.
• Кислотность среды Кислотность ― это концентрация ионовводорода, выраженная в единицах (от 1 до 14) по шкале
pH. Среда считается нейтральной при показателе 7,0,
кислой ― ниже 6,5 и щелочной ― более 7,5 единиц.
27.
28.
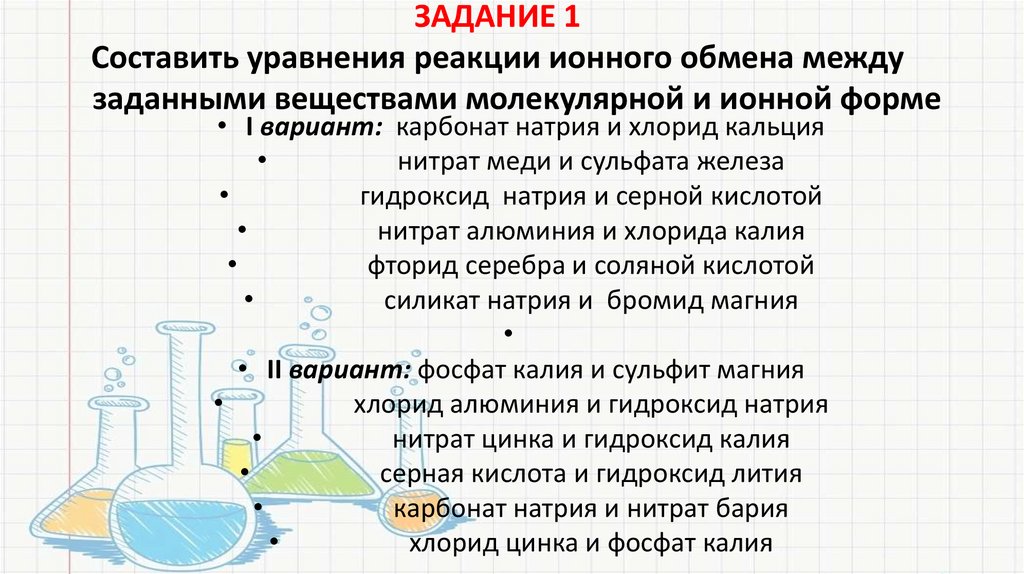
ЗАДАНИЕ 1Составить уравнения реакции ионного обмена между
заданными веществами молекулярной и ионной форме
• I вариант: карбонат натрия и хлорид кальция
нитрат меди и сульфата железа
гидроксид натрия и серной кислотой
нитрат алюминия и хлорида калия
фторид серебра и соляной кислотой
силикат натрия и бромид магния
• II вариант: фосфат калия и сульфит магния
хлорид алюминия и гидроксид натрия
нитрат цинка и гидроксид калия
серная кислота и гидроксид лития
карбонат натрия и нитрат бария
хлорид цинка и фосфат калия
29.
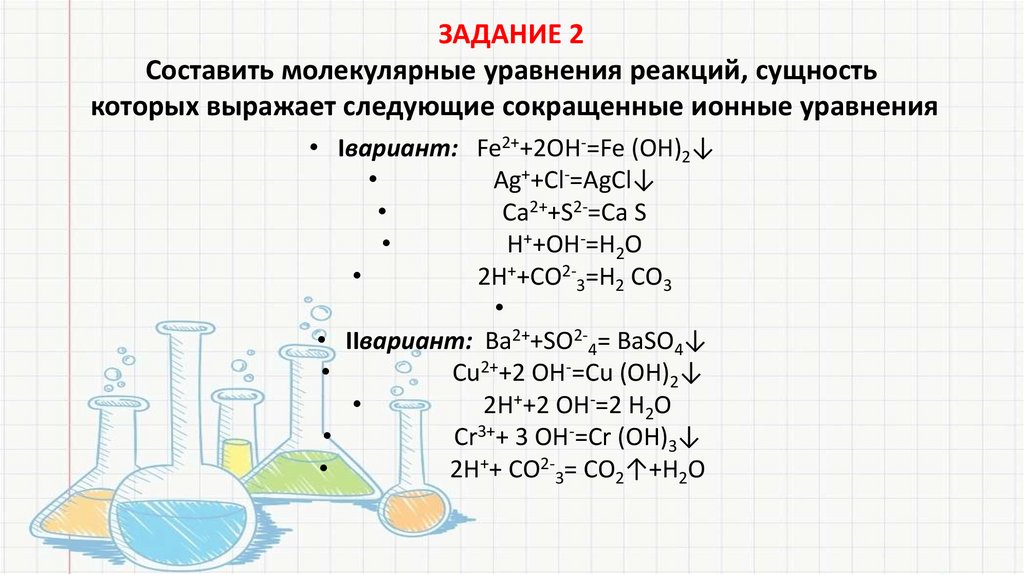
ЗАДАНИЕ 2Составить молекулярные уравнения реакций, сущность
которых выражает следующие сокращенные ионные уравнения
• Iвариант: Fe2++2ОН-=Fe (OH)2↓
Ag++Cl-=AgCl↓
Са2++S2-=Ca S
Н++ОН-=H2O
2Н++СО2-3=Н2 СО3
• IIвариант: Вa2++SO2-4= ВaSO4↓
Cu2++2 ОН-=Cu (OH)2↓
2Н++2 ОН-=2 Н2О
Cr3++ 3 ОН-=Сr (ОН)3↓
2Н++ СО2-3= СО2↑+Н2О
30.
Вывод по практической работе:5/17/2016
adasdfsdzfvzx
30
31.
Вопросы для закрепления пройденного материала1. При каких условиях возможны необратимые реакции?
2. Возможна ли реакция: HCl + KOH = KCl + H2O
3. Допишите реакцию: FeCl2 + NaOH = ? +?
Почему возможна эта необратимая реакция?
4. Запишите типы химических реакций по имеющимся
классификациям, проделанных в лабораторной работе.




















 chemistry
chemistry








