Similar presentations:
Электролитическая диссоциация
1.
2.
11. Рис.1
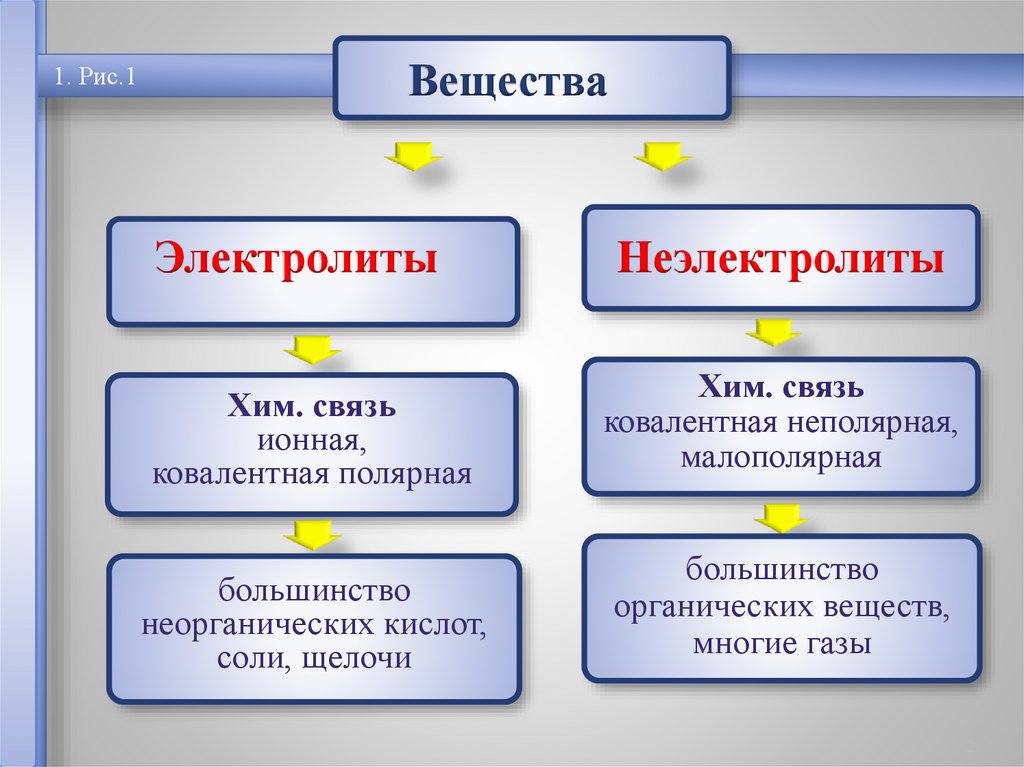
Вещества
Электролиты
Неэлектролиты
Хим. связь
ионная,
ковалентная полярная
Хим. связь
ковалентная неполярная,
малополярная
большинство
неорганических кислот,
соли, щелочи
большинство
органических веществ,
многие газы
2
3.
1. Электролиты и неэлектролитыВода – хороший растворитель,
т.к. молекулы воды полярны.
Вода – слабый амфотерный
электролит.
Н2О + Н2О
Н2О
104,50
Н3О+ + ОН-
ион
гидроксония
Механизм ЭД
Н+ + ОН-
Ионное произведение воды (КН О)
КН О = [Н+]•[ОН-] = 10-7•10-7 = 10-14
2
2
3
4.
1. Электролиты и неэлектролитыЭлектролиты -
это вещества, растворы и
расплавы которых
проводят электрический ток.
Кислоты: HCl; HNO3; H2SO4
Щелочи: NaOH; KOH; Ba(OH)2
Соли:
NaCl; CuSO4; Al(NO3)3
4
5.
Электролиты-
Катод
Анод
+
-
+
+
Катионы
-
Анионы
+
+
-
5
6.
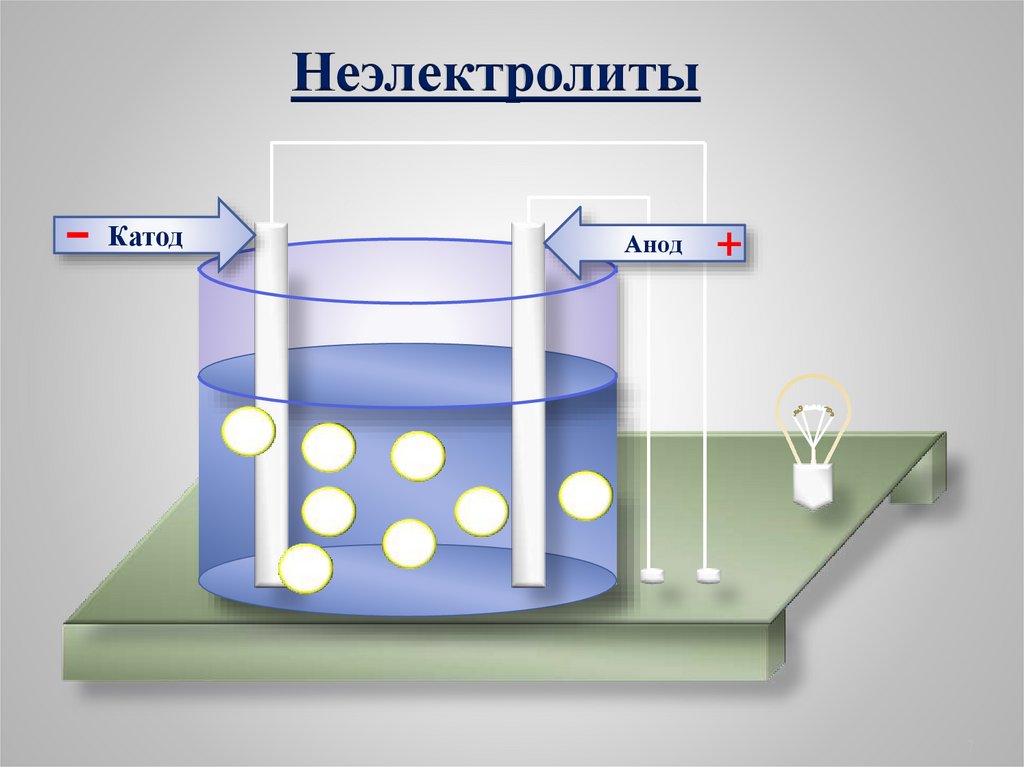
1. Электролиты и неэлектролитыНеэлектролиты -
это вещества, растворы или
расплавы которых не
проводят электрический ток.
Органические вещества:
сахар, ацетон,бензин, керосин, глицерин,
этиловый спирт, бензол и др.
Газы: кислород, водород, азот идр.
24.02.2024
Русецкая О.П.
6
7.
Неэлектролиты-
Катод
Анод
+
7
8.
2.Электролитическая диссоциацияЭлектролитическая диссоциация процесс распада молекул
электролита на ионы в
растворе или расплаве.
С.Аррениус
Теория электролитической
диссоциации. 1887 г.
8
9.
2.Электролитическая диссоциацияАррениус Сванте
Август
С.Аррениус
(1859 – 1927)
Шведский ученый, академик.
В 1887 году сформулировал
основные положения теории
электролитической диссоциации.
В 1903 г. награжден
Нобелевской премией.
Проводил исследования во
многих других областях науки.
9
10.
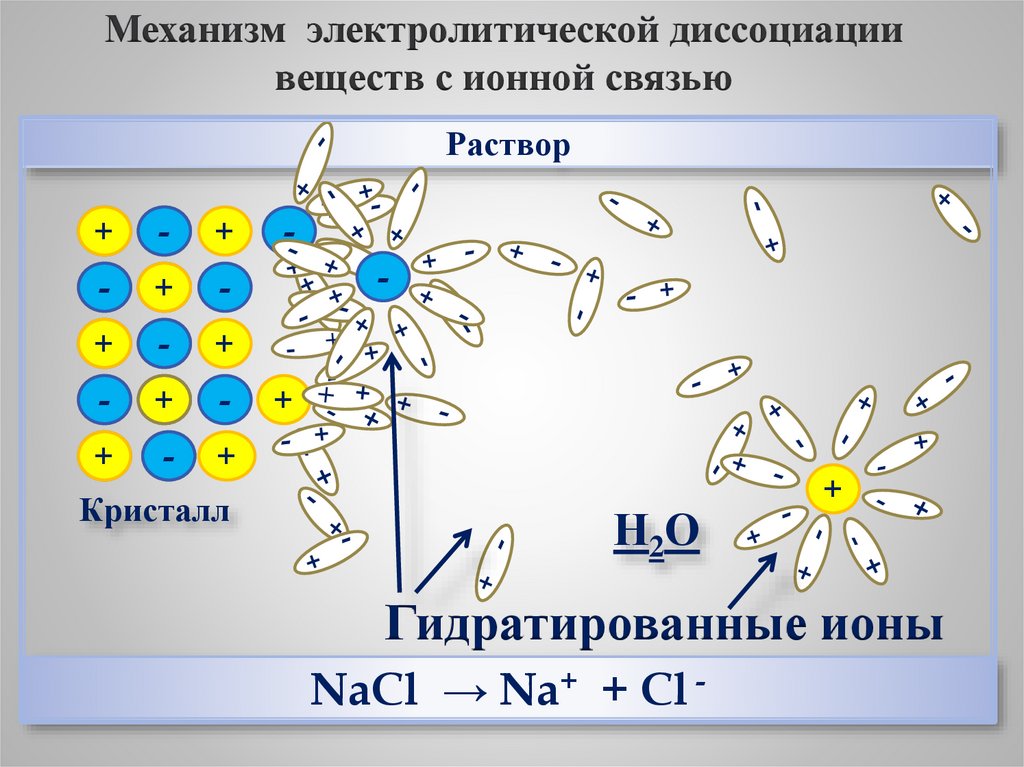
Механизм электролитической диссоциациивеществ с ионной связью
Раствор
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
Кристалл
+
Н2О
+
Гидратированные ионы
NaCl → Na+ + Cl -
11.
Механизм электролитической диссоциациивеществ с ковалентной полярной связью
Раствор
+
Н 2О
-
+
Сl-
HCl
H+
Cl-
Н+
Гидратированные ионы
НCl → Н+ + Cl -
12.
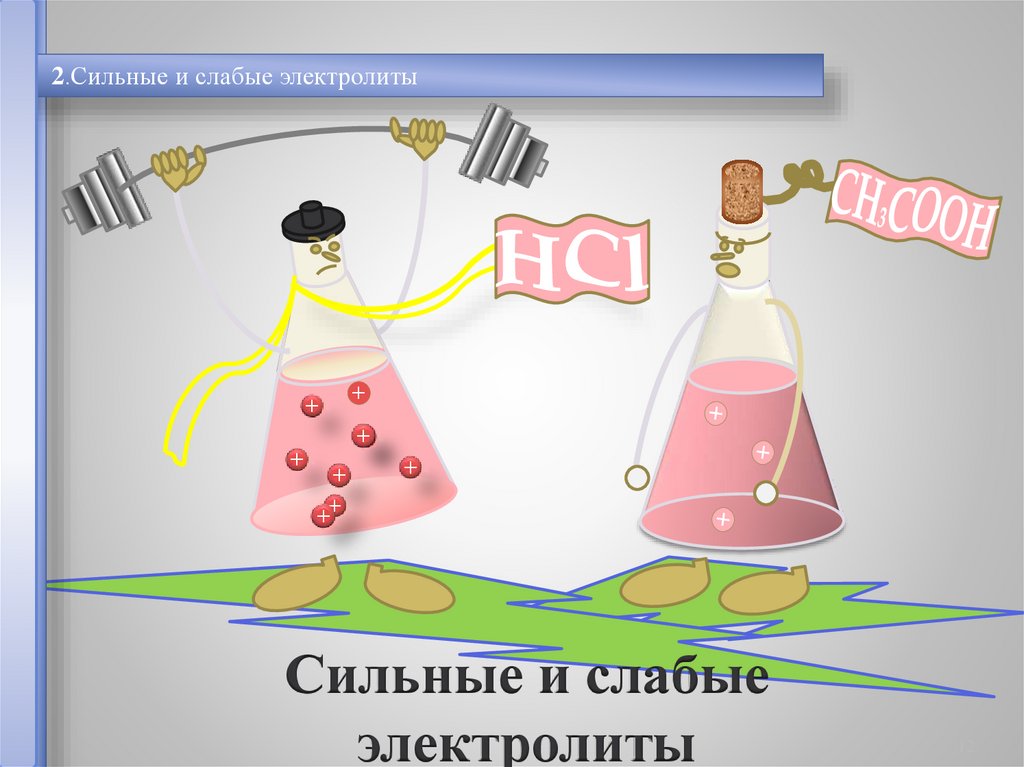
2.Сильные и слабые электролиты+
+
+
++
+
+
+
Сильные и слабые
электролиты
12
13.
Степень электролитическойдиссоциации (α) отношение числа диссоциированных
молекул к общему числу молекул,
находящихся в растворе.
n
α=
N
Сильные электролиты
α > 30%
Слабые электролиты
α< 30%
13
14.
2.Сильные и слабые электролитыЭлектролиты
Соли
Сильные (α >30%) Слабые (α < 30%)
практически все
Hg2Cl2 , некоторые
cоли тяжелых металлов
гидроксиды
щелочных и
щелочноземельных
металлов
водный раствор
аммиака
Основания
растворимые в воде
нерастворимые
-
все
Кислоты
HI, HBr, HCl
кислородосодержащие HClO4 H2SO4,
HNO3
бескислородные
HF, H2S
H2SO3, H2CO3,
H2SiO3, Н3РO4,
CH3COOH и др.
15.
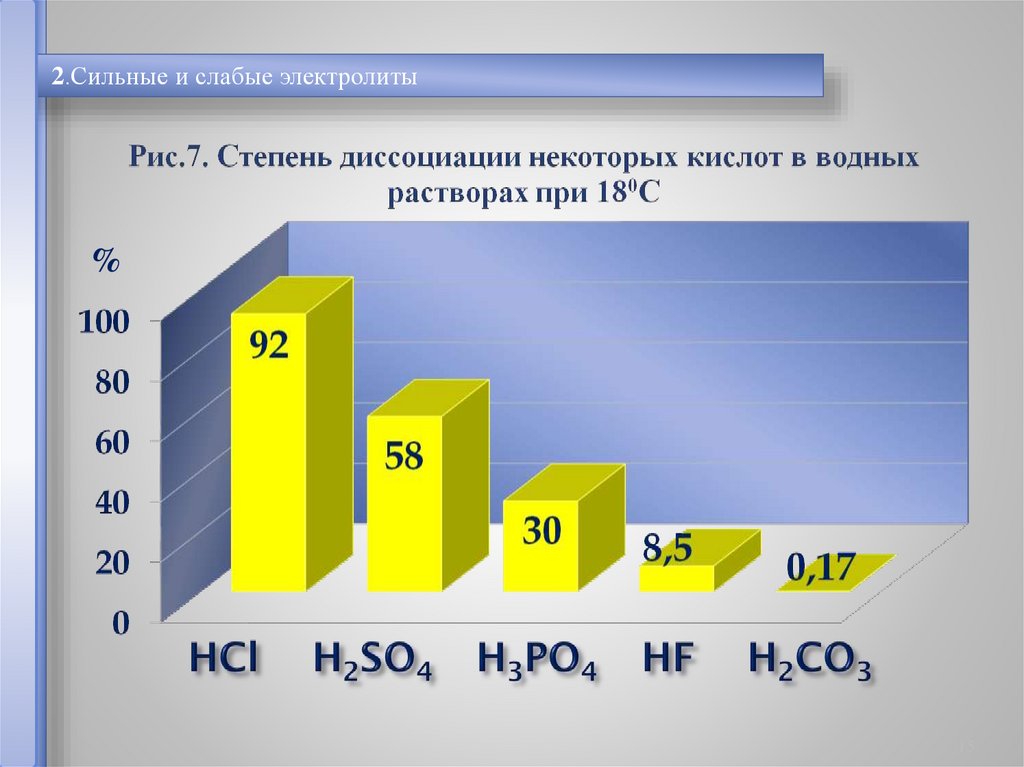
2.Сильные и слабые электролиты%
15
16.
Диссоциация кислот5. Диссоциация кислот, оснований, солей
Кислоты - это сложные вещества, при
диссоциации которых в водных
растворах в качестве катионов
отщепляются только ионы водорода.
НCl → Н+ + Cl -
+
Н
Н2SO4 → 2Н+ + SO4 2-
Н2 CO3
2 Н+ + CO3 216
17.
Диссоциация основанийОснования - это сложные вещества,
при диссоциации которых в водных
растворах в качестве анионов
отщепляются только гидроксид-ионы.
KOH → K
Ca(OH)2
+
-
+ OН
2+
Ca
-
ОН
-
+ 2OН
17
18.
Диссоциация солейСоли - это сложные вещества,
которые в водных растворах
диссоциируют на катионы металла и
анионы кислотного остатка.
NaCl →
K2SO4
Na+ + Сl→ 2 K+ + SO4 2-
Al(NO3)3 → Al3+ + 3 NO3 -
Me
n+
(кислотный остаток)
18
19.
Электролитическая диссоциация6. О значении электролитов для живых организмов
Электролиты – составная часть жидкостей и плотных
тканей живых организмов.
Ионы Na+,K+,Ca2+,Mg2+,H+; OH-; Cl-; SO4-2; НCO3- имеют
большое значение для физиологических и биохимических
процессов:
ионы H+; OH- играют большую роль в работе ферментов,
обмене веществ, переваривании пищи и др.
при нарушении водно-солевого обмена в медицине
применяется физиологический раствор – 0,85% раствор
NaCl;
ионы I - влияют на работу щитовидной железы.
19
20.
Механизм электролитической диссоциацииNaCl
Разрушение кристаллической решетки под
действием молекул воды.
Гидратация
NaCl + nН2О →Na+ (Н2О)х + Сl-(Н2О)n-х
NaCl →
Na+
+ Cl
-
Механизм ЭД
HCl
Поляризация связи в молекуле НСl под
действием молекул воды.
Гидратация
HCl + nН2О →H+ (Н2О)х + Сl-(Н2О)n-х
+
Механизм ЭД
НCl → Н + Cl
24.02.2024
20















 chemistry
chemistry








