Similar presentations:
Теория электролитической диссоциации (ТЭД)
1.
«Математика – царица всех наук,химия – глаза и руки её»
М.В.Ломоносов.
2.
Теория электролитическойдиссоциации (ТЭД).
3.
Содержание1. Электролиты и неэлектролиты
2. Теория электролитической диссоциации
3. Механизм электролитической диссоциации
веществ с ионной связью
4. Механизм электролитической диссоциации
веществ с ковалентной полярной связью
5. Сильные и слабые электролиты
6. Количественная оценка диссоциации
7. О значении электролитов для живых организмов
4.
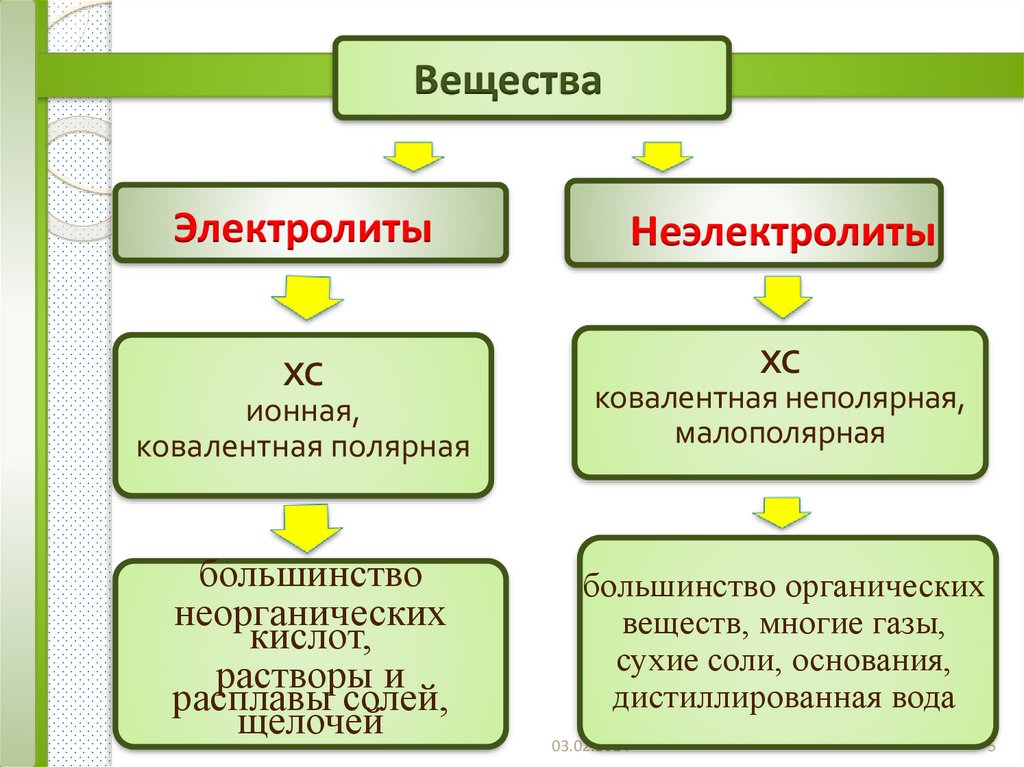
Все вещества по отношению к электрическому токуможно разделить на электролиты и неэлектролиты.
Электролиты – вещества, растворы и
расплавы которых проводят электрический ток.
Неэлектролиты – вещества, растворы и
расплавы которых не проводят
электрический ток.
5.
1Вещества
Электролиты
Неэлектролиты
ХС
ионная,
ковалентная полярная
ХС
ковалентная неполярная,
малополярная
большинство
неорганических
кислот,
растворы и
расплавы солей,
щелочей
большинство органических
веществ, многие газы,
сухие соли, основания,
дистиллированная вода
03.02.2024
5
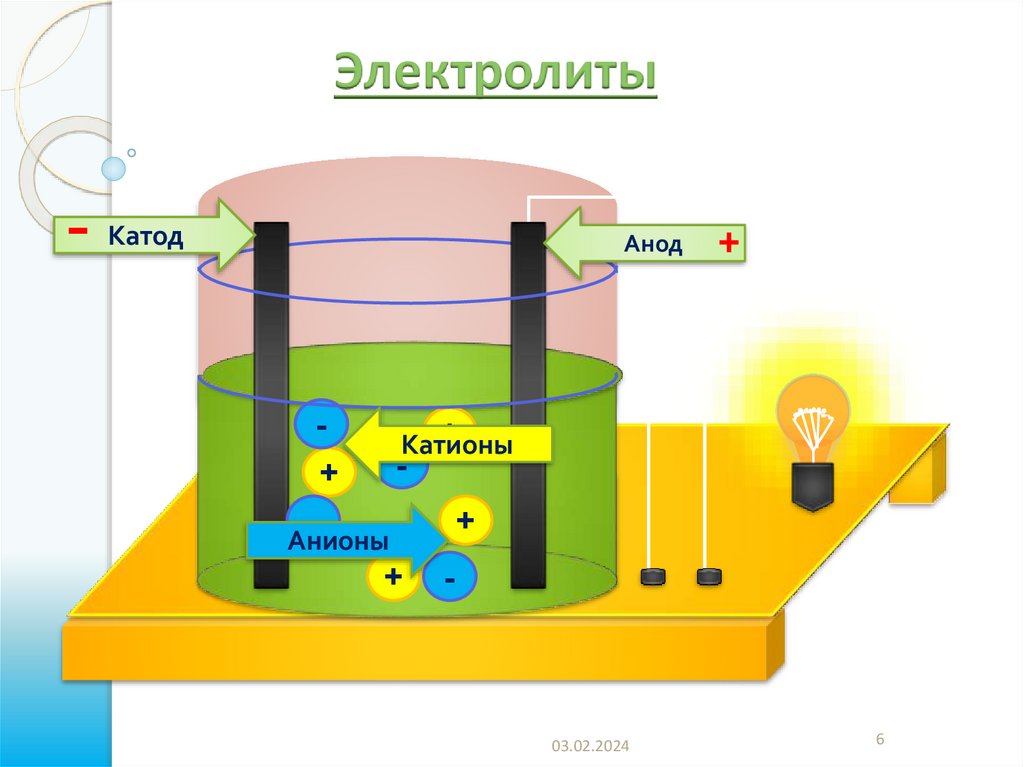
6.
Электролиты-
Катод
Анод
+
-
+
+
Катионы
-
Анионы
+
+
-
03.02.2024
6
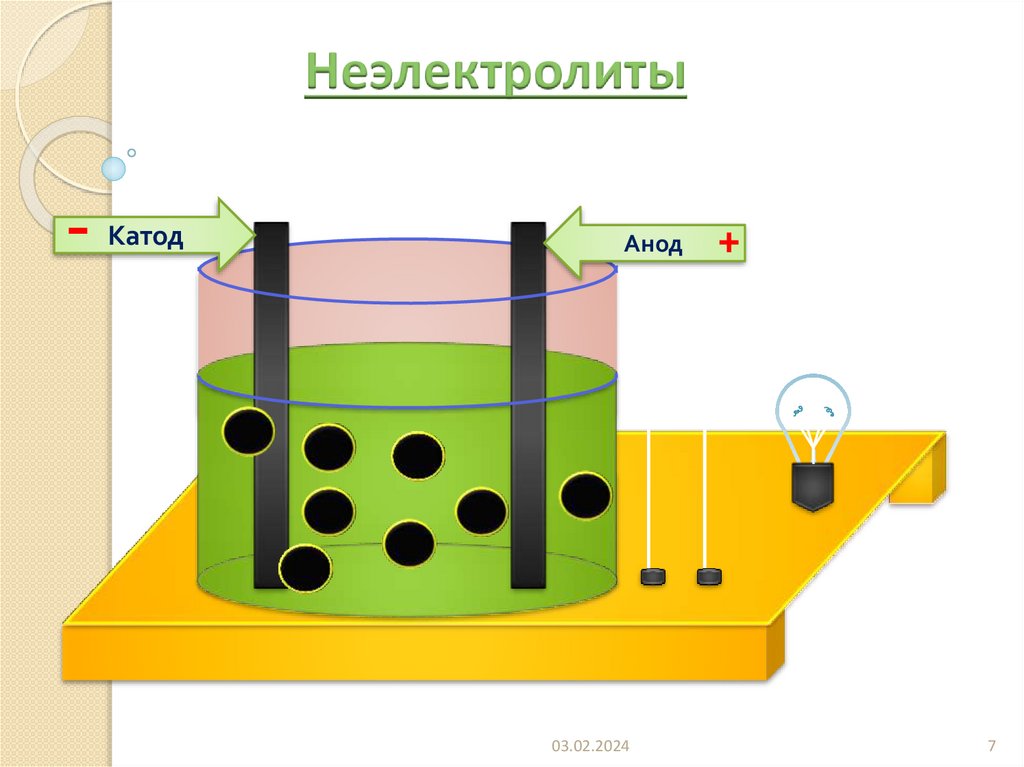
7.
Неэлектролиты-
Катод
Анод
03.02.2024
+
7
8.
2.Электролитическая диссоциацияАррениус Сванте
Август
С.Аррениус
(1859 – 1927)
Шведский ученый, академик.
В 1887 году сформулировал
основные положения теории
электролитической диссоциации.
В 1903 г. награжден
Нобелевской премией.
Проводил исследования во
многих других областях науки.
03.02.2024
8
9.
Каблуков Иван АлексеевичСущественный
вклад в развитие
ТЭД внесли русские
ученые И.А.
Каблуков и В.А.
Кистяковский.
Кистяковский Владимир Александрович
10.
Электролитическая диссоциация –процесс распада электролита на ионы.
1. Все вещества по способности диссоциировать в
растворе и расплаве делятся на электролиты и
неэлектролиты.
2. Электролиты диссоциируют на ионы:
положительные(катионы) и отрицательные(анионы).
Суммарный заряд всех катионов равен суммарному
заряду катионов, в целом раствор(расплав) нейтрален.
11.
3. Ионы непрерывно движутся. Происходитассоциация - притяжение противоположно
заряженных ионов с образованием частиц
электролита. Диссоциация - процесс
обратимый.
4. Равновесное состояние водного раствора
электролита характеризует степень
электролитической диссоциации.
12.
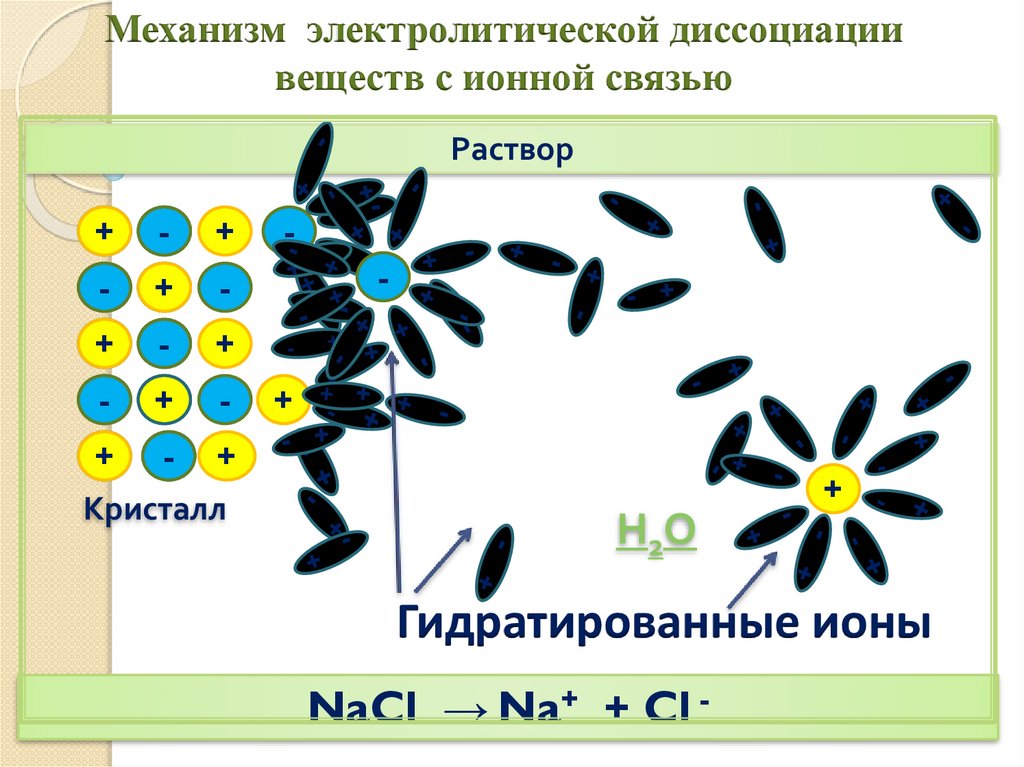
Механизм электролитической диссоциациивеществ с ионной связью
Раствор
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
Кристалл
+
+
Н2О
Гидратированные ионы
NaCl → Na+ + Cl -
13.
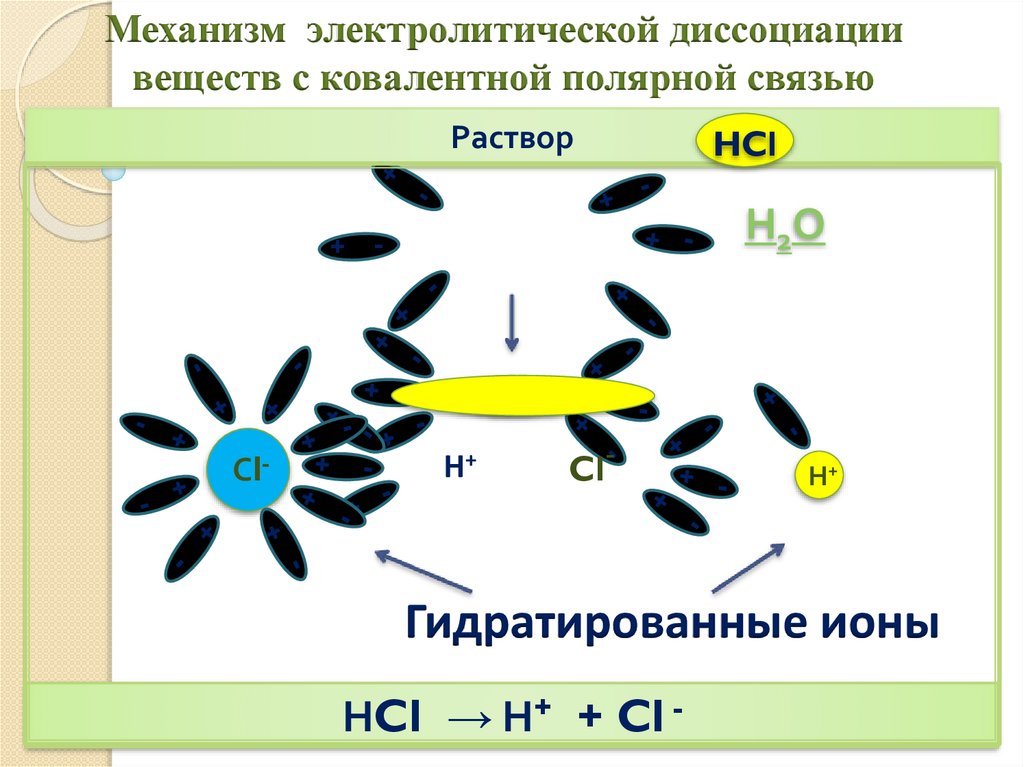
Механизм электролитической диссоциациивеществ с ковалентной полярной связью
Раствор
+
Н2О
-
+
Сl-
HCl
H+
Cl-
Н+
Гидратированные ионы
НCl → Н+ + Cl -
14.
Количественная оценка диссоциацииСтепень электролитической
диссоциации (α) - отношение числа частиц,
распавшихся на ионы (n) к общему числу
частиц электролита(N).
α=
n
Сильные электролиты α
N
Средние электролиты
> 30%
α = 2 – 30%
Слабые электролиты
03.02.2024
α< 2%
14
15.
Константа диссоциации – отношениепроизведения концентрации продуктов диссоциации к
концентрации недиссоциированных молекул.
+
k=
−
[А ][В ]
[АВ]
HNO2+ <=> −H +NO2
+
k=
[H ][NO2 ]
[HNO2]
-
= 5,1 ∙ 10
–4
16.
2.Сильные и слабые электролиты+
+
+
+
+
++
+
Сильные и слабые
Рис.6.
16
17.
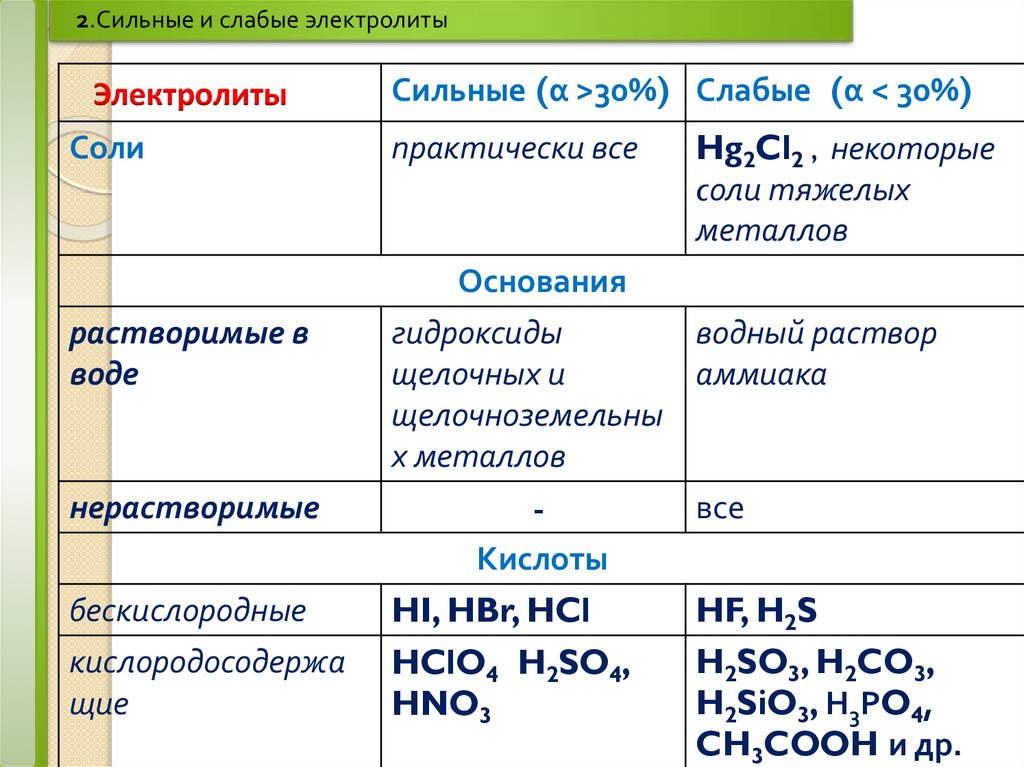
2.Сильные и слабые электролитыЭлектролиты
Соли
растворимые в
воде
нерастворимые
Сильные (α >30%) Слабые (α < 30%)
практически все
Hg2Cl2 , некоторые
cоли тяжелых
металлов
Основания
гидроксиды
водный раствор
щелочных и
аммиака
щелочноземельны
х металлов
все
Кислоты
бескислородные
кислородосодержа
щие
HI, HBr, HCl
HClO4 H2SO4,
HNO3
HF, H2S
H2SO3, H2CO3,
H2SiO3, Н3РO4,
CH3COOH и др.
18.
19.
2.Сильные и слабые электролитыРис.7. Степень диссоциации некоторых кислот в водных
растворах при 180С
%
100
80
60
40
20
92
58
30
8,5
0,17
0
19
20.
Электролитическая диссоциация6. О значении электролитов для живых организмов
Электролиты – составная часть жидкостей и плотных
тканей живых организмов.
Ионы Na+,K+,Ca2+,Mg2+,H+; OH-; Cl-; SO4-2;
имеют
НCO3
большое значение для физиологических и биохимических
процессов:
ионы H+; OH- играют большую роль в работе ферментов,
обмене веществ, переваривании пищи и др.
при нарушении водно-солевого обмена в медицине
применяется физиологический раствор – 0,85% раствор
NaCl;
ионы I - влияют на работу щитовидной железы.
20
21.
Характерные симптомы дефицита химических элементов в организме человекаИоны
2+
Замедление роста скелета
2+
Мускульные судороги
Са
Mg
Fe
Типичный симптом
2+
Zn
Анемия, нарушение иммунной системы
2+
Повреждение кожи, замедление
полового созревания
2+
Учащение депрессий, дерматиты
Mn
подробне
е
21
22.
23.
24.
25.
26.
KHCO3 ⇄ K+ + HCO3– (α=1)HCO3– ⇄ H+ + CO32– (α < 1)
Mg(OH)Cl ⇄ MgOH+ + Cl–
(α=1)
MgOH+ ⇄ Mg2+ + OH– (α<< 1)
Кислые соли диссоциируют
также ступенчато, сначала
разрываются ионные связи, затем —
ковалентные полярные. Например,
гидрокабонат калия и
гидроксохлорид магния:

















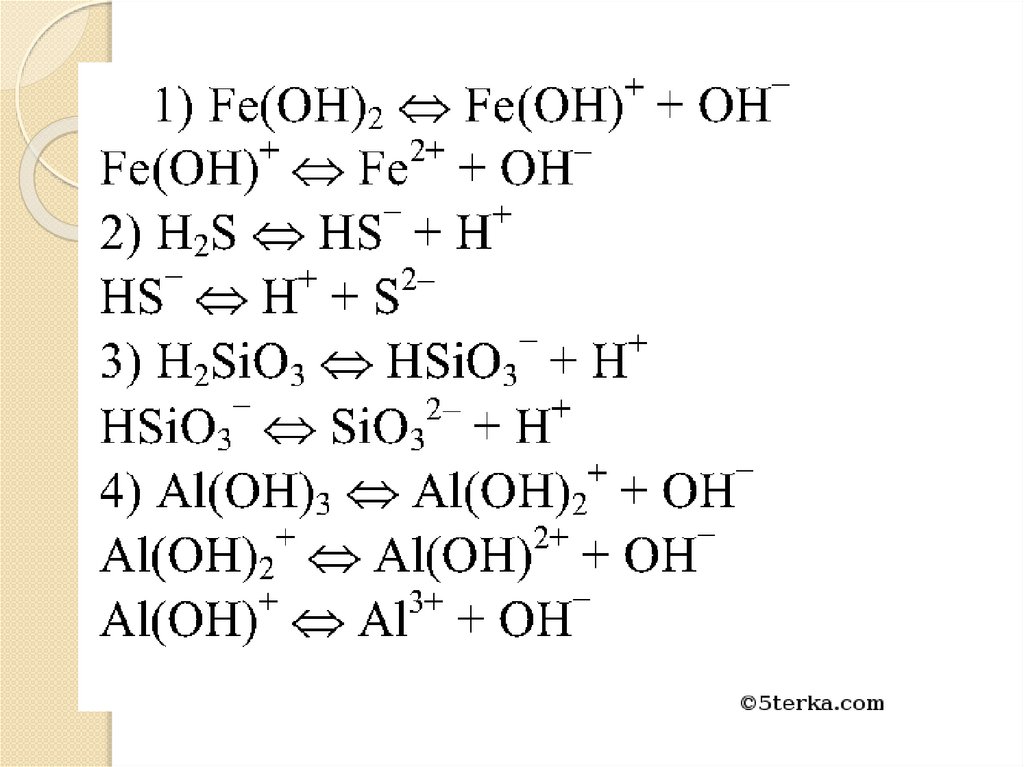

 chemistry
chemistry








