Similar presentations:
Теория электролитической диссоциации (ТЭД)
1. Теория электролитической диссоциации (ТЭД).
2. План урока
1. Теория электролитическойдиссоциации.
2. I- е положение ТЭД.
3. Задания к I-му положению ТЭД.
4. II-е положение ТЭД.
5. Задания к II-му положению ТЭД.
3. 1. Теория электролитической диссоциации (ТЭД).
СвантеАррениус
В 1887г. Шведский учёный
С.Аррениус для объяснения
особенностей водных растворов
веществ предложил теорию
электролитической диссоциации.
В дальнейшем эта теория была
развита многими учёными, в том
числе И.А. Каблуковым и
В.А. Кистяковским.
4.
I-е положение:Все вещества по их способности
проводить электрический ток в
растворах делятся на электролиты и
неэлектролиты.
5.
Испытание веществ наэлектропроводность
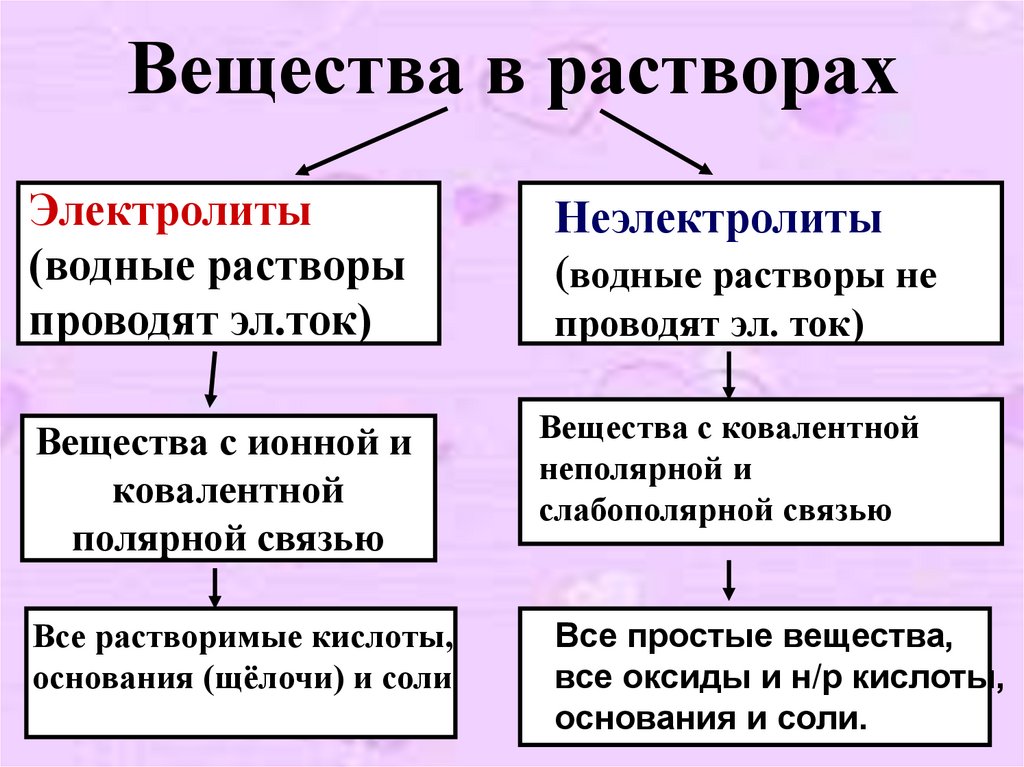
6. Вещества в растворах
Электролиты(водные растворы
проводят эл.ток)
Неэлектролиты
(водные растворы не
Вещества с ионной и
ковалентной
полярной связью
Вещества с ковалентной
неполярной и
слабополярной связью
Все растворимые кислоты,
основания (щёлочи) и соли
Все простые вещества,
все оксиды и н/р кислоты,
основания и соли.
проводят эл. ток)
7. Задания к I-му положению ТЭД
1. Какие вещества называютсяэлектролитами и неэлектролитами?
2. Назовите по два вещества, которые
являются электролитами и
неэлектролитами.
3. Укажите вид связи и принадлежность
данных веществ к электролитам и
неэлектролитам: KCl, O2 , HNO3 ,CuO.
4. Назовите из перечня веществ электролиты
(не забудьте воспользоваться таблицей
растворимости !): BaCl2 , CaO, H2 SO4 ,
NaOH, Cl2 , Zn(OH)2
8. II-е положение ТЭД
В растворах электролиты диссоциируют( распадаются ) на положительные и
отрицательные ионы.
Процесс распада электролита на ионы
называется электролитической
диссоциацией (ЭД).
Причиной диссоциации электролита
является его взаимодействие с молекулами
воды (гидратация).
9.
10. Механизм ЭД:
Вещества сВещества с
ионной связью:
ковалентной
Ориентация
связью:
диполей воды Ориентация диполей
гидратация воды гидратация
ионизация
диссоциация.
диссоциация
11.
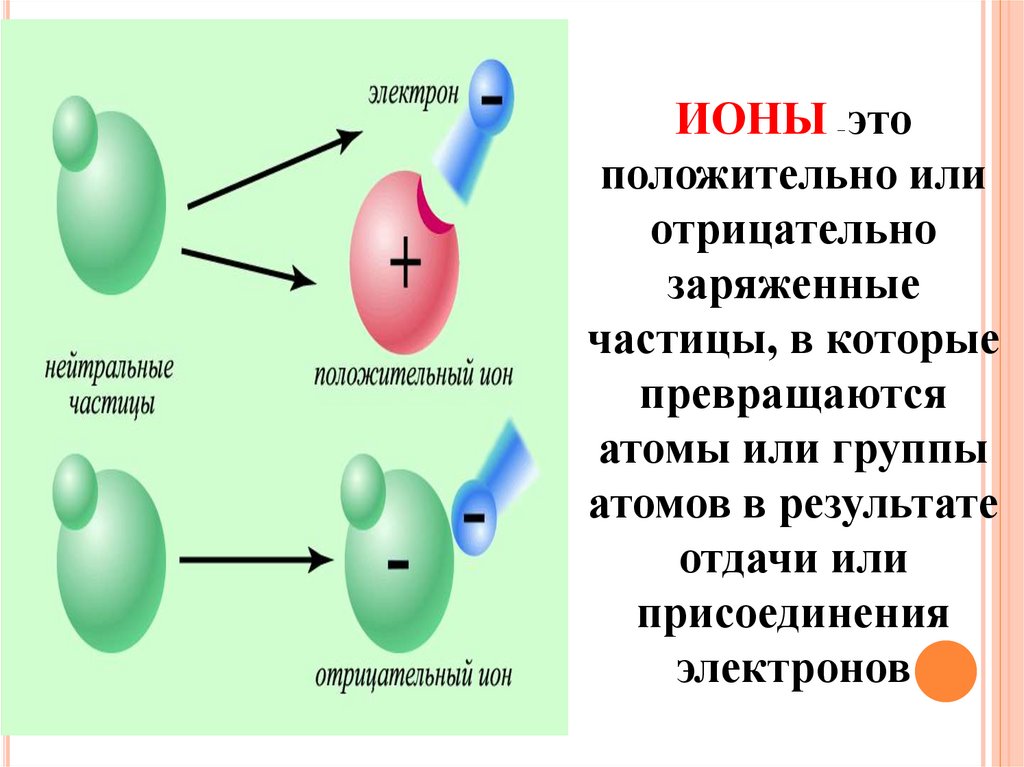
ИОНЫ этоположительно или
отрицательно
заряженные
частицы, в которые
превращаются
атомы или группы
атомов в результате
отдачи или
присоединения
электронов
–
12. Типы ионов
1) По заряду: катионы(положительные - Mg2+ ) и
анионы (отрицательные- SO42-);
2) По отношению к воде:
Гидратированные и
негидратированные
( в безводных средах)
3) По составу: простые ( Na+, Cl- ) и
сложные ( PO43-, OH- ).
13.
14. Сильные и слабые электролиты
αnν дисс
nν общ
Зависит
от:
-природы
электролита
- от t °
- от с
Слабые
< 3%
H2S H2SiO3
H2CO3
дисс
общ
Средней силы
3%< <30%
H3PO4 HF HNO2 H2SO3
Сильные >30%
1.Растворимые соли
2.Щелочи: LiOH NaOH KOH RbOH
CsOH FrOH Ca(OH)2 Sr(OH)2 Ba(OH)2
3.Кислоты HCl, HBr, HI HNO3
HClO4 H2SO4 HMnO4 HClO H CrO
3
2
4
15.
Условия, влияющие на ЭДКонцентрация электролита
Температура
СH3COOН <=> СH3COO- + Н+
Природа электролита
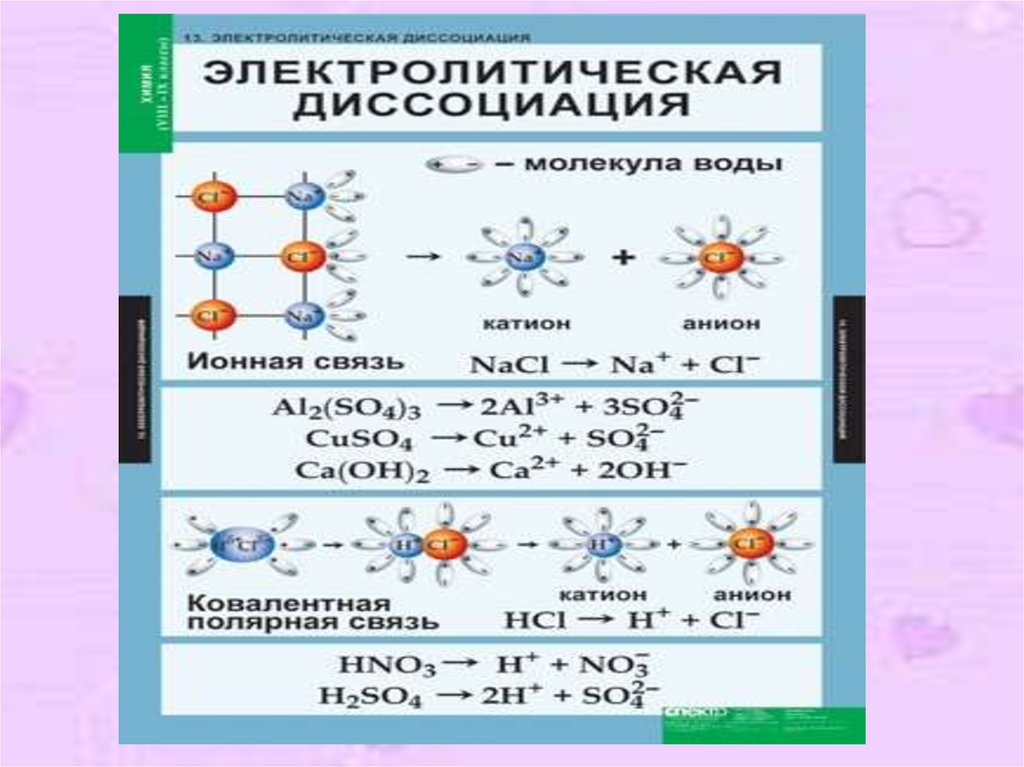
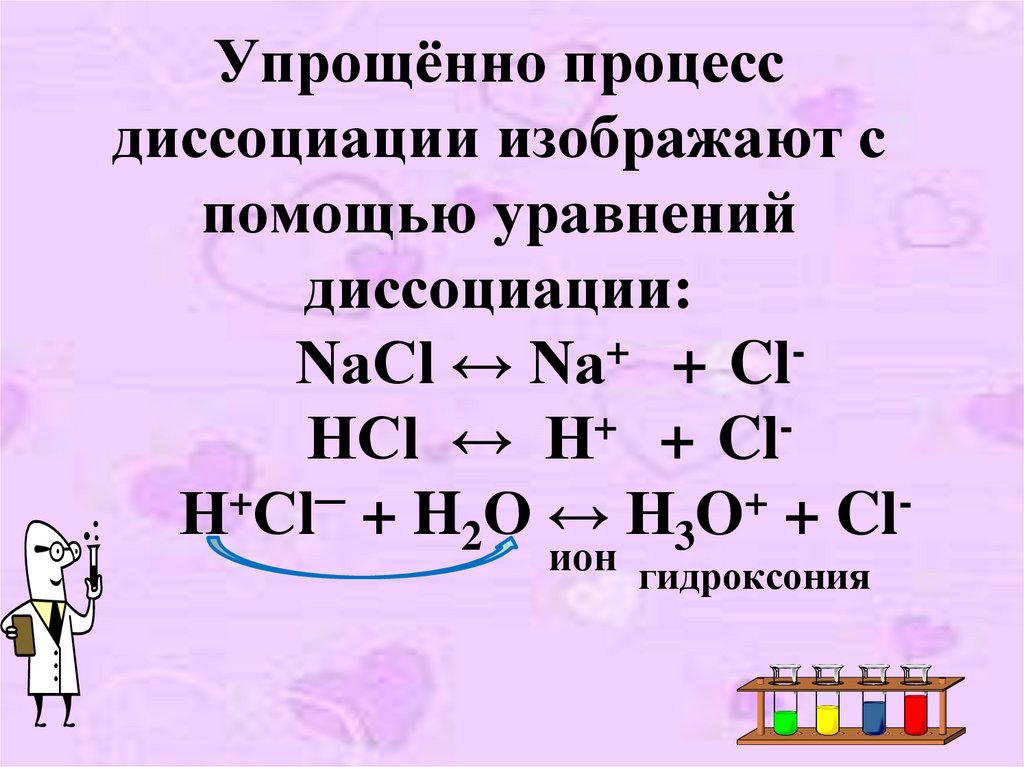
16. Упрощённо процесс диссоциации изображают с помощью уравнений диссоциации: NaCl ↔ Na+ + Cl- HCl ↔ H+ + Cl- Н+Сl─ + H2O ↔ H3O+ +
Упрощённо процессдиссоциации изображают с
помощью уравнений
диссоциации:
NaCl ↔ Na+ + ClHCl ↔ H+ + ClН+Сl─ + H2O ↔ H3O+ + Clион гидроксония
17. ΙΙΙ –е положение ТЭД Ионы находятся в движении. В постоянном электрическом поле движение ионов становится направленным.
18.
Химические свойстварастворов электролитов
определяются свойствами
тех ионов, которые они
образуют при
диссоциации.
19. ЭЛЕКТРОЛИТЫ (по характеру образующихся ионов)
ЭЛЕКТРОЛИТЫ(ПО ХАРАКТЕРУ ОБРАЗУЮЩИХСЯ
ИОНОВ)
КИСЛОТЫ
ОСНОВАНИЯ
СОЛИ
20. ЗАДАНИЕ
Составьте возможныеуравнения электролитической
диссоциации веществ в водных
растворах:
1) HCl 2) HNO3
3) Н2SiO3
21. ДОПИШИТЕ ОПРЕДЕЛЕНИЕ
Кислоты – это электролиты,которые диссоциируют на
катионы …
и анионы…
22. КИСЛОТЫ - это
КИСЛОТЫ - ЭТОэлектролиты, которые при
диссоциации образуют катионы
водорода и анионы кислотного
остатка. HCl = H+ + ClHNO3 = H+ + NO3H+ + H2O = H3O+
ион гидроксония
23. Многоосновные кислоты диссоциируют ступенчато
МНОГООСНОВНЫЕ КИСЛОТЫДИССОЦИИРУЮТ СТУПЕНЧАТО
H3PO4 (ортофосфорная кислота)
1) Образование дигидроортофосфат-
ионов
H3PO4 ↔ H+ + H2PO42) Образование гидроортофосфатионов
H2PO4- ↔ H+ + HPO423) Образование ортофосфат-ионов
HPO42- ↔ H+ + PO43-
24. ЗАДАНИЕ
Составьте возможныеуравнения электролитической
диссоциации веществ в водных
растворах.
1) NaOH
2) KOH
3)NH4OH 4) 2Fe(NO3)3
25. ДОПИШИТЕ ОПРЕДЕЛЕНИЕ
Основания – это электролиты,которые диссоциируют на
катионы …
и анионы…
26. ОСНОВАНИЯ - это
ОСНОВАНИЯ - ЭТОэлектролиты, которые при
диссоциации образуют катионы
металла и гидроксид-анионы.
NaOH = Na+ + OH-
KOH = K+ + OH-
27. Многокислотные основания диссоциируют ступенчато
МНОГОКИСЛОТНЫЕ ОСНОВАНИЯДИССОЦИИРУЮТ СТУПЕНЧАТО
Ba(OH)2 (гидроксид бария)
1) Образование гидроксо-ионов
бария
Ba(OH)2 ↔ OH- + BaOH+
2) Образование ионов бария
BaOH+ ↔ Ba2+ + OH-
28. ЗАДАНИЕ
Составьте возможныеуравнения электролитической
диссоциации веществ в водных
растворах.
1) NaCl 2) 4KNO3 3) BaSO4
29. ДОПИШИТЕ ОПРЕДЕЛЕНИЕ
Cоли – это электролиты, которыедиссоциируют на
катионы
и анионы
30. СОЛИ -это
СОЛИ -ЭТОэлектролиты, которые при
диссоциации образуют катионы
металла (или аммония NH4+) и
анионы кислотных остатков.
Na3PO4
+
3= 3Na + PO4
+
NH4NO3= NH4 +NO3
31. ПРОВЕРЬ СВОИ ЗНАНИЯ
Вещества, растворы которыхпроводят электрический ток,
называют ………
Процесс распада электролита на
ионы называют ……..
Вещества, растворы которых не
проводят электрический ток,
называют ……….
Отношение числа частиц,
распавшихся на ионы, к общему
числу растворенных частиц
называют …………



























 chemistry
chemistry








