Similar presentations:
Теория электролитической диссоциации (ТЭД)
1. Теория электролитической диссоциации (ТЭД)
2. Все вещества по отношению к электрическому току можно разделить на :
3.
Электролитами называются вещества, растворы илирасплавы которые проводят электрический ток.
Электролиты:
соли;
кислоты;
основания.
Тип связи: ионные или ковалентные полярные.
4.
Неэлектролитами называются вещества, растворыили расплавы которые не проводят электрический ток.
Неэлектролиты:
кислород;
водород;
многие органические вещества (сахар, эфир, бензол).
Тип связи: ковалентные неполярные
5.
процесс растворения электролитовсопровождается образованием
заряженных частиц, способных
проводить электрический ток.
Процесс появления гидратированных
ионов в водном растворе называется
электролитической диссоциацией
(С. Аррениус, 1887 г.)
6.
7. Первое положение ТЭД
Все вещества по их способностипроводить электрический ток в
растворах или расплавах делятся на
электролиты и неэлектролиты.
8. Второе положение ТЭД
Врастворах
электролиты
диссоциируют
(распадаются)
на
положительные и отрицательные ионы.
NaOH Na OH
H 2SO 4 2H SO 42
MgCl 2 Mg2 2Cl
Процесс распада электролита на ионы в
растворе или расплаве называется
электролитической диссоциацией.
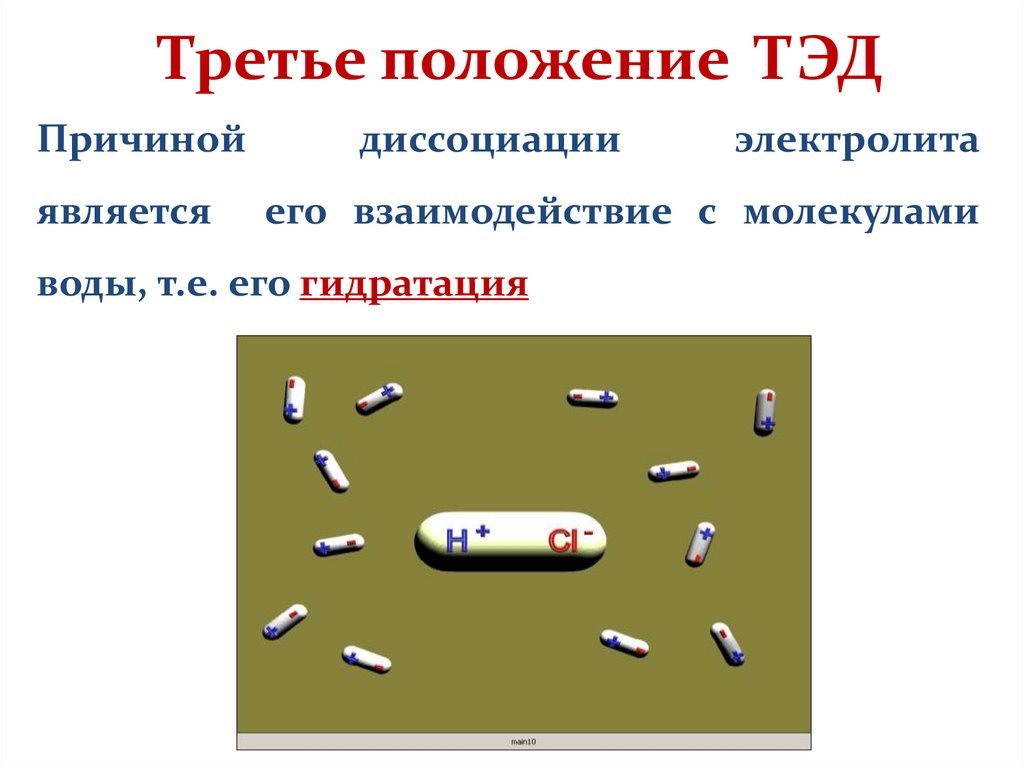
9. Третье положение ТЭД
Причинойявляется
диссоциации
электролита
его взаимодействие с молекулами
воды, т.е. его гидратация
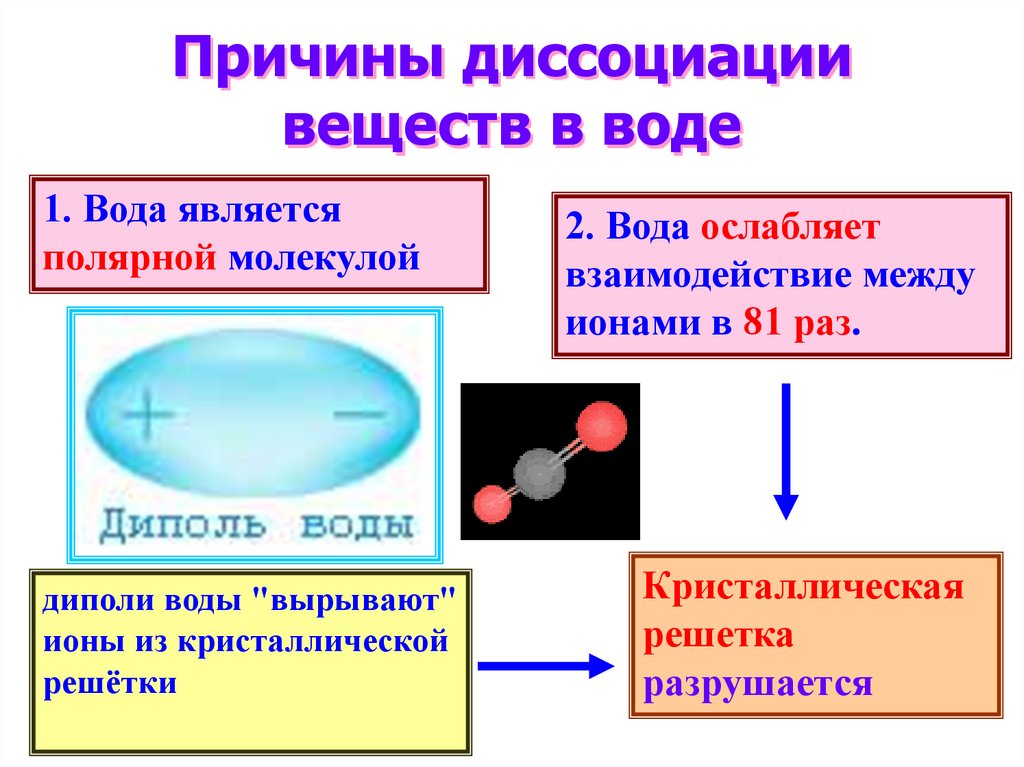
10. Причины диссоциации веществ в воде
1. Вода являетсяполярной молекулой
диполи воды "вырывают"
ионы из кристаллической
решётки
2. Вода ослабляет
взаимодействие между
ионами в 81 раз.
Кристаллическая
решетка
разрушается
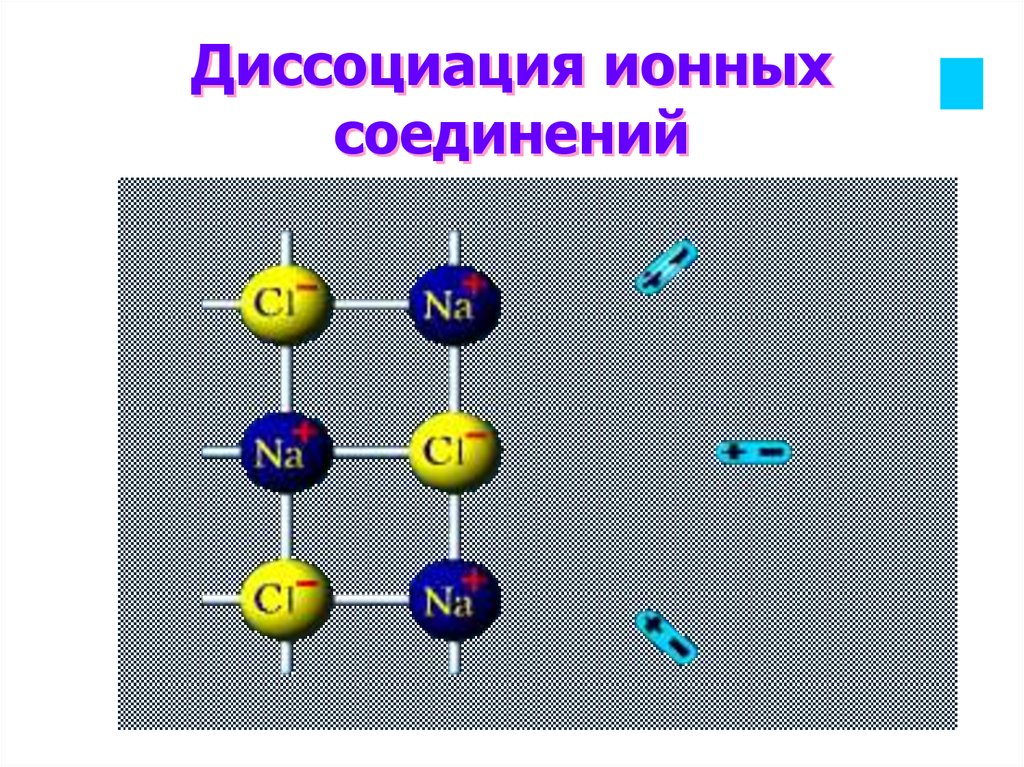
11. Диссоциация ионных соединений
12.
Образование в результате распада электролитовгидратированных ионов отражается при написании
уравнений диссоциации, однако, чаще эти
уравнения записывают в более короткой форме
+
-
NaCl+mH2O Na (H2O)x + Cl (H2O)y
+
-
NaCl Na +Cl
+
-
HCl+mH2O H (H2O)x+ Cl (H2O)y
+
-
HCl H +Cl
13. Четвертое положение ТЭД
Под действием тока положительныеионы движутся к катоду и называются
катионы, а отрицательные – к аноду и
называются анионы.
14. Пятое положение ТЭД
Не все электролиты в одинаковоймере диссоциируют на ионы
Сильные
электролиты
Электролиты
средней силы
Слабые
электролиты
> 30%
3% 30%
< 3%
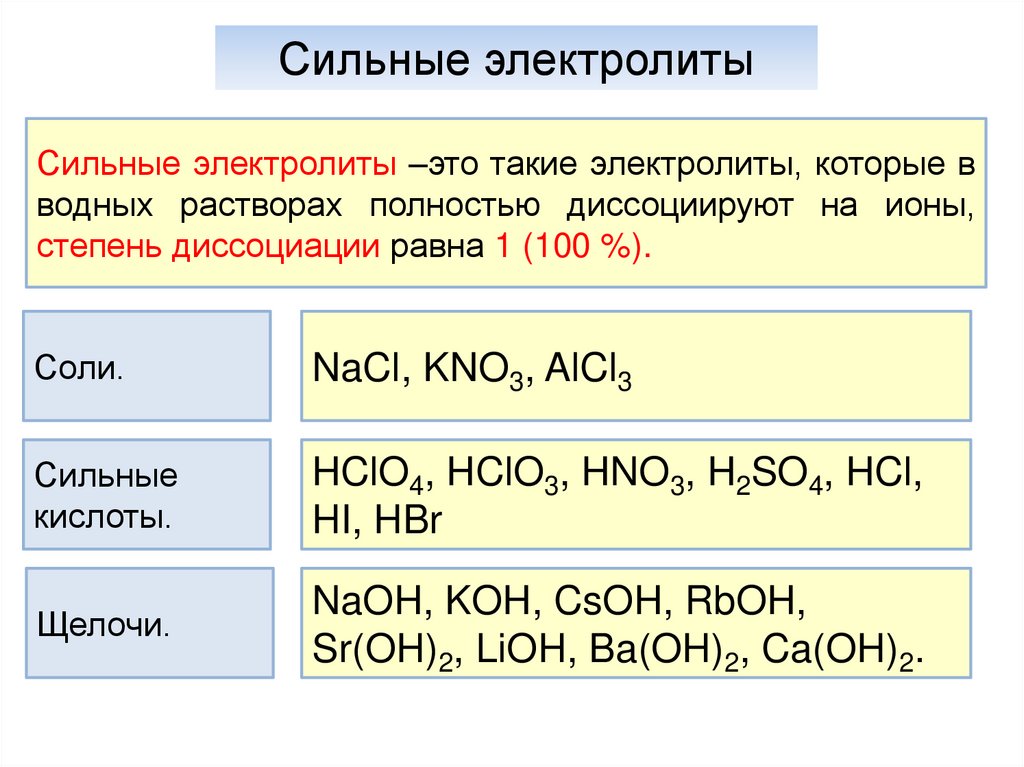
15.
Сильные электролитыСильные электролиты –это такие электролиты, которые в
водных растворах полностью диссоциируют на ионы,
степень диссоциации равна 1 (100 %).
Соли.
NaCl, KNO3, AlCl3
Сильные
кислоты.
HClO4, HClO3, HNO3, H2SO4, HCl,
HI, HBr
Щелочи.
NaOH, KOH, CsOH, RbOH,
Sr(OH)2, LiOH, Ba(OH)2, Ca(OH)2.
16.
Слабые электролитыСлабые электролиты –это такие электролиты, которые в
водных растворах не полностью диссоциируют на ионы,
степень диссоциации меньше 1 (100 %).
Слабые кислоты:
HClO2, HClO, HNO2, H2SO3,H2CO3, H2SiO3,
H3PO4, H3PO3, H3BO3, CH3COOH, H2S, HCN, HF
Слабые нерастворимые в воде основания:
Fe(OH)2, Cu(OH)2, Pb(OH)2
Гидроксид аммония:
NH4OH.
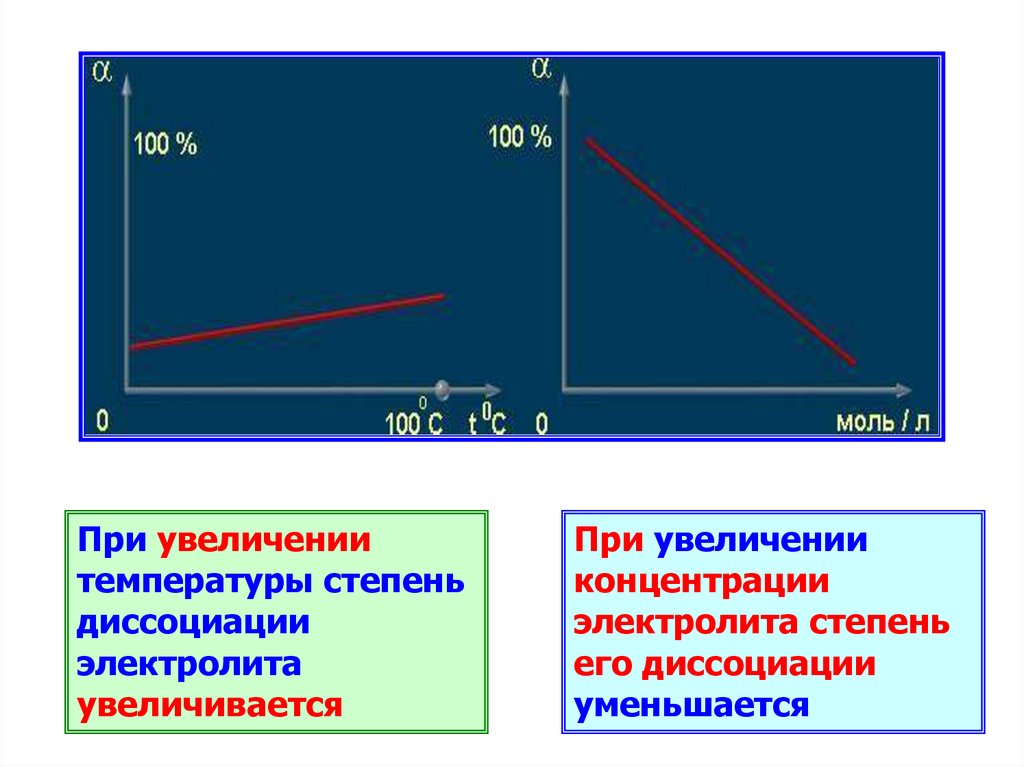
17.
При увеличениитемпературы степень
диссоциации
электролита
увеличивается
При увеличении
концентрации
электролита степень
его диссоциации
уменьшается
18.
Шестое положение ТЭДСвойства растворов электролитов
определяются
свойствами
тех
ионов, которые они образуют при
диссоциации.
19. Шестое положение ТЭД
Условия протекания реакцииионного обмена
Реакции
в
растворах
электролитов
протекают до конца если:
1. Образуется или растворяется осадок;
2. Выделяется газ;
3. Образуется
вещество
малодиссоциирующее
20. Классы неорганических веществ с точки зрения ТЭД. Диссоциация кислот, оснований, солей
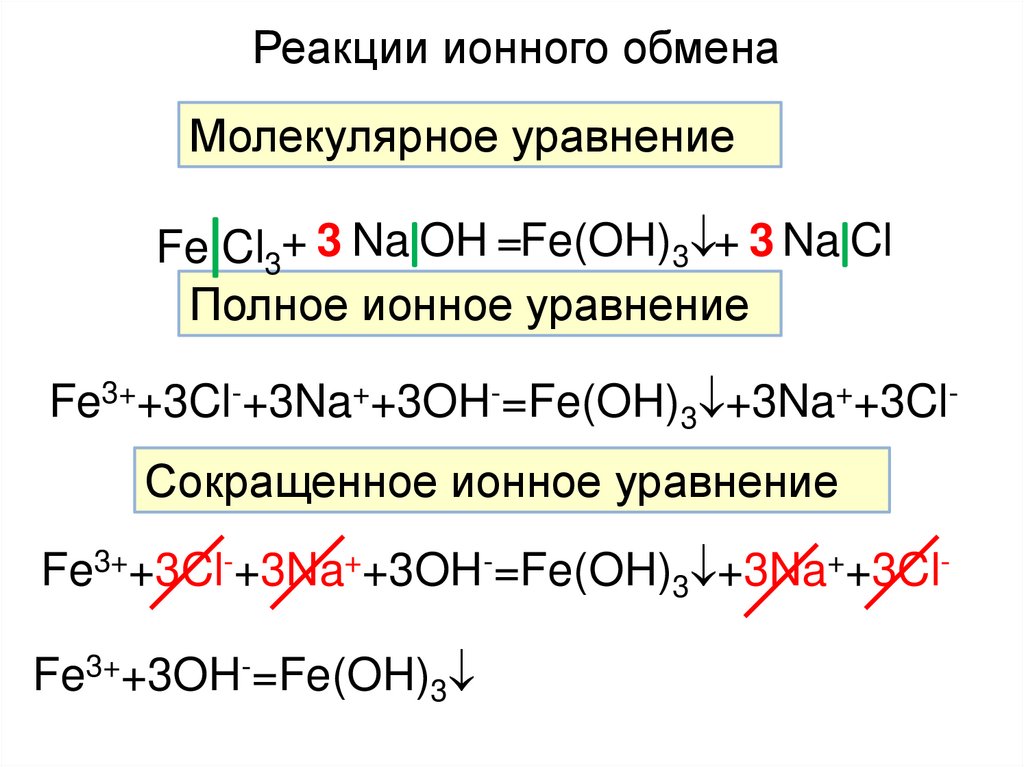
Реакции ионного обменаМолекулярное уравнение
Fe Cl3+ 3 Na OH =Fe(OH)3 + 3 Na Cl
Полное ионное уравнение
Fe3++3Cl-+3Na++3OH-=Fe(OH)3 +3Na++3ClСокращенное ионное уравнение
Fe3++3Cl-+3Na++3OH-=Fe(OH)3 +3Na++3ClFe3++3OH-=Fe(OH)3
21. Основность кислот
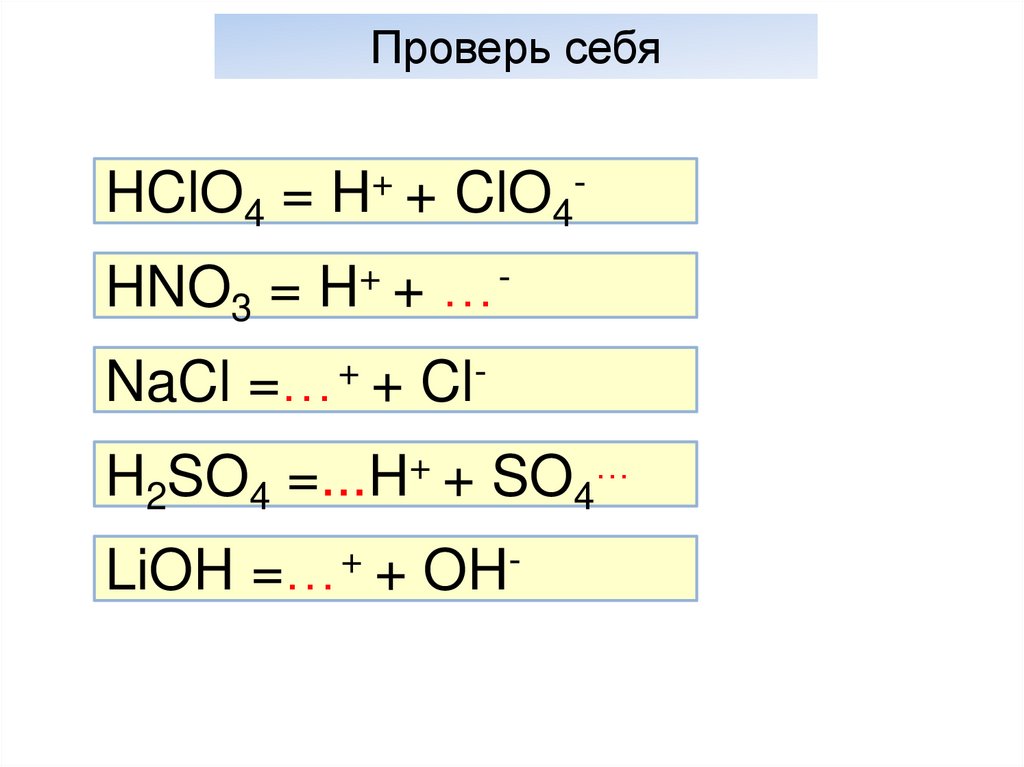
Проверь себяHClO4 = H+ + ClO4HNO3 = H+ + …NaCl =…+ + ClH2SO4 =...H+ + SO4…
LiOH =…+ + OH-













 chemistry
chemistry








