Similar presentations:
Общая характеристика элементов VI A группы
1.
2.
Общая характеристикаэлементов VI A группы
Общая характеристика
серы. Аллотропия.
Химические свойства
серы.
3.
Po+84
2 8 18 6
))))) 5s 5p
2
4
2 8 18 18 6
)))))) 6s 6p
2 8 18 32 18 6
2
4
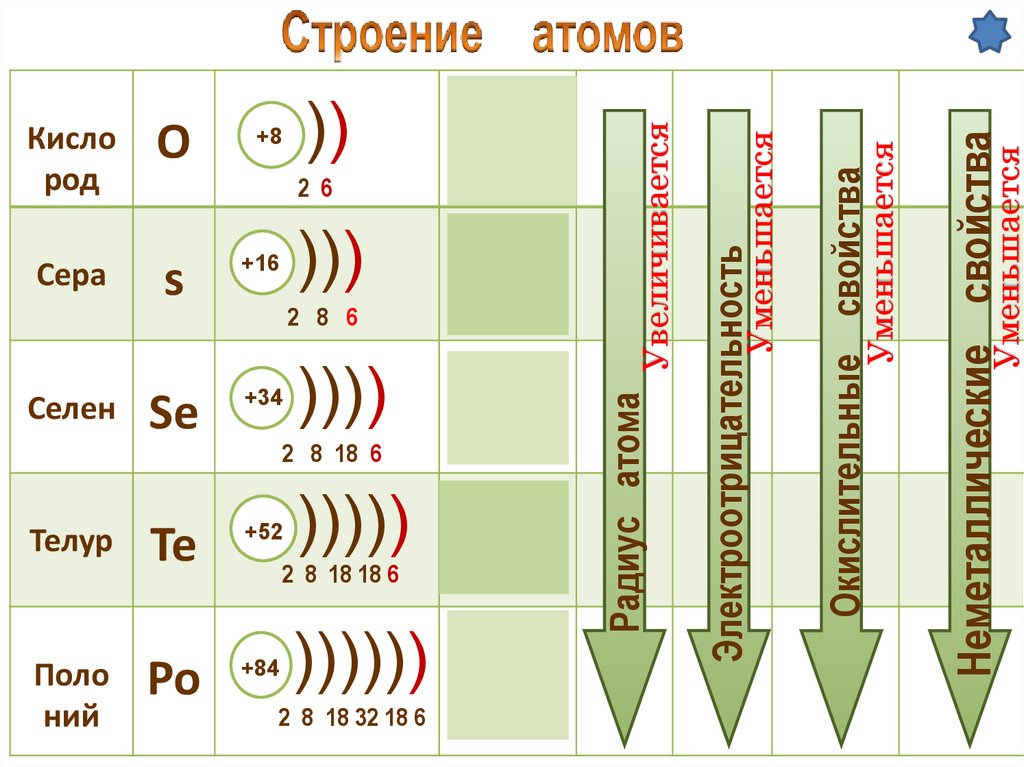
Уменьшается
Поло
ний
4s24p4
Неметаллические свойства
Te
+52
))))
Уменьшается
Телур
2 8 6
Окислительные свойства
Se
+34
3s23p4
Уменьшается
)))
s
Селен
2s22р4
2 6
+16
Сера
))
Электроотрицательность
+8
Увеличивается
О
Радиус атома
Кисло
род
4.
32S
3 период (м); VIA группе
16
S(16p;16n)16e )2)8)6
32
16
2
2
6
2
4
0
1s 2s 2p 3s 3p 3d
Вал-ть: II, IV, VI
СО: -2, 0, +4, +6
вль вль/оль оль
5.
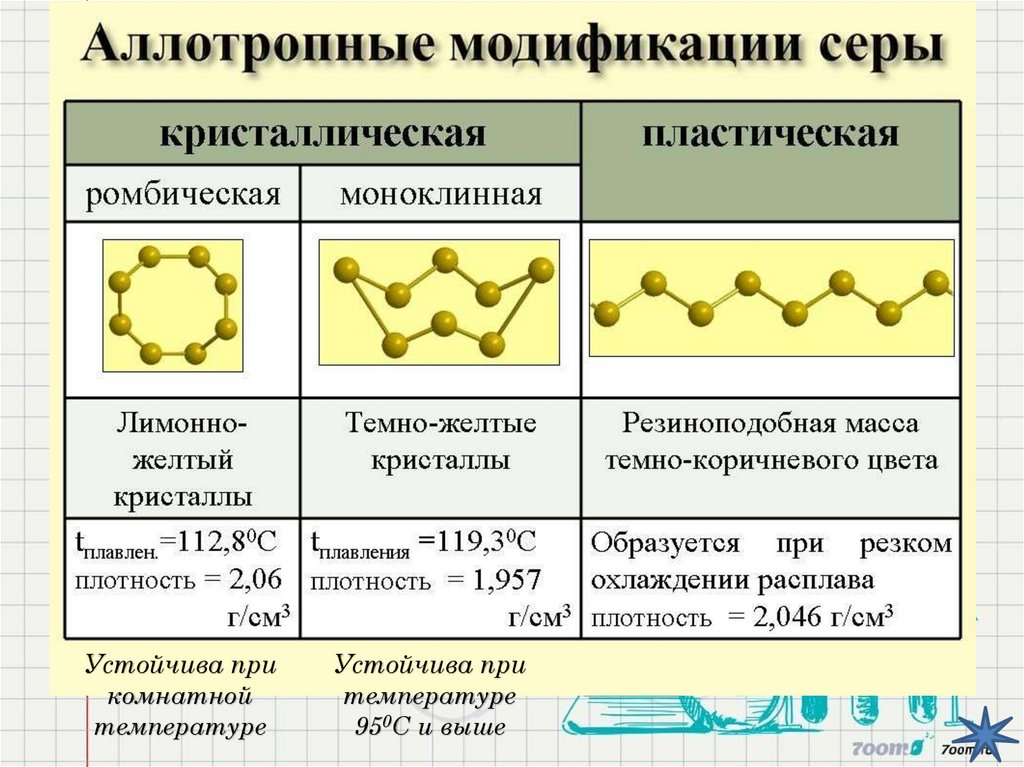
Твёрдое кристаллическое вещество;Желтого цвета;
Без запаха;
Плохо проводит теплоту и не
проводит электрический ток;
Плотность серы = 2,07 г/см3
Сера в воде не тонет, не
растворяется и водой не
смачивается;
Легкоплавкая, tплав = 112,80C;
Обладает свойством
АЛЛОТРОПИИ
6.
7.
Устойчива прикомнатной
температуре
Устойчива при
температуре
950С и выше
8.
В самородномвиде
В составе сложных Барит BaSO4
веществ (сульфаты,
пирит FeS2
сульфиды)
цинковая обманка
Гипс
ZnS(сфалерит) CaSO4·2H2O
Глауберова соль
Мирабиллит
Na2SO4·10H2O
1. Выплавление из руды с помощью водяного пара.
2. Добыча руды открытым способом с последующим отделением серы.
1. Неполное окисление сероводорода
(при недостатке кислорода)
2H2S + O2 → 2S + 2H2O
2. Реакция Валенродера
2H2S + SO2 → 3S + 2H2O
9.
S – окислительS + 2е = S-2
1. Взаимодействие с металлами
0
+1
-2
Na + S = Na2S
0
+1
Na – 1e = Na
0
-2
S + 2e = S
окислитель, восстановление
Hg + S = HgS
Процесс ДЕМЕРКУРИЗАЦИЯ
0
восстановитель, окисление
- удаление и
обезвреживание
ртути
2.Взаимодействие с водородом и другими неметаллами
0
0
+1
-2
Н2 + S = Н2S
+1
Н2 – 2·1e = 2H восстановитель, окисление
0
-2
окислитель, восстановление
S + 2e = S
0
10.
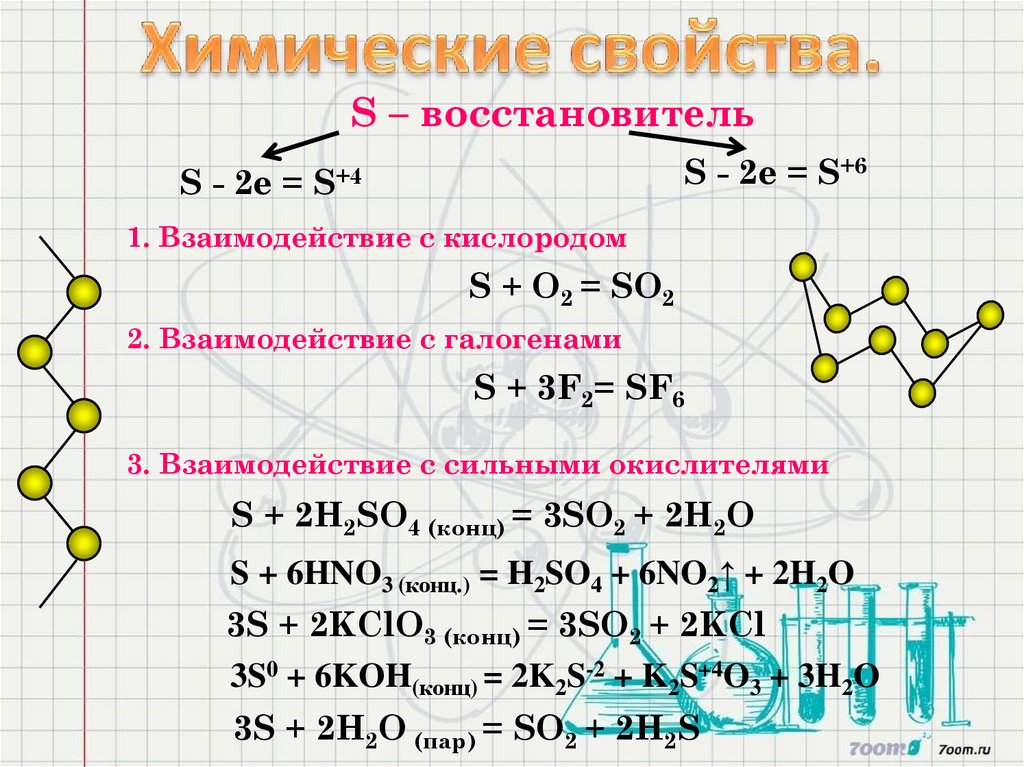
S – восстановительS - 2е = S+6
S - 2е = S+4
1. Взаимодействие с кислородом
S + O2 = SO2
2. Взаимодействие с галогенами
S + 3F2= SF6
3. Взаимодействие с сильными окислителями
S + 2Н2SО4 (конц) = 3SO2 + 2H2O
S + 6HNO3 (конц.) = H2SO4 + 6NO2↑ + 2H2O
3S + 2KClO3 (конц) = 3SO2 + 2KCl
3S0 + 6KOH(конц) = 2K2S-2 + K2S+4O3 + 3H2O
3S + 2Н2О (пар) = SO2 + 2H2S
11.
• Жизненно важный элемент для высших организмов,составная часть многих белков, концентрируется в волосах.
• Также много серы в биологически активных веществах
(например, в витаминах).
• Играет значительную роль в процессах обезвреживания
ядовитых веществ в печени.
• Основные источники серы - продукты животного
происхождения, но довольно значительно ее содержание и в
растительной пище. Сыр содержит 263 мг серы в 100 г
продукта, яйца, мясо - 230, рыба - 175, горох, фасоль, овсяная
крупа - более 200, другие крупы и хлеб - более 100 мг.
• Потребность организма в сере около 1 г в сутки.









 chemistry
chemistry








