Similar presentations:
Характеристика элементов VI группы .Кислород. Озон
1.
Общаяхарактеристика
элементов VI группы .
Кислород. Озон.
2.
Общая характеристика элементовVI группы главной подгруппы
Это элементы :
кислород О
сера S
селен Se
теллур Te
полоний Ро
Группа называется халькогены
(рождающий руды)
3.
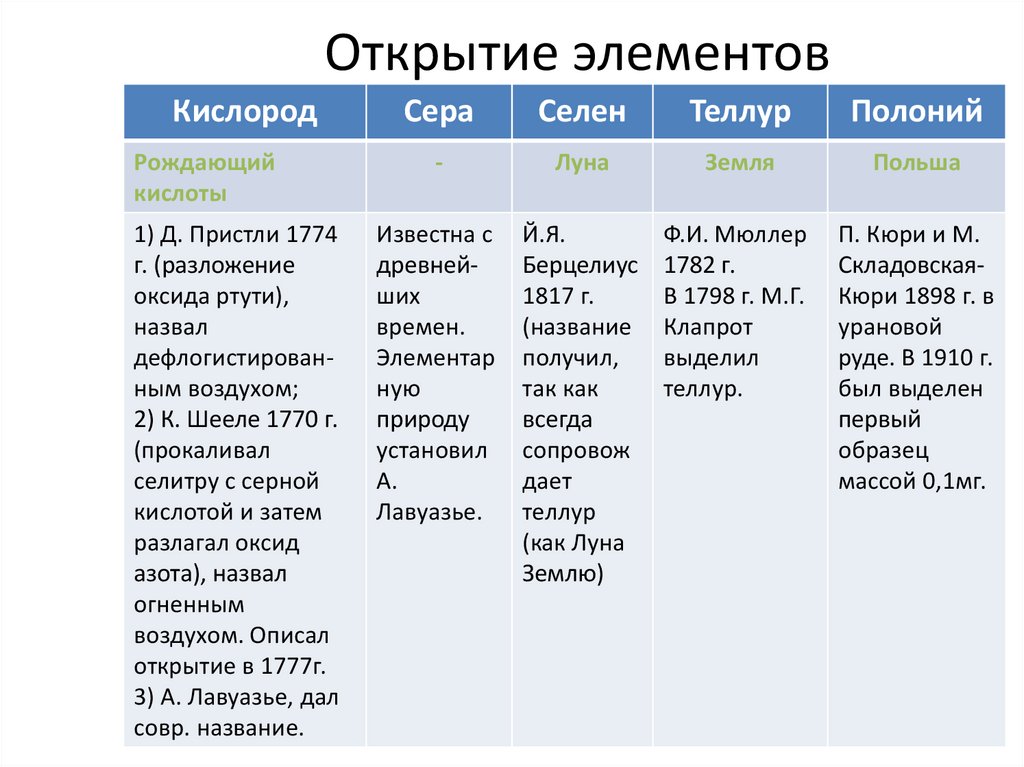
Открытие элементовКислород
Рождающий
кислоты
1) Д. Пристли 1774
г. (разложение
оксида ртути),
назвал
дефлогистированным воздухом;
2) К. Шееле 1770 г.
(прокаливал
селитру с серной
кислотой и затем
разлагал оксид
азота), назвал
огненным
воздухом. Описал
открытие в 1777г.
3) А. Лавуазье, дал
совр. название.
Сера
Селен
Теллур
Полоний
-
Луна
Земля
Польша
Известна с
древнейших
времен.
Элементар
ную
природу
установил
А.
Лавуазье.
Й.Я.
Берцелиус
1817 г.
(название
получил,
так как
всегда
сопровож
дает
теллур
(как Луна
Землю)
Ф.И. Мюллер
1782 г.
В 1798 г. М.Г.
Клапрот
выделил
теллур.
П. Кюри и М.
СкладовскаяКюри 1898 г. в
урановой
руде. В 1910 г.
был выделен
первый
образец
массой 0,1мг.
4.
Изменение наиболее важныхфизико-химических характеристик.
1. Электронная конфигурация внешнего
энергетического уровня ns2np4 .
2. Радиусы атомов от О к Ро возрастают,
ослабевают неметаллические свойства.
3. Электроотрицательность уменьшается
от О к Ро.
4. Температуры плавления и кипения
увеличиваются.
5. Плотность увеличивается.
5.
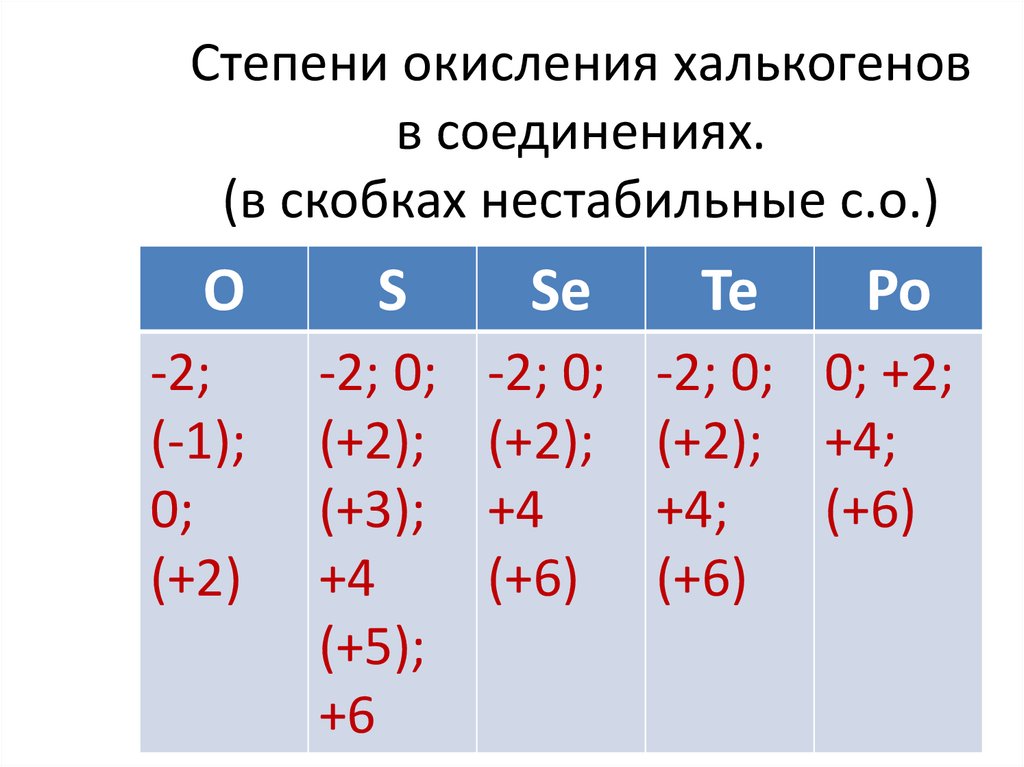
Степени окисления халькогеновв соединениях.
(в скобках нестабильные с.о.)
О
-2;
(-1);
0;
(+2)
S
Se
-2; 0;
(+2);
(+3);
+4
(+5);
+6
-2; 0;
(+2);
+4
(+6)
Te
Po
-2; 0; 0; +2;
(+2); +4;
+4;
(+6)
(+6)
6.
Кислород, сера, селен – типичныенеметаллы.
Устойчивость соединений с высшей
степенью окисления уменьшается.
О и S – диэлектрики (не проводят эл. ток);
Se и Te – полупроводники;
Ро – радиоактивный металл.
7.
Нахождение в природе:Кислород. Самый распространенный на
Земле элемент (49%). В водах – 88,8% по
массе, в атмосфере – 20,95% об. Входит
в состав более 1500 соединений земной
коры. Это основной биогенный элемент.
Сера. 15 –й по распространенности.
Встречается в самородном состоянии и в
составе соединений:
FeS2 – пирит, ZnS- цинковая обманка,
PbS – свинцовый блеск, HgS- киноварь,
CaSO4· 2H2O – гипс и др.
8.
Селен. Очень редкий элемент,содержание 5 · 10-6%.
Содержатся в вулканических
горных породах, вулканических
термальных водах (38
минералов). Практического
значения минералы селена не
имеют. Весь промышленный
селен является попутным
продуктом переработки руд.
9.
Теллур. Редкий элемент1· 10-7%. В магме, горячих
подземных источниках, в
сульфидных рудах.
Полоний. Всегда присутствует в
урановых и ториевых
минералах. Полоний-210
содержится в табаке и
табачном дыме.
10.
Простые вещества. Получение.Кислород. (О2).
Газ, без цвета, запаха и вкуса, жидкий
кислород голубого цвета, Ткип =-182,9˚С.
Получение.
1. В промышленности: перегонка
сжиженного воздуха. Первым испаряется
азот (Ткип = -195,8˚С). Более чистый
кислород можно получить электролизом
водных растворов щелочей или солей
кислородсодержащих кислот.
11.
В лаборатории:1. Разложение перманганата калия при
нагревании:
2KMnO4 K2MnO4 + MnO2 + O2
2. Разложение пероксида водорода в
присутствии катализатора MnO2:
2H2O2 2H2O + O2
3. При прокаливании нитрата натрия:
2NaNO3 2NaNO2 + O2
12.
Получение кислорода накосмических кораблях, подводных
лодках :
Используют пероксид натрия Na2O2:
2Na2O2 + 2CO2 = 2Na2CO3 + O2
13.
Аллотропные модификациикислорода
ОЗОН (О3). Это газ синего цвета, с резким
раздражающим запахом. Токсичен.
Сильный окислитель. При обычных
условиях окисляет серебро. Дышать
воздухом со значительным содержанием
озона нельзя – он разрушает ткани
дыхательных путей. Образуется при
грозовых разрядах:
3О2 = 2О3
14.
Химические свойства кислорода.Реакции горения, образуются оксиды.
С неметаллами:
2H2 + O2 = 2H2O
4P + 5O2 = 2P2O5
S + O2 = SO2
C + O2 = CO2
С металлами:
4AI + 3O2 = 2AI2O3
3Fe + 2O2 = Fe3O4
15.
Щелочные металлы (кроме лития)и барий при взаимодействии с
кислородом образуют пероксиды:
2Na + O2 = Na2O2
Na2O2 + 2Na = 2Na2O
литий образует оксид:
4Li + O2 = 2Li2O
16.
Взаимодействие со сложнымивеществами. Образуются оксиды
элементов, из которых состоит
молекула сложного вещества:
2CuS + 3O2 = 2CuO + 2SO2
2H2S + O2 = 2S + 2H2O
2H2S + 3O2 = 2SO2 + 2H2O
17.
Напишите уравнения реакцийгорения:
а) метана
б) аммиака
18.
Озон более сильный окислитель,чем кислород.
2O3 + 2Ag = Ag2O2 + 2O2
3PbS + 4O3 = 3PbSO4
2KI + O3 + H2O = I2 + 2KOH + O2
















 chemistry
chemistry








