Similar presentations:
Общая характеристика элементов VI группы главной подгруппы. Кислород
1.
Общая характеристикаэлементов VI группы главной
подгруппы. Кислород.
Селен
Теллур
2.
ОХалькогены – это элементы VIA группы.
S
Название халькогены означает «рождающие
руды».
Se
Te
Po
3.
Халькогены в природе встречаются чаще всего в составе руды – сульфидов, пиритов,оксидов, селенидов. К халькогенам относятся неметаллы и металлы.
В группе сверху вниз свойства меняются следующим образом:
1. металлические свойства усиливаются;
2. свойства окислителя ослабевают;
3. электроотрицательность уменьшается;
4. термическая устойчивость ослабевает.
Общая характеристика группы халькогенов:
неметаллы – кислород, сера, селен;
металлы – теллур, полоний;
валентность: II – О; IV и VI – S; II, IV, VI – Se, Te, Po;
электронная конфигурация – ns2np4;
гидриды – H2R;
оксиды – RO2, RO3;
кислородные кислоты – H2RO3, H2RO4.
4.
По электронному строению халькогены относятся к р-элементам. Навнешнем энергетическом уровне находится шесть электронов. До
завершения р-орбитали не хватает двух электронов, поэтому в соединениях
халькогены проявляют свойства окислителя. С увеличением в группе
количества энергетических уровней связь с внешними электронами
ослабевает, поэтому теллур и полоний являются восстановителями.
Селен
Сера
5.
ЭлементФизические свойства
Химические свойства
Кислород (О)
Газ. Образует две модификации – О2 и О3 (озон). О2 не имеет
Реагирует с металлами, неметаллами
запаха и вкуса, плохо растворим в воде.
Сера (S)
Типичный неметалл. Твёрдое вещество с температурой
плавления 115°С. Нерастворима в воде.
Степень окисления – -2, -1, 0, +1, +2, +4, +6
Реагирует с кислородом, галогенами,
неметаллами, металлами
Селен (Se)
Хрупкое твёрдое вещество. Полупроводник. Имеет три
модификации – серый, красный, чёрный селен.
Степень окисления – -2, +2, +4, +6
Реагирует со щелочными металлами,
кислородом, водой
Теллур (Te)
Внешне похож на металл. Полупроводник.
Степень окисления – -2, +2, +4, +6
Реагирует с кислородом, щелочами,
кислотами, водой, металлами,
неметаллами, галогенами
Полоний (Po)
Радиоактивный металл серебристого цвета.
Степень окисления – +2, +4, +6
Реагирует с кислородом, галогенами,
кислотами
6.
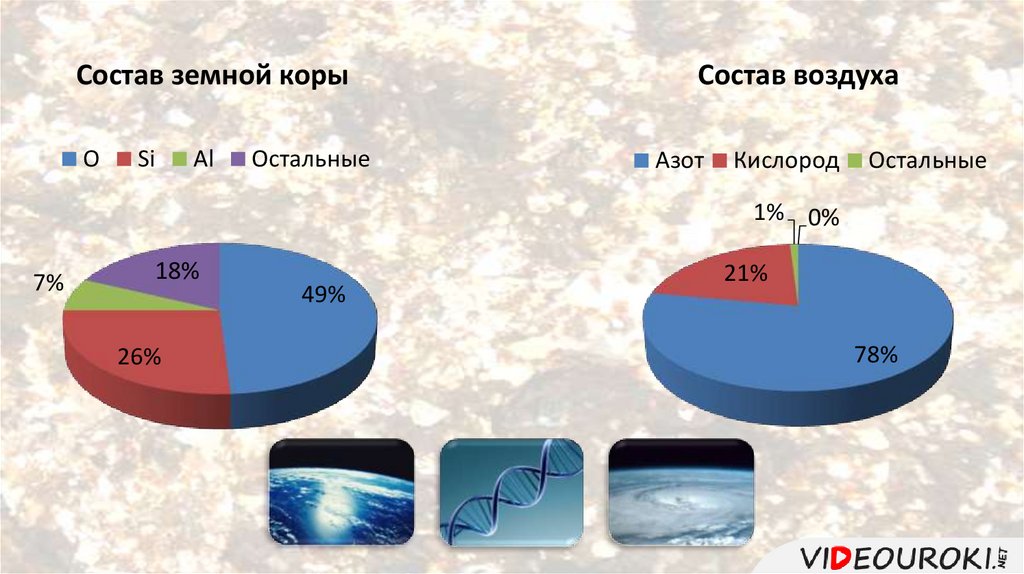
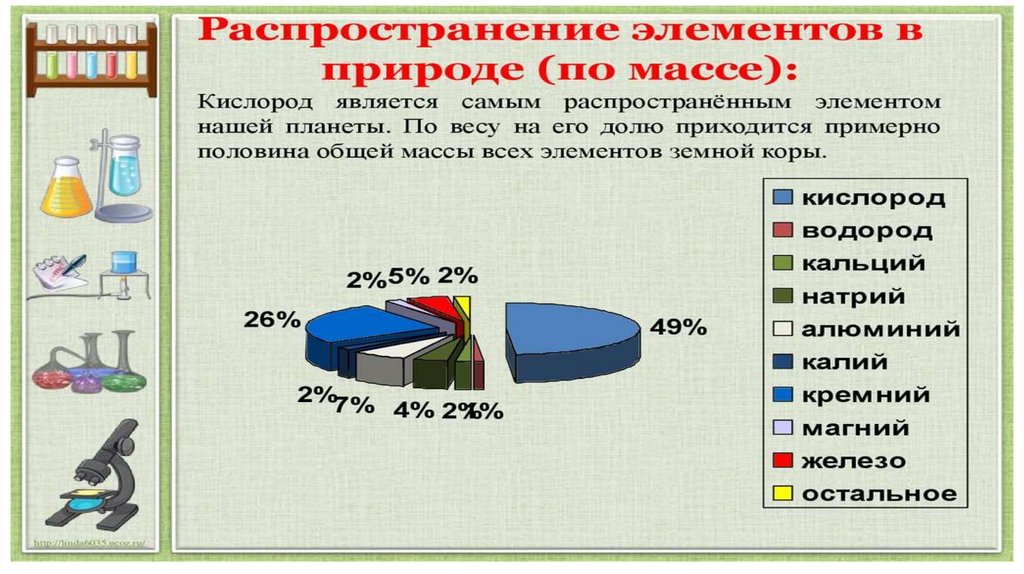
Состав земной корыО
Si
Al
Остальные
Состав воздуха
Азот
Кислород
Остальные
1% 0%
7%
18%
26%
49%
21%
78%
7.
В 1774 г. получил кислород.t
2HgO= 2Hg + O2↑
А. Лавуазье
Дж. Пристли
Дал название кислороду –
oxygenium,
т.е. «рождающий кислоты».
Получил кислород
нагреванием
селитры.
К. Шееле
8.
9.
10.
11.
12.
Получение кислородаВ промышленности
Из жидкого воздуха.
13.
14.
15.
16.
17.
1Применение кислорода
O2
2
3
5
6
4
1 – в металлургии;
4 – в медицине;
2 – газовая сварка и
резка металлов;
5 – как окислитель ракетного
топлива;
3 – при работе водолазов и
пожарных;
6 – для получения взрывчатых
веществ.














 chemistry
chemistry








