Similar presentations:
Элементы vi группы главной подгруппы. Халькогены (рождающие руды)
1. ЭЛЕМЕНТЫ VI ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ
ХАЛЬКОГЕНЫ(рождающие руды)
2. СТРОЕНИЕ И СВОЙСТВА атомов ЭЛЕМЕНТОВ
ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВПОДГРУППЫ КИСЛОРОДА
СТРОЕНИЕ И СВОЙСТВА АТОМОВ
ЭЛЕМЕНТОВ
3.
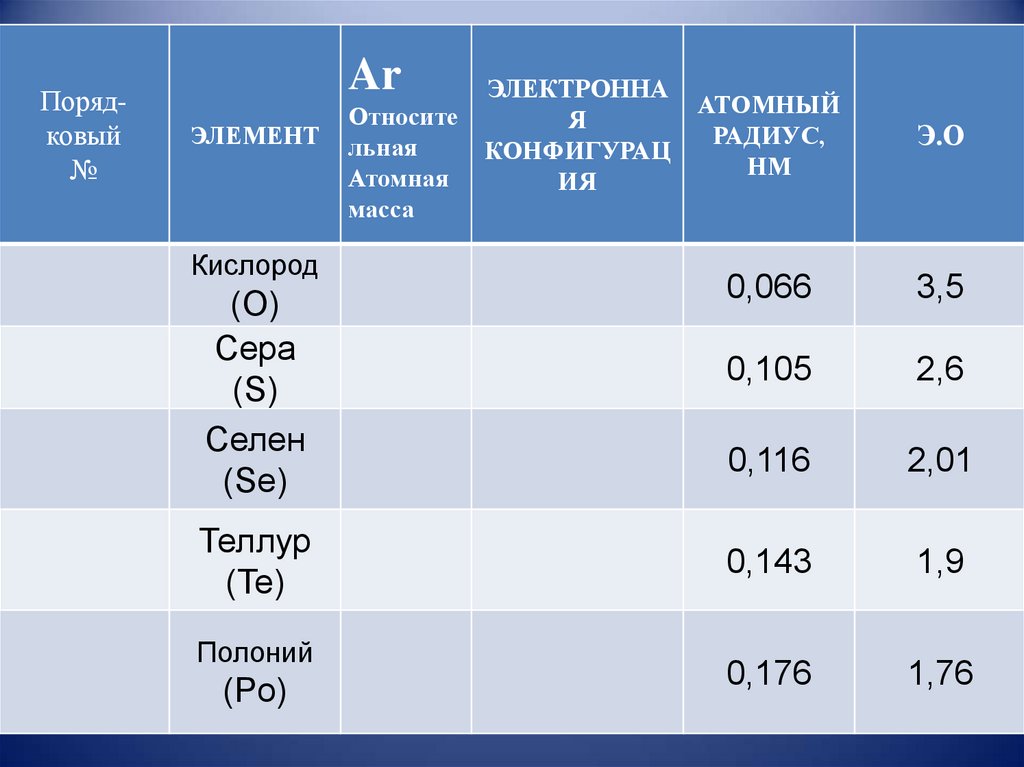
Порядковый№
Ar
ЭЛЕМЕНТ
Кислород
(O)
Сера
(S)
Селен
(Se)
Теллур
(Te)
Полоний
(Po)
Относите
льная
Атомная
масса
ЭЛЕКТРОННА
Я
КОНФИГУРАЦ
ИЯ
АТОМНЫЙ
РАДИУС,
НМ
Э.О
0,066
3,5
0,105
2,6
0,116
2,01
0,143
1,9
0,176
1,76
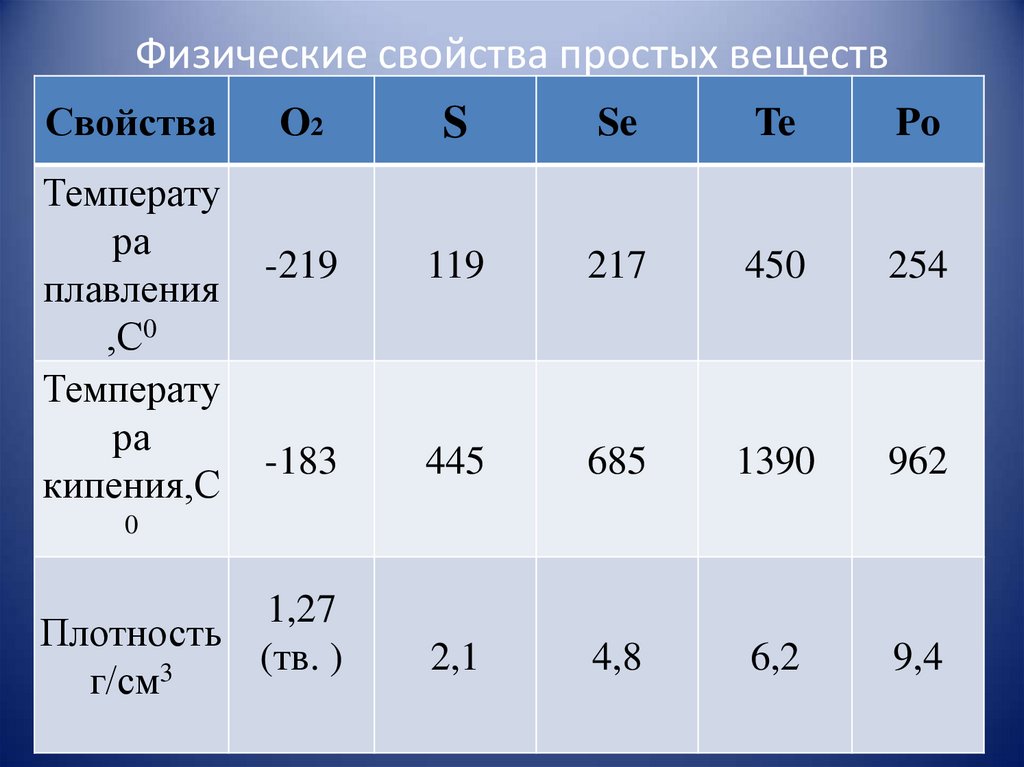
4. Физические свойства простых веществ
СвойстваO2
S
Se
Te
Po
-219
119
217
450
254
-183
445
685
1390
962
1,27
Плотность
(тв. )
3
г/см
2,1
4,8
6,2
9,4
Температу
ра
плавления
,С0
Температу
ра
кипения,С
0
5. Кислород .Элемент и вещество.
Простое вещество кислород O2(Получен -К.В. Шееле 1772 г.,
Дж. Пристли 1774 г.
Название дал А.Лавуазье)
Слово кислород (именовался в начале XIX века
ещё «кислотвором») своим появлением в
русском языке до какой-то степени
обязано М. В. Ломоносову
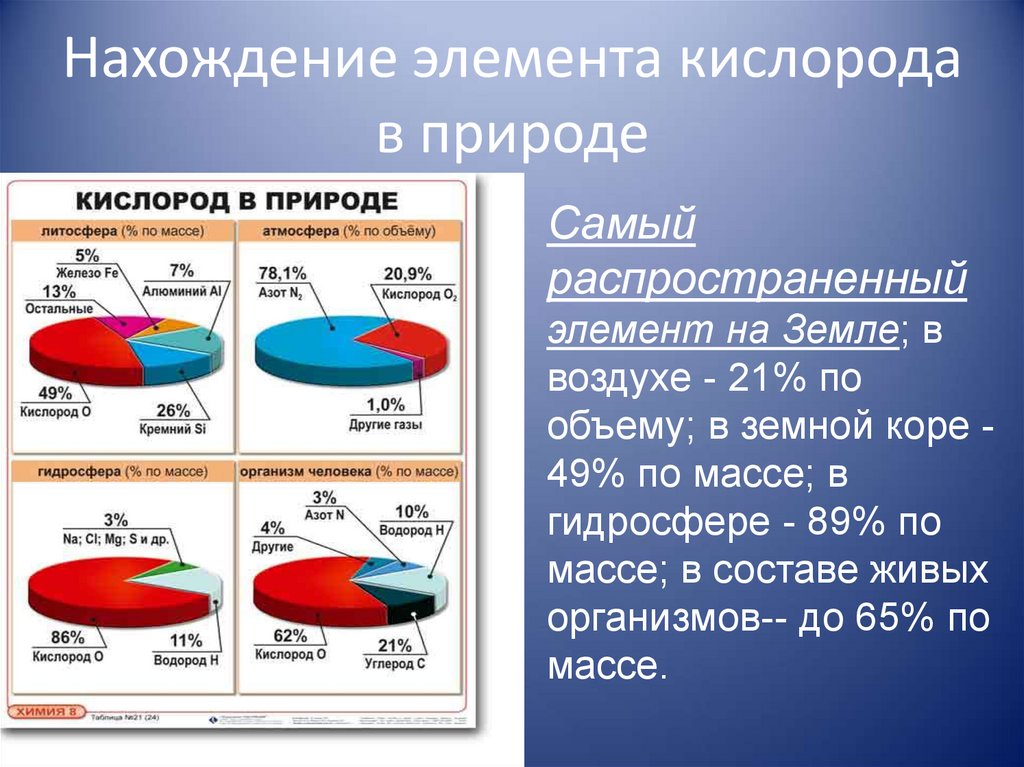
6. Нахождение элемента кислорода в природе
Самыйраспространенный
элемент на Земле; в
воздухе - 21% по
объему; в земной коре 49% по массе; в
гидросфере - 89% по
массе; в составе живых
организмов-- до 65% по
массе.
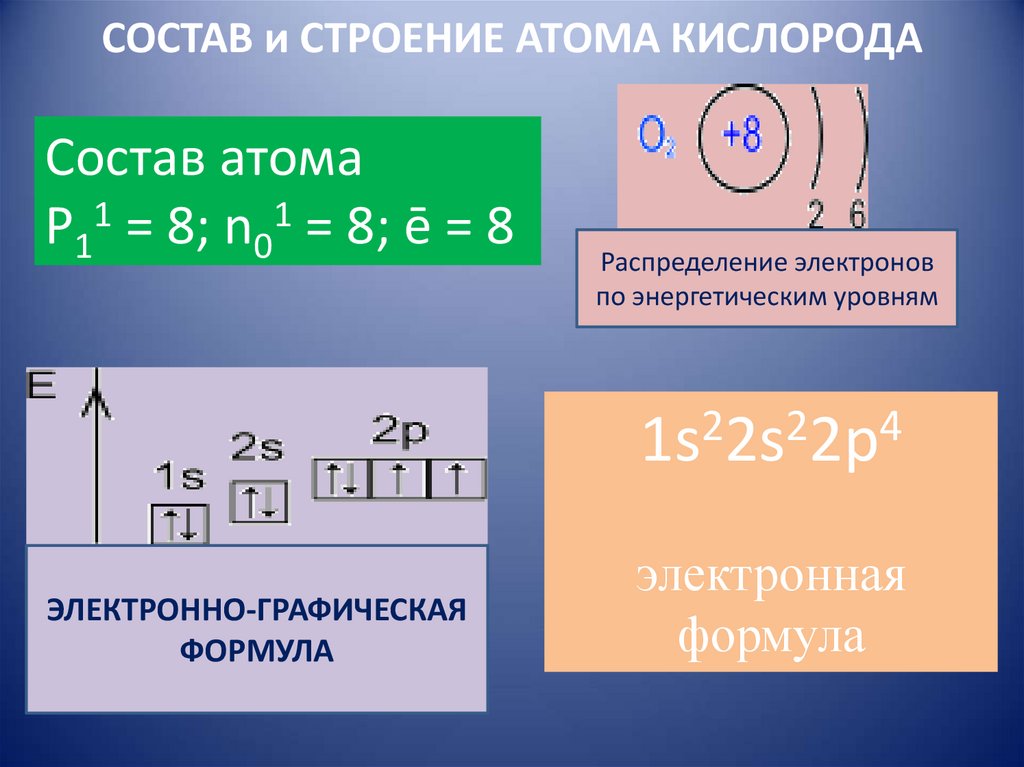
7. СОСТАВ и СТРОЕНИЕ АТОМА КИСЛОРОДА
Состав атомаP11 = 8; n01 = 8; ē = 8
Распределение электронов
по энергетическим уровням
2
2
4
1s 2s 2p
ЭЛЕКТРОННО-ГРАФИЧЕСКАЯ
ФОРМУЛА
электронная
формула
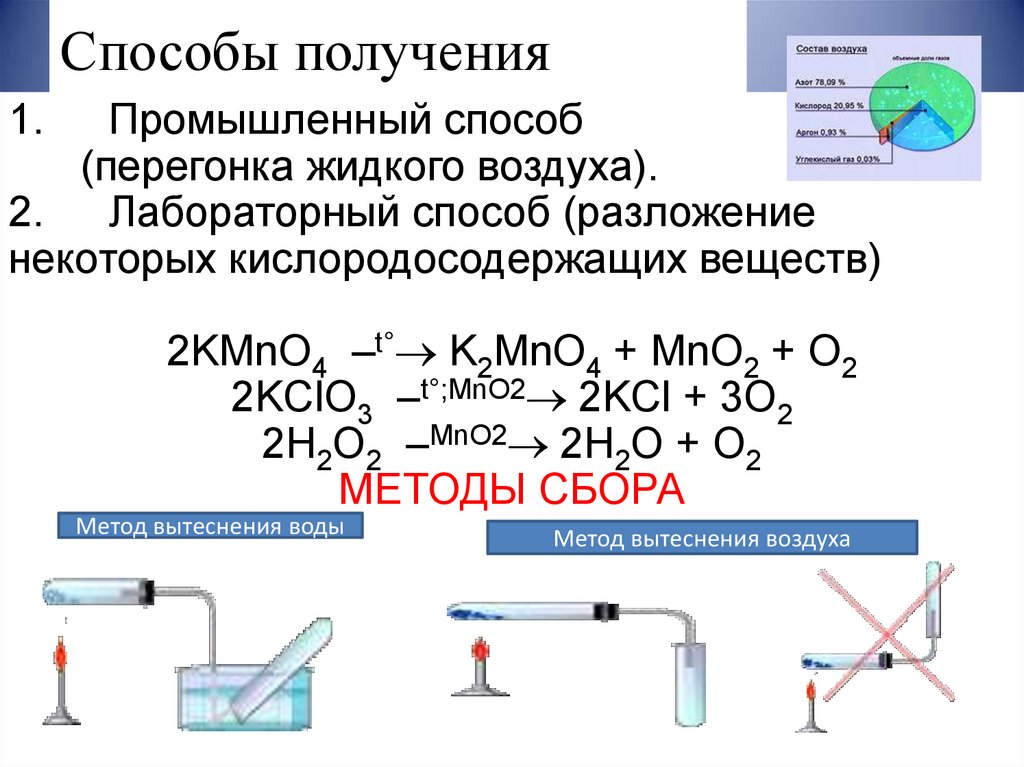
8. Способы получения
Промышленный способ(перегонка жидкого воздуха).
2. Лабораторный способ (разложение
некоторых кислородосодержащих веществ)
1.
2KMnO4 –t° K2MnO4 + MnO2 + O2
2KClO3 –t°;MnO2 2KCl + 3O2
2H2O2 –MnO2 2H2O + O2
МЕТОДЫ СБОРА
Метод вытеснения воды
Метод вытеснения воздуха
9. Физические свойства кислорода
• Газ - без цвета, вкуса и запаха;(Ц В З)
• Плохо растворим в воде
в 100V H2O растворяется 3V O2 (н.у.);
• t°кип= -183°С;
• t°пл = -219°C;
• d по воздуху = 1,1.(тяжелее воздуха)
10. ХИМИЧЕСКИЕ СВОЙСТВА простого вещества кислорода
ХИМИЧЕСКИЕ СВОЙСТВАпростого вещества кислорода
Взаимодействие веществ с кислородом
называется окислением;
• С кислородом реагируют все простые вещества ,
кроме: галогенов Au, Pt, He, Ne и Ar;
• всех реакциях кислород - окислитель.
• Степени окисления кислорода
в соединениях -2;
-кроме соединений с фтором(+1, +2) ;
- в пероксидах -1
11. ВЗАИМОДЕЙСТВИЕ С ПРОСТЫМИ ВЕЩЕСТВАМИ
неметалламиC + O2 =
S + O2 =
H2 + O2 =
металлами
Mg + O2 =
Cu + O2 =
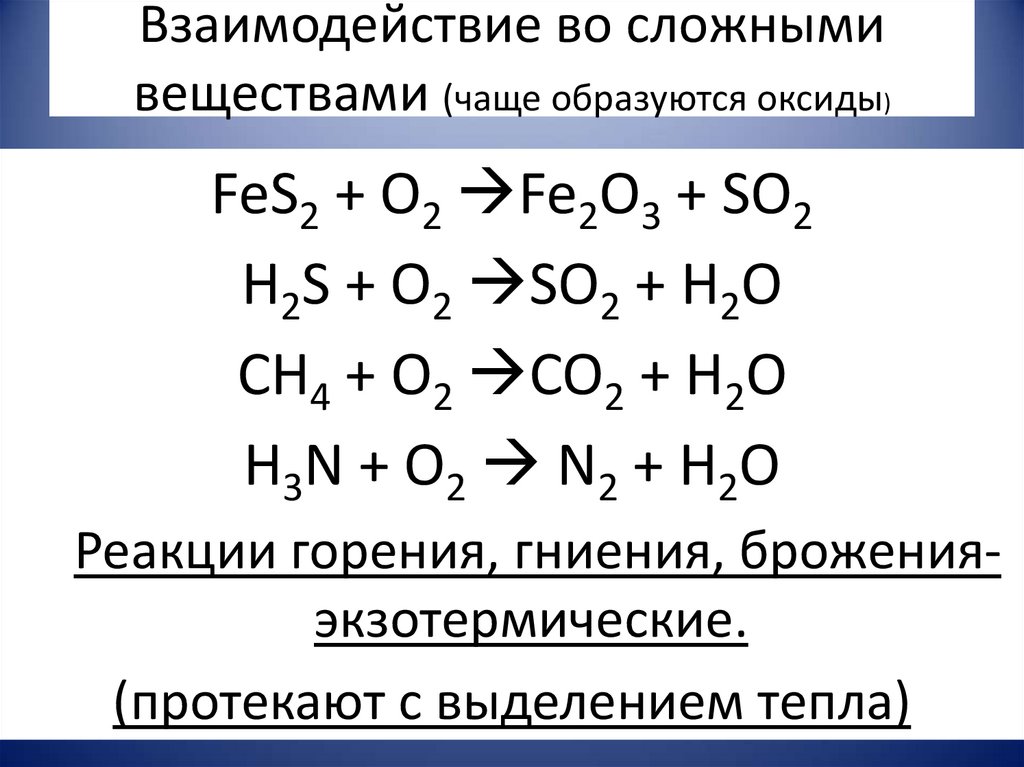
12. Взаимодействие во сложными веществами (чаще образуются оксиды)
FeS2 + O2 Fe2O3 + SO2H2S + O2 SO2 + H2O
CH4 + O2 CO2 + H2O
H3N + O2 N2 + H2O
Реакции горения, гниения, броженияэкзотермические.
(протекают с выделением тепла)
13. Озон -аллотропная модификация кислорода.
Озон O3ОЗОН -АЛЛОТРОПНАЯ МОДИФИКАЦИЯ
КИСЛОРОДА.
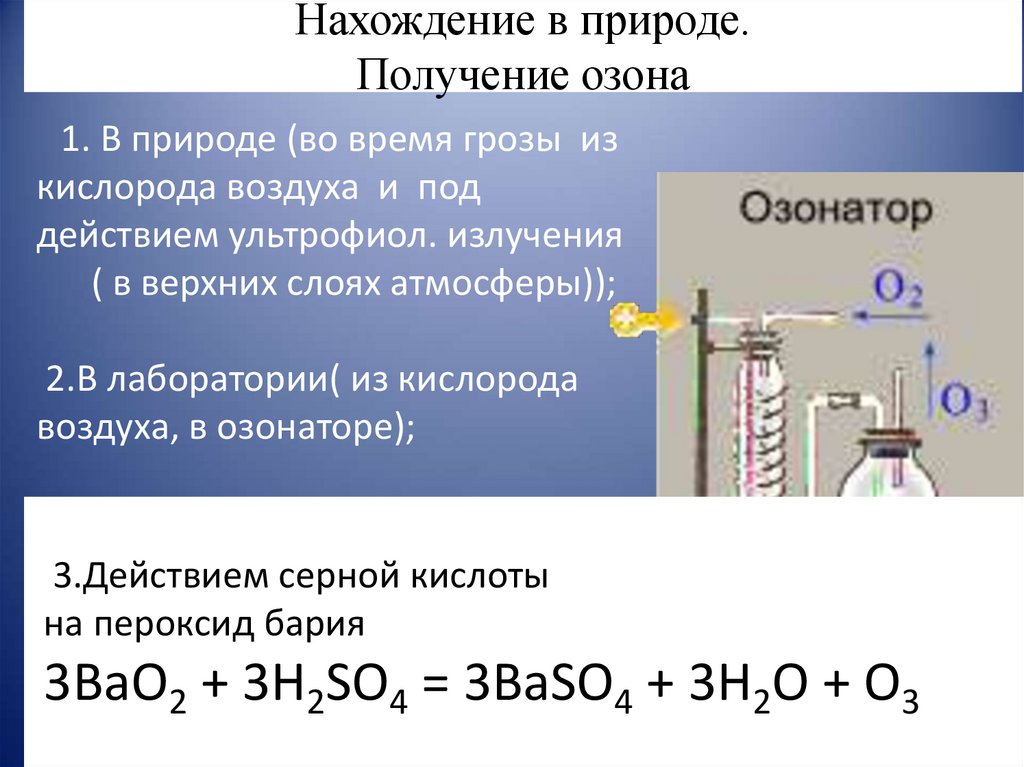
14. Нахождение в природе. Получение озона
1. В природе (во время грозы изкислорода воздуха и под
действием ультрофиол. излучения
( в верхних слоях атмосферы));
2.В лаборатории( из кислорода
воздуха, в озонаторе);
3.Действием серной кислоты
на пероксид бария
3BaO2 + 3H2SO4 = 3BaSO4 + 3H2O + O3
15. ФИЗИЧЕСКИЕ СВОЙСТВА нахождение в природе
ГазЗапах свежей хвои
Голубого цвета
Растворим в воде
t°кип= -112°С
t°пл= -193°C.
16. ХИМИЧЕСКИЕ СВОЙСТВА простого вещества озона
Неустойчив под действием ультрафиолетовогоизлучения
O3 = O2 + O
2. Сильный окислитель:
а)2KI + O3 + H2O =2KOH + I2 + O2
б) обесцвечивает красящие вещества;
1.
в)отражает УФ - лучи
(превращаясь в кислород O2);
г) уничтожает микроорганизмы
(окисляет их);
17. Домашнее Задание
ПАРАГРАФЫ 7 и 8• № 1-2
• Уметь давать характеристику элементов по их
положению в ПСХЭ
• Знать строение атомов эл. VI группы гл.
подгруппы, закономерности изменения св-в
элементов в подгруппе
• Знать аллотропные модификации кислорода
(простые вещества кислород и озон)
• Знать ,что такое реакции окисления ;










 chemistry
chemistry








