Similar presentations:
Равновесие в реакциях гидролиза. Лекция 6
1.
Равновесие в реакциях гидролизаЛекция 6
2.
ПЛАН ЛЕКЦИИ1
Гидролиз солей.
2
Количественные характеристики процесса гидролиза.
3
Гидролиз по катиону и аниону.
2
3.
Реакции обменного разложения солей водой!
!
Гидролиз – результат поляризационного взаимодействия ионов
соли с их гидратной (Н2О) оболочкой
Соли – сильные электролиты –
диссоциируют полностью:
MeА Mem+ + An-
!
Гидролиз идет по иону слабого электролита:
Mem+ + НOH MeОН(m-1)+ + H+
или
An- + НОH HA(n-1)- + OHмалодиссоциированные
частицы
изменение рН раствора
3
4.
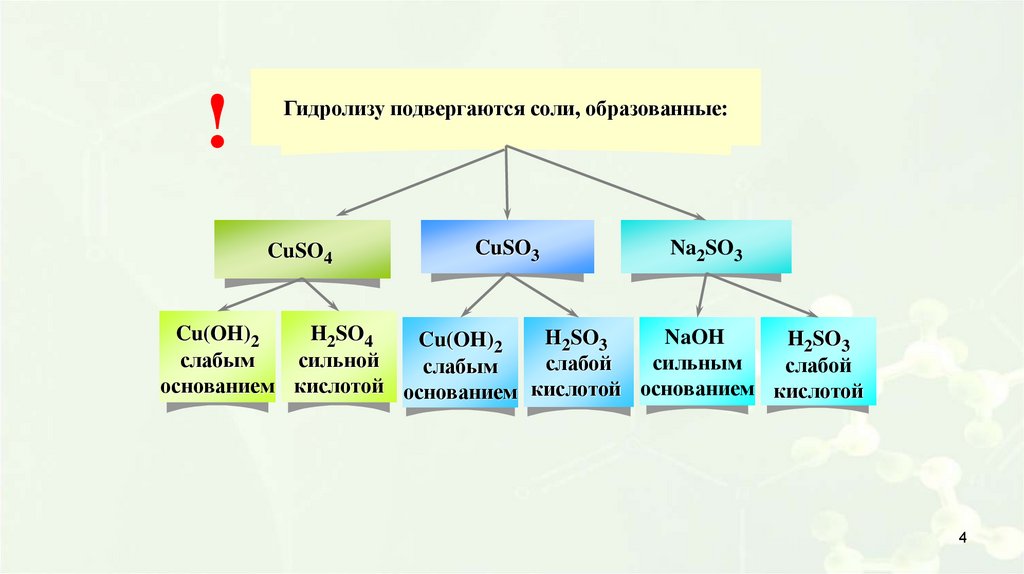
!Гидролизу подвергаются соли, образованные:
CuSO4
CuSO3
Na2SO3
Cu(OH)2
H2SO4
NaOH
H2SO3
H2SO3
Cu(OH)2
слабым
сильной
сильным
слабой
слабой
слабым
основанием кислотой основанием кислотой основанием кислотой
4
5.
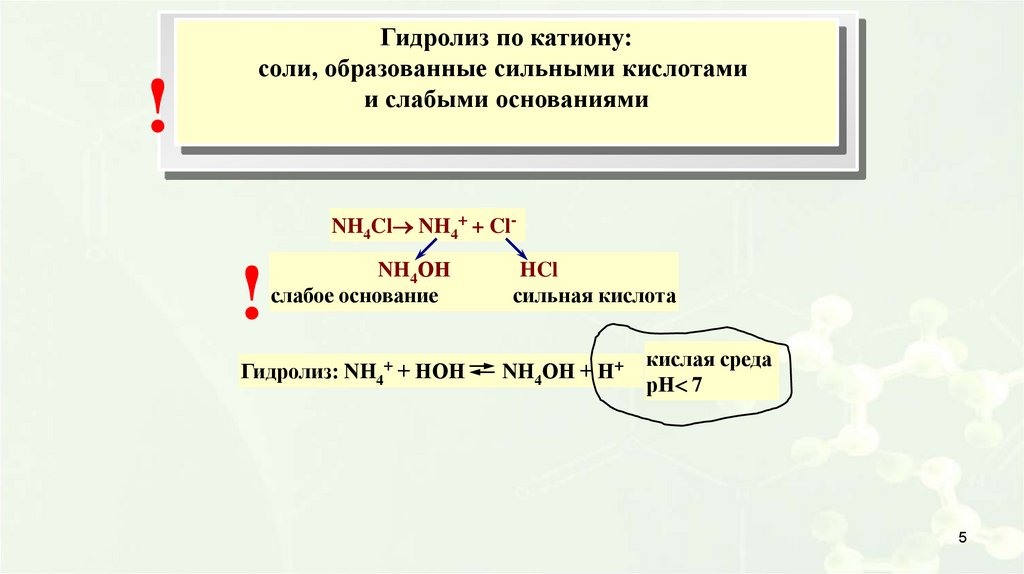
!Гидролиз по катиону:
соли, образованные сильными кислотами
и слабыми основаниями
NH4Cl NH4+ + Cl-
!
NH4ОН
слабое основание
Гидролиз: NH4+ + НОН
HCl
сильная кислота
NH4ОН + Н+
кислая среда
рН 7
5
6.
!Гидролиз по аниону:
соли, образованные слабыми кислотами
и сильными основаниями
!
Na2S 2Na+ + S2-
NaOH
сильное основание
H2 S
слабая кислота
Гидролиз по ступеням:
1 cтупень: S2- + HOН
2 ступень: HS– + HOН
HS– + ОН–
H2S + ОН–
рН 7
6
7.
Соли, образованные сильной кислотой и сильнымоснованием, гидролизу не подвергаются.
!
Na2SO4 2Na+ + SO42NaOH
сильное основание
H2SO4
сильная кислота
раствор нейтральный: рН 7
!
7
8.
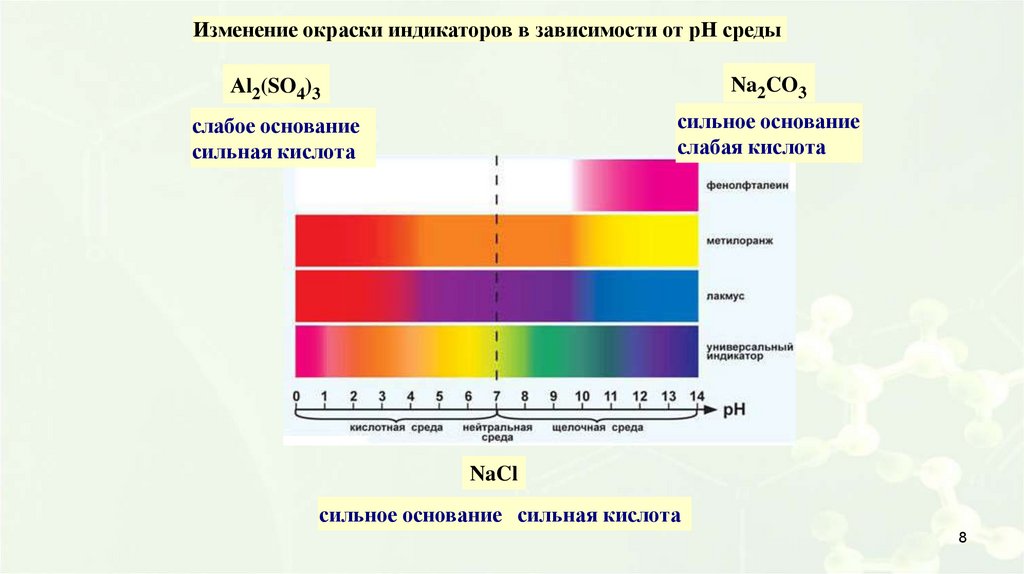
Изменение окраски индикаторов в зависимости от рН средыАl2(SO4)3
Na2CO3
слабое основание
сильная кислота
сильное основание
слабая кислота
NaCl
сильное основание сильная кислота
8
9.
!Нг 0 – эндотермический процесс
с увеличением температуры гидролиз усиливается
9
10.
Национальный исследовательский университет МЭИКафедра Химии и электрохимической энергетики
Электрохимические процессы.
Электродные потенциалы
Лекция 13
11.
ПЛАН ЛЕКЦИИ1
Электрохимические процессы.
2
Законы Фарадея.
3
Электродные потенциалы.
4
Стандартный электродный потенциал.
5
Уравнение Нернста.
6
Расчет равновесных потенциалов.
11
12.
ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ:!
процессы взаимного превращения химической и электрической
энергий.
две группы электрохимических устройств:
!
самопроизвольный
процесс
ΔG< 0
Гальванический элемент,
топливный
элемент
Электролизер
Превращение
химической
энергии в
электрическую
Превращение
электрической
энергии в
химическую
!
несамопроизвольный
процесс
ΔG 0
12
13.
Общее:• окислительно-восстановительная
реакция - электрохимическая
реакция;
• пространственная локализация
электронных переходов;
• процессы восстановления и
окисления разделены.
13
14.
Электрохимическая система состоит:внешняя
цепь:
внутренняя
цепь:
металлические
проводники,
измерительные
приборы,
потребители
два электрода,
ионный
проводник
!
Электроды – металлические, полупроводниковые материалы или
газовые.
Ионный проводник – раствор, расплав или твердый электролит.
14
15.
12
+К
1
2
–А
–К
3
+А
3
3
3
1
1
4
5
4
5
Электролизер
Электрохимическая ячейка
1 – регистрирующий прибор
2 – провода внешней цепи
3 – электроды
4 – электролит
5 – диафрагма
1 – источник тока
2 – провода внешней цепи
3 – электроды
4 – электролит
5 – диафрагма
источник постоянного
+ –
тока
раствор
серебр
о
соли
серебра
латунная ложка
15
16.
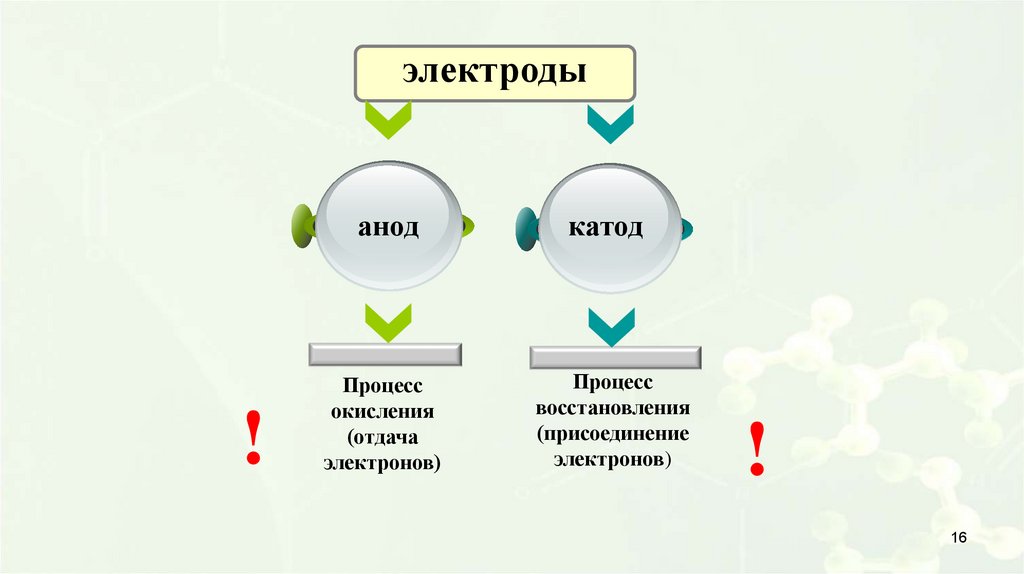
электроды!
анод
катод
Процесс
окисления
(отдача
электронов)
Процесс
восстановления
(присоединение
электронов)
!
16
17.
ЗАКОНЫ ФАРАДЕЯМ. Фарадей
(1791 -1867)
!
1. Масса или количество вещества, претерпевшего
превращение на электроде при протекании
постоянного тока, прямо пропорционально
количеству прошедшего электричества
17
18.
!2. При прохождении через различные электролиты
одного и того же количества электричества, массы
веществ, участвующих в электродных реакциях,
пропорциональны молярным массам их эквивалентов.
m(1) / m(2) = MЭ(1) / МЭ(2)
m(1) / MЭ(1) = m(2) / MЭ(2)
Э (1) моль экв.= Э (2) моль экв.
К
А
Э
Э
18
19.
!!
На любое электрохимическое превращение 1 моль
эквивалента вещества требуется одинаковое
количество электричества, равное 96484 Кл (А с )
!
F - фундаментальная физическая константа,
равная произведению величины элементарного
заряда на постоянную Авогадро NA :
F = e·NA = 1,602·10−19 · 6·1023 =
= 96484,56 Кл/моль = 96500 Кл (А с)
19
20.
Для расчета массы вещества:!
M q MЭ I t
m
n F
F
М – молярная масса вещества, г/моль;
n – число электронов, участвующих в процессе;
МЭ =М/n – молярная масса эквивалента вещества, г/моль;
q – количество электричества, А с, (А час);
I – ток, А;
t – время, с (час).
q = It
20
21.
для расчета объема газообразных веществ:!
Vm I t VЭ I t
V
n F
F
VЭ = Vm / n – объем моль эквивалента газа, л/моль;
Vm = 22,4 - молярный объем газа, л/моль,
n – число электронов, участвующих в процессе
образования газа.
21
22.
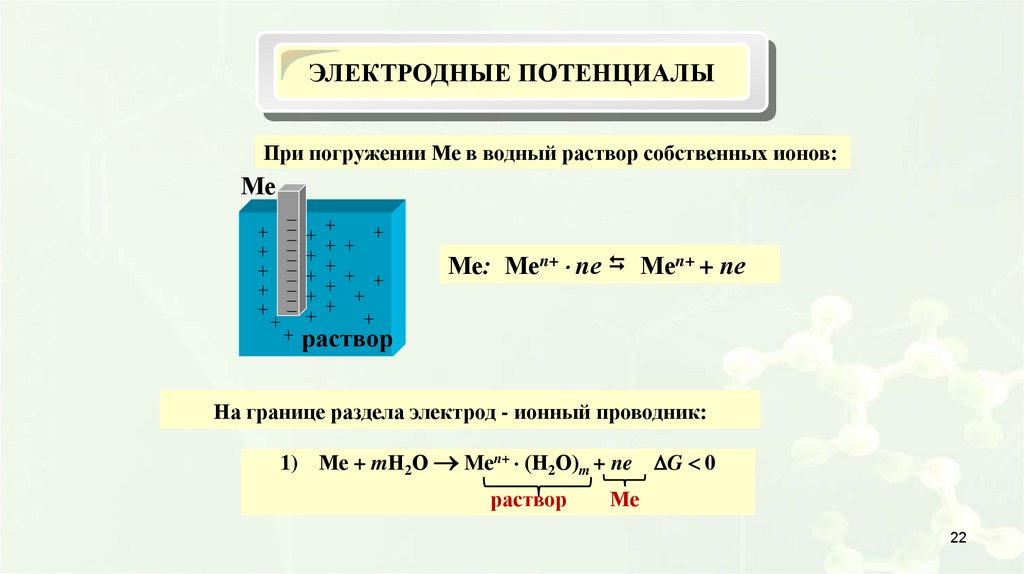
ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫПри погружении Ме в водный раствор собственных ионов:
Ме
Ме: Меn+ nе Меn+ + nе
раствор
На границе раздела электрод - ионный проводник:
1) Ме + mН2О Mеn+ (Н2О)m + ne G 0
раствор
Ме
22
23.
2) диффузия Меn+ в раствор;3) образование двойного электрического слоя
на Ме (–), в растворе (+);
4) на границе Ме – раствор возникает скачок потенциалов:
( 2 – 1) = Е Меn+/Ме – электродный потенциал;
Знак потенциала – заряд на Ме
1953 г – ИЮПАК (IUPAC International Union of Pure and Applied Chemistry)
23
24.
5) устанавливается равновесие:Ме + mН2О Меn+ (Н2О)m+ ne
Возникает равновесный электродный потенциал: ЕРМеn+/ Ме
Величина потенциала ЕР Меn+/ Ме зависит от:
• природы металла
• активности потенциалопределяющих ионов
• температуры
24
25.
Случаи возникновения разности потенциалов на границе Ме – раствор:1) Активные металлы (Ме - Fe, Zn) переход ионов в раствор (-Е)
Ме
Меn+ + ne
раствор Ме
С поверхности металла
положительно заряженные ионы
Men+ переходят в раствор, на
поверхности металла образуется
избыток электронов и металл имеет
заряд (-).
2) Неактивные металлы (Ме- Cu, Ag)
адсорбция ионов из раствора на поверхность металла (+Е)
Меn+ + ne Ме
Переход ионов Men+ на металл
(адсорбция ионов из раствора),
поверхность металла заряжается
положительно, у поверхности
располагаются противоионы.
3) Благородные металлы (Ме - Au, Pt) разность потенциалов не возникает за счет
перехода ионов может за счет адсорбции молекул газа Их используют в качестве
подложки для адсорбции газов в газовых электродах.
25
26.
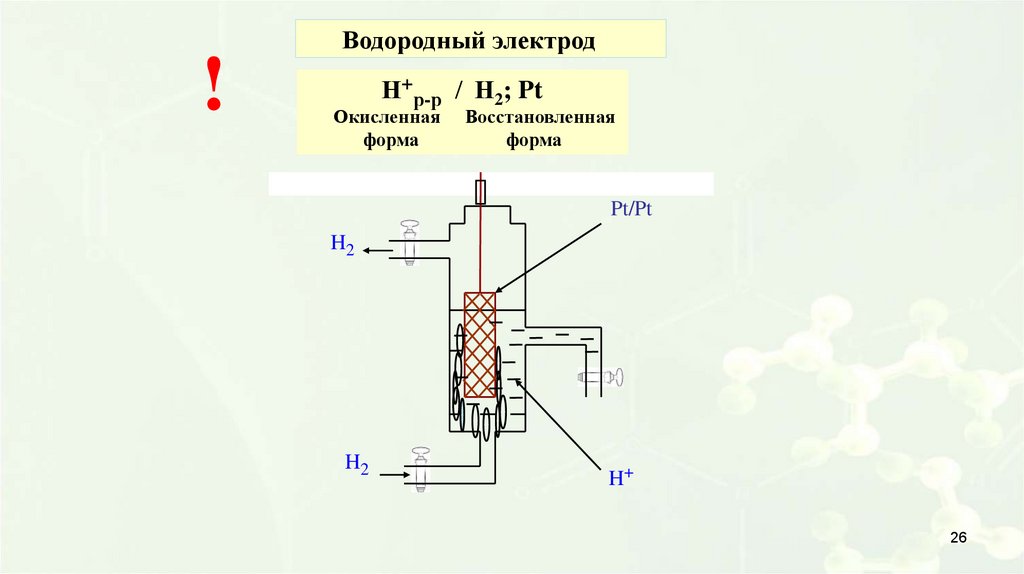
Водородный электрод!
Н+р-р / Н2; Pt
Окисленная
форма
Восстановленная
форма
Pt/Pt
H2
H2
H+
26
27.
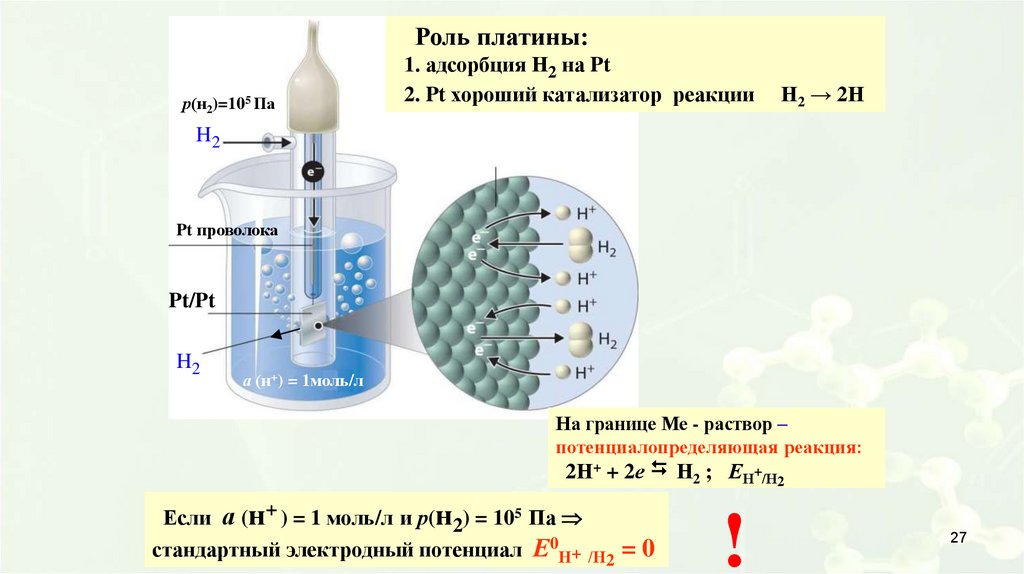
Роль платины:р(н2)=105 Па
1. адсорбция Н2 на Pt
2. Pt хороший катализатор реакции
Н2 → 2Н
H2
Pt проволока
Pt/Pt
H2
а (н+) = 1моль/л
На границе Ме - раствор –
потенциалопределяющая реакция:
2Н+ + 2е Н2 ; ЕН+/Н
2
Если а (н+ ) = 1 моль/л и р(н2) = 105 Па
стандартный электродный потенциал Е0Н+ /Н2 = 0
!
27
28.
Кислородный электродО2, Pt / ОН-р-р
окисленная восстановленная
форма
форма
На границе Ме-раствор потенциалопределяющая реакция:
О2 + 2Н2О + 4е 4ОН-
!
Если а (он- ) = 1моль/л и р(О2) = 105 Па
стандартный электродный потенциал Е0О2/ОН-= 0,401 В
28
29.
!Равновесный электродный потенциал E p
– потенциал,
Ox/ Red
возникающий при равновесии потенциалопределяющей
реакции
(в отсутствии тока в цепи)
!
При протекании электрического тока электродный
потенциал отличается от равновесного - E i
Ox/Red
Индекс Ox/Red обозначает окисленная (Ox) и восстановленная (Red)
формы вещества потенциалопределяющей реакции.
29
30.
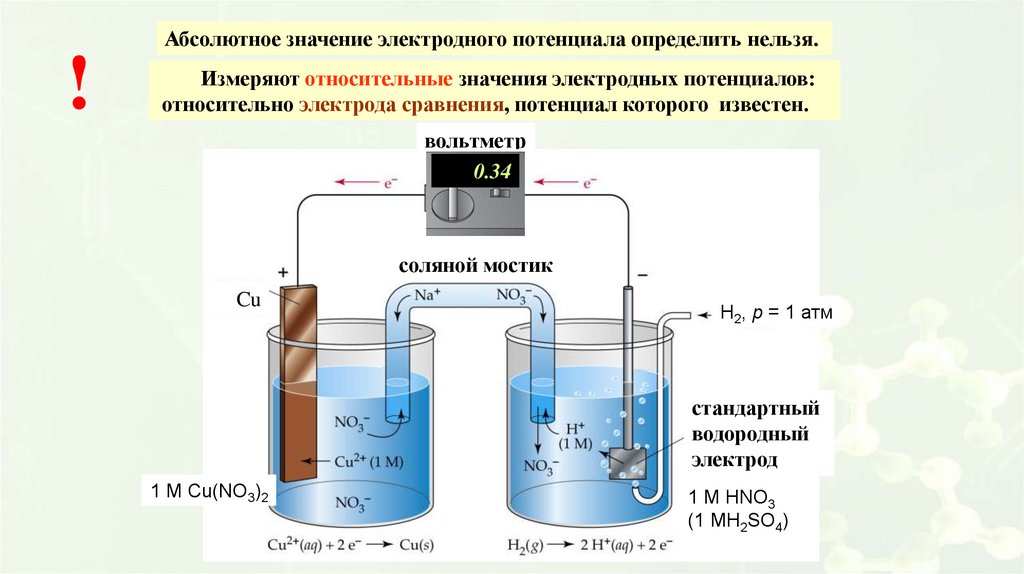
Абсолютное значение электродного потенциала определить нельзя.!
Измеряют относительные значения электродных потенциалов:
относительно электрода сравнения, потенциал которого известен.
вольтметр
0.34
соляной мостик
Cu
H2, p = 1 атм
стандартный
водородный
электрод
1 M Cu(NO3)2
1 M HNO3
(1 MH2SO4)
31.
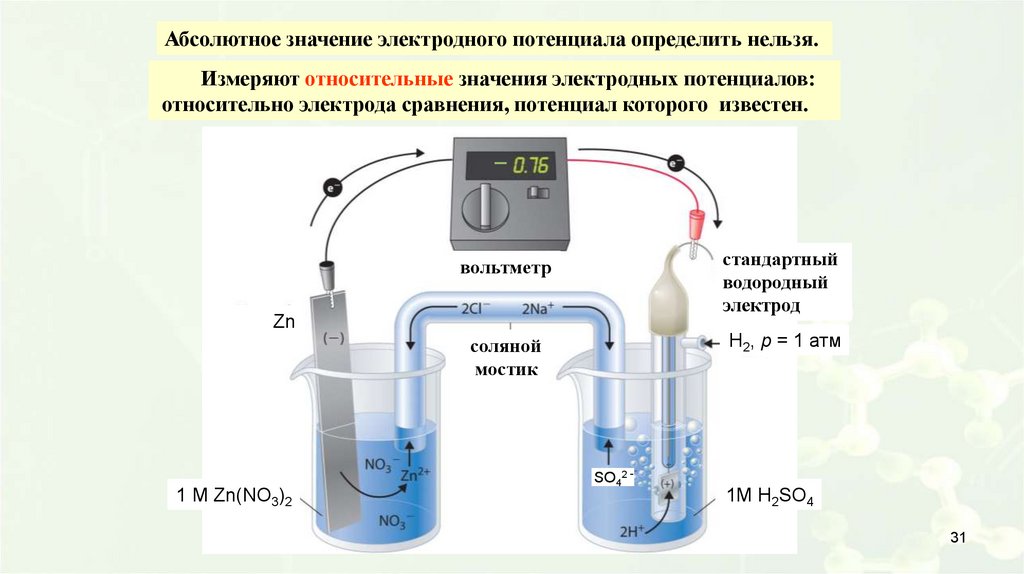
Абсолютное значение электродного потенциала определить нельзя.Измеряют относительные значения электродных потенциалов:
относительно электрода сравнения, потенциал которого известен.
вольтметр
стандартный
водородный
электрод
соляной
мостик
H2, p = 1 атм
Zn
1 M Zn(NO3)2
SO42 -
1M H2SO4
31
32.
Стандартным электродным потенциалом E0Ox/Red называетсяпотенциал, когда окисленная и восстановленная формы
потенциалопределяющей реакции находятся в стандартном
состоянии
(относительные давления pгаза 1 и активности аионов = 1)
Стандартные электродные потенциалы – табулированы.
В таблице стандартных электродных потенциалов потенциалы
расположены в порядке возрастания, что соответствует уменьшению
восстановительной и повышению окислительной активности систем.
Ряд металлов, расположенных в порядке возрастания их стандартных
потенциалов Е0 называют рядом напряжения металлов.
Водородная шкала стандартных потенциалов при 250С - шкала относительных
потенциалов (относительно потенциала водородного электрода).
Чем меньше потенциал, тем активнее (сильнее восстановительные свойства)
частица
32
33.
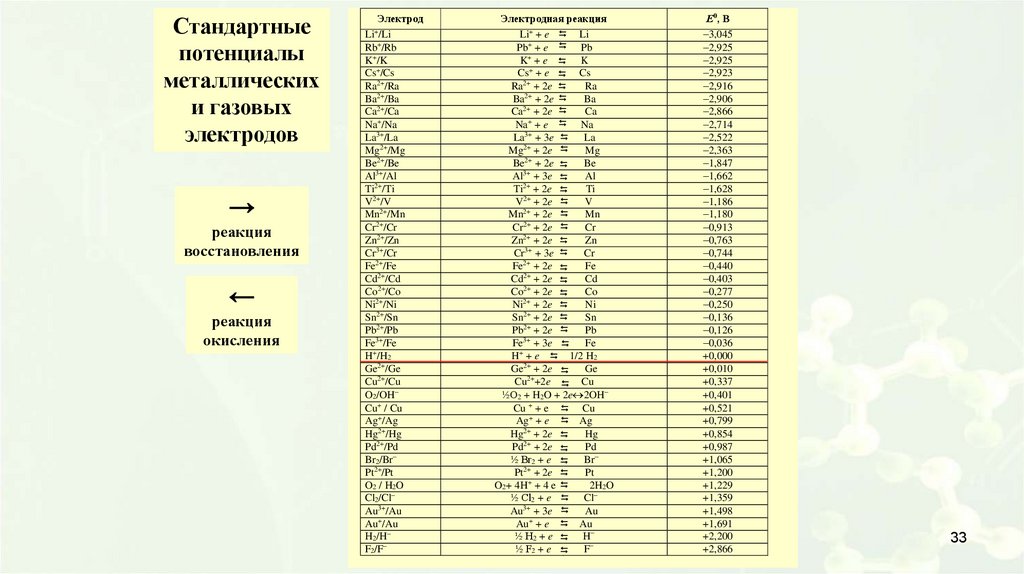
Стандартныепотенциалы
металлических
и газовых
электродов
→
реакция
восстановления
←
реакция
окисления
Электрод
+
Li /Li
Rb+/Rb
K+/K
Cs+/Cs
Ra2+/Ra
Ba2+/Ba
Ca2+/Ca
Na+/Na
La3+/La
Mg2+/Mg
Be2+/Be
Al3+/Al
Ti2+/Ti
V2+/V
Mn2+/Mn
Cr2+/Cr
Zn2+/Zn
Cr3+/Cr
Fe2+/Fe
Cd2+/Cd
Co2+/Co
Ni2+/Ni
Sn2+/Sn
Pb2+/Pb
Fe3+/Fe
H+/H2
Ge2+/Ge
Cu2+/Cu
O2/OH–
Cu+ / Cu
Ag+/Ag
Hg2+/Hg
Pd2+/Pd
Br2/Br–
Pt2+/Pt
O2 / H2O
Cl2/Cl–
Au3+/Au
Au+/Au
H2/H–
F2/F–
Электродная реакция
Li+ + e Li
Pb+ + e Pb
K+ + e K
Cs+ + e Cs
Ra2+ + 2e
Ra
Ba2+ + 2e
Ba
Ca2+ + 2e
Ca
Na+ + e Na
La3+ + 3e La
Mg2+ + 2e
Mg
Be2+ + 2e
Be
Al3+ + 3e
Al
Ti2+ + 2e
Ti
V2+ + 2e
V
Mn2+ + 2e
Mn
Cr2+ + 2e
Cr
Zn2+ + 2e
Zn
Cr3+ + 3e Cr
Fe2+ + 2e
Fe
Cd2+ + 2e
Cd
Co2+ + 2e
Co
Ni2+ + 2e
Ni
Sn2+ + 2e
Sn
Pb2+ + 2e
Pb
Fe3+ + 3e Fe
H+ + e 1/2 H2
Ge2+ + 2e
Ge
Cu2++2e Cu
½O2 + H2O + 2e 2OH–
Cu + + e Cu
Ag+ + e Ag
Hg2+ + 2e
Hg
Pd2+ + 2e
Pd
½ Br2 + e Br–
Pt2+ + 2e
Pt
O2+ 4H+ + 4 e
2H2O
½ Cl2 + e Cl–
Au3+ + 3e
Au
Au+ + e Au
½ H2 + e H–
½ F2 + e F–
Е0, В
–3,045
–2,925
–2,925
–2,923
–2,916
–2,906
–2,866
–2,714
–2,522
–2,363
–1,847
–1,662
–1,628
–1,186
–1,180
–0,913
–0,763
–0,744
–0,440
–0,403
–0,277
–0,250
–0,136
–0,126
–0,036
+0,000
+0,010
+0,337
+0,401
+0,521
+0,799
+0,854
+0,987
+1,065
+1,200
+1,229
+1,359
+1,498
+1,691
+2,200
+2,866
33























 chemistry
chemistry