Similar presentations:
Лекция 5 Химическое равновесие. Введение в электрохимию. Редокс процессы и равновесия
1.
Лекция №5План
1. Химическое равновесие
2. Введение в электрохимию
3. Редокс процессы и равновесия
2.
Обратимые реакцииХимические реакции, которые при одних и
тех же условиях могут идти в
противоположных направлениях.
При написании уравнений обратимых
реакций вместо знака равенства ставят две
противоположно направленные стрелки.
Реакцию, протекающую слева направо,
называют прямой (константа скорости
прямой реакции k1), справа налево обратной (константа скорости обратной
реакции k2).
3.
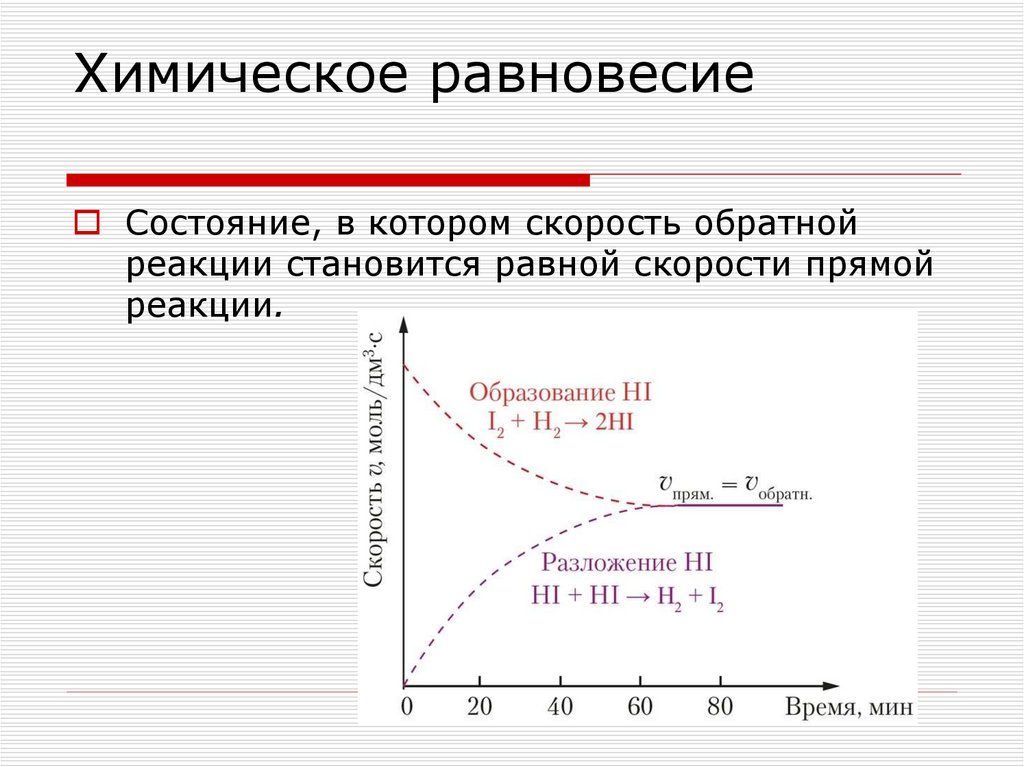
Химическое равновесиеСостояние, в котором скорость обратной
реакции становится равной скорости прямой
реакции.
4.
Константа равновесияаА bB cC dD
k1 C С
K
k2 C C
c
C
a
A
d
D
b
B
5.
Уравнение изотермыКонстанта равновесия связана
со стандартной энергией Гиббса реакции
G R T ln K 2,3 R T lg K
0
при ΔG <0 - реакция идет в прямом
направлении;
при ΔG = 0 - реакция достигла
равновесия ;
при ΔG >0 - реакция идет в обратном
направлении.
6.
7.
ТИПЫ ПРОВОДНИКОВПроводники первого рода(металлы)
Проводники второго рода (электролиты)
1
L ; [ Ом -1 См (Сименс)]
R
l
R ρ ;
S
8.
Электропроводность в растворахэлектролитов
Удельная (κ – каппа)
l
м
1
1
1
Ом м (См м )
2
R S Ом м
Молярная (λ)
λm
C
;
См м -1
2
1
См
м
моль
;
-3
моль м
9.
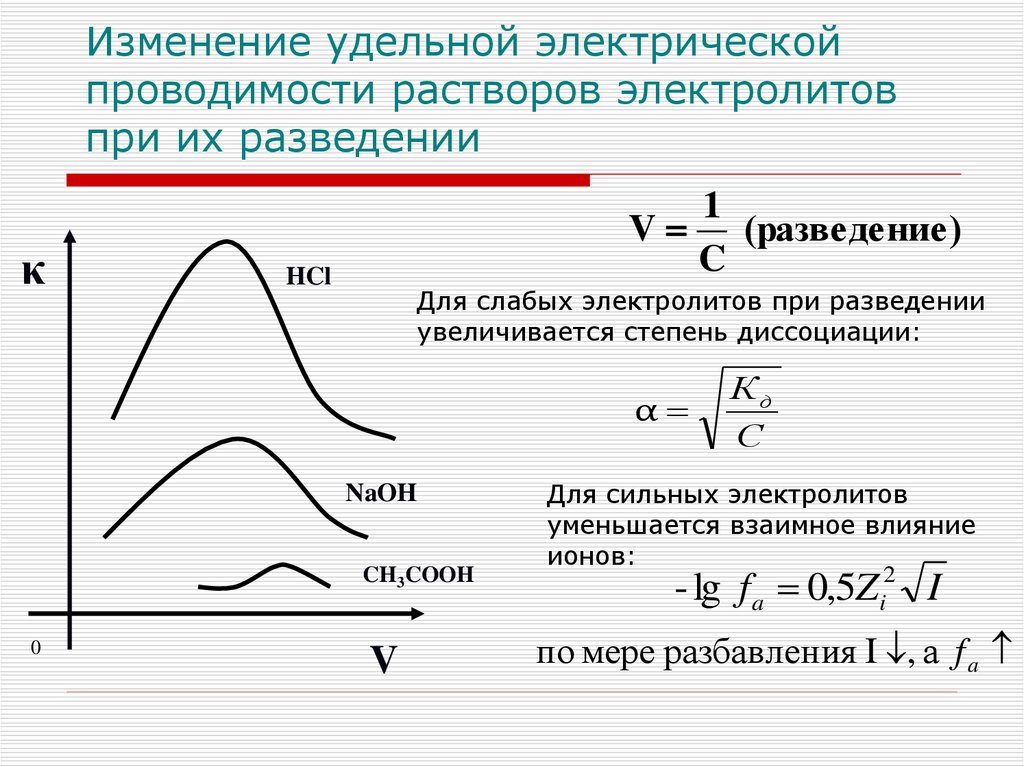
Изменение удельной электрическойпроводимости растворов электролитов
при их разведении
κ
1
V
(разведение)
C
HCl
Для слабых электролитов при разведении
увеличивается степень диссоциации:
α
NaOH
CH3COOH
0
V
Кд
С
Для сильных электролитов
уменьшается взаимное влияние
ионов:
- lg f a 0,5Zi2 I
по мере разбавления I , а f a
10.
Зависимость молярной электрическойпроводимости растворов электролитов от
разведения
λm
HCl
NaOH
λ∞
λ∞
С разбавлением раствора
молярная
электропроводность
увеличивается, достигая
максимального значения
при бесконечном
разведении:
λ∞
CH3COOH
λ∞
0
V
11.
Для слабых электролитовV, , число ионов, m;
∞ – полная ионизация ( =1)
Для сильных электролитов
V, сила межионного взаимодействия,
fа, m; ∞– полное отсутствие
межионного взаимодействия(fа =1)
12.
КОЛЬРАУШФридрих Вильгельм Георг
(1840-1910)
Предложил способ
определения
электрического
сопротивления
электролитов,
установил закон
независимости
движения ионов
в электролитах
13.
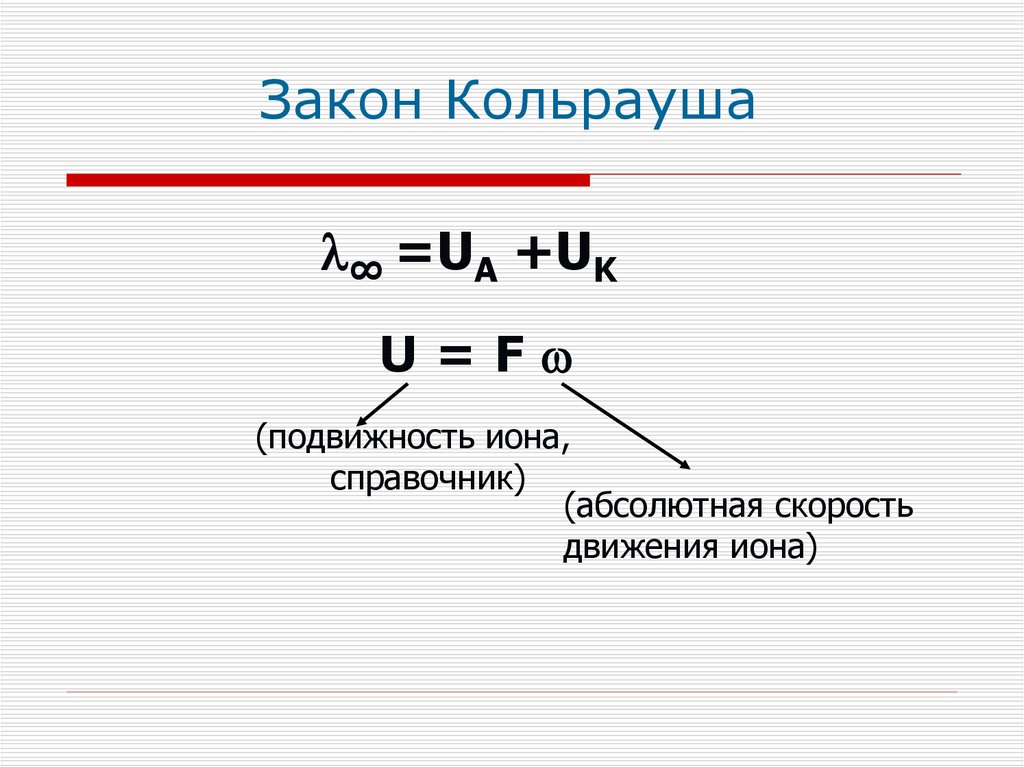
Закон КольраушаПредельная молярная
электропроводность раствора данного
электролита равна сумме предельных
молярных проводимостей ионов,
входящих в его состав
14.
Закон Кольрауша∞ =UA +UK
U=F
(подвижность иона,
справочник)
(абсолютная скорость
движения иона)
15.
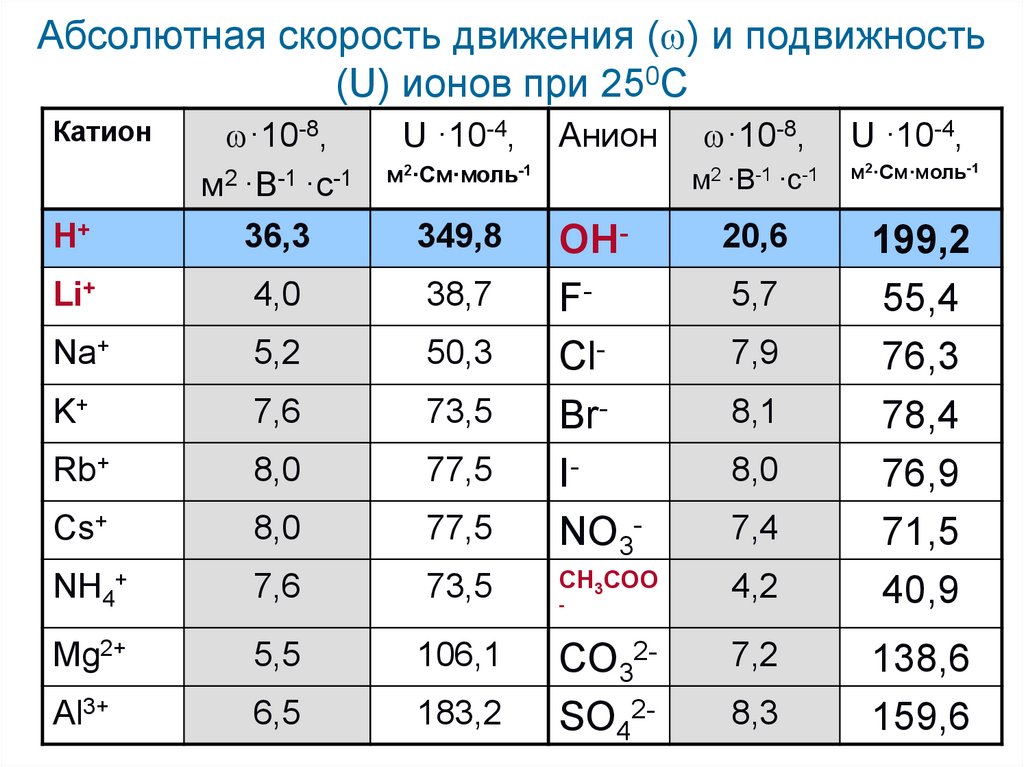
Абсолютная скорость движения ( ) и подвижность(U) ионов при 250С
м2·См·моль-1
H+
·10-8,
м2 ·В-1 ·с-1
36,3
Li+
4,0
38,7
Na+
5,2
50,3
K+
7,6
73,5
Rb+
8,0
77,5
Cs+
8,0
77,5
NH4+
7,6
Mg2+
Al3+
Катион
·10-8,
U ·10-4,
м2 ·В-1 ·с-1
м2·См·моль-1
OHFClBrINO3-
20,6
73,5
CH3COO
4,2
199,2
55,4
76,3
78,4
76,9
71,5
40,9
5,5
106,1
6,5
183,2
CO32SO42-
U ·10-4,
349,8
Анион
-
5,7
7,9
8,1
8,0
7,4
7,2
8,3
138,6
159,6
16.
Электропроводностьбиологических объектов
Изучение электропроводности
тканей позволяет оценить
особенности их функционирования,
состояние нормы и патологии
Используется в диагностике
Лежит в основе
физиотерапевтических методов
лечения: электрофорез, ионофорез
Лежит в основе рефлексологии
17.
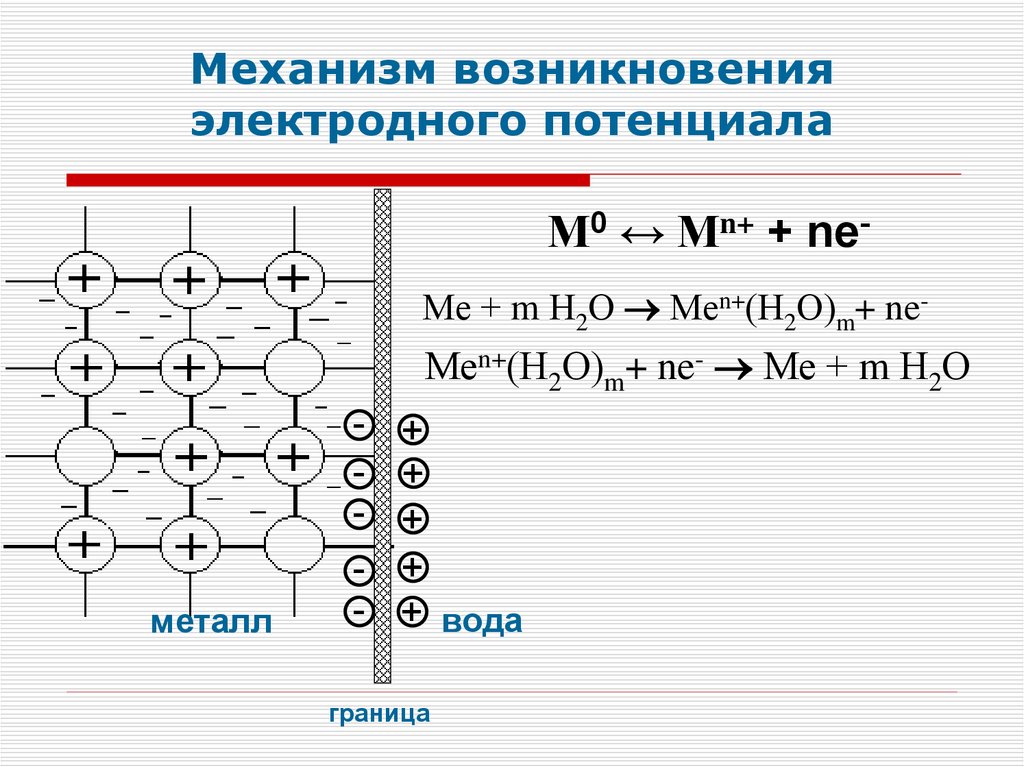
Механизм возникновенияэлектродного потенциала
М0 ↔ Mn+ + neМе + m Н2О Меn+(Н2О)m+ ne-
Меn+(Н2О)m+ ne- Ме + m Н2О
металл
-
+
+
+
+
+ вода
граница
18.
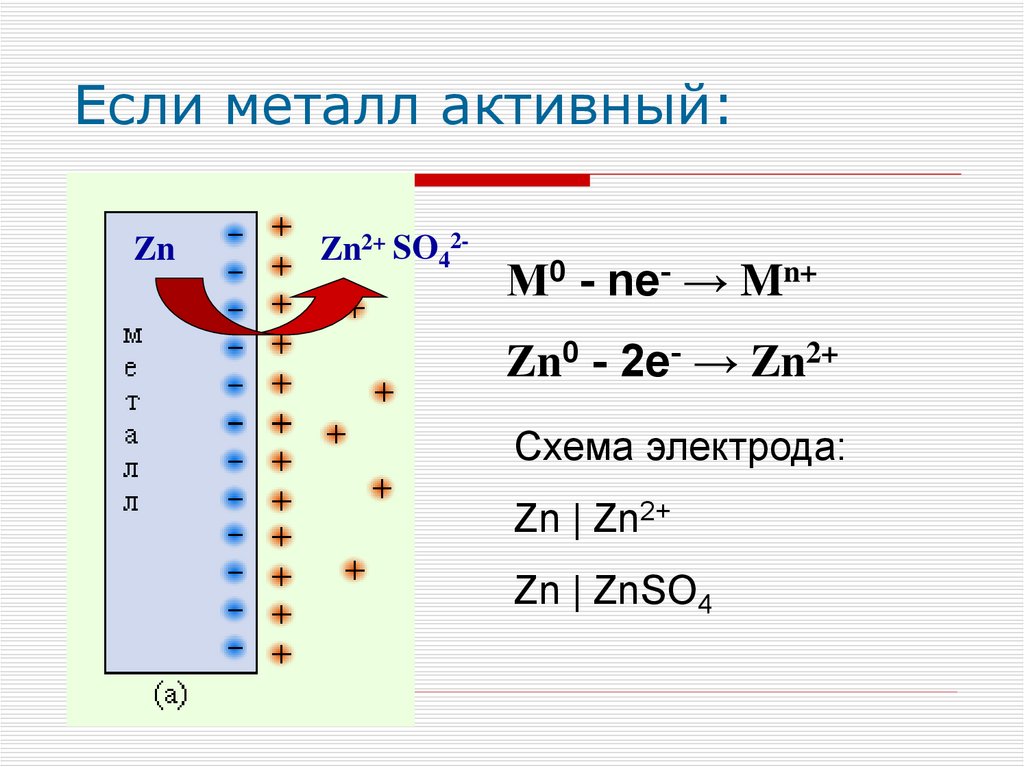
Если металл активный:Zn
Zn2+ SO42-
М0 - ne- → Mn+
Zn0 - 2e- → Zn2+
Схема электрода:
Zn | Zn2+
Zn | ZnSO4
19.
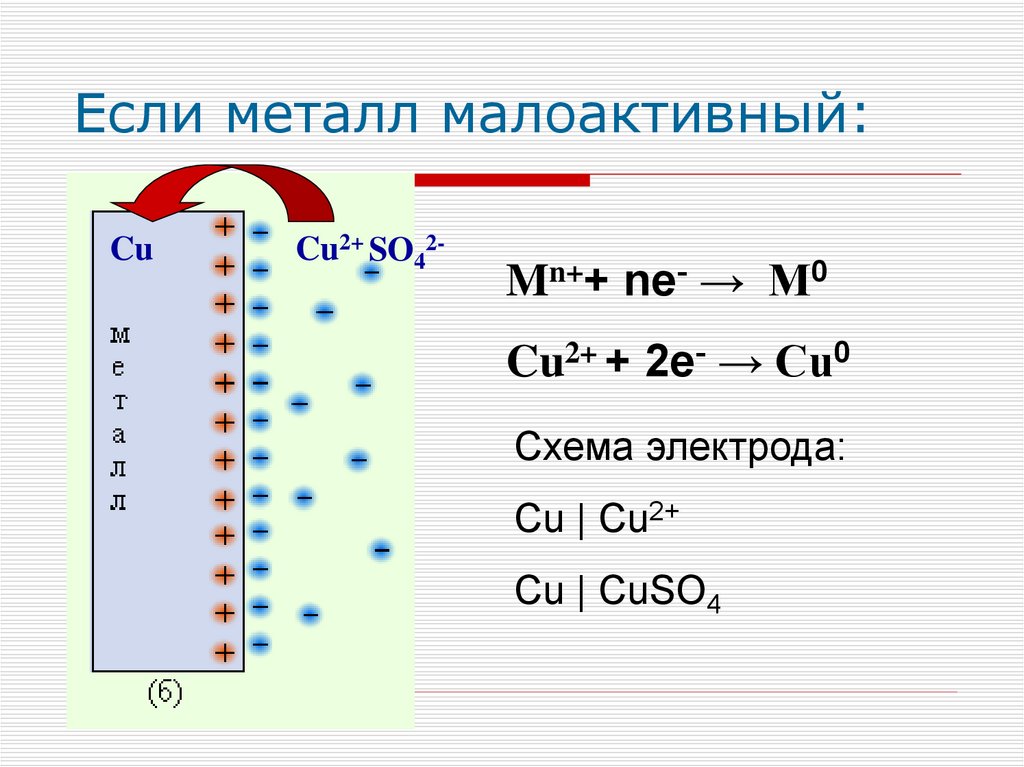
Если металл малоактивный:Cu
Cu2+ SO42-
Mn++ ne- → М0
Cu2+ + 2e- → Cu0
Схема электрода:
Cu | Cu2+
Cu | CuSO4
20.
Электродный потенциал зависит:Природы металла
Активности его ионов
Температуры
Величина потенциала в реальных
условиях рассчитывается по
уравнению Нернста
21.
Уравнение НернстаEMen / Me E
4
0
Men / Me
2 10 T
lg СMen
n
При температуре 25°С (298 К)
EMen / Me E
E
0
Men / Me0
0
Men / Me
0,059
lg aMen
n
- стандартный электродный потенциал
22.
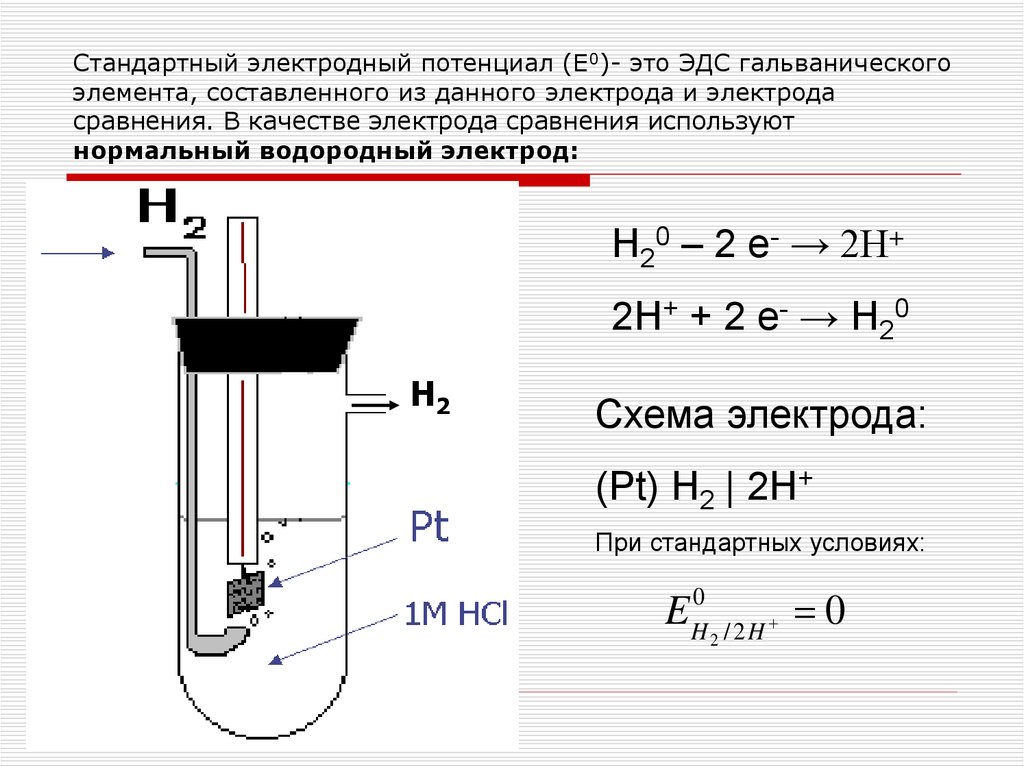
Стандартный электродный потенциал (Е0)- это ЭДС гальваническогоэлемента, составленного из данного электрода и электрода
сравнения. В качестве электрода сравнения используют
нормальный водородный электрод:
H20 – 2 e- → 2H+
2H+ + 2 e- → H20
Н2
Схема электрода:
(Pt) H2 | 2H+
При стандартных условиях:
EH0 / 2 H 0
2
23.
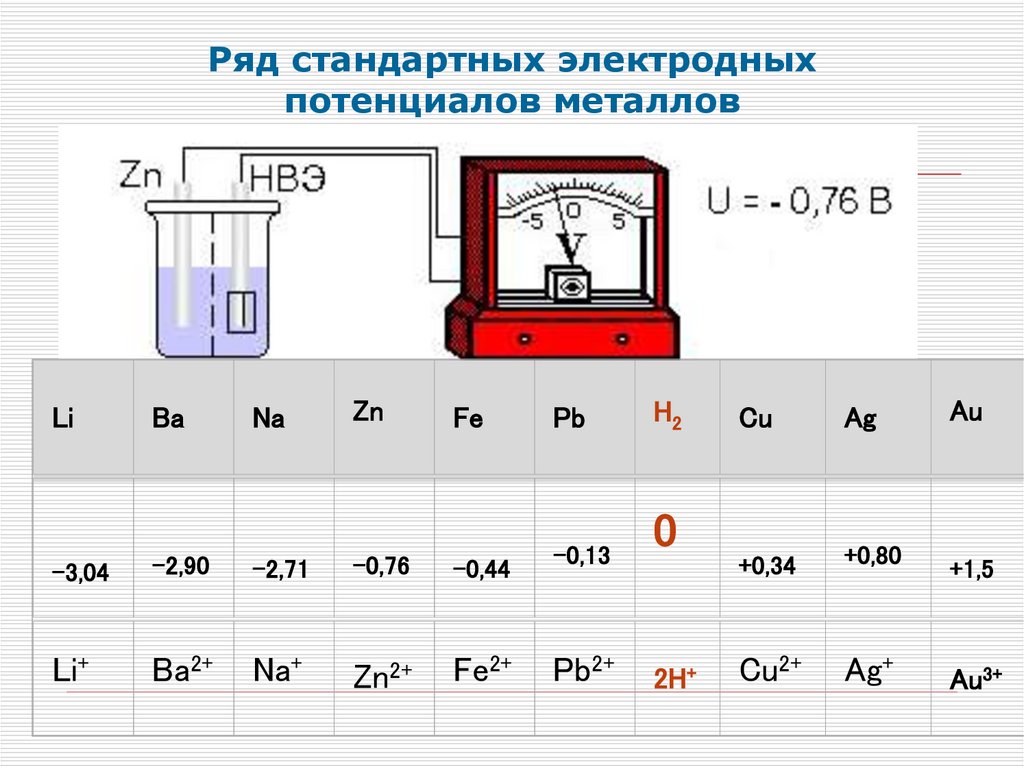
Ряд стандартных электродныхпотенциалов металлов
Li
Ba
Na
Zn
Fe
-3,04
-2,90
-2,71
-0,76
-0,44
Li+
Ba2+
Na+
Zn2+
Fe2+
Pb
-0,13
Pb2+
H2
0
2H+
Cu
Ag
+0,34
+0,80
Cu2+
Ag+
Au
+1,5
Au3+
24.
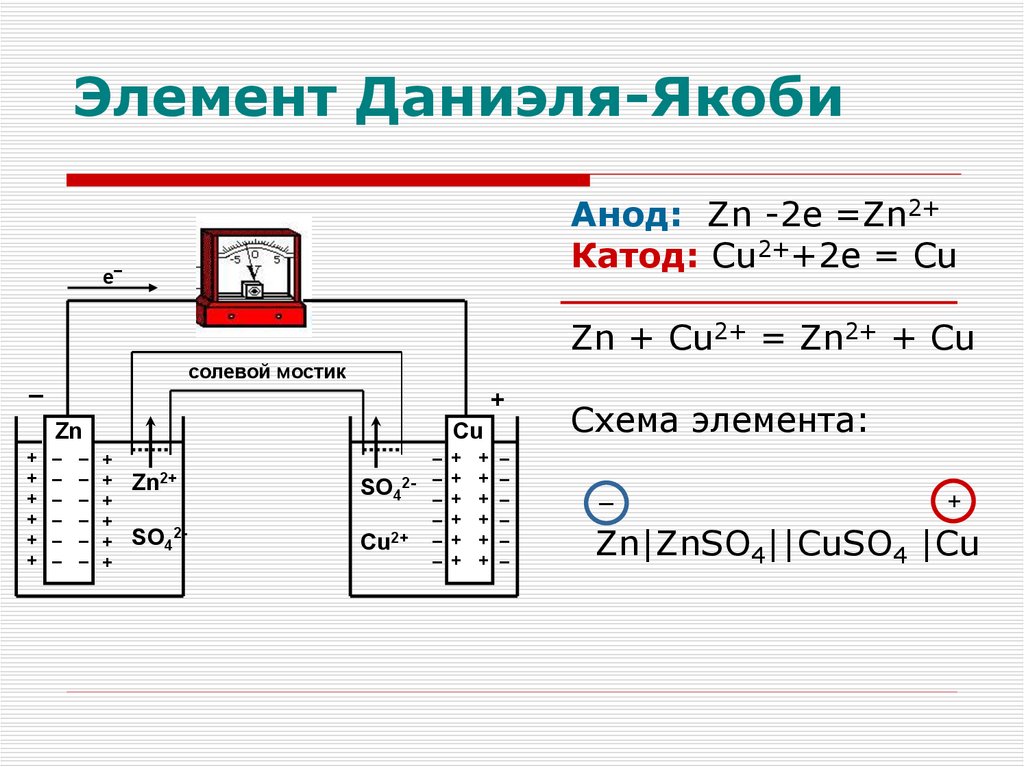
Гальванический элементБиметаллический
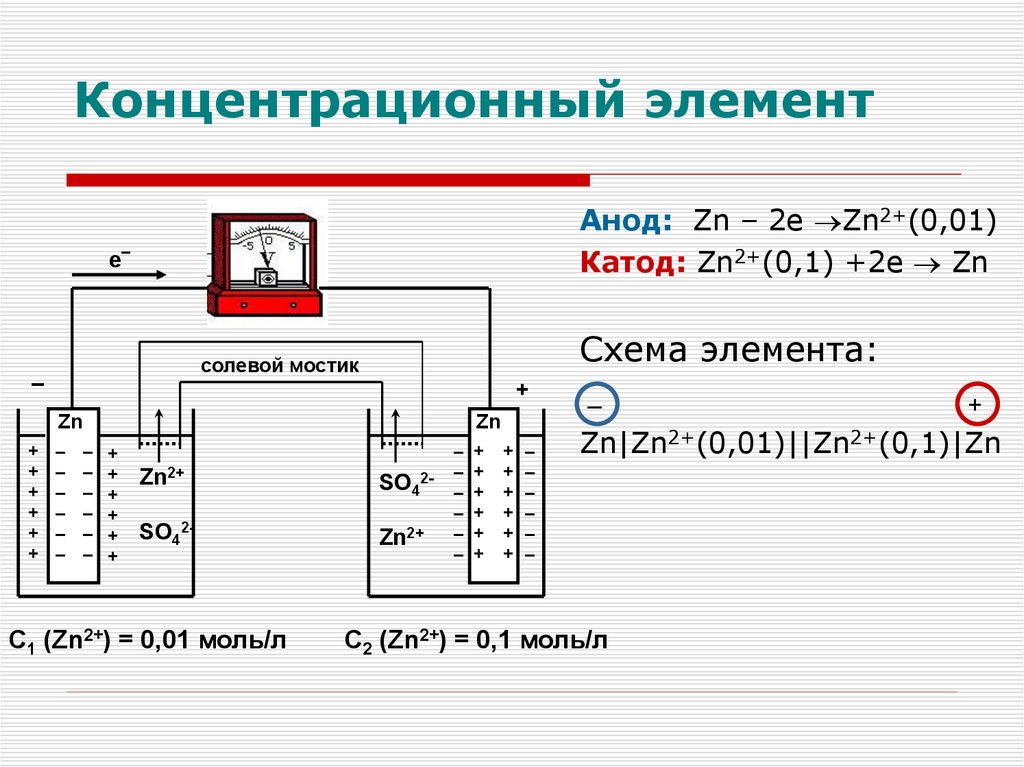
Концентрационный
25.
Элемент Даниэля-ЯкобиАнод: Zn -2e =Zn2+
Катод: Cu2++2e = Cu
е‾
Zn + Cu2+ = Zn2+ + Cu
солевой мостик
–
+
Zn
+
+
+
+
+
+
–
–
–
–
–
–
–
–
–
–
–
–
Cu
+
+
+
+
+
+
Zn2+
SO42-
– +
SO42- –– ++
– +
2+
– +
Cu
– +
+ –
+ –
+ –
+ –
+ –
+ –
Схема элемента:
–
+
Zn|ZnSO4||CuSO4 |Cu
26.
Электродвижущая сила (ЭДС)ЭДС гальванического элемента (ЕГЭ )равна
разности его электродных потенциалов
ЕГЭ = Екатода – Еанода
В гальванической цепи работающей
самопроизвольно
Екатода > Еанода
0
0
если ЕZn
0
,
76
B
;
E
0,34 В,
2
/ Zn
Cu 2 / Cu
0
то, Е ГЭ
0,34 ( 0,76) 1,1 B
27.
Концентрационный элементАнод: Zn – 2е Zn2+(0,01)
Катод: Zn2+(0,1) +2e Zn
е‾
Схема элемента:
солевой мостик
–
+
Zn
+
+
+
+
+
+
–
–
–
–
–
–
Zn
–
–
–
–
–
–
+
+
+
+
+
+
Zn2+
SO42-
SO42-
Zn2+
С1 (Zn2+) = 0,01 моль/л
– +
– +
– +
– +
– +
– +
+
+
+
+
+
+
–
–
–
–
–
–
–
+
Zn|Zn2+(0,01)||Zn2+(0,1)|Zn
С2 (Zn2+) = 0,1 моль/л
28.
Концентрационный элемент4
2
10
T
0
E Ан.( Zn 2 / Zn ) EZn 2 / Zn
lg C1
n
4
2 10 Т
0
EКат.( Zn 2 / Zn ) EZn 2 / Zn
lg С2
n
4
2 10 Т С2
E ГЭ
lg
n
С1
29.
Классификация электродовПо типу электродной реакции:
первого рода
второго рода
По принципу применения:
индикаторные (определения)
сравнения
30.
Электроды сравненияСтандартный водородный
Хлорсеребряный
Каломельный
31.
Хлорсеребряныйэлектрод
AgCl
Ag | AgCl | KCl
Ag
Электрод второго рода
потенциал определяется
активностью аниона в
растворе
KCl
солевой мостик
32.
Каломельный электродЭлектрод второго рода
(Pt) Hg | Hg2Cl2 | KCl
33.
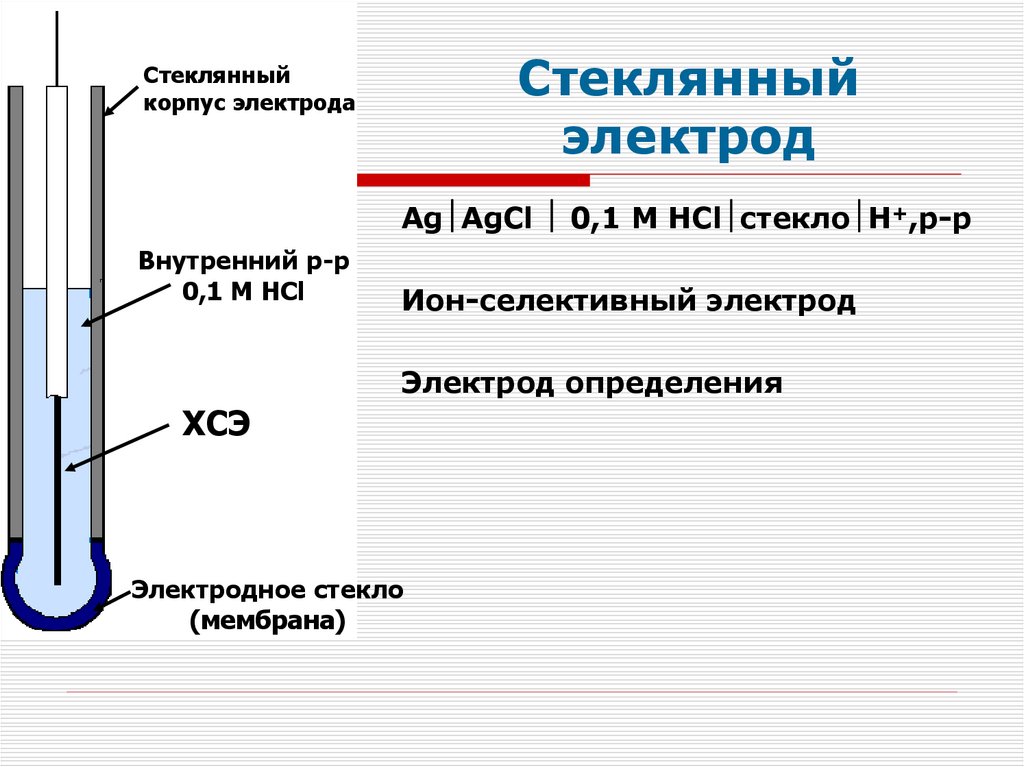
Стеклянныйэлектрод
Стеклянный
корпус электрода
Ag AgCl 0,1 M HCl стекло H+,р-р
Внутренний р-р
0,1 М НCl
Ион-селективный электрод
Электрод определения
ХСЭ
Электродное стекло
(мембрана)
34.
Определение рНpH
ЭДС Eэлектрода сравнения
4
2 10 Т
35.
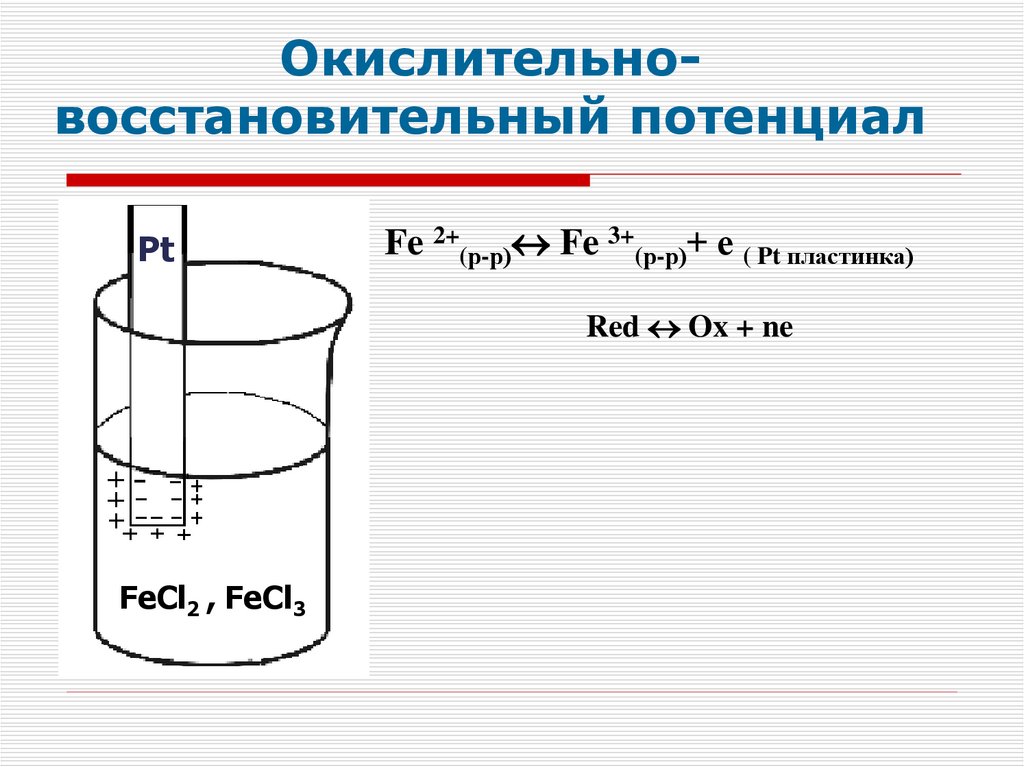
Окислительновосстановительный потенциалPt
Fe 2+(р-р) Fe 3+(р-р)+ е ( Pt пластинка)
Red Ox + ne
FeCl2 , FeCl3
36.
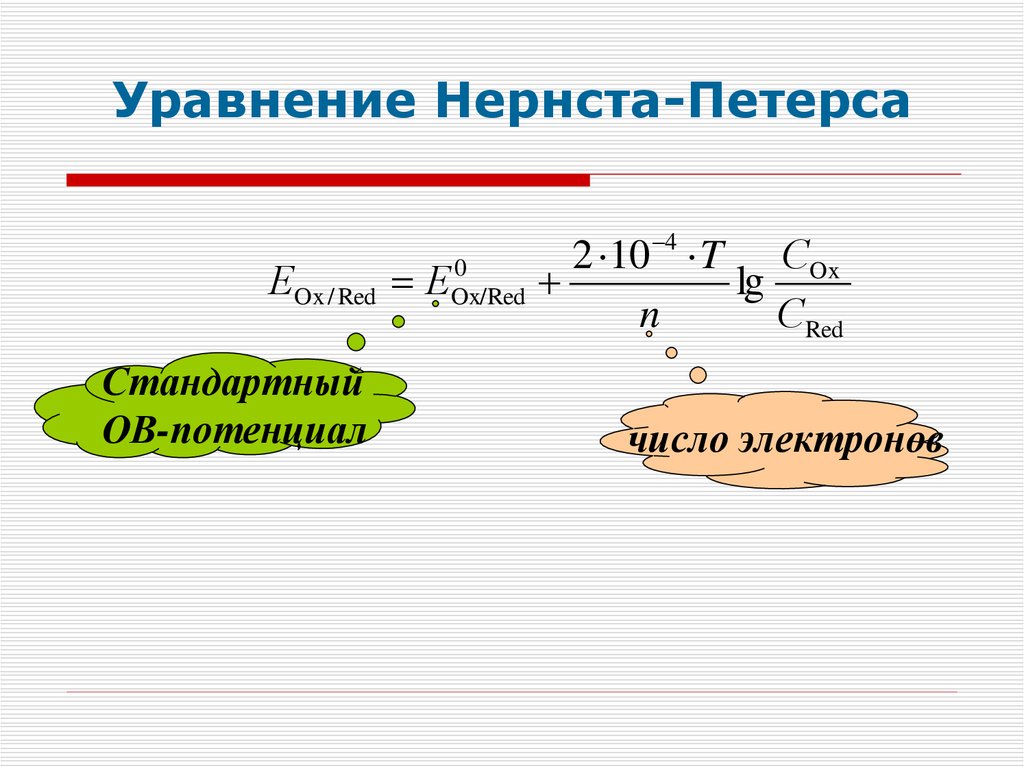
Уравнение Нернста-Петерса4
2
10
T СOx
0
ЕOx / Red ЕOx/Red
lg
n
СRed
Стандартный
ОВ-потенциал
число электронов
37.
ОВП зависит от:Температуры
Природы окислителя и
восстановителя
Концентраций окисленной и
восстановленной форм
рН среды
38.
MnO4- + 8H+ +5e Mn 2+ + 4H2Oa(MnO4-) = a(Mn2+) = 1 моль/л,
а(H+) = 1 моль/л
Если составить гальванический элемент из (Pt)
MnO4-/Mn2+ и стандартного водородного электрода
(Pt),H2|2H+, то:
E
0
MnO4 / Mn 2
1,51В
39.
Направление ОВРЧем больше стандартный ОВ потенциал
системы, тем в большей степени
выражены ее окислительные свойства в
стандартных условиях. Например:
MnO4-/Mn2+
E0= 1,51 B
Fe3+/Fe2+
E0= 0,77 B
Sn4+/Sn2+
E0= 0,15 B
40.
Пример:Sn2+ + 2Fe3+ ↔ Sn4+ + 2Fe2+
Red
Ox
Ox
Red
Вычислим стандартное значение ∆Е
∆Е = Е0 (Fe3+/ Fe2+) – Е0 (Sn4+/ Sn2+)
∆Е = 0,77 – 0,15 = 0,62 В
Данная реакция может протекать
самопроизвольно в прямом направлении так
как ∆Е > 0

























 chemistry
chemistry








