Similar presentations:
Электрохимические процессы
1.
Лекция 7Электрохимические
процессы
1
2.
Двойной электрический слой. Электродные потенциалыH2O
+n
Me
+
+
H2O
+
+
+
+
+
+
+
+
+
+
+
+
Me
H2O
H2O
по схеме:
Ме0 – nē Меn+
Меn+ + nē Ме0
Двойной электрический слой
3.
С течением времени устанавливаетсяравновесие:
Ме0 + mH2O ⇄ Me(H2O)mn+ + nē
Или упрощенно:
0
Ме
⇄
n+
Ме +
nē
3
4.
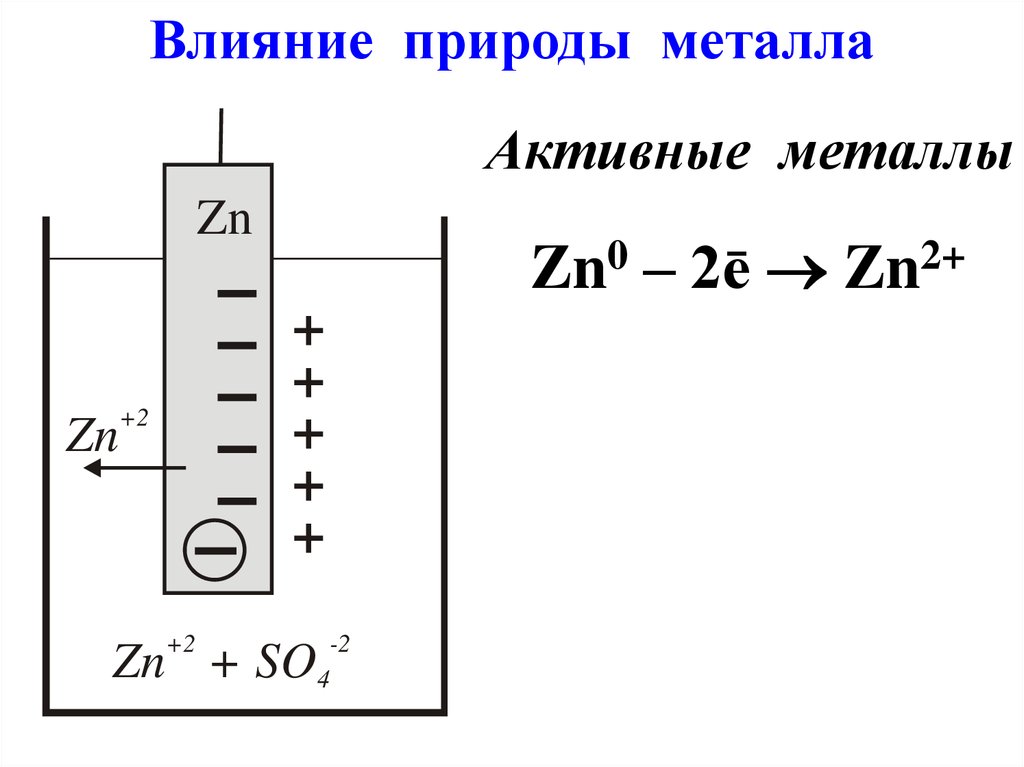
Влияние природы металлаАктивные металлы
Zn
+
+
+
+
+
Zn
Zn0 – 2ē Zn2+
+2
+2
Zn + SO4
-2
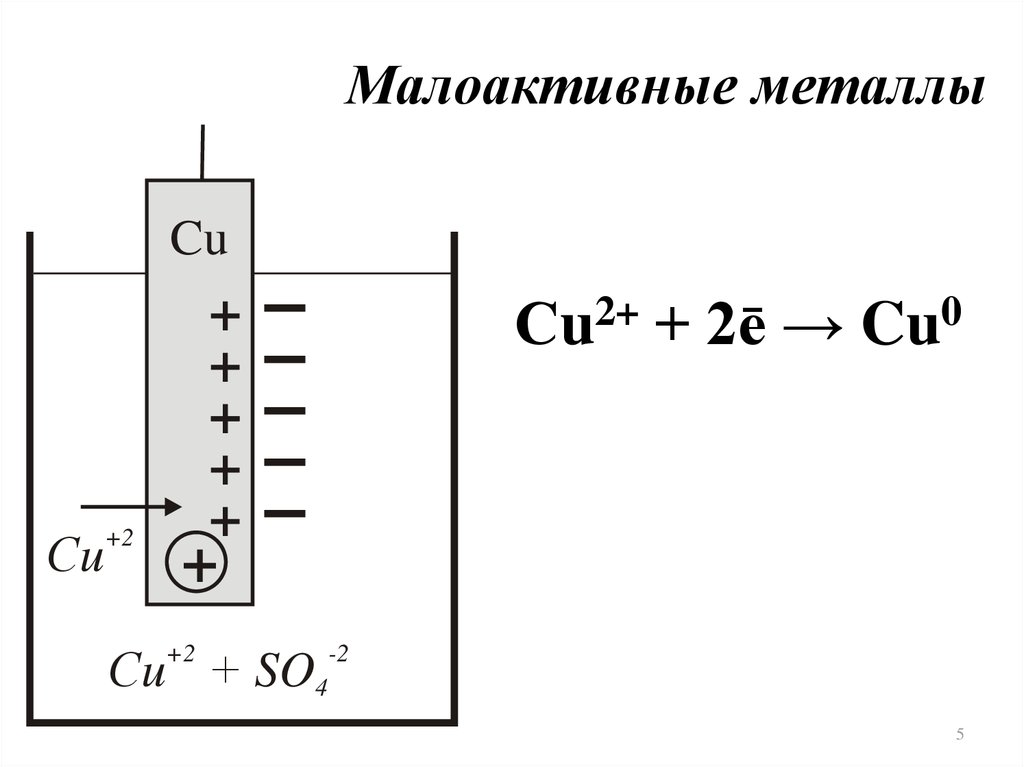
5.
Малоактивные металлыCu
Сu
+2
Сu2+ + 2ē → Cu0
+
+
+
+
+
+
Сu + SO4
+2
-2
5
6.
Электродный потенциал (Е, , [В])Если концентрация ионов равна 1 моль/л при
температуре 25оС, то электродный потенциал
называют стандартным электродным
потенциалом Ео( о).
o
Zn 2 / Zno 0.76 B
для полуреакции Zn
o
Cu 2 / Cu o
2
2e Zn
0.34 B
для полуреакции Cu
2
2e Cu
6
7.
Водородный электродН2 – 2ē ⇄ 2Н+
o
2Н / Н2
0.00 В
Pt
Н2
2Н / SO
+
-2
4
Н / H2 (Pt)
+
7
8.
Пример:Fe + CuCl2 = FeCl2 +Cu
Cu + Hg(NO3)2 = Hg + Cu(NO3)2
Zn+2HCl=ZnCl2+H2
8
9.
Таблица стандартных электродныхпотенциалов характеризует химическую
активность металлов.
1. чем меньше электродный потенциал металла, тем
больше его восстановительная способность и тем
активнее металл
2. металлы, имеющие отрицательный электродный
потенциал и стоящие в ряду напряжений до водорода,
вытесняют его из разбавленных растворов кислот
(кроме азотной кислоты);
3. каждый металл способен вытеснять (восстанавливать)
из растворов солей те металлы, которые в ряду
напряжений стоят после него.
10.
формула Нернста:RT
n
ln Ме
nF
о
о – стандартный электродный
потенциал (В);
F – постоянная Фарадея (96500
Кл/экв);
11.
R – универсальная газоваяпостоянная (8,314 Дж/моль);
T – фактическая температура (298 К);
n – число электронов, принимающих
участие в процессе;
n – концентрация
Ме
(активность) ионов
металла в растворе
(моль/л)
11
12.
0,059n
lg Ме
n
о
Цинковая пластинка погружена в 0,01 М
раствор её соли
o
Zn 2 / Zn o
Zn 2 / Zn o
0
,
059
n
0.76 В
lg Ме
n
0,059
2
0.76
lg 10 0.819 B
2
о
12
13.
Гальваническиеэлементы (ГЭ)
13
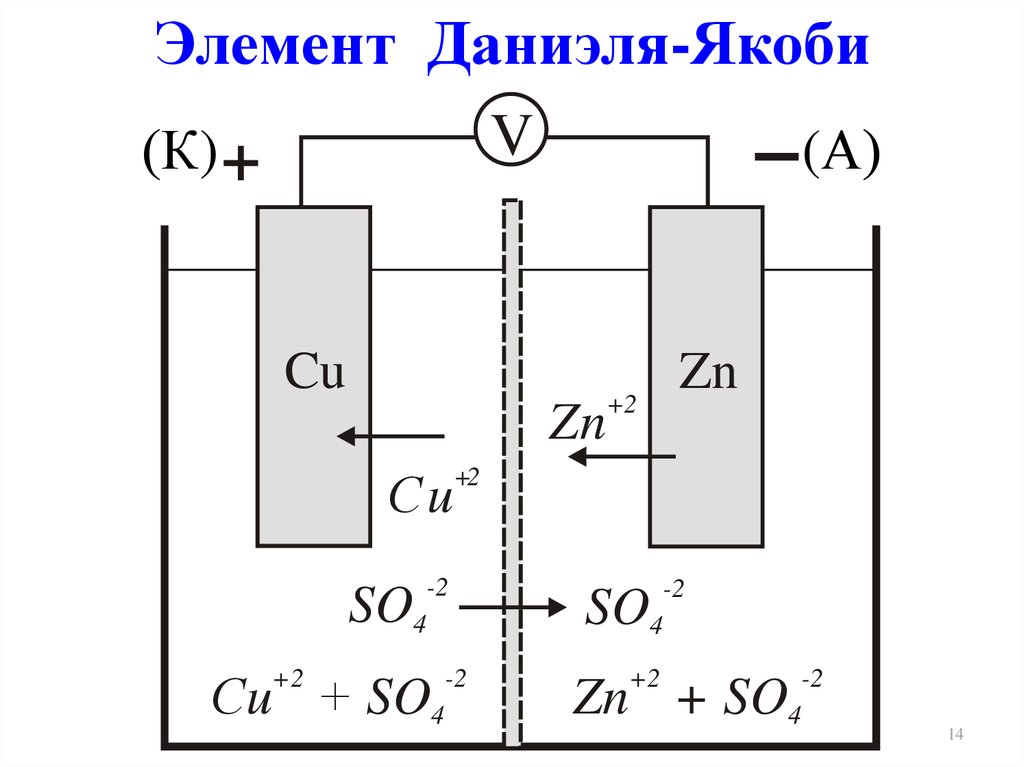
14.
Элемент Даниэля-ЯкобиV
(К) +
(А)
Cu
Zn
Сu
+2
+2
-2
SO4
Сu + SO4
+2
SO4
+2
Zn
-2
-2
Zn + SO4
-2
14
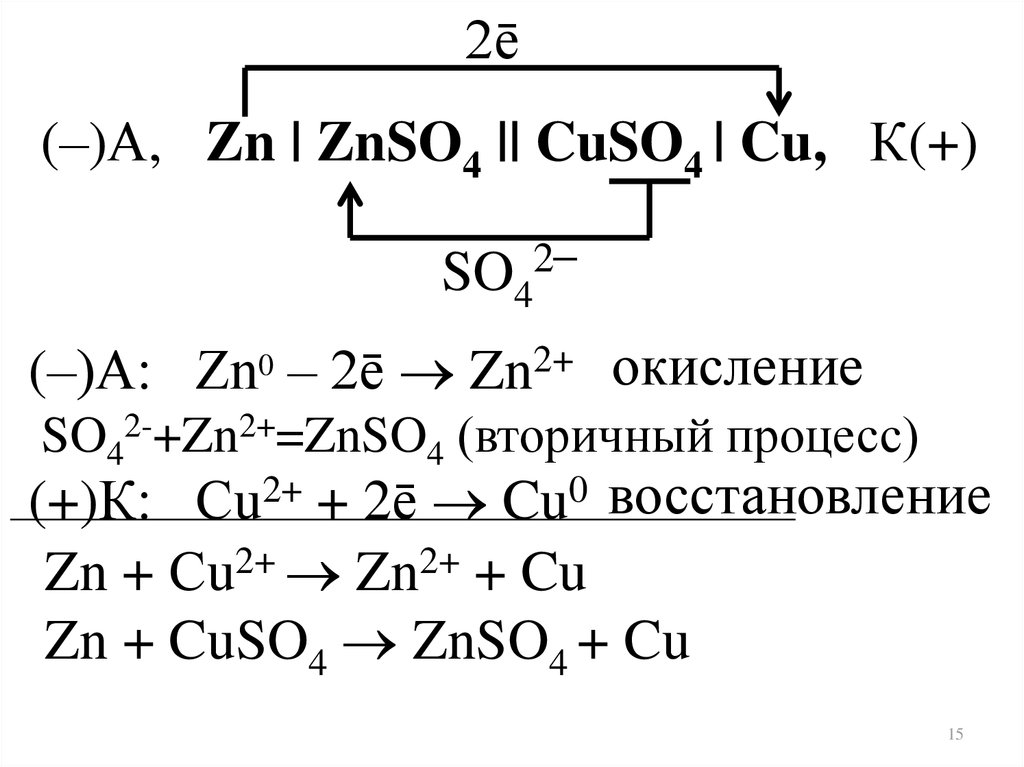
15.
2ē(–)А, Zn | ZnSO4 || CuSO4 | Cu, К(+)
2–
SO4
(–)А: Zn0 – 2ē Zn2+ окисление
SO42-+Zn2+=ZnSO4 (вторичный процесс)
(+)К: Сu2+ + 2ē Cu0 восстановление
Zn + Сu2+ Zn2+ + Cu
Zn + CuSO4 ZnSO4 + Cu
15
16.
ЭДС при стандартных условиях:o
ЭДС = катода –
o
анода
Для элемента Даниэля-Якоби:
ЭДС
o
= Cu 2 / Cu o
o
– Zn 2 / Zn o
=
= 0,34 + 0,76 = 1,1 В
16
17.
Формула Нернста0,059
о
n
lg Ме
n
о – стандартный электродный
потенциал (В);
n – число отданных или принятых
электронов;
Ме – концентрация ионов металла
n
в растворе (моль/л).
18.
Пример:Цинковая пластинка погружена в 0,01 м
раствор её соли.
o
Zn 2 / Zn o
0.76 В
0,059
n
lg Ме
n
о
Zn 2 / Zn o
0,059
2
0.76
lg 10 0.819 B
2
18
19.
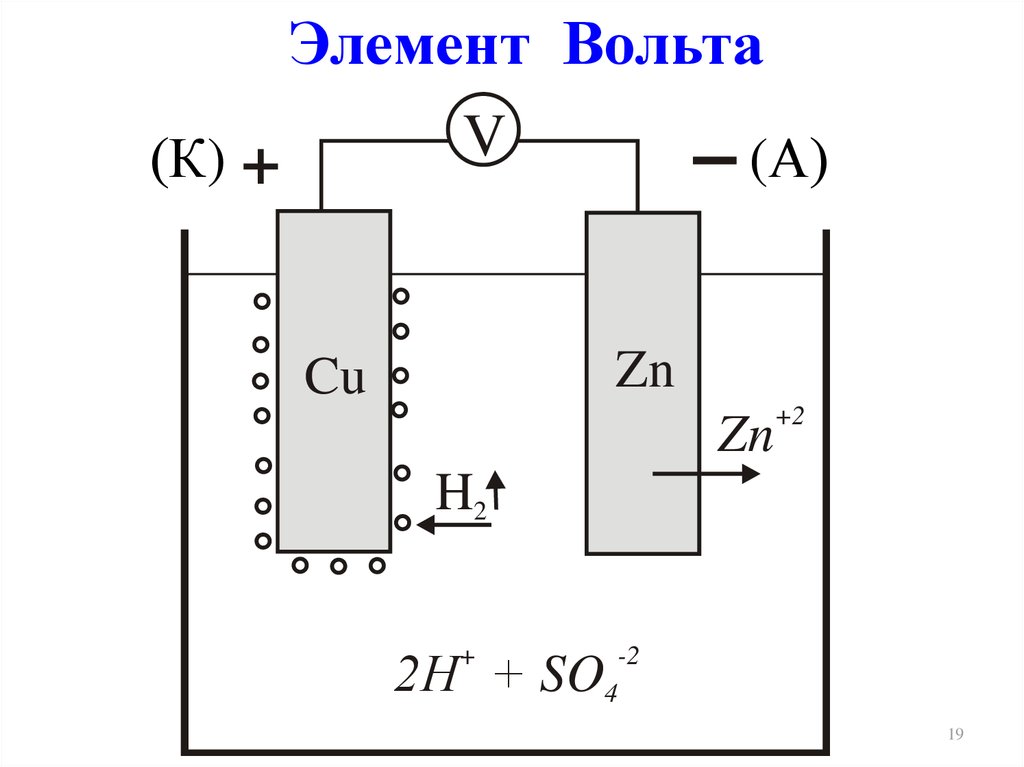
Элемент ВольтаV
(К) +
(А)
Zn
Cu
Zn
+2
H2
2Н + SO
+
-2
4
19
20.
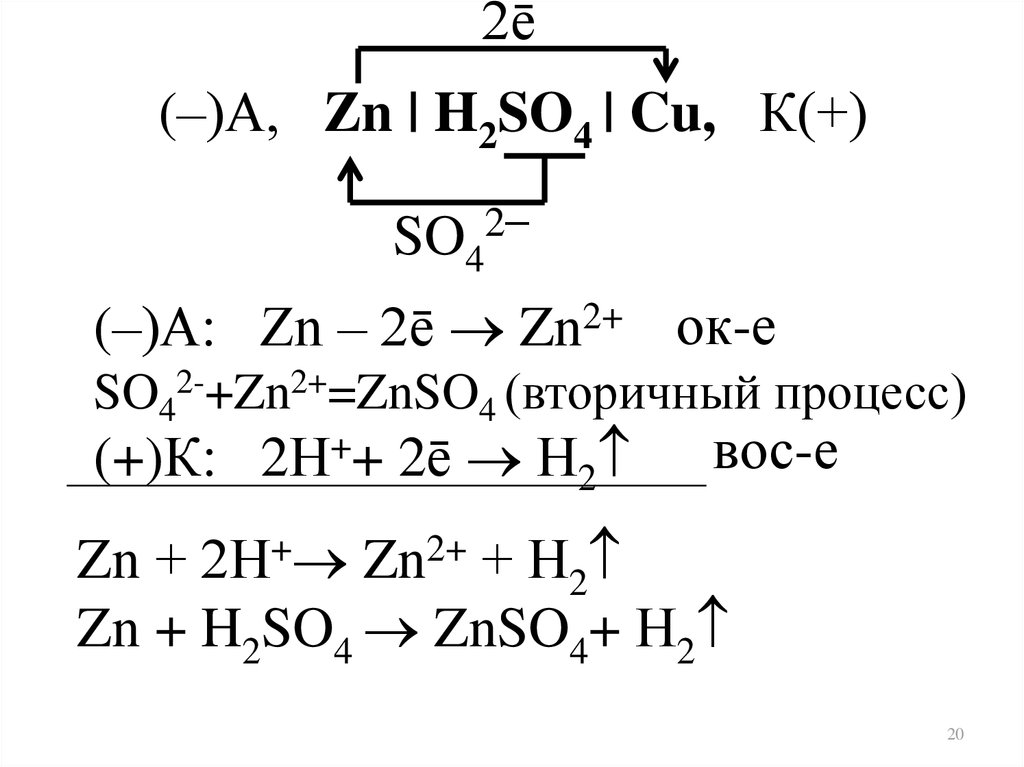
2ē(–)А, Zn | H2SO4 | Cu, К(+)
SO42–
(–)А: Zn – 2ē Zn2+ ок-е
SO42-+Zn2+=ZnSO4 (вторичный процесс)
(+)К: 2Н++ 2ē Н2
вос-е
Zn + 2Н+ Zn2+ + Н2
Zn + H2SO4 ZnSO4+ Н2
20
21.
ЭДСo
= Cu 2 / Cu o
o
– Zn 2 / Zn o
= 0,34 + 0,76 = 1,1 В
=
22.
ЭЛЕКТРОЛИЗ23.
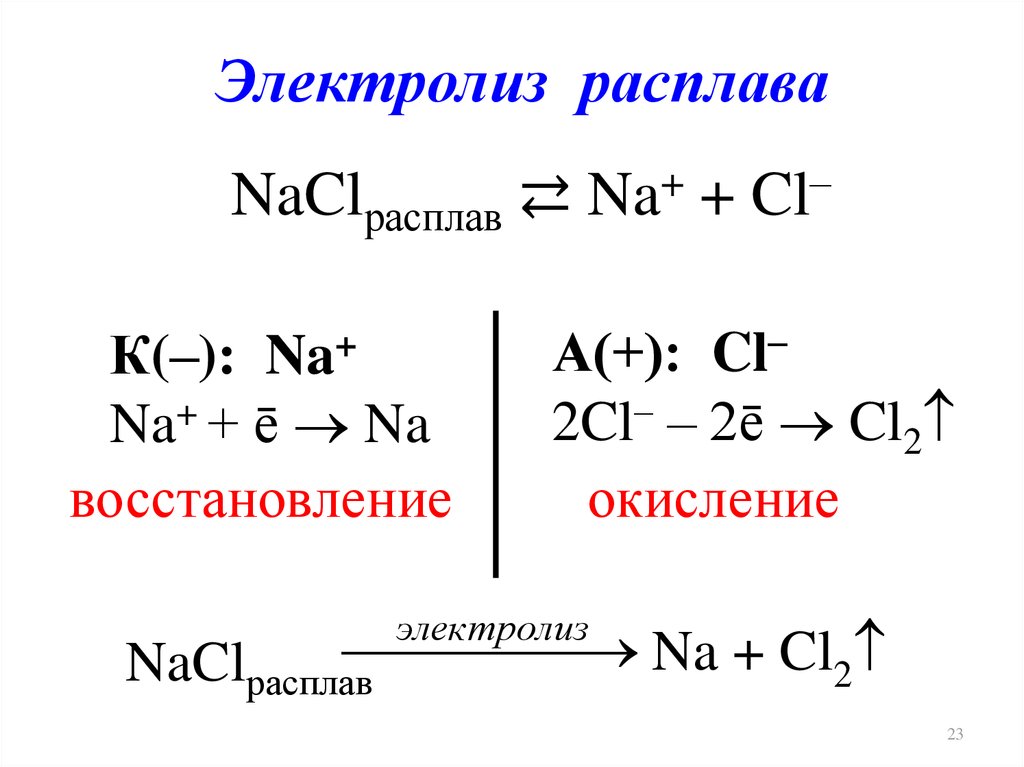
Электролиз расплаваNaClрасплав ⇄ Na+ + Cl–
К(–): Na+
Na+ + ē Na
восстановление
А(+): Cl–
2Cl– – 2ē Cl2
окисление
электролиз
Na + Cl2
NaClрасплав
23
24.
Na2SO4 расплав ⇄ 2Na+ + SO4–2К (–): Na+
А (+): SO4–2
Na++ ē Na SO4–2– 2ē SO3 +1/2O2
электролиз
2Na2SO4 расплав
4Na + 2SO3 + O2
25.
Электролиз водных растворов25
26.
Последовательность разрядкиионов и молекул на электродах
1) На катоде: в первую очередь разряжается
(восстанавливается) ион металла, имеющий
больший потенциал.
Zn2+
о, В –0.76
3
Ag+
+0.85
1
Cu2+
+0,34
2
–
0
Ag + 1ē → Ag
2+
0
Ca + 2ē → Cu
26
27.
Металл о, ВLi … Al
Mn … Pb
Cu … Au
Процесс восстановления
2H2O + 2ē → 2OH– + H2↑
о = –0.41 B
В кислой среде:
2H+ + 2ē → H2↑ φо = 0 B
Mn2+ + 2ē Mn
2H2O + 2ē → 2OH– + H2↑
восстановление и металла, и воды.
Cu2+ + 2ē Cu
28.
2) На аноде: окисляются более сильныевосстановители – вещества, имеющие
меньшее значение потенциала.
о, В
SO42–
+2.05
3
OH– (H2O) Cl–
+1.4
+1,36
2
1
–
2Cl – 2ē → Cl2↑
2H2O – 4ē → 4H+ + O2↑
28
29.
Асm–Анод
бескислородных
кислот
кислородсодержащих
кислот
Растворимый
Me – nē Men+
Инертный
Асm– – mē Асо В кислой и нейтральной
(кроме F–)
среде:
2H2O – 4ē → 4H+ + O2↑
о = –1,23 B
для прямой полуреакции
В щелочной среде:
4OH– – 4ē → 2H2O+O2↑
о = –0.401 B
для прямой полуреакции
29
30.
Электролиз водного раствора иодидакалия с инертными электродами
KI ⇄ K+ + I–
H2O ⇄ H+ + OH–
К(–): K+; H+(H2O) А(+): I–; OH–(H2O)
о
о
+0.54 < +1.4
–2.9 0
2H2O + 2ē →
–
2I – 2ē → I2
–
→ 2OH + H2↑
вторичный процесс:
K+ + OH– → KOH
pH > 7
31.
Электролиз водного раствора Na2SO4 синертными электродами
Na2SO4 ⇄ 2Na+ + SO42– H2O ⇄ H+ + OH–
К(–):
Na+,
H+(H2O)
о –3 0
2H2O + 2ē →
2OH– + H2↑
вторичный процесс:
Na+ + OH– → NaOH
pH > 7
–
OH (H
А(+): SO4
о +2.05 +1.4
2–,
2O)
2H2O – 4ē →
→ 4H+ + O2↑
вторичный процесс:
2H++SO42– → H2SO4
pH < 7
32.
Электролиз водного раствора NiSO4 синертными электродами
NiSO4 ⇄ Ni2+ + SO42–
H2O ⇄ H+ + OH–
К(–):
Ni2+,
H+(H2O)
о –0,25 0
2H2O + 2ē →
2OH– + H2↑
Ni2+ + 2ē → Ni0
–
OH (H
А(+):
о +2.05 +1.4
SO42–,
2H2O – 4ē →
→ 4H+ + O2↑
2O)
33.
Электролиз водного раствора NiSO4 сникелевым анодом
NiSO4 ⇄ Ni2+ + SO42–
H2O ⇄ H+ + OH–
К(–):
Ni2+,
H+(H2O)
о –0,25 0
2H2O + 2ē →
2OH– + H2↑
Ni2+ + 2ē → Ni0
–
OH ,
А(+):
Ni0
о +2.05 +1.4>–0,25
SO42–,
Ni0 – 2ē → Ni2+
34.
Законы электролизаI закон Фарадея
m = kQ
m – количество вещества, г;
k – электрохимический эквивалент,г/Кл;
Q – количество электричества, Кл.
35.
Q = II – сила тока, А;
– время, с.
m = kI
36.
Мэk
F
Мэ – молярная масса эквивалента
металла, г/моль;
I – сила тока, А;
F – число Фарадея (96500 Кл).
– время, с.
37.
МэЭМ Q
m
I
F
96500
Vэ
I
для газов: V
96500
VЭ(O2) = 5,6 л/моль
VЭ(H2,Cl2) = 11,2 л/моль
38.
II закон Фарадеяm1 : m2 : … : mn = ЭМ1 : ЭМ2 : … : ЭМn
Эм – химические эквиваленты веществ.
39.
Пример:ZnCl2 ⇄ Zn2++ 2Cl–
Zn2+,
К (–):
H2O
о –0.76 –0.41
А (+): Cl–, H2O
1.36 1.23
Zn2+ + 2ē → Zn
2Cl– – 2ē → Cl2↑
40.
МэZnI
mZn =
96500
mZn 96500 3.6 96500
МэZn
32.5 г / моль
I
3 3600
mZn МэZn
VCl
VэCl
22.4 МэCl 22.4 35.5
VэCl
11.2 л / моль
M Cl
71
41.
VCl 2mZn VэCl 3.6 11.2
1.24 л
МэZn
32.5














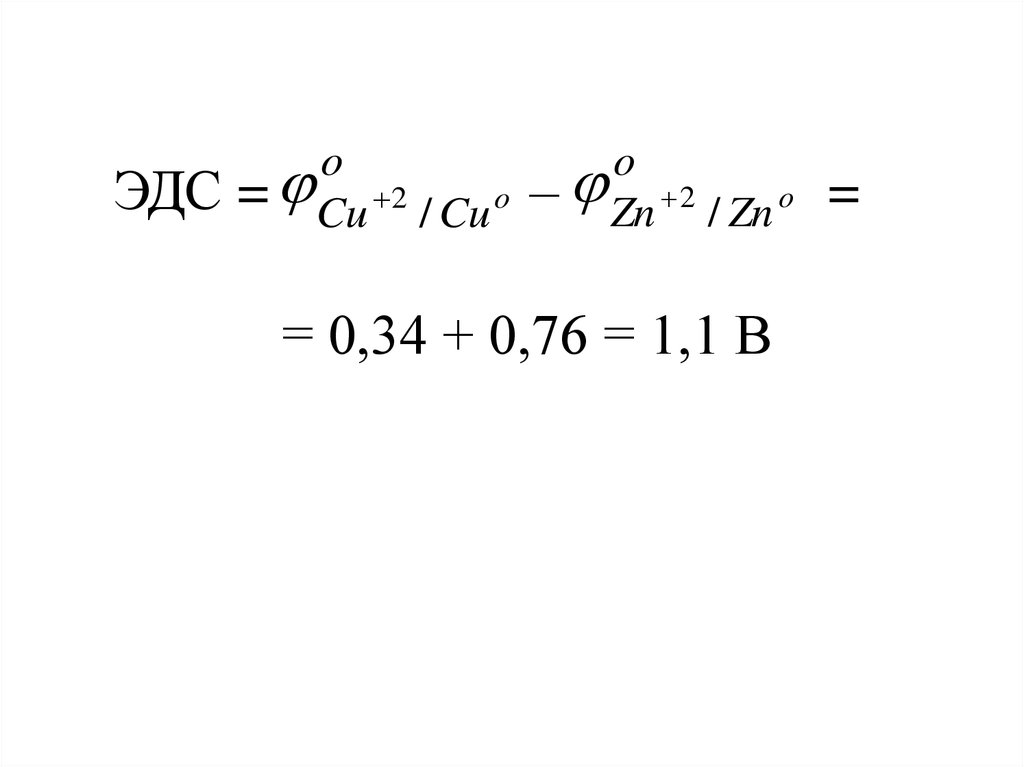


















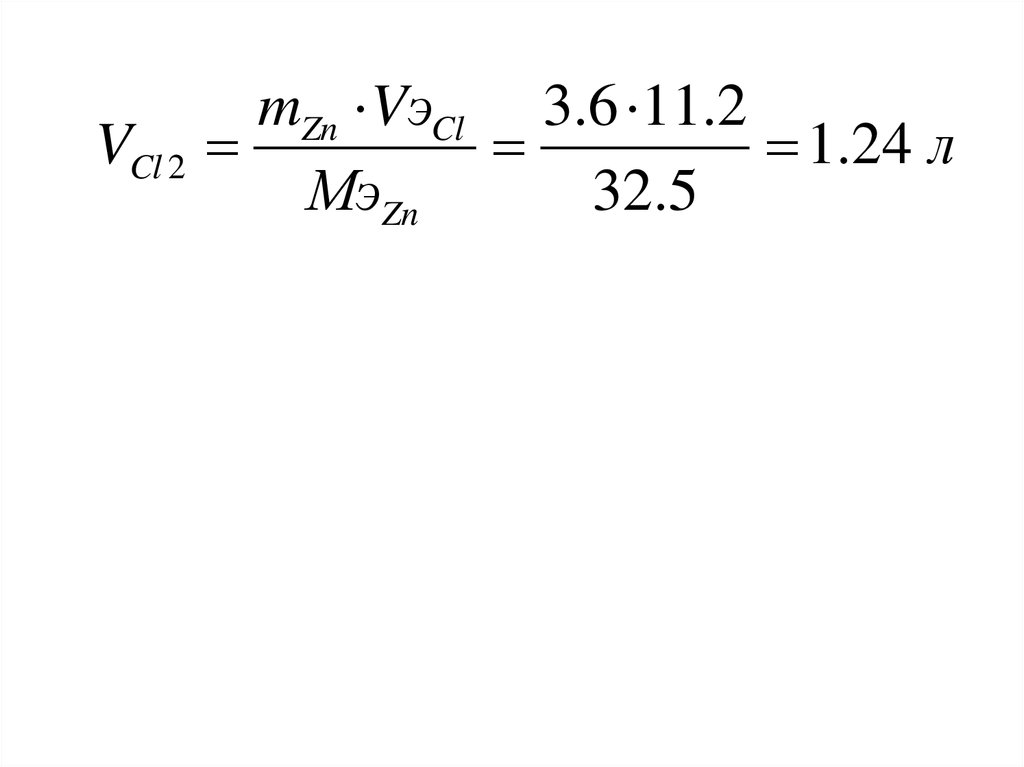
 chemistry
chemistry








