Similar presentations:
Диены. Сопряженные диены
1.
ДиеныСопряженные диены
H2C CH HC CH2
H2C C HC CH2
1,3-Бутадиен
CH3
(Дивинил)
2-Метил-1,3-бутадиен
(Изопрен)
Изолированные диены
H2C CH CH2 HC CH2
1,4-Пентадиен
Куммулированные диены (аллены)
H2C C CH2
Пропадиен
(Аллен)
1
2.
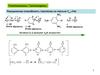
Способы полученияДегидрирование
CH3 CH2 CH2 CH3
CH2 CH CH2 CH3
Cr2O3
500-650
OC
Cr2O3
CH3 CH CH CH3 500-650
OC
CH2 CH CH CH2
Процесс С.В.Лебедева
2 CH3 CH2 OH
ZnO + Al2O3 , 500-650 OC
CH2 CH CH CH2 + 2 H2O + H2
Способ В.Реппе
H2C O, Cu2C2, P
HC C H Cu2C2, P HC C
HO CH2 C C CH2 OH
1,4-Бутиндиол
CH2 OH
H2C O
Прпаргиловый
спирт
HO CH2 C C CH2 OH
1,4-Бутиндиол
H2, Ni
HO CH2 CH2 CH2 CH2 OH
1,4-Бутандиол
H2C CH HC CH2
1,3-Бутадиен
H3PO4/SiO2
2
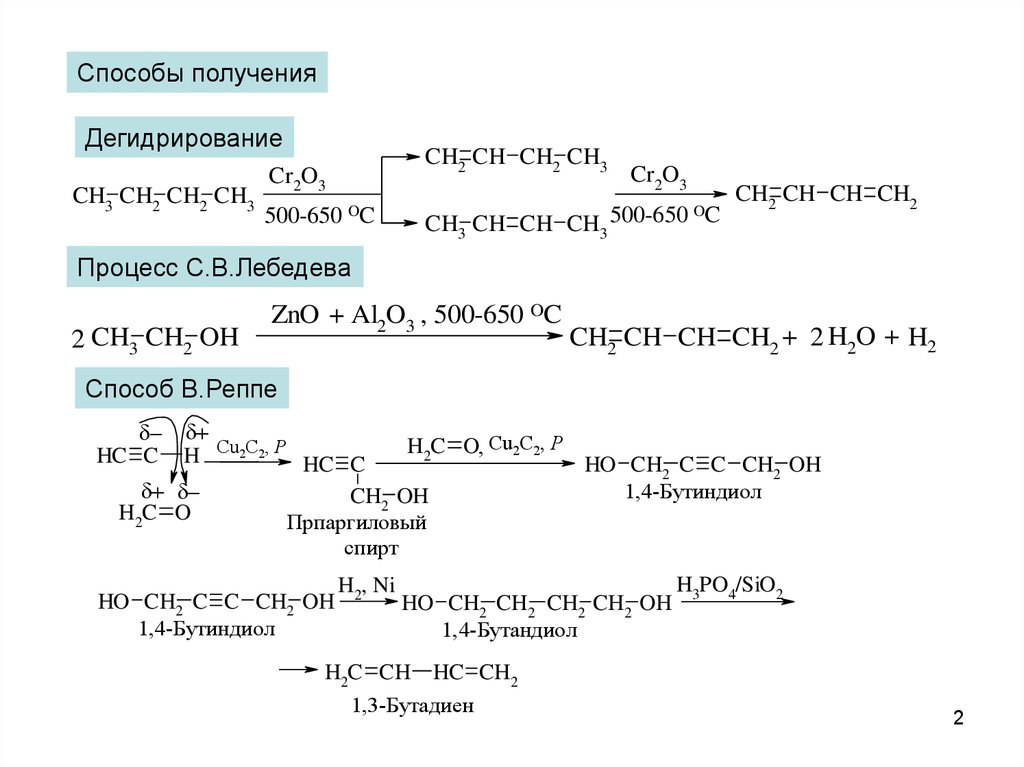
3.
Реакция Г.ПринсаCH3
CH3
H3C
C
H2C
CH2 + 2 H2C=O
C
H2SO4
CH3
C
O
CH2
CH2
CH2 H3PO4 / SiO2
O
CH CH2 + H2C=O + H2O 4,4-диметил-1,3-диоксан
CH3
3
4.
Строение молекулы сопряженных диеновТеплоты гидрирования алкенов и диенов
Соединение
Теплоты гидрирования,
CH3–CH=CH2 (Пропен)
126
CH3–CH2–CH2–CH=CH2 (1-Пентен)
127
CH2=CH–CH2–CH=CH2 (1,4-Пентадиен)
254
CH2=CH–CH=CH2 (1,3-Бутадиен)
239
H2C CH HC CH2+ 2H2
254 кДж/моль
(вычислено)
H3C CH2 CH2 CH3
кДж/моль
15 кДж/моль
энергия сопряжения
239 кДж/моль
(эксперимент)
Рис. Влияние сопряжения
на теплоту гидрирования
4
5.
Гибридизация атомов углерода и длиныпростых углерод-углеродных связей
Соединение
Связь С–С
Гибридизация
Длина связи, нм
CH3–C2H2–C3H2–CH3
C2–C3
sp3– sp3
15,4 10-2
CH2=C2H–C3H–CH3
C2–C3
sp2– sp3
15,2 10-2
CH2=C2H–C3H=CH2
C2–C3
sp2– sp2
14,8 10-2
C
C
C
C
Взаимодействие -электронных
облаков в сопряженном диене
5
6.
Порядок связи3,5
3
3
2,5
2
2
1,5
4
H
1
1
H
H
H
H
RT
0,5
1
1,2
1,4
1,6
2
Длина связи 10 , нм
x
Рис. Зависимость порядка связи
углерод-углерод от ее длины:
1 - простая связь С-С в этане;
2 - двойная связь С=С в этилене;
3 - тройная связь С≡ С в ацетилене;
4 - связь С2–С3 (кратность 1,2) в
1,3-бутадиене
H
H
H
H
s-цис-1,3-бутадиен
1%
H
H
H
s-транс-1,3-бутадиен
99%
6
7.
Химические свойстваЭлектрофильное присоединение
Галогенирование и гидрогалогенирование
1,2-присоединение
Br2
H2C CH HC CH2 + H2C HC CH CH2
Br Br
Br
Br
3,4-Дибром-1-бутен
H2C CH HC CH2
HCl
1,4-присоединение
1,4-Дибром-2-бутен
H2C CH HC CH2 + H2C HC CH CH2
H Cl
H
Cl
3-Хлор-1-бутен
H3C HC CH HC CH CH3 + HCl
1-Хлор-2-бутен
H3C CH CH HC CH CH3
H Cl
4-Хлор-2-гексен
H3C CH HC CH CH CH3
H
Cl
2-Хлор-3-гексен
7
8.
Механизм реакции AdE+
H3C HC CH HC CH CH3 + H
+
C C C
H
+
H3C CH CH HC CH CH3
I
+
H3C C HC HC CH CH3
H H
II
Аллильный карбокатион
Ряд устойчивости карбокатионов
+
CH3
<
+
+
R-CH2 < R CH
R
<
R
R C+
R
<
+
C C C
8
9.
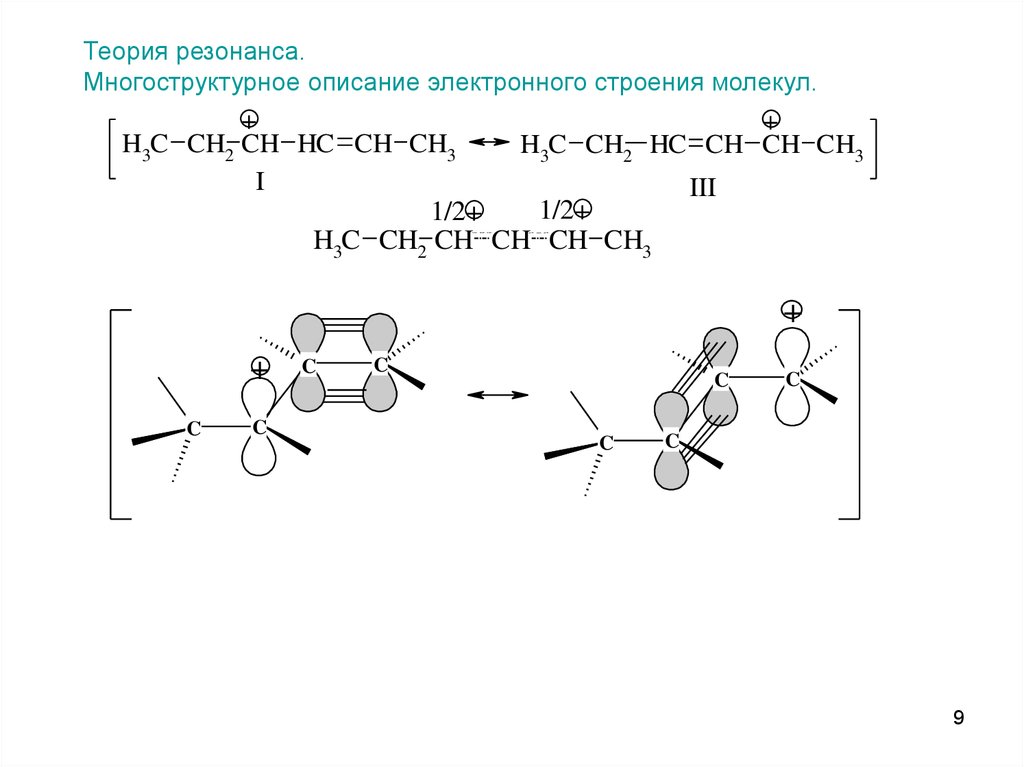
Теория резонанса.Многоструктурное описание электронного строения молекул.
+
+
H3C CH2 CH HC CH CH3
H3C CH2 HC CH CH CH3
I
III
1/2+
1/2+
H3C CH2 CH CH CH CH3
+
+
C
C
C
C
C
C
C
C
9
10.
Основное положение теории резонанса1. Если молекула может быть представлена двумя или более структурами,
в которых атомные ядра соединены одинаково, а различно только
распределение -электронов, то реальное распределение -элекронов
не может быть удовлетворительно представлено ни одной из них.
Реальная молекула представляет собой нечто промежуточное между
ними – резонансный гибрид этих структур.
Такие гипотетические структуры называют граничными (каноническими).
Граничные структуры соединяют знаком ↔.
2. Граничные структуры должны иметь одинаковое число неспаренных
электронов. Структура (I) не может быть граничной структурой для
аллильного катиона.
.
CH3 CH2 CH
+
CH
.
CH CH3
(I)
+
CH3 CH2 CH CH CH CH3
+
CH3 CH2 CH CH CH CH3
10
11.
3. Энергия реальной молекулы (резонансного гибрида) меньше, чемэнергия любой из граничных структур. Вклад отдельных канонических
структур в истинную структуру частицы неодинаков, наиболее
устойчивая структура дает наибольший вклад. Наибольшая
стабилизация достигается в тех случаях, когда структуры, вносящие
вклад в резонансный гибрид, энергетически эквивалентны.
Выигрыш энергии за счет суммирования вкладов всех граничных
структур называют энергией резонанса.
11
12.
Правила построения граничных структур.1) Резонансные (граничные или канонические) структуры реально не
существуют, но они позволяют нам описывать молекулы, ионы, и радикалы,
для которых единственная структура Льюиса не является адекватной. Мы
пишем две или больше структур Льюиса, называя их граничные структуры,
соединяем эти структуры стрелками ( ↔ ) и мы говорим, что реальная
молекула, ион, или радикал - гибрид всех этих структур.
2) В граничных структурах можно перемещать только электроны кратных
связей ( -электроны) и неподеленные пары электронов (n-электроны).
Порядок связывания атомов должен быть одинаковым во всех граничных
структурах (нельзя писать изомеры). Общее число электронов и суммарный
заряд в каждой резонансной структуре должны быть одинаковыми.
Все атомы, участвующие в резонансе, лежат в одной плоскости.
Например, структура 3 не может быть граничной структурой для аллильного
катиона, потому что при ее написании мы переместили атом водорода.
12
13.
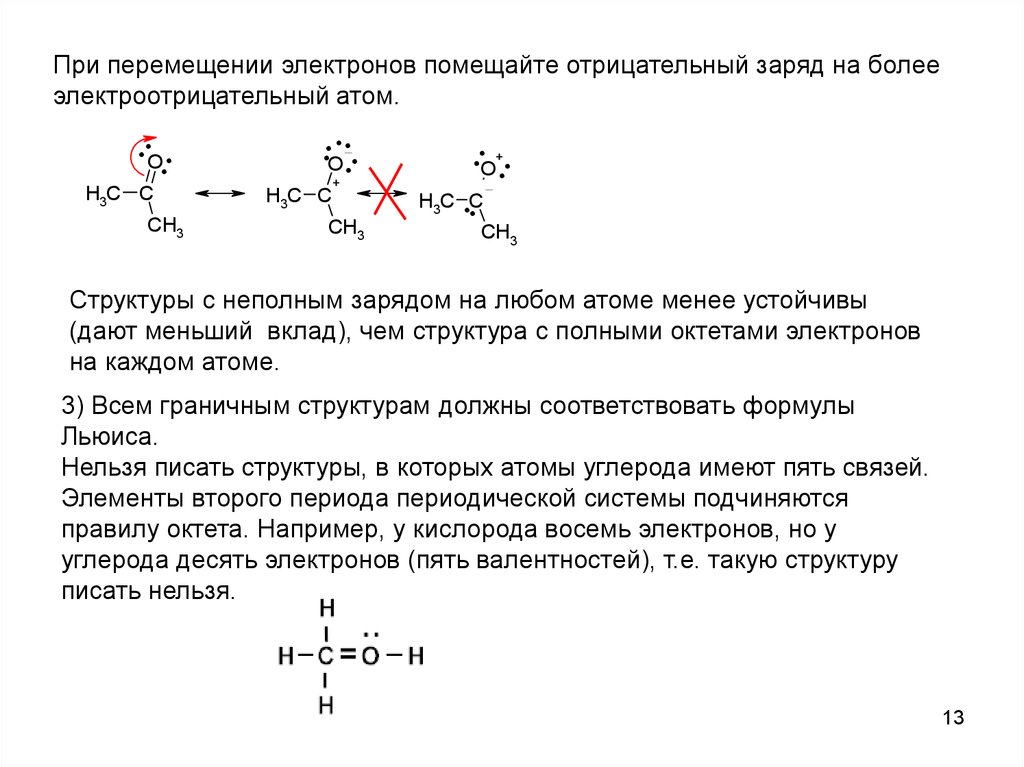
При перемещении электронов помещайте отрицательный заряд на болееэлектроотрицательный атом.
..O .
.
H3C C
CH3
.
..O ...
H3C C
+
CH3
..O+..
H3C ..C
CH3
Структуры с неполным зарядом на любом атоме менее устойчивы
(дают меньший вклад), чем структура с полными октетами электронов
на каждом атоме.
3) Всем граничным структурам должны соответствовать формулы
Льюиса.
Нельзя писать структуры, в которых атомы углерода имеют пять связей.
Элементы второго периода периодической системы подчиняются
правилу октета. Например, у кислорода восемь электронов, но у
углерода десять электронов (пять валентностей), т.е. такую структуру
писать нельзя.
13
14.
4) Энергия реальной молекулы ниже, чем энергия любой граничнойструктуры. Аллильный катион, например, более устойчив, чем граничные
структуры 4 или 5. Хотя структуры 4 и 5 напоминают первичные
карбокатионы, аллильный катион более устойчив, чем вторичный
карбокатион.
Это называется резонансная стабилизация
14
15.
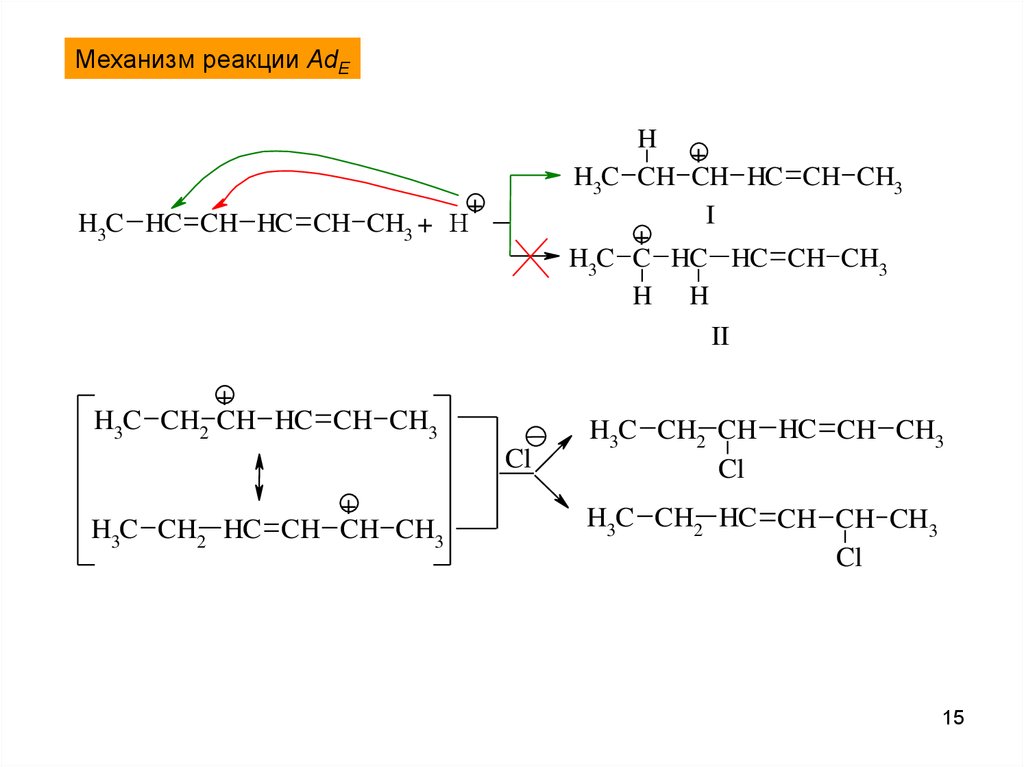
Механизм реакции AdEH
+
H3C CH CH HC CH CH3
I
+
H3C C HC HC CH CH3
H H
II
+
H3C HC CH HC CH CH3 + H
+
H3C CH2 CH HC CH CH3
Cl
+
H3C CH2 HC CH CH CH3
H3C CH2 CH HC CH CH3
Cl
H3C CH2 HC CH CH CH3
Cl
15
16.
1,2- и 1,4-Присоединение. Кинетический контроль,термодинамический контроль.
-80 OC
H2C CH HC CH2 + HBr
40 OC
H3C HC CH CH2Br
или
-80 OC
Br
H3C HC CH CH2Br + H3C CH HC CH2
20 %
80 %
Br
H3C HC CH CH2Br + H3C CH HC CH2
80 %
20 %
нет изменений
H3C CH HC CH2
Br
H3C HC CH CH2Br
или
H3C CH HC CH2
Br
40
OC
Br
H3C HC CH CH2Br + H3C CH HC CH2
20 %
80 %
16
17.
при -80 °С образуется кинетически контролируемый продукт реакции+
1 2
3 4
1
2 3 4
H2C CH CH CH2
H2C HC CH CH2
H2C CH CH CH2
+
H Br
H Br
H Br
Еа
1,2-присоединение
Е,
кДж/моль
Еа(1,2)
ионизации
Еа
1,4-присоединение
H3C CH CH CH2
Еа(1,4)
ионизации
+
Br
H3C CH HC CH2
Br
+
H Br + H2C HC CH CH2
1,2-присоединение
H3C HC CH CH2
Br
1,4-присоединение
Рис. Кинетический и термодинамический контроль
в реакции присоединения НВr к 1,3-бутадиену
17
18.
при 40 °С образуется термодинамически контролируемыйпродукт реакции
40 OC
+
+
H2C CH HC CH2
H2C CH CH CH2
H2C HC CH CH2
H
H Br
H
Br
H2C HC CH CH2
H
Br
Термодинамически контролируемый продукт – это более устойчивый
продукт, который накапливается не в результате более быстрого
образования, а в результате равновесия.
Перициклические реакции.
1. Электроциклические реакции
2. Реакции циклоприсоединения
Перициклические реакции – это реакции ненасыщенных
молекул, протекающие через циклическое переходное
состояние
Особенности перициклических реакций:
1. инициируются нагреванием или излучением (мало чувствительны
к катализаторам, типу растворителя);
2. протекают без образования ионов и радикалов;
3. стереоспецифические процессы.
18
19.
Образование -связи. Симметрия орбиталей.НСМО(разрыхляющая)
антисимметричная
+
-
-
+
ВЗМО(связывающая)
симметричная
+
+
-
-
.
C
.
C=C
C
Электроциклические реакции.
Это процессы, в ходе которых образуется
s-связь между концевыми атомами сопряженной -системы.
1,3-бутадиен
циклобутен
циклобутен
1,3-бутадиен
19
20.
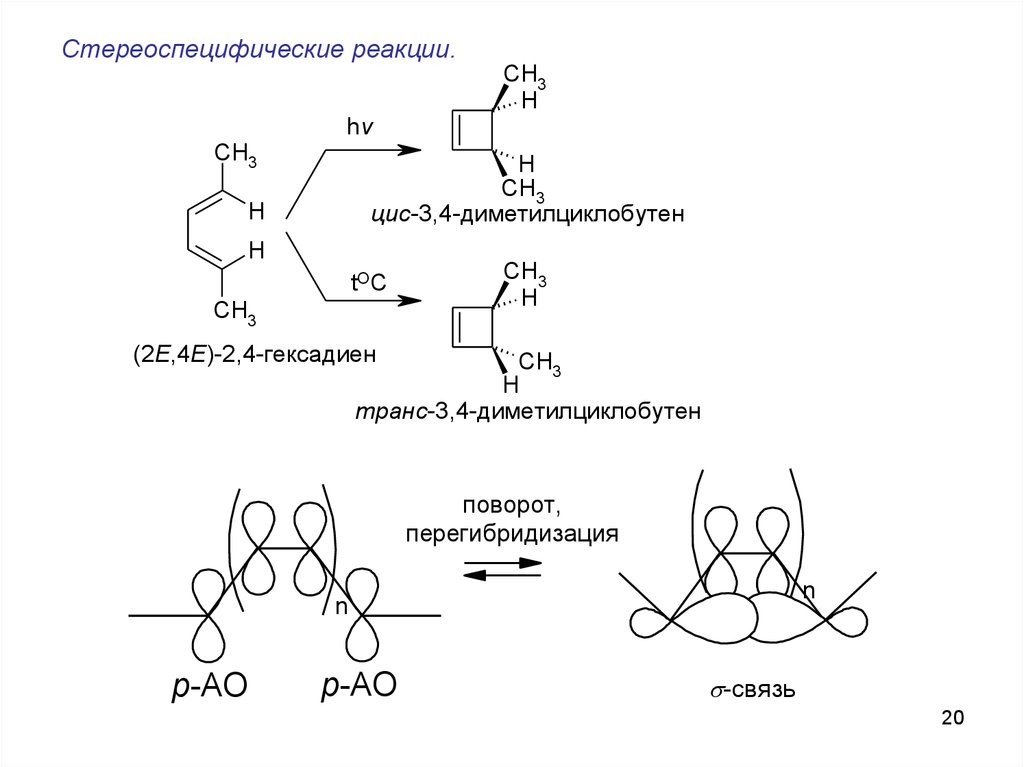
Стереоспецифические реакции.CH3
H
hv
CH3
H
CH3
цис-3,4-диметилциклобутен
H
H
tOC
CH3
CH3
H
(2Е,4Е)-2,4-гексадиен
CH3
H
транс-3,4-диметилциклобутен
поворот,
перегибридизация
n
n
р-АО
р-АО
s-связь
20
21.
Р.Вудворд, Р.Хофман (1965 г.)Орбитальный контроль.
При облучении протекание
реакции определяется
симметрией ВЗМО* диена,
находящегося в
возбужденном состоянии.
При нагревании протекание
реакции определяется
симметрией ВЗМО диена,
находящегося в
основном состоянии.
Принцип сохранения орбитальной симметрии:
реакция протекает легко, когда существует соответствие между симметрией
орбиталей реагентов и продуктов.
+
+
р-АО
р-АО
дисротаторный
процесс
s-связь
-
+
+
р-АО
р-АО
конротаторный
процесс
21
22.
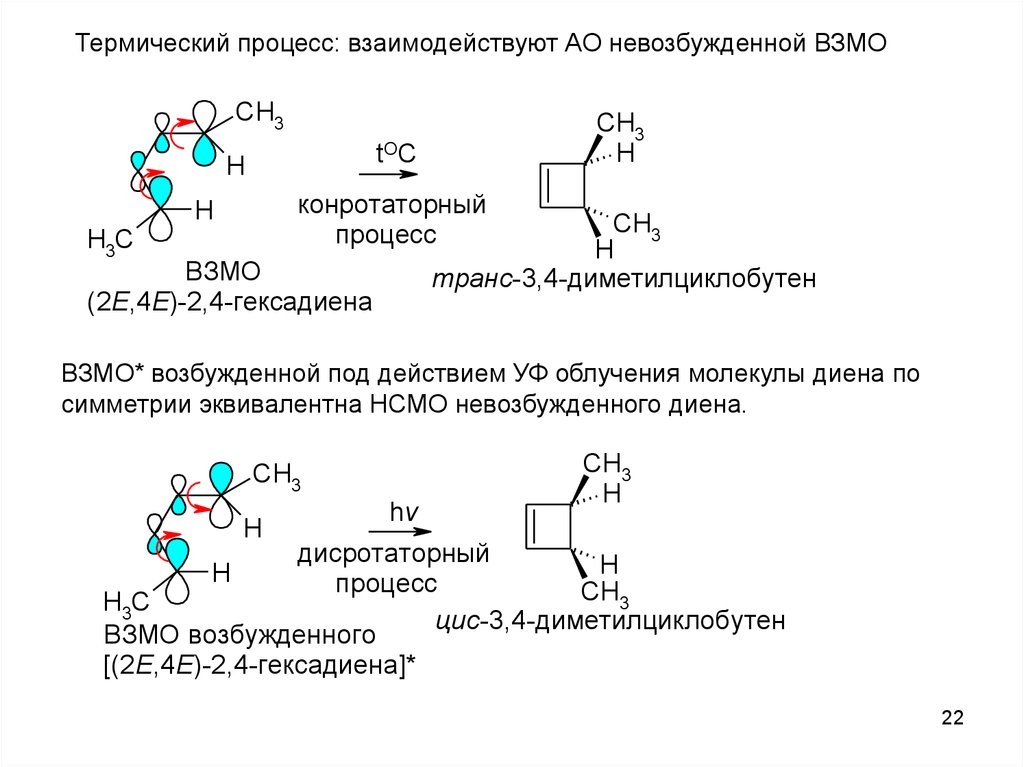
Термический процесс: взаимодействуют АО невозбужденной ВЗМОCH3
CH3
H
tOC
H
конротаторный
процесс
H
H3C
CH3
H
транс-3,4-диметилциклобутен
ВЗМО
(2Е,4Е)-2,4-гексадиена
ВЗМО* возбужденной под действием УФ облучения молекулы диена по
симметрии эквивалентна НСМО невозбужденного диена.
CH3
H
hv
CH3
H
дисротаторный
H
H
процесс
CH3
H3C
цис-3,4-диметилциклобутен
ВЗМО возбужденного
[(2Е,4Е)-2,4-гексадиена]*
22
23.
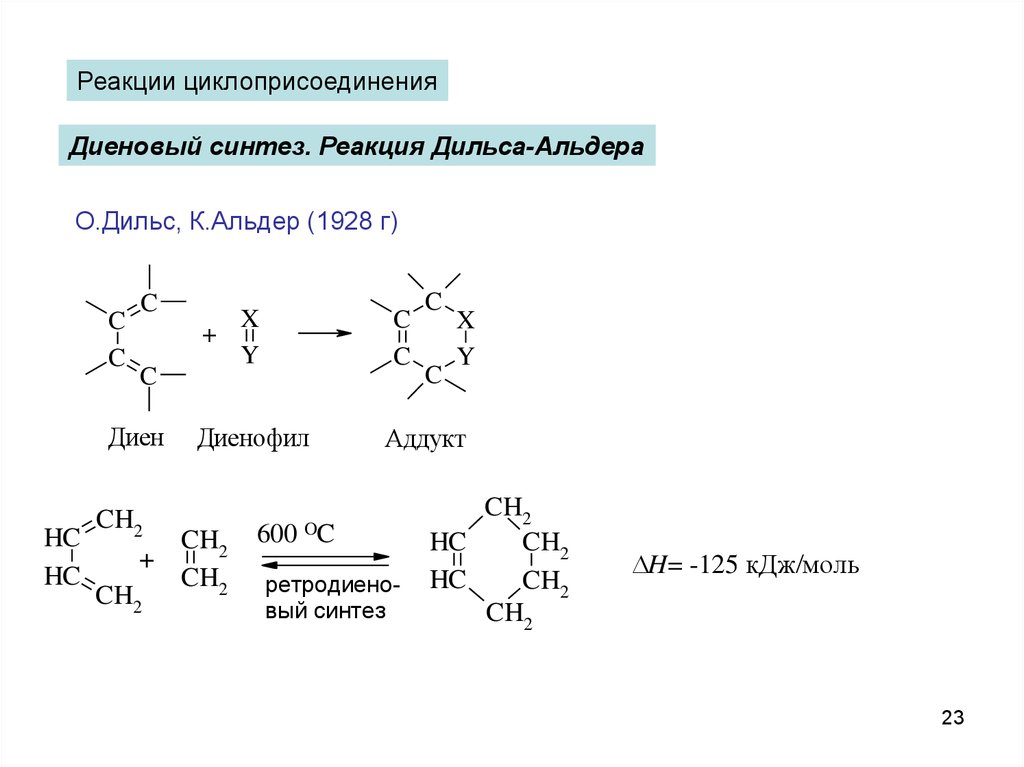
Реакции циклоприсоединенияДиеновый синтез. Реакция Дильса-Альдера
О.Дильс, К.Альдер (1928 г)
C
C
C
C
Диен
X
+
Y
C
C
Диенофил
CH2
HC
CH2
+
HC
CH2
CH2
600
C
C
X
Y
Аддукт
OC
ретродиеновый синтез
CH2
HC
CH2
HC
CH2
CH2
H= -125 кДж/моль
23
24.
H2C0,28 нм
H
H2C
C
C
HC
HC
CH2
H
CH2
S-транс-конформация
не вступает в реакцию
CH. s '
.
.
.
...CH
HC.
.
' .
.
HC .. ...CH
2
CH2
CH2
C
C
H2C
H
S-цис-конформация
вступает в реакцию
CH2
H 0,38 нм
CH2s '
2
HC
2
HC
CH2
CH2
CH2
CH2
Активированный
комплекс
Переходное состояние с круговой делокализацией электронов
называется перициклом.
24
25.
OCH2
HC
HC C
+
O
HC
HC C
CH2
O
Бензол, 20 ОС
Малеиновый
ангидрид
Реакционная способность
диенофилов
C2H5
3,5-Октадиен
1,2,3,6-Тетрагидрофталевый ангидрид
O
H2C CH2
<
H2C CH C
C2H5
COOC 2H5
эфир, 25
+
C 2H5
O
C
O
C
O
COOC 2H5
Диэтиловый эфир
2-бутиндиовой кислоты
H
<
O
HC C
O
HC C
O
COOC2H5
ОС
COOC2H5
C2H5
Диэтиловый эфир 3,6-диэтил1,4-циклогексадиен-1,2дикарбоновой кислоты
25
26.
Диен – донор, диенофил – акцептор.Орбитальный контроль.
t OC
+
ВЗМО
НСМО
конротаторный процесс
Конфигурация диена и диенофила сохраняется при образовании аддукта
H
H
COOCH3
H
COOCH3
H
COOCH3
200 OC
H
COOCH3
H
H
COOCH3
+
+
H3COOC
150
OC
H
COOCH3
Синтетические возможности реакции
Дильса-Альдера представлены
В учебнике О.А.Реутова т.1, стр. 538.
COOCH3
26
27.
ПолимеризацияC6H5
C6H5
CO O O CO C6H5
CO O
R CH2 HC CH
+ H2C
H2C
2 C6H5
HC CH CH2
+
H2C HC CH CH2
CO O
C6H5
CO O
CH2 HC CH
R CH2 HC CH
H2C CH2 HC CH
H2C HC CH CH2
R CH2 HC CH
H2C
H2C
n H2C HC CH CH2
H2C CH2 HC CH H2C CH2 HC
CH CH2
R CH2 HC CH H2C
CH2 HC CH H2C CH2 CH CH2 HC CH CH CH HC CH
2
CH2
...
CH HC CH
CH2
...
CH2 HC CH
CH2
...
CH CH2
27
28.
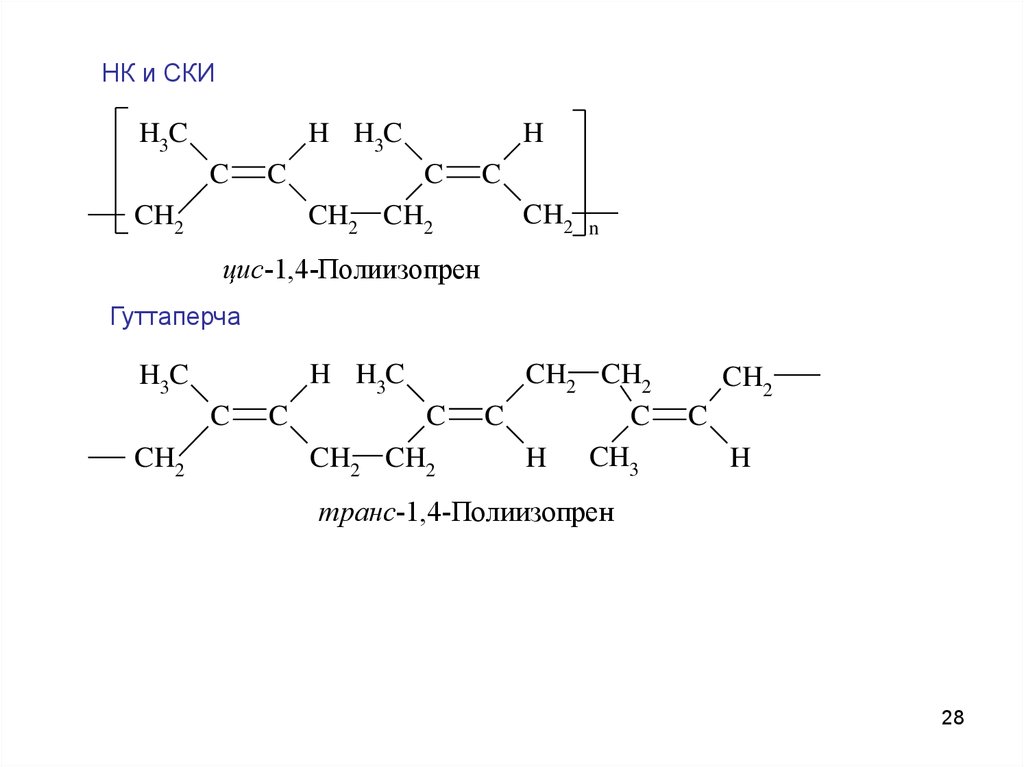
НК и СКИH
H H3C
H3C
C
C
C
CH2
CH2 CH2
C
CH2
n
цис-1,4-Полиизопрен
Гуттаперча
H H3C
H3C
C
CH2
C
C
CH2 CH2
CH2 CH2
C
C
H CH3
CH2
C
H
транс-1,4-Полиизопрен
28
29.
Вулканизация (Гудьир, 1839 г.)CH3
HC
C
CH3
CH CH2
CH CH2 CH C
(S)n
(S)n
CH C
CH CH2 CH2 C
CH3
CH CH
CH3
Хлоропреновый каучук
H
Cl
C
CH2
Cl
C
C
CH2 CH2
CH2 CH2
C
C
H Cl
CH2
C
H
Бутадиен-стирольный каучук
CH2 HC CH CH2
CH2 HC CH CH2
CH2 CH
29
30.
Радикальное присоединение. Механизм AR.Br2
hv
2 Br
+
CH CH2
Br CH2 CH
Br
HC H2C
Br CH2 CH
радикал аллильного типа
1,4
1,2
Br
Br
Br
Br
30
31.
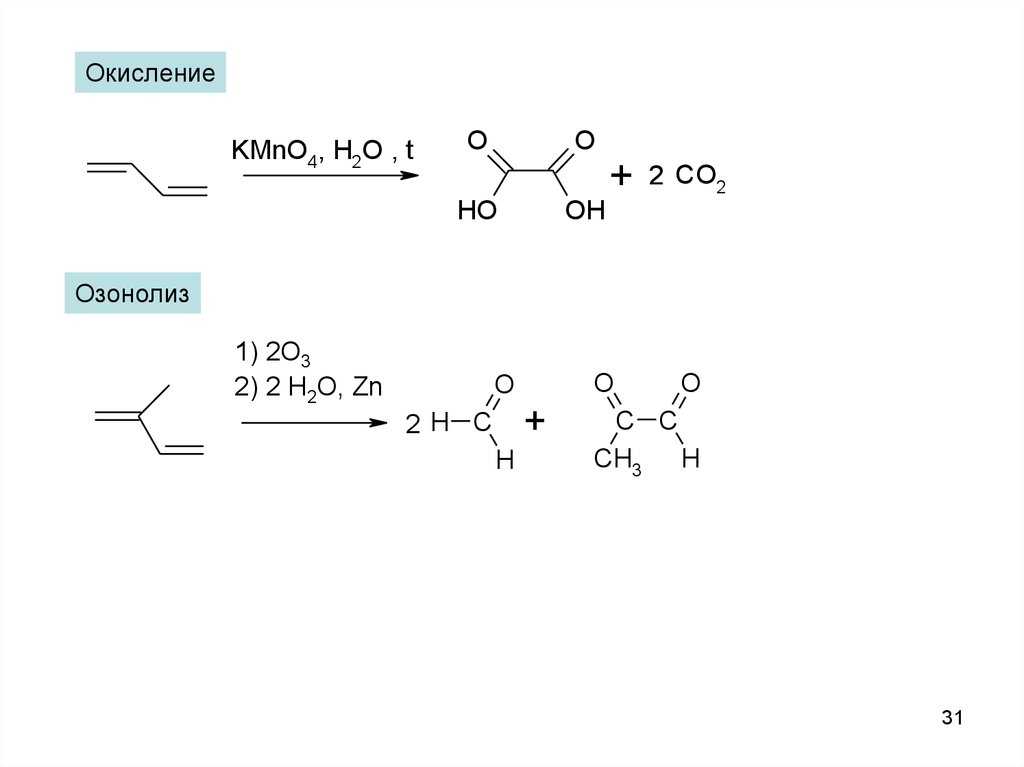
ОкислениеKMnO4, H2O , t
O
O
+
HO
2 CO2
OH
Озонолиз
1) 2O3
2) 2 H2O, Zn
O
O
+
2H C
H
O
C C
CH3 H
31
32.
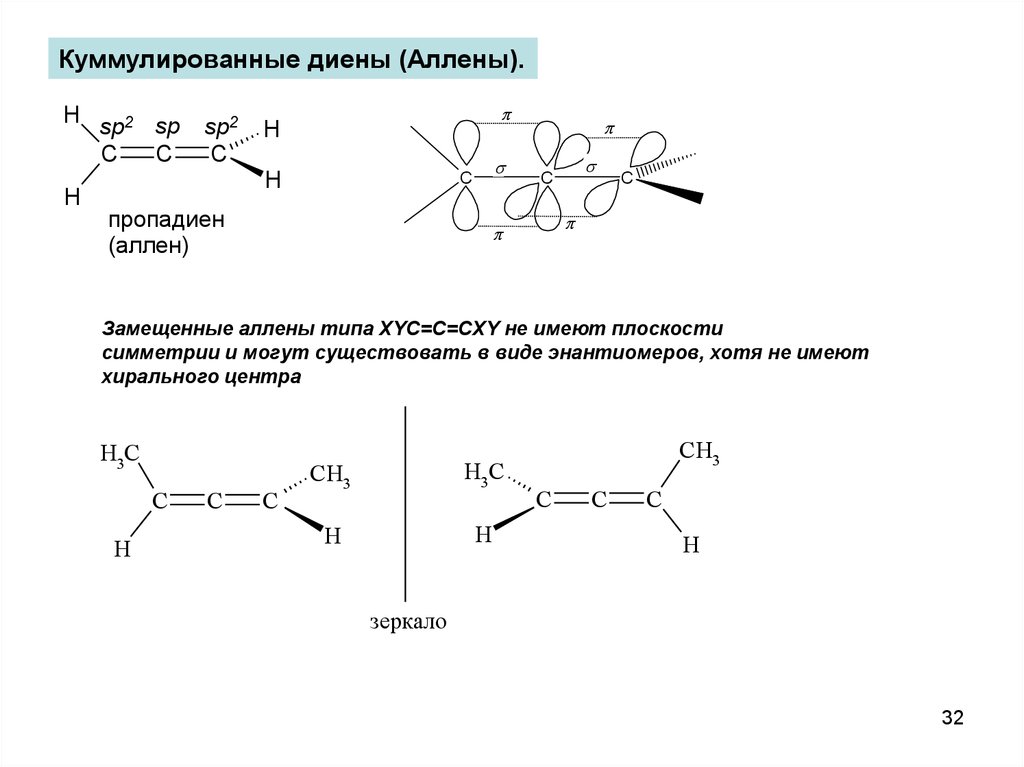
Куммулированные диены (Аллены).H sp2 sp
C
C
H
sp2
C
H
H
s
C
пропадиен
(аллен)
s
C
C
Замещенные аллены типа XYC=C=CXY не имеют плоскости
симметрии и могут существовать в виде энантиомеров, хотя не имеют
хирального центра
H3C
C
H
C
C
CH3
H3C
H
H
CH3
C
C
C
H
зеркало
32
33.
Получение алленовДегалогенирование
H2C C CH2 Cl
Cl
Zn, 80 OC
CH3COOC4H9
H2C C CH2
Дегидрогалогенирование
H
(98%)
Соотношение син :анти-элиминирования = 1:1500
Br
C C
H3C CH2 CH2
CH CH2 CH3
H
цис-4-бром-4-октен
H
CH3ONa; 80 OC
H3C CH2 CH C CH CH2 CH2 CH3
CH3OH - ДМСО (1:4)
(85%)
3,4-октадиен
CH2 CH2 CH3
C C
Br
H3C CH2 CH2
транс-4-бром-4-октен
CH3ONa; 80 OC
CH3OH - ДМСО (1:4)
H3C CH2 CH2 C C CH2 CH2 CH3
4-октин
(78%)
33
34.
Химические свойстваГидрирование
R HC C CH2 + 2H2
Pt
C2H5OH
R H2C CH2 CH3
Окисление
R' HC C CH R"
R' HC C CH R"
KMnO4
R'
H 2O
R'
C O
1) O3; CH2Cl2; - 78 OC
2) (C6H5)3P
+
R"
C O
R"
O
R'
C
H
+ R"
+
CO2
O
C
H
+
CO2
34
35.
Электрофильное присоединениеAdE присоединение к незамещенному аллену
Региоспецифичный процесс
H2C C CH2 + HX
H3C CX2 CH3
H3C C CH2
X=Cl, Br, I
X
+
H3C C CH2
H2C C CH2
+H
вакантная орбиталь
+
+
H2C HC CH2
C
+
C C
менее устойчив
35
36.
AdE присоединение к замещенному алленуC6H5 HC C CH2
H3C
C C CH2
+
+
HCl
C6H5 HC CH CH2Cl
CH3COOH
HBr
H3C
CH3COOH
CH3
C CH
CH2Br
CH3
Механизм
H3C
C C CH2
+
H
+
H3C
H3C
C HC CH2
CH3
третичный
аллилбромид
+
HC CH2
Br
CH3
CH3
Br
C
+
ионизация
H3C
C
....CH ....CH ~ Br
CH3 Br
аллильный
карбокатион
2
H3C
C CH CH2 Br
CH3
первичный
аллилбромид
(более стабилен)
36
37.
Присоединение Cl2 и Br2 к незамещенному аллену AdEKBr
H2C C CH2 + X2
X=Cl, Br
CH3COOH
Br2, KBrO3
X H2C C CH2
X
CH3COOH
H2XC CX2 CH2X
37


























 chemistry
chemistry