Similar presentations:
Буферные системы
1.
Буферные системы2.
называются растворы, сохраняющиезначение рН при добавлении небольших количеств
кислоты или щёлочи, а также при разбавлении.
В состав буферных смесей входят сильный и слабый
электролиты, содержащие одноимённые ионы.
Различают кислые и основные буферные смеси, например:
Ацетатная буферная смесь: СН3СООН + СН3СОО Na
Аммиачная буферная смесь: NH4OH + NH4 Cl
Ацетатная
буферная
смесь
+
Н+ → CН3COO- + Н+ = СН3СООН
ОН- → CН3COOН + ОН- = СН3СОО- + Н2О
При разбавлении ацетатного буферного раствора
уменьшение концентрации ионов Н+ компенсируется
увеличением диссоциации уксусной кислоты
3.
называют количествомолей кислоты или основания, добавление которого к 1л
изменяет его рН на единицу. Различают буферную
ёмкость по кислоте и по основанию.
В аналитической практике буферные системы используют для
поддержания постоянного значения рН при проведении
анализа.
4.
Комплексныесоединения
5.
- процессобразования более сложных соединений из
простых или сложных молекул.
CoCl3 + 6NH3 → CoCl3·6NH3
CuSO4 + 5H2O → CuSO4·5H2O
1893 г. Альфред Вернер
опубликовал основополагающую
работу «О строении неорганических
соединений», в которой предложил
6.
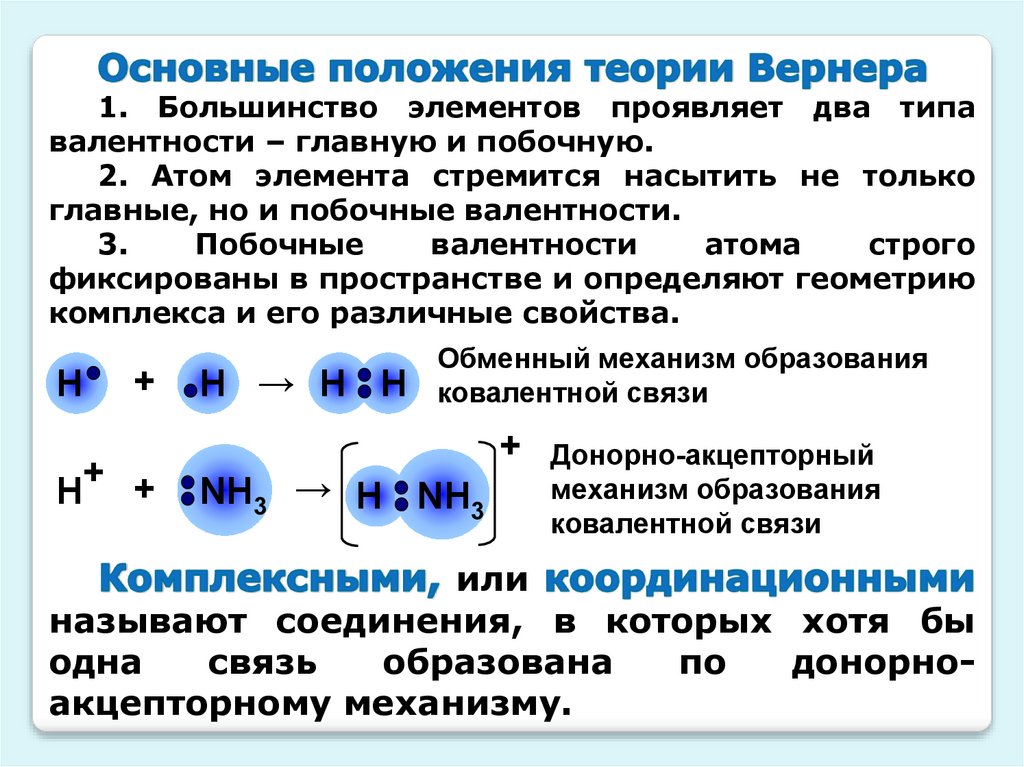
1. Большинство элементов проявляет два типавалентности – главную и побочную.
2. Атом элемента стремится насытить не только
главные, но и побочные валентности.
3.
Побочные
валентности
атома
строго
фиксированы в пространстве и определяют геометрию
комплекса и его различные свойства.
Н
+
Н+ +
Н → Н Н
Обменный механизм образования
ковалентной связи
NН3 → Н NН3
+
Донорно-акцепторный
механизм образования
ковалентной связи
или
называют соединения, в которых хотя бы
одна
связь
образована
по
донорноакцепторному механизму.
7.
CoCl3·6NH3 = [ Co (NH3)6 ] Cl31. Центральный атом или ион в комплексном
соединении называется КОМПЛЕКСООБРАЗОВАТЕЛЕМ.
Противоположнозаряженные или нейтральные
молекулы, связанные с комплексообразователем
называются ЛИГАНДАМИ.
2. Число связей комплексообразователя с
лигандами называют КООРДИНАЦИОННЫМ ЧИСЛОМ.
Валентность лиганда называют ДЕНТАТНОСТЬЮ.
3. Комплексообразователь и лиганды образуют
ВНУТРЕННЮЮ (координационную) сферу комплекса.
Остальные молекулы и ионы образуют ВНЕШНЮЮ
сферу и отщепляются при диссоциации.
CuSO4·5H2O = [ Cu (H2O)4] SO4·H2O
8.
F¯ фтороCl¯ хлороBr¯ бромоI¯ йодо-CN¯ цианоSCN¯ тиоцианатоNO2¯ нитроOH¯ гидроксо-
H2O акваNH3 амминоCO карбонил
NO нитрозил
I2 дийод
N2 диазот
SO42- сульфатоC2O42- оксалатоS2- сульфоS2O32- тиосульфато:NH2-CH2-CH2-H2N: этилендиамин,
аминополикарбоновые кислоты и их соли,
диметилглиоксим и т.д.
В химическом анализе используют реактивы,
способные образовывать с катионами металлов
характерно окрашенные или труднорастворимые
комплексы
9.
1. НАЗВАНИЕ КОМПЛЕКСНЫХ АНИОНОВ:Простые анионы: Cl- - хлорид, SO42- - сульфат и т.д.
Комплексные анионы: греческое числительное,
лиганд, комплексообразователь (лат. название
элемента) в именительном падеже с указанием
степени окисления
Al алюминат
Bi висмутат
Fe феррат
Pb плюмбат
As арсенат
Co кобальтат
Hg меркурат
Pt платинат
Ag аргентат
Cr хромат
Mo молибдат
Sb антимонат
Au аурат
Cu купрат
Ni никелат
Zn цинкат
2. НАЗВАНИЕ КОМПЛЕКСНЫХ КАТИОНОВ:
Простые ионы: Na+ - натрия, Са2+ - кальция и т.д.
Комплексные катионы: греческое числительное,
лиганд, комплексообразователь (рус. название
элемента) в родительном падеже с указанием
степени окисления
10.
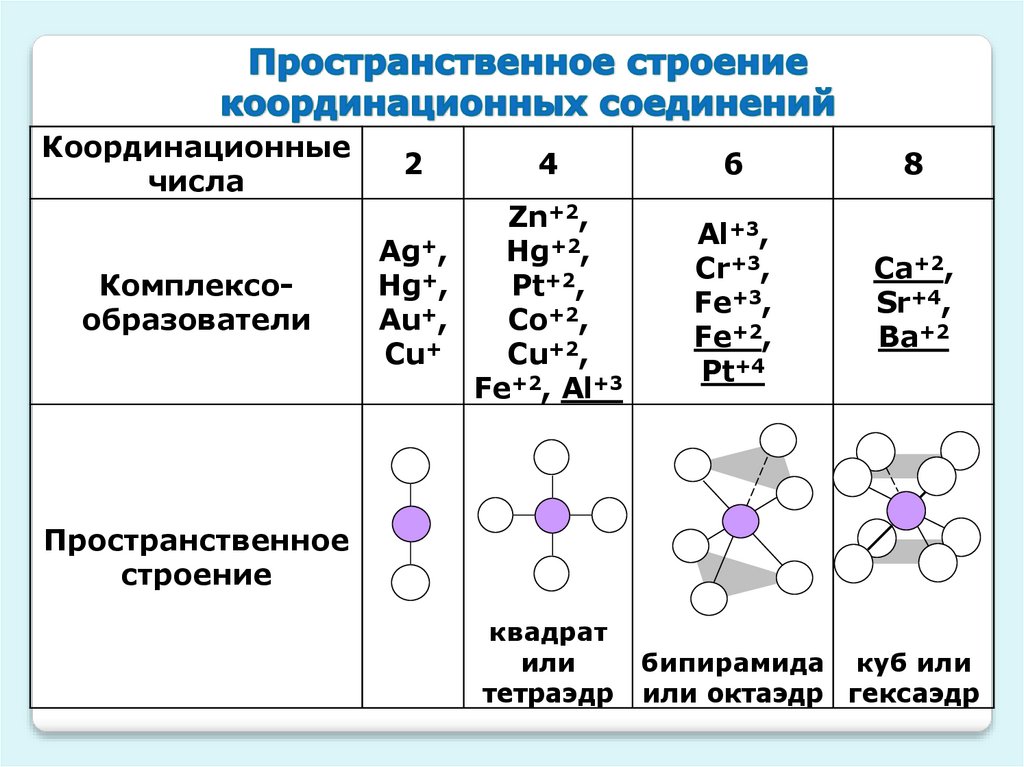
Координационныечисла
Комплексообразователи
2
4
Zn+2,
Ag+,
Hg+2,
Hg+,
Pt+2,
Au+,
Co+2,
Cu+
Cu+2,
Fe+2, Al+3
6
8
Al+3,
Cr+3,
Fe+3,
Fe+2,
Pt+4
Ca+2,
Sr+4,
Ba+2
Пространственное
строение
квадрат
или
тетраэдр
бипирамида куб или
или октаэдр гексаэдр
11.
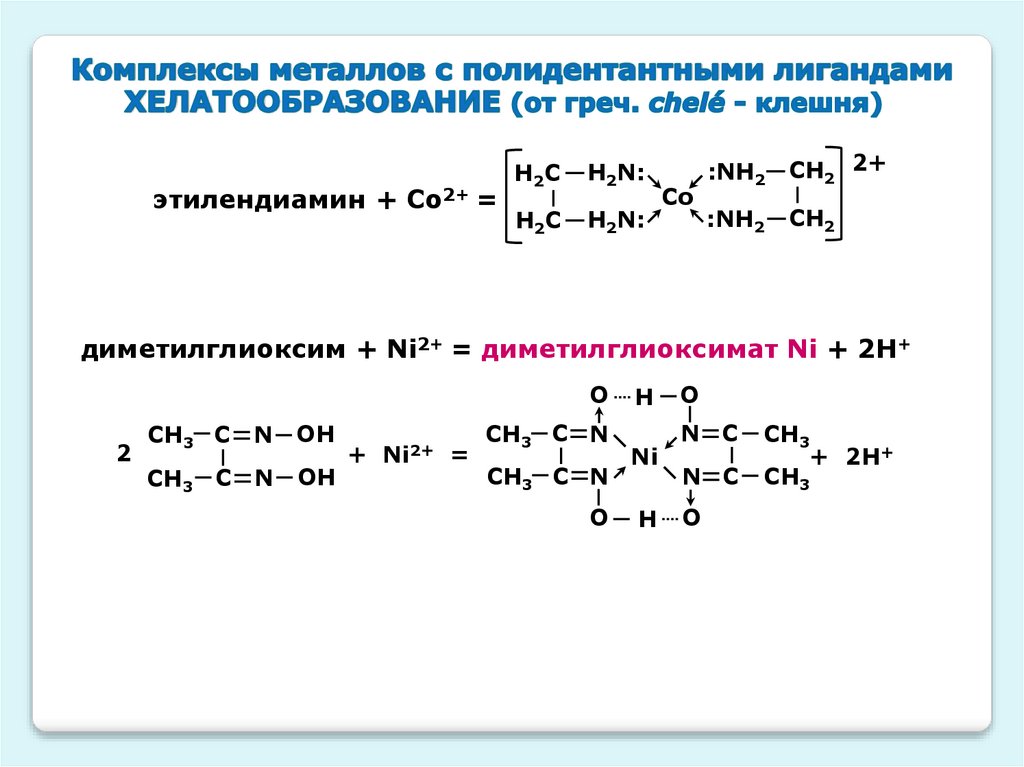
этилендиамин + Со2+ =H2C
H2N:
H2C
H2N:
Co
:NH2
CH2 2+
:NH2
CH2
диметилглиоксим + Ni2+ = диметилглиоксимат Ni + 2H+
O
2
CH3 C N
OH
CH3 C N
OH
+
Ni2+
=
CH3 C N
CH3 C N
O
H
Ni
H
O
N C
N C
O
CH3
+ 2H+
CH3
12.
Ag+ + 2NH3 = [Ag(NH3)2]+Ag+ + 2CN- = [Ag(CN)2]-
На устойчивость комплексных соединений
влияют:
• состав раствора,
• значение рН,
• температура.









 chemistry
chemistry








