Similar presentations:
Комплексные соединения
1. Комплексные соединения
Na3[Co(NO2)6] 2+[Cu(NH3)4]
Содержание
• Проблемный подход к изучению комплексных соединений
• Исторические предпосылки возникновения
координационной теории
• Координационная теория А.Вернера
• Основы номенклатуры комплексных соединений
• Строение комплексных соединений
• Растворы комплексных соединений
• Хелатные комплексы
• Альфред Вернер
K3[Fe(CN)6]
1
2. Проблема «дополнительных валентностей»
CuSO4.4NH3 – Андрей Либавий, 1597 г.AgCl.2NH3 – И. Глаубер, 1648 г.
CoCl3.6NH3 – Тассер, 1798 г.
1704 г. Дисбах – получил берлинскую
лазурь KCN.Fe(CN)2.Fe(CN)3
1749-1753 гг. Пьер Жозеф Макер
получил красную кровяную соль.
2
3. Двойная соль или комплексное соединение?
KCr(SO4)2∙ 12H2O – хромокалиевые квасцыKCr(SO4)2∙ 12H2O =
= K+ + Cr3+ + 2SO42- + 12H2O
Fe(CN)3.3KCN = 3K+ + Fe3+ + 6CNКрасная кровяная соль
не определяются в растворе
3
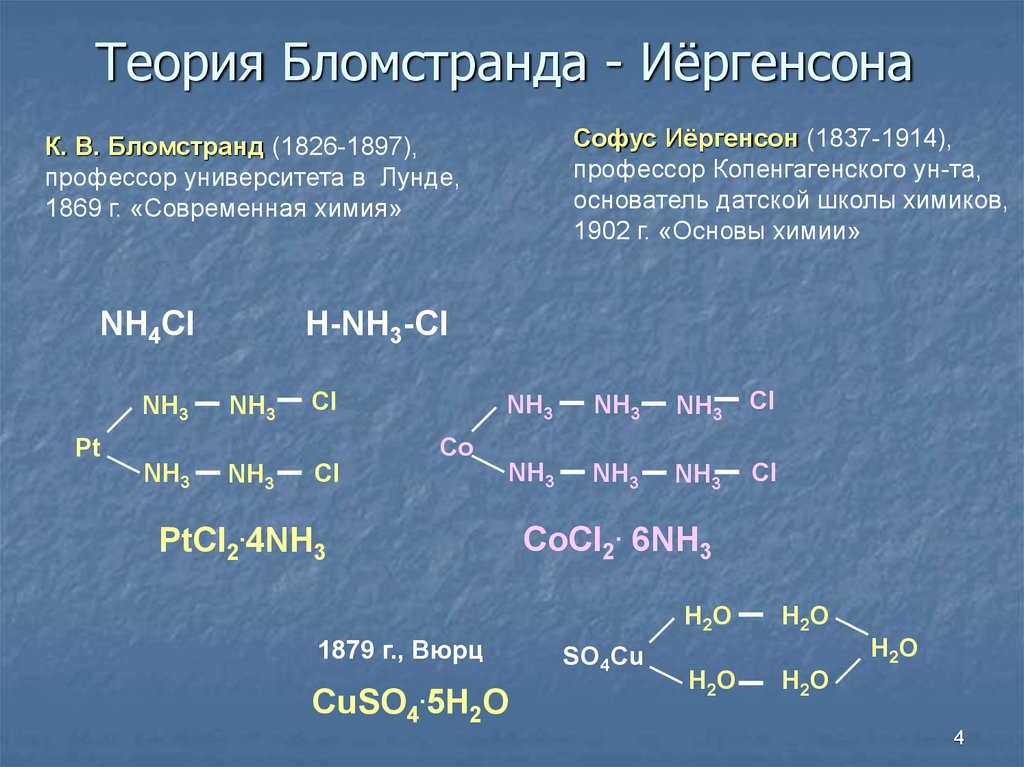
4. Теория Бломстранда - Иёргенсона
Софус Иёргенсон (1837-1914),профессор Копенгагенского ун-та,
основатель датской школы химиков,
1902 г. «Основы химии»
К. В. Бломстранд (1826-1897),
профессор университета в Лунде,
1869 г. «Современная химия»
NH4Cl
NH3
H-NH3-Cl
NH3
Cl
NH3
NH3
NH3
Cl
NH3
NH3
NH3
Cl
Co
Pt
NH3
NH3
Cl
PtCl2.4NH3
CoCl2. 6NH3
H2O
1879 г., Вюрц
CuSO4.5H2O
SO4Cu
H2O
H2O
H2O
H2O
4
5. Валентность постоянная или переменная?
«Соединительная сила»«Атомность»
Эдуард Франкланд, 1852 г.
«Валентность» Г. Вихельгауз, 1868 г.
Эдуард Франкланд
(1825-1899)
Valencia - сила
Фридрих
Август Кекуле
(1829 – 1896)
5
6.
Цепь аммиаков может быть, по-видимому,беспредельна, и, нам кажется, наиболее
существенный недостаток такого
представления и состоит именно в том, что
оно не указывает вовсе на число аммиаков,
могущих удерживаться платиной.
Притом допустить связь азота с азотом в
столь прочных телах едва ли возможно.
Д.И.Менделеев
6
7. Рождение координационной теории
Альфред Вернер«К вопросу о строении
неорганических
соединений». 1893 г.
1.
2.
3.
4.
Главная и побочная
валентности
Принцип координации
Внутренняя и внешняя
сферы
Пространственное
строение комплексных
ионов
1905 г.
«Новые воззрения в области
неорганической химии»
7
8. Главная и побочная валентности
PtCl4.2NH3Cl
Cl
NH3
Pt
Cl
NH3
[Pt(NH3)2Cl4]
Cl
Главная валентность соответствует обычной валентности элемента,
закономерности которой находят отражение в ПСХЭ
Побочная валентность – дополнительная, остаточная валентность,
которую атомы проявляют после насыщения главной
8
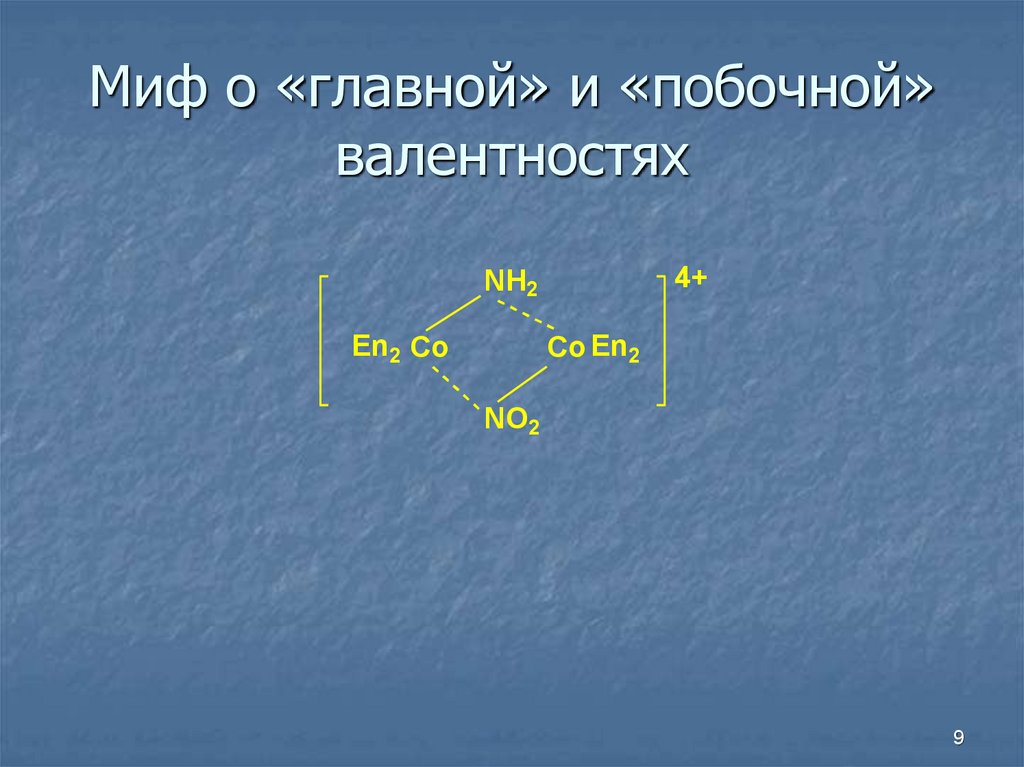
9. Миф о «главной» и «побочной» валентностях
4+NH2
En2 Co
Co En2
NO2
9
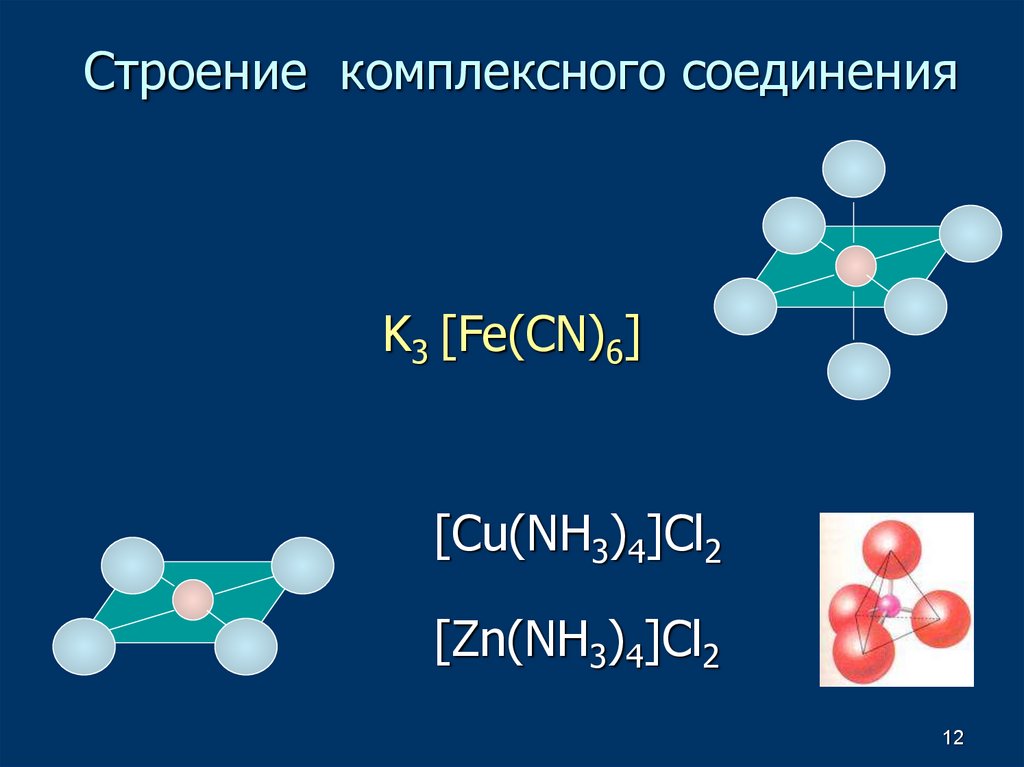
10. Строение комплексного соединения
Внешняясфера
Внутренняя сфера
K3 [Fe(CN)6]
ИонКомплексообразователь
Координационное
число
Лиганды
[Cu(NH3)4]Cl2
Внутренняя сфера Внешняя
сфера
10
11. Рождение стереохимии
1874 г.Якоб Вант-Гофф
(1852 — 1912)
«Предложение применять в пространстве современные
структурно-химические формулы вместе с примечанием
об отношении между оптической
вращательной способностью
и химической конструкцией органических соединений»
«Фантастическая чепуха,
Г. Кольбе
напрочь лишенная какого бы то ни было
фактического основания и
совершенно непонятная серьезному исследователю»
11
12. Строение комплексного соединения
K3 [Fe(CN)6][Cu(NH3)4]Cl2
[Zn(NH3)4]Cl2
12
13. Номенклатура комплексных соединений
+3K3 [Fe(CN)6]
Гексацианоферрат(III) калия
+2
[Cu(NH3)4]Cl2
Хлорид тетраамминмеди(II)
1 – моно
2 – ди
3 – три
4 – тетра
5 – пента
6 – гекса
H2O – аква
NH3 – аммин
Cl- – хлороNO2- - нитро
CN- - цианоSCN- - родано-
Порядок перечисления лиганд:
1. Анионные: H-, O2-, OH-, простые анионы, многоатомные анионы,
органические в алфавитном порядке
1. Нейтральные: NH3, H2O и т.д.
- -о
2. Катионные: N2H5+ и т.д.
+ -иум
13
14. Упражнение 1
Первое основание Рейзе [Pt(NH3)4](OH)2Соль Чугаева [PtCl(NH3)5]Cl3
Соль Цейзе K[PtCl3C2H4]
Пурпуреосоль [CoCl(NH3)5]Cl2
Кроцеосоль [Co(NO2)2(NH3)4]Cl
Соль Рейнеке NH4[Cr(SCN)4(NH3)2]
Соль Магнуса [Pt(NH3)4][PtCl4]
14
15. Упражнение 2
Гексанитрокобальтат(III) натрияNa3[Co(NO2)6]
Гидроксид диамминсеребра(I)
[Ag(NH3)2]OH
реактив Толленса
Тетраиодомеркурат(II) калия
K2[HgI4]
реактив Несслера
Тетрароданомеркурат(II) аммония
(NH4)2[Hg(SCN)4]
15
16.
1617. Вернер подтверждает Вернера
1893-4 гг. не были периодомутверждения теории.
Вернер 20 лет
не оставлял лаборатории
Для установления состава соединений
Вернер использовал:
1. Химический метод
2. Измерение электропроводности
Химический метод
При действии AgNO3
на 1 моль CrCl3. 6NH3 осаждается 3 моль Cl[Cr(NH3)6]Cl3
на 1 моль CrCl3. 5NH3 осаждается 2 моль Cl[Cr(NH3)5Cl]Cl2
на 1 моль CrCl3. 4NH3 осаждается 1 моль Cl[Cr(NH3)4Cl2]Cl
17
18. Ряды Вернера - Миолати
34
5
6
7
[Pt(NH3)4Cl2]Cl2
[Pt(NH3)3Cl3]Cl
[Pt(NH3)2Cl4]
K[Pt(NH3)Cl5]
K2[PtCl6]
, Ом-1.см2.моль-1
В 1893 г. А.Вернер
совместно
с А. Миолати,
используясоединений
метод
Диаграмма
молярной
электропроводности
измерения молярной электропроводности установили
600
закономерности ее изменения
в ряду комплексных соединений.
1
[Pt(NH3)6]Cl4
В основе метода – способность электролитов
проводить эл. ток
523
500
2 в зависимости
[Pt(NH3)5Cl]Cl
3
от наличия
свободных ионов в растворе
404
400
300
256
229
200
100
108
97
1,5
0
1
2
3
4
5
6
7
18
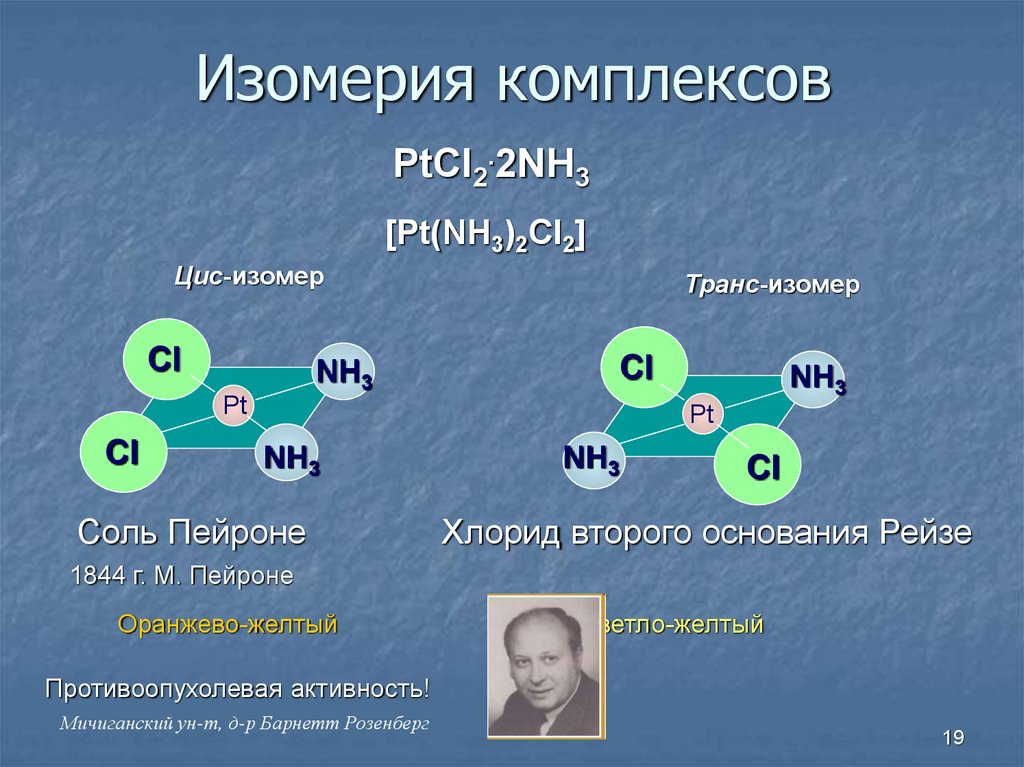
19. Изомерия комплексов
PtCl2.2NH3[Pt(NH3)2Cl2]
Цис-изомер
Cl
NH3
Транс-изомер
Cl
Pt
Cl
NH3
Pt
NH3
Соль Пейроне
NH3
Cl
Хлорид второго основания Рейзе
1844 г. М. Пейроне
Оранжево-желтый
Светло-желтый
Противоопухолевая активность!
Мичиганский ун-т, д-р Барнетт Розенберг
19
20. Сольватная изомерия
[Cr(H2O)6]Cl3Фиолетовый
[Cr(H2O)5Cl]Cl2
Светло-зеленый
[Cr(H2O)4Cl2]Cl
Темно-зеленый
20
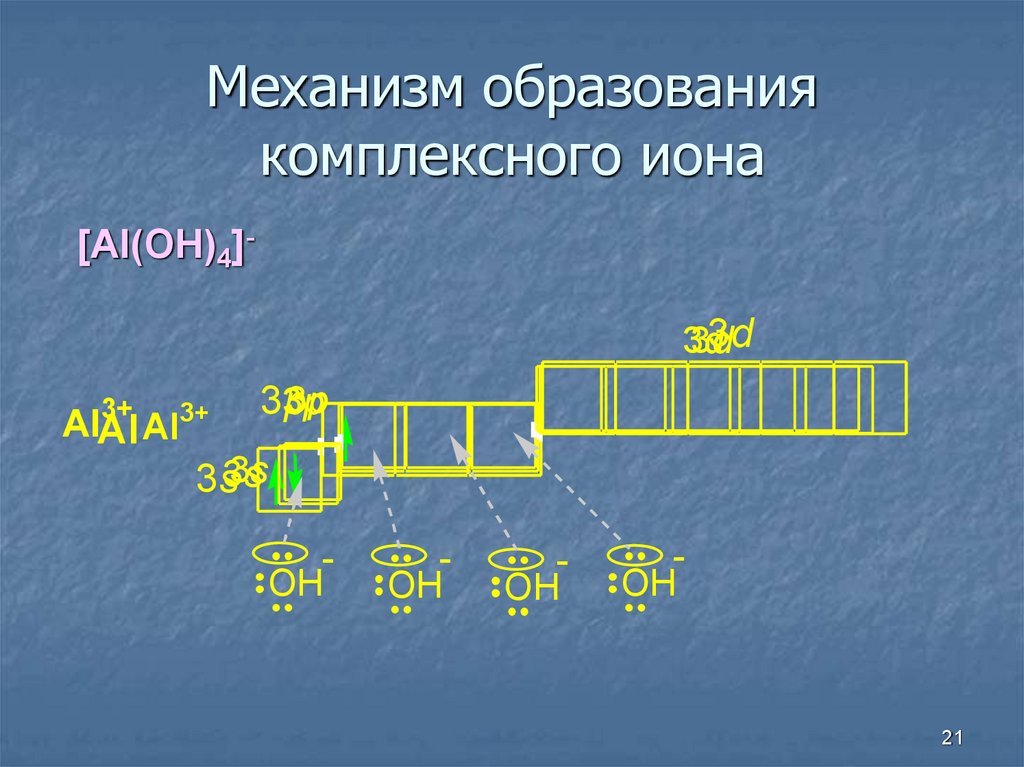
21. Механизм образования комплексного иона
[Al(OH)4]-3d
3d
3d
3+
AlAl Al
3+
3p
3p
3p
3s
3s3s
OH
OH
OH
OH
21
22. Комплексные соединения в растворах
Первичная диссоциация комплексных соединенийK3[Fe(CN)6] = 3K+ + [Fe(CN)6]3[Cu(NH3)4]SO4 = [Cu(NH3)4]2+ + SO42[Ag(NH3)2]Cl = [Ag(NH3)2]+ + Cl-
22
23. Вторичная диссоциация комплексов
[Ag(NH3)2]+[Ag(NH3)]+
[Ag(NH3)]+ + NH3
Ag+ + NH3
[Ag(NH3)2]+
Ag+ + 2NH3
[Ag+] [NH3]2
= 9,3.10-8
KH =
[ [Ag(NH3)2]+ ]
Диссоциация комплексов (или реакции обмена
лигандов на молекулы растворителя) количественно
характеризуется константами нестойкости
комплексов Kн .
23
24. Константы нестойкости некоторых комплексов
Комплексный ион[Fe(CN)6]3[Fe(CN)6]4[Co(NH3)6]2+
[Ag(NH3)2]+
[Cu(NH3)4]2+
[Zn(OH)4]2–
Константа нестойкости
1,0 . 10–31
1,0 . 10–36
7,75 . 10–6
9,31 . 10–8
2,14 . 10–13
3,6 . 10–16
24
25. Что же такое комплексы?
Комплексные соединения – вещества,существующие как в кристаллическом
состоянии, так и в растворе,
особенностью которых является наличие
центрального атома (акцептора электронов),
окруженного лигандами (донорами
электронов).
В растворе лиганды способны ступенчато и
обратимо отщепляться от центрального атома
по гетеролитическому типу.
25
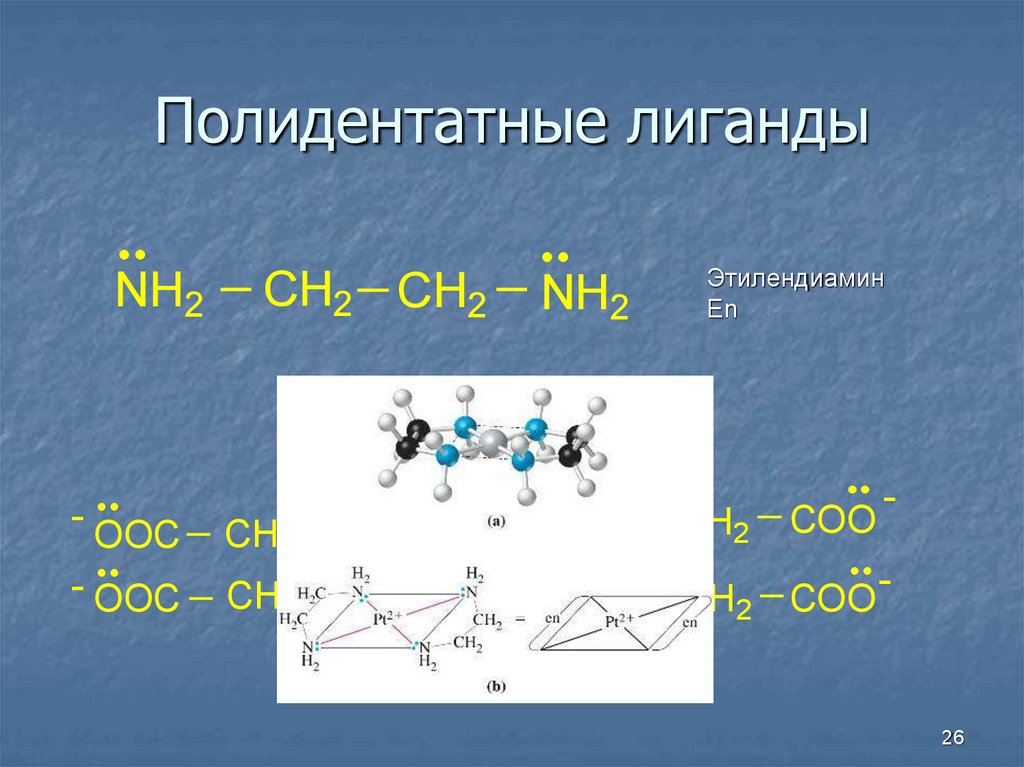
26. Полидентатные лиганды
NH2-
CH2 CH2
OOC
CH2
- OOC
CH2
N
NH2
CH2 CH2
Этилендиамин
En
CH2
N
COO
CH2 COO
-
ЭДТА
26
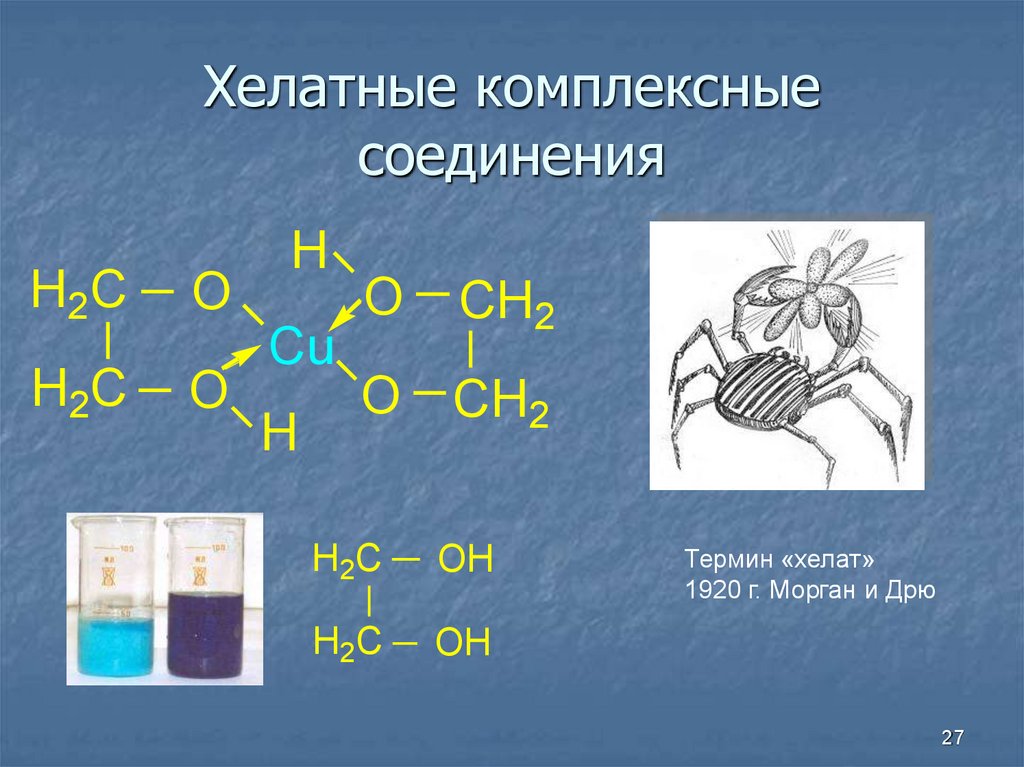
27. Хелатные комплексные соединения
H2CO
H2C
O
H
O
Cu
H
CH2
O CH2
H 2C
OH
H2 C
OH
Термин «хелат»
1920 г. Морган и Дрю
27
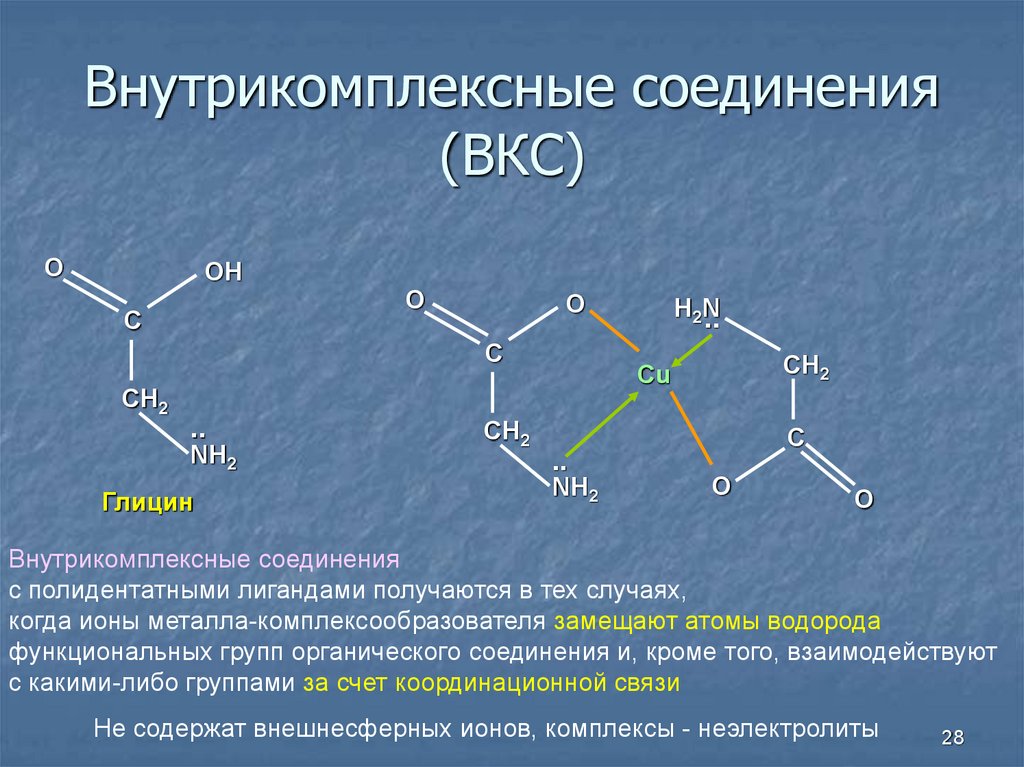
28. Внутрикомплексные соединения (ВКС)
OOH
O
С
O
С
CH2
..
NH2
Глицин
CH2
H2N
..
CH2
Cu
С
..
NH2
O
O
Внутрикомплексные соединения
с полидентатными лигандами получаются в тех случаях,
когда ионы металла-комплексообразователя замещают атомы водорода
функциональных групп органического соединения и, кроме того, взаимодействуют
с какими-либо группами за счет координационной связи
Не содержат внешнесферных ионов, комплексы - неэлектролиты
28
29. Качественная реакция на Ni2+ c диметилглиоксимом
H3CHO
C
N
C
CH3
N OH
+ [Ni(NH3)6]
Реактив Чугаева
H3C
C
2+
.H
.
.
O
O
N
N
Лев Александрович
Чугаев
(1873-1922)
C
CH3
+
+ 2NH4 + 4NH3
Ni
H3C
C
N
N
O
H
.. .
C
CH3
O
29
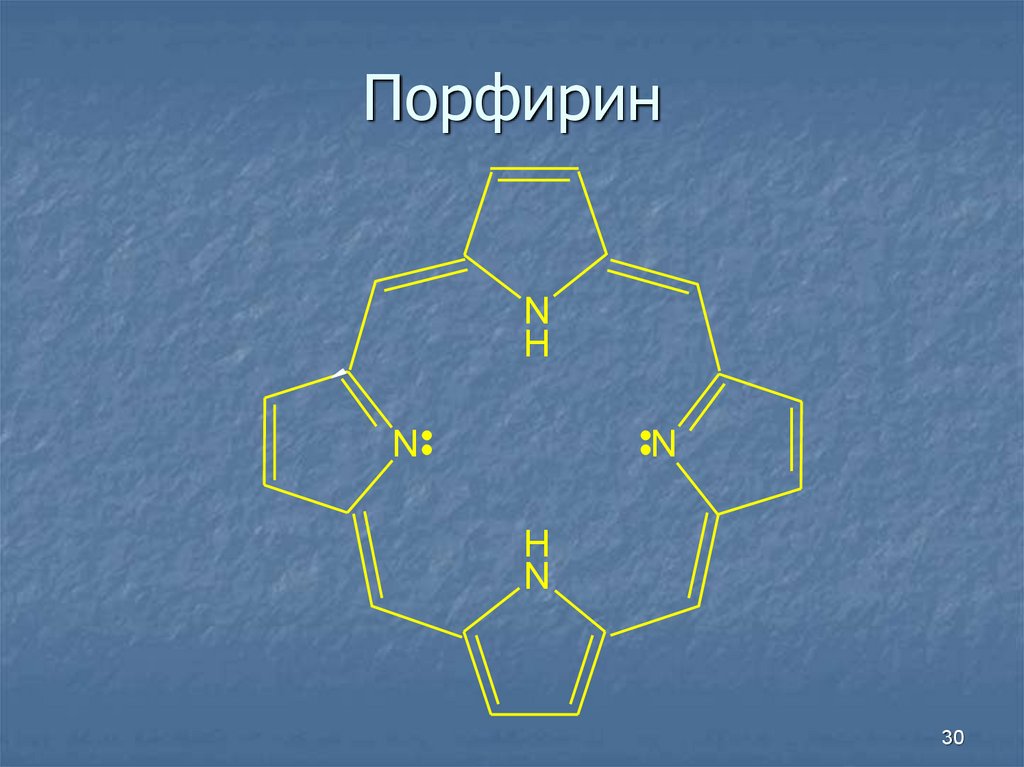
30. Порфирин
NH
N
N
H
N
30
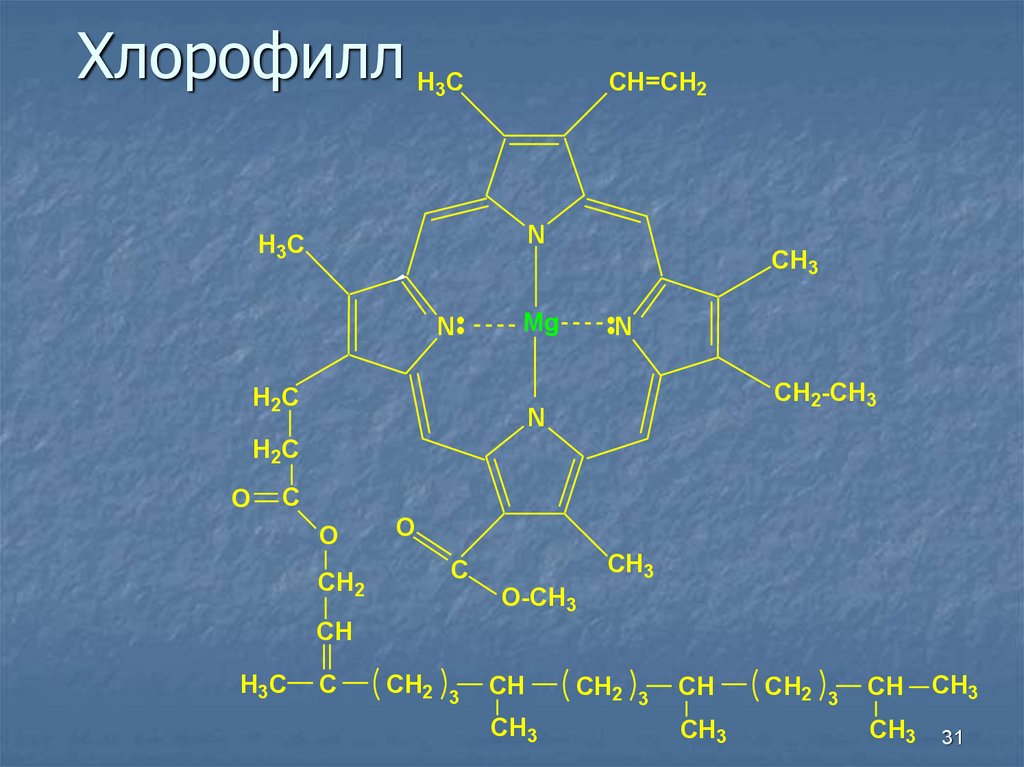
31. Хлорофилл
H CCH=CH2
3
N
H3C
CH3
N
Mg
H2C
N
CH2-CH3
N
H2C
O
C
O
O
CH3
C
CH2
O-CH3
CH
H3C
C
CH2
3
CH
CH3
CH2
3
CH
CH3
CH2
3
CH
CH3
CH3
31
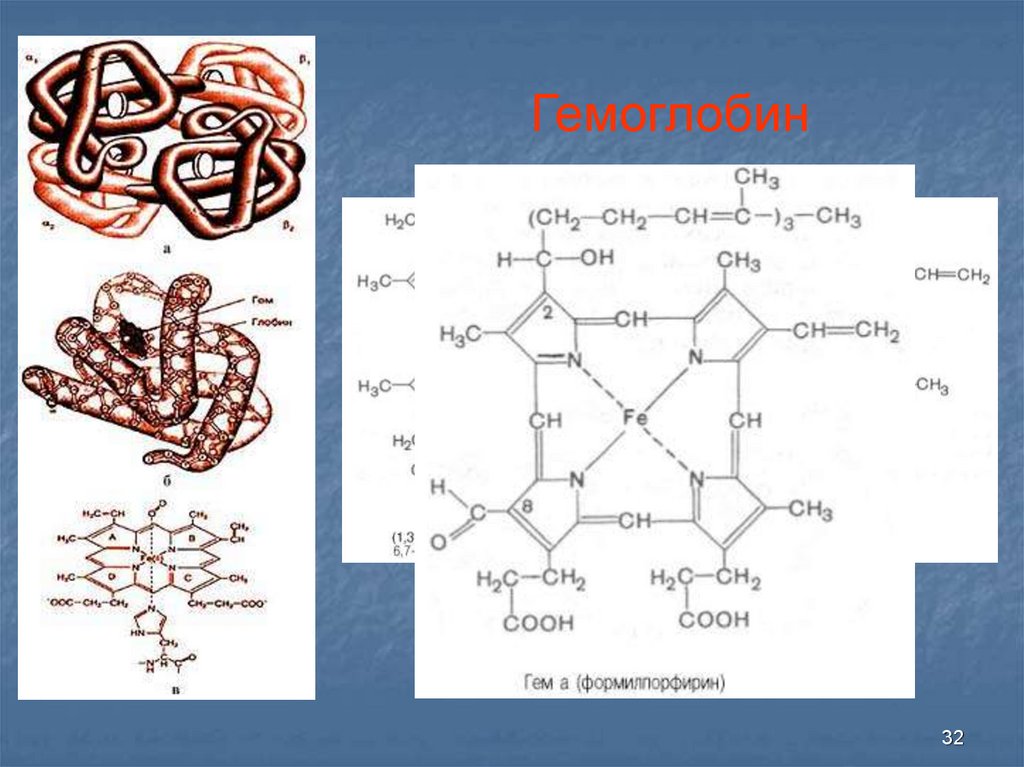
32.
Гемоглобин32
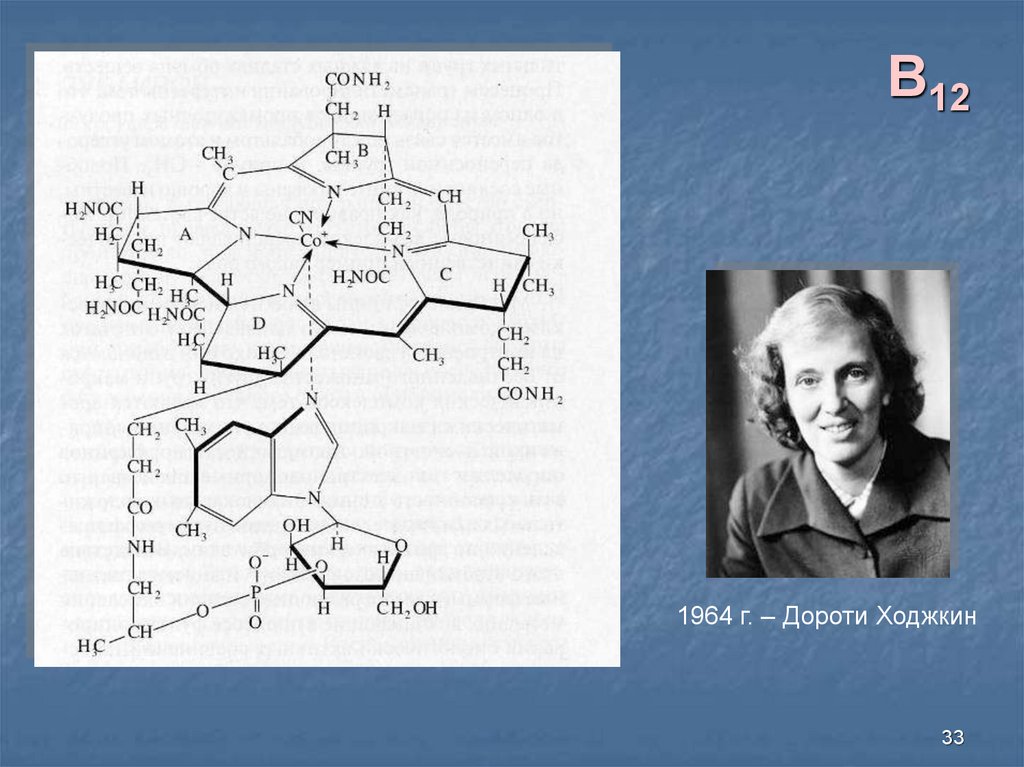
33.
B121964 г. – Дороти Ходжкин
33
34. Альфред Вернер
1866-19191866 г. – родился в Мюлузе (Эльзас)
34
35.
1885 г. – служба в армии в КарлсруэС 1886 г. – Цюрих.
1886 г. – 1889 г. Цюрихский политехникум.
Профессор Артур Ганч
1890 г. «О пространственном расположении
атомов в азотсодержащих молекулах»
1891 г. – конкурсная работа на звание приват-доцента
«К теории сродства и валентности»
1891 г – стажировка в лаборатории Марселена Бертло
1892 г.-1893 г. – статья «О строении неорганических соединений»
35
36. Альфред Вернер
1866-1919В 1913 г. шведский король Густав V вручил Альфреду Вернеру
золотую медаль лауреата Нобелевской премии и диплом,
"в признание его работ о природе связей в молекулах,
которыми он по-новому осветил старые проблемы и
открыл новые области для исследований,
особенно в неорганической химии".
"Меня часто охватывает экстаз пред красотой моей науки.
Чем дальше я погружаюсь в ее тайны, тем более она
кажется мне огромной, величественной, слишком красивой
для простого смертного"
36
37. Спасибо за внимание!
3738. Литература
• Кукушкин Ю.Н. Химия координационных соединений.М.: Высшая школа, 1985.
• Кукушкин Ю.Н. Соединения высшего порядка. Л.: Химия, 1991.
• Макашев Ю.А., Замяткина В.М. Соединения в квадратных скобках.
Л.: Химия, 1976.
• Степин Б.Д., Аликберова Л.Ю. Книга по химии для домашнего чтения.
М.: Химия, 1994.
• Беликова М.Ю. Чудесные секреты Мастера Турнбуля
// Химия в школе. – №4. – 1998. – С.27-37
• Федоренко Н.В. Вернер: изучение сочетаний атомов в молекуле
// Химия в школе. – №4. – 1998. – С.79-83
http://www.alhimik.ru/compl_soed/content.htm
http://www.chem.msu.su/rus/school/zhukov/welcome.html
38


























 chemistry
chemistry








